معادله شیمیایی چیست؟ – به زبان ساده
معادله شیمیایی به معادلهای میگویند که به طور تقریبی، همه دانشآموزان و دانشجویان به هنگام یادگیری علم شیمی با آن ارتباط پیدا میکنند. این معادله به کمک اعداد و نمادهایی نوشته میشود که فرآیند انجام شده به هنگام یک واکنش شیمیایی را نشان میدهد. علاوه بر این، معادله شیمیایی با بکارگیری نمادهای مختلف، شرایط مختلفی همچون جهت انجام واکنش یا حالت فیزیکی مواد شرکت کننده در واکنش را به ما نشان میدهد. خوب است بدانید که معادله شیمیایی برای اولین بار در سال 1615 توسط شیمیدان فرانسوی «ژان بگین» (Jaan Beguin) مورد استفاده قرار گرفت.


به کمک معادله شیمیایی میتوان واکنشهای شیمیایی را بر روی کاغذ نشان داد. در زیر، نمونهای از یک معادله شیمیایی برای واکنش بین گازهای هیدروژن و اکسیژن به هنگام تشکیل آب آورده شده است.
در مثال بالا مشاهده میکنید که مواد واکنشدهنده در طرف چپ فلش و فرآورده خاص از این واکنش، در طرف راست فلش نوشته شده است. به طور کلی، در طرف چپ، واکنشدهندهها و در طرف راست، فرآوردهها قرار دارند. همچنین، با دقت بیشتر در معادله بالا در مییابیم که ضرایبی پشت نماد هریک از واکنشدهندهها یا فرآوردهها وجود دارد. با این ضرایب، در مباحث استوکیومتری و موازنه واکنش، بیشتر آشنا میشویم.
جهت یک واکنش شیمیایی
جهت یک واکنش شیمیایی را به کمک معادله شیمیایی میتوان مشخص کرد. به عبارت دیگر، واکنشدهندهها و فرآوردهها به کمک یکی از ۳ نماد زیر مشخص میشوند.
- «»: واکنش یکطرفه
- «»: واکنش تعادلی (دوطرفه) یا برگشتپذیر
- «»: برای نمایش روابط استوکیومتری
در برخی متون، برای نمایش واکنشهایی که در هر دو جهتِ رفت و برگشت انجام میشوند، از نماد «» بهره میگیرند.

نمایش حالت فیزیکی مواد به کمک معادله شیمیایی
بار دیگر نگاهی به معادله شیمیایی بالا خواهیم داشت. میبینیم که به غیر از ضرایب استوکیومتری واکنش، حروف انگلیسی نیز در داخل پرانتز وجود دارند. این حروف بیانگر حالت فیزیکی فرآوردهها یا واکنشدهندهها در طول مدت زمان واکنش است و به طور کلی، به چهار شکل زیر نوشته میشوند:
- (s): حالت جامد
- (l): حالت مایع
- (g): حالت گاز
- (aq): ذرات در «محلول آبی» (Aqueous Solution)
نمایش انرژی در معادله شیمیایی
برخی از واکنشهای شیمیایی برای شروع نیاز به انرژی دارند. اگر انجام واکنش، به انرژی نیاز داشته باشد، در بالای فلشها نشان داده میشود. این انرژی را به دو شکل میتوان نشان داد
- استفاده از نماد یونانی دلتا به معنای انرژی اضافه شده به شکل گرما
- به کمک عبارت «»، به معنای انرژی فوتون. استفاده از این عبارت یعنی برای انجام واکنش به نور نیاز داریم.
به یاد داشته باشید که ضرایب استوکیومتری پشت هر ماده در واکنش، برای این استفاده میشود تا بیانگر قوانین پایستگی بار و جرم باشد.
معادله شیمیایی یونی
در معادلات شیمیایی که الکترولیت داشته باشیم، میتوان آنرا به دو بخش تقسیم کرد و معادله شیمیایی را به صورت یونی نوشت. از این واکنشها برای توصیف واکنشهای جانشینی یگانه و دوگانه استفاده میشود.
مثال معادله شیمیایی یونی
در مثال زیر، یک نمونه معادله شیمیایی یونی را بررسی میکنیم. معادله اول، یک معادله شیمیایی و معادله دوم معادلهای به صورت یونی است.
معادله شیمیایی:
معادله یونی:
در موارد بسیار کمی، برای نشان دادن رسوب، به جای استفاده از عبارت «(s)» در کنار فرآورده، از کمک میگیرند. با مقایسه فرآوردهها و واکنشدهندههای معادله یونی و شیمیایی، مشاهده میکنیم که یون کلسیم و یون نیترات در هر دو طرف معادله یونی حضور دارند. به این یونها «یون تماشاچی» (Spectator Ion) میگویند زیرا در واکنش شیمیایی، شرکت نمیکنند.
معادله یونی خالص برای مثال بالا را بعد از حذف یونهای تماشاچی، میتوان به شکل زیر نوشت. در حقیقت، در اینجا، معادله را تنها برای یونهای شرکت کننده در واکنش نوشتیم:
معادله یونی بالا را اینگونه میتوان توصیف کرد که دو یون کلرید - ناشی از کلسیم کلرید - با دو کاتیون نقره - ناشی از نقره نیترات - وارد واکنش میشوند تا رسوب نقره کلرید به تولید برسد.
موازنه معادله شیمیایی ساده
زمانیکه یک شیمیدان، با واکنشی جدید مواجه میشود، به طور معمول معادله آن در حالت موازنه شده خود وجود ندارد. در عوض، شیمیدان باید واکنشدهندهها و فرآوردهها را مشخص کند و سپس آنها را به شکل یک معادله شیمیایی بنویسد و آنرا موازنه کند. به طور مثال، سوختن نرمال هپتان با فرمول شیمیایی را در نظر بگیرید.
در اثر سوختن کامل هر نوع هیدروکربن با مقدار کافی از اکسیژن، دیاکسید کربن و آب تولید میشود. واکنش بالا موازنه نیست. تعداد اتمهای کربن، اکسیژن و هیدروژن در طرف چپ معادله، با تعداد آنها در طرف راست معادله، برابر نیستند. بنابراین، مقدار ضرایب پشت واکنشدهندهها و فرآوردهها باید به گونهای تنظیم شوند تا اتمها در هر دو طرف، مقدار یکسانی داشته باشند.
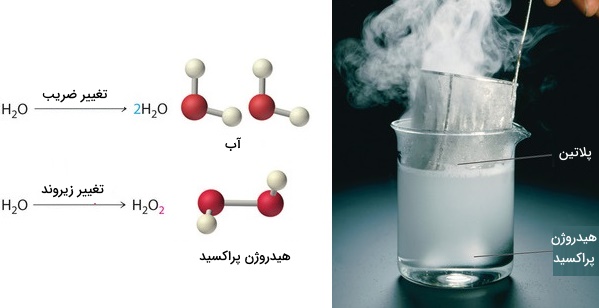
توجه داشته باشید که در این شرایط، تنها میتوانیم ضرایب پشت مولکولها را تغییر دهیم زیرا با تغییر زیروندها، نوع ماده واکنشدهنده یا فرآورده به طور کامل عوض میشود. به طور مثال، در تصویر زیر، اگر ضرایب پشت مولکول تغییر پیدا کنند، نوع مولکول (در اینجا آب) تغییری پیدا نمیکند اما با تغییر زیروندها، مولکول آب به یک مولکول دیگر (هیدروژن پراکسید) تبدیل خواهد شد.
مراحل موازنه واکنش به روش وارسی
عمومی ترین و ساده ترین روش برای موازنه یک واکنش شیمیایی، «روش وارسی» (Inspection Method) یا آزمون و خطا نام دارد. در ادامه، نحوه موازنه واکنش شیمیایی به روش وارسی را بیان میکنیم. این روش موازنه، شامل چهار مرحله کلی است.
- کار را با پیچیدهترین ترکیب شروع و فرض کنید تنها یک مولکول از این ترکیب در واکنش شرکت میکند.
- اتم با کمترین تعداد در این ترکیب را در دو طرف موازنه کنید. برای این کار، میتوان از ضرایب کسری نیز کمک گرفت.
- در انتها، تعداد اتمهای مشترک در سایر ترکیبات را موازنه کنید.
- بعد از اینکه اتمها و بارهای الکتریکی، موازنه شدند، با اعمال ضرایب مناسب، عبارات کسری را حذف کنید.
مثال موازنه واکنش به روش وارسی
واکنش سوختن اتیلن گلایکول (ماده اصلی در ضدیخ خودروها) را در نظر بگیرید:
در این مثال، پیچیدهترین مولکول، اتیلن گلایکول است. بنابراین، ضریب ۱ را برای آن در نظر میگیریم. البته زمانیکه هیچ عددی پشت مولکول نباشد، بیانگر ضریب ۱ است اما برای اینکه مولکولهای بررسی شده و مراحل موازنه، مشخص باشند، از این ضریب استفاده میکنیم.
هریک از اتمهای کربن و هیدروژن را در ۲ مولکول داریم اما اکسیژن در تمامی ۴ مولکول وجود دارد. پس ادامه کار را با موازنه کربن و هیدروژن پی میگیریم. در مولکول اتیلن گلایکول، ۲ اتم کربن داریم. بنابراین، ضریب ۲ را در پشت مولکول دیاکسید کربن قرار میدهیم.
با طی کردن مراحل بالا، میبینیم که اتم کربن، موازنه شده است. حالا نوبت به هیدروژن میرسد. در سمت چپ واکنش، ۶ اتم هیدروژن داریم و بنابراین، با داشتن ۳ مولکول آب در طرف راست، هیدروژن نیز موازنه خواهد شد.
در ادامه باید به موازنه اکسیژن بپردازیم. ۷ اتم اکسیژن در سمت راست داریم که ۴ اتم متعلق به مولکول دیاکسید کربن و ۳ اتم متعلق به مولکول آب است. برای موازنه این معادله شیمیایی باید در طرف چپ، ۷ اتم اکسیژن داشته باشیم. از این ۷ اتم، ۲ اتم در مولکول اتیلن گلایکول موجود است. در نتیجه، به ۵ اتم اکسیژن برای مولکول نیاز داریم. این ۵ اتم را به شکل کسری به مولکول اکسیژن اضافه میکنیم. در حقیقت، اگر کسر را پشت مولکول اکسیژن قرار دهیم، در ادامه اگر کل معادله را در عدد ۲ ضرب کنیم، با عدد ۲ در مخرج ساده خواهد شد.

مثال دوم موازنه واکنش به روش وارسی
قانون دیگری نیز وجود دارد که میگوید گروههای چنداتمی را که در طول واکنش، تغییر نمیکنند، به مانند اتمهایی بزرگ در نظر بگیرید و این گروهها را به گونهای مجزا موازنه کنید. برای اینکه با این قانون، بیشتر آشنا شویم، از معادله واکنش بین کلسیم کربنات و فسفریک اسید کمک میگیریم. معادله این واکنش در زیر آورده شده است:
پیچیدهترین مولکول در این مثال، کلسیم فسفات است. بنابراین عدد ۱ را پشت این مولکول قرار میدهیم.
در اینجا، ترکیب را به عنوان یک گروه جدا در نظر میگیریم. البته یک یون است و در اینجا، بار الکتریکی آن را در نظر نگرفتهایم. حال، به جای در نظر گرفتن اتمهای فسفر و گوگرد، میتوانیم به طور کلی، گروه را موازنه کنیم. در سمت راست، دو گروه کلسیم فسفات داریم و بنابراین، عدد ۲ را پشت فسفریک اسید در سمت چپ معادله شیمیایی قرار میدهیم.
همچنین، سه اتم کلسیم در سمت چپ نیاز داریم.
در ادامه، کربن، اکسیژن و هیدروژن برای موازنه باقی ماندهاند. سه اتم کربن در سمت چپ داریم و بنابراین، ضریب ۳ را برای مولکول دیاکسید کربن سمت راست، در نظر میگیریم.
در سمت چپ، ۶ هیدروژن داریم و بار دیگر به سمت راست معادله، ضریب ۳ را اضافه میکنیم اما این بار این ضریب به مولکول آب اختصاص پیدا میکند.
آخرین عنصر برای موازنه، اکسیژن است. با توجه به اینکه گروه را از قبل موازنه کردهایم، اکسیژنِ این گروه را در نظر نمیگیریم. حال، تعداد اتمهای اکسیژن را شمارش میکنیم. در سمت چپ معادله، ۹ اتم اکسیژن در کلسیم کربنات و در سمت راست، ۳ اتم اکسیژن در مولکول آب و ۶ اتم در مولکول دیاکسید کربن داریم. با شمارش این اتمها در مییابیم که در هر دو طرف، ۹ اتم اکسیژن وجود دارد و بنابراین، معادله واکنش، موازنه شده است.
موازنه بار
اگر در معادله واکنش، ذرات باردار داشته باشیم، این بارها را نیز باید موازنه کنیم. به طور مثال، واکنش زیر را در نظر بگیرید:
موازنه این معادله شیمیایی قدری ساده است. پیچیدهترین مولکول، آهن (II) فسفات در سمت راست معادله است. با فرض اینکه یک مولکول از این ترکیب پیچیده داشته باشیم، باید ضریب ۳ را برای و ضریب ۲ را برای یون فسفات در نظر بگیریم. با این کار، معادله شیمیایی ما موازنه میشود.
حال، به سادگی میتوانیم موازنه بار را نیز بررسی کنیم. مقدار بار در سمت راست، برابر با صفر است. در سمت چپ نیز این میزان طبق محاسبات زیر، برابر با صفر خواهد بود که نشان میدهد، معادله، موازنه شده است.

محدودیت های موازنه به روش وارسی
البته موازنه معادله شیمیایی به روش وارسی، با محدودیتهایی نیز همراه است. به طور مثال، واکنش زیر را در نظر بگیرید:
اگر بخواهیم واکنش بالا را به روش وارسی، موازنه کنیم به جایی نمیرسیم. به کمک دو قانون اول، موازنه را از کربن آغاز خواهیم کرد و ضریب ۱ را برای در نظر میگیریم. با این کار، نتیجه میگیریم که ۱ مولکول از نیز به تولید میرسد. این سادهترین بخش کار بود.
سایر اتمها در ترکیبات دیگر یافت میشوند. بنابراین، زمانیکه ضریبی را در پشت یک مولکول قرار دهیم، حداقل، تعداد دو اتم دیگر تغییر میکنند. در نتیجه، باید از سایر روشها برای موازنه استفاده کنیم.













خیلی ممنون از سایت زیبای تان.
سلام، لطفاً دربارهی نوشتن طرف دوم واکنش هم توضیح بدین؛ تشکر.
سایتتون عالیه ?