طول پیوند و مرتبه پیوند در شیمی – به زبان ساده
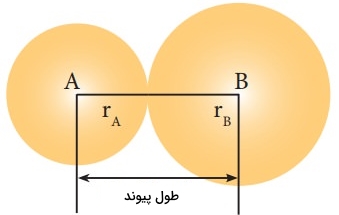
در هندسه مولکولی و بیان شکل مولکول، طول پیوند یا «فاصله پیوند» (Bond Distance)، به صورت متوسط فاصله بین هسته دو اتم پیوندی در یک مولکول تعریف میشود. طول پیوند به مرتبه پیوند ارتباط دارد. زمانیکه الکترونهای بیشتری در یک پیوند شرکت داشته باشند، پیوند کوتاهتری خواهیم داشت. طول پیوند همچنین به طور معکوس به قدرت پیوند و انرژی تفکیک پیوند وابسته است. زمانی که تمامی عوامل یکسان باشند، پیوند قویتر، طول کمتری خواهد داشت. توجه داشته باشید که در پیوندی بین دو اتم یکسان، به نیمی از فاصله بین دو اتم، «شعاع کووالانسی» (Covalent Radius) میگویند.
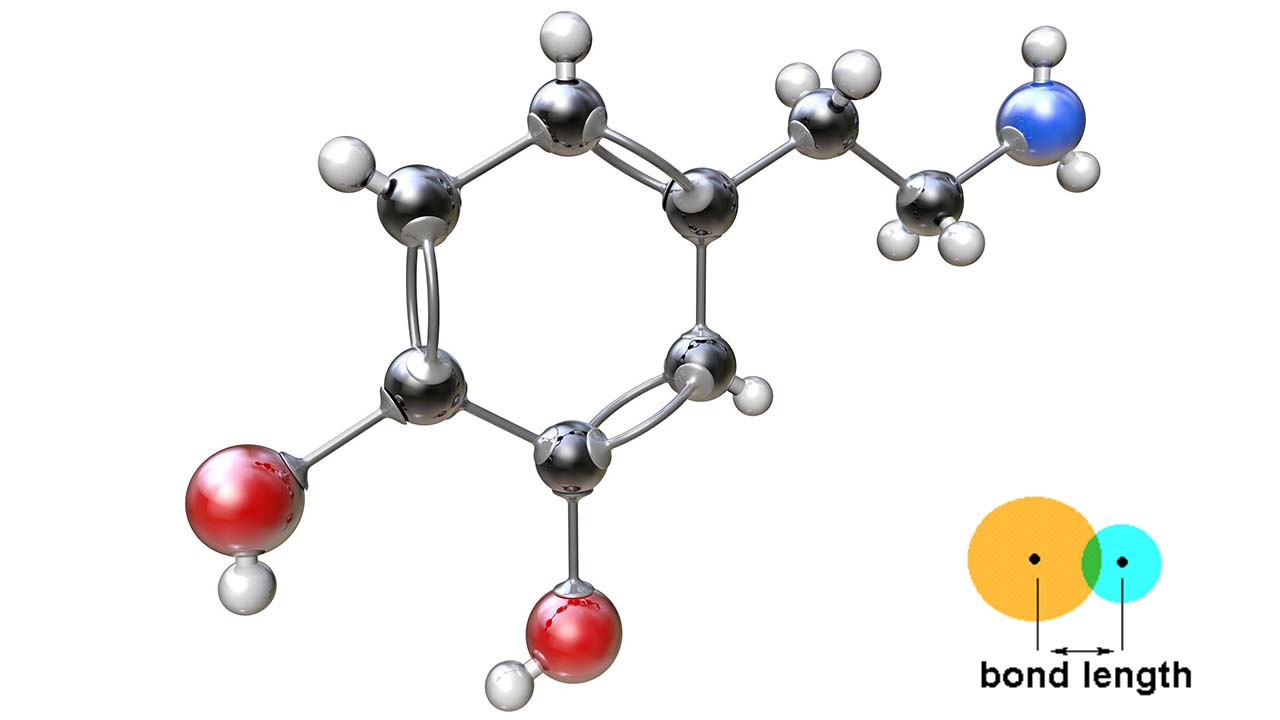

طول پیوند را در فاز جامد و به کمک پراش اشعه ایکس اندازهگیری میکنند. همچنین در فاز گاز، این فاصله به کمک طیفسنجی ریزموج اندازهگیری میشود. پیوند بین یک جفت اتم ممکن است در مولکولهای مختلف با یکدیگر تفاوت داشته باشد. به طور مثال، پیوند کربن-هیدروژن در متان با متیل کلرید تفاوت دارد.
مقدمه
علم شیمی با نحوه پیوندهای ذرات زیراتمی برای تشکیل اتمها ارتباط دارد. علاوه بر این، در علم شیمی، تمرکز بر نحوه پیوند اتمها برای تشکیل مولکولها نیز وجود دارد. همانطور که میدانید، در یک ساختار مولکولی، الکترونها، در محدودهای در اطراف هسته موسوم به اوربیتال قرار دارند. هر اوربیتال، تعداد مشخصی الکترون را در خود نگهداری میکند.
زمانی که نزدیکترین اوربیتال به هسته، از الکترون پر شود، الکترونها، شروع به پر کردن لایههای دیگری میکنند. زمانی که دو اتم برای تشکیل یک مولکول با یکدیگر پیوند تشکیل دهند، الکترونهای این اتمها با ترکیب زیرلایههای خود موجب تشکیل این پیوند خواهند شد که این مبحث به خوبی در مطلب اوربیتال مولکولی پوشش داده شده است.
طول پیوند و انرژی پیوند
همانطور که در ابتدای متن به آن اشاره شد، فاصله بین مراکز دو اتم به صورت طول پیوند یا فاصله پیوند بیان میشود. طول پیوند بسته به عوامل مختلف، تغییر میکند اما به طور کلی، عدد ثابتی را میتوان برای آن در نظر گرفت.
البته مرتبه پیوند نیز بر طول پیوند تاثیرگذار است اما طول پیوند در یک جفت اتم با مرتبه پیوند یکسان در مولکولهای مختلف، عدد ثابتی دارد. به همین دلیل است که در کتب مرجع شیمی، جداولی از فاصلههای بیناتمی یا طول پیوند دیده میشود. طول و انرژی پیوند برای هالوژنها را در جدول زیر مشاهده میکنید.
| پیوند | طول پیوند | انرژی پیوند |
| 142 | 158 | |
| 199 | 243 | |
| 228 | 193 | |
| 267 | 151 |
طول پیوند، بازهای بین 74 پیکومتر برای پیوند هیدروژن-هیدروژن تا ۲۰۰ پیکومتر برای اتمهای بزرگتر دارد. انرژی پیوند نیز به مرتبه و طول پیوند وابسته است. به یاد دارید که شعاع کووالانسی را به صورت نیمی از طول یک پیوند یگانه بین دو اتم یکسان تعریف کردیم. مجموع دو شعاع کووالانسی دو اتم نیز به طور معمول، برابر با طول یک پیوند یگانه خواهد بود. به طور مثال، شعاع کووالانسی اتمهایی همچون هیدروژن و کربن به ترتیب برابر با 37 و ۷۷ پیکومتر است. در نتیجه، طول پیوند کربن-هیدروژن برابر با مجموع این دو شعاع، یعنی 114 پیکومتر خواهد بود.
مرتبه پیوند، به تعداد الکترون اشتراکی بین دو اتم به هنگام تشکیل یک پیوند میگویند. مرتبه پیوند در پیوندهای دوگانه کربن-کربن و اکسیژن-اکسیژن برابر با ۲ است. به مقدار انرژی مورد نیاز برای شکست یک پیوند، انرژی تفکیک پیوند یا به طور سادهتر، انرژی پیوند میگویند. با توجه به اینکه طول پیوند، عدد مشخصی دارد، انرژی پیوند در پیوندهای مشابه نیز عدد مشخصی خواهد داشت.
انرژی پیوند و آنتالپی
به طور کلی، انرژی پیوند برابر با متوسط تغییرات آنتالپی در یک واکنش گازی بمنظور شکستن تمامی پیوندها تعریف میشود. به طور مثال، در یک مول از مولکول متان، برای شکستن پیوند یگانه کربن-هیدروژن، به 435 کیلوژول انرژی نیاز داریم. اما شکستن تمامی چهار پیوند کربن هیدروژن در متان، به 1662 کیلوژول انرژی نیاز دارد.
در نتیجه، متوسط انرژي پیوند، یعنی برابر با 416 خواهد بود که با برابر نیست. توجه داشته باشید که انرژی پیوند، معیاری برای اندازهگیری قدرت یک پیوند شیمیایی به شمار میرود. به عبارت دیگر، هرقدر انرژی پیوند بیشتری داشته باشیم، قدرت پیوند نیز قویتر خواهد بود.
بحث در خصوص پیوند کووالانسی
همانطور که میدانید، پیوند بین اتمهای یکسان از نوع پیوند کووالانسی است و همچنین پیوندهای بین اتمهایی با اختلاف الکترونگاتیوی در حدود 0/7 نیز به طور مشخصی خاصیت کووالانسی دارند. همچنین، در بین برخی از یونها که به جامدات یونی معروف هستند نیز خاصیت کوولانسی وجود دارد.
به طور نظری، پیوندهای یونی نیز خاصیتی کووالانسی دارند و به همین دلیل، مرز بین پیوند کووالانسی و پیوند یونی در برخی موارد، به طور دقیق مشخص نیست. در پیوندهای کووالانسی، انرژی و طول پیوند به عوامل مختلفی وابسته هستند که از آنجمله میتوان به موارد زیر اشاره کرد:
- «الکترونخواهی» (Electron Affinity)
- اندازه اتمهای شرکتکننده در پیوند
- اختلاف الکترونگاتیوی
- ساختار کلی مولکول
یک روند کلی را میتوان در نظر گرفت که هرقدر طول پیوند کوتاهتر باشد، انرژی آن بیشتر است. البته هیچ رابطه و فرمولی برای نشان دادن این ارتباط وجود ندارد زیرا تغییرات گستردهای را در این خصوص شاهد هستیم. در حقیقت، به کمک مقادیر موجود در جداول، روند مشخصی را به سادگی نمیتوان پیدا کرد. بهترین راه برای مشاهده این روند، رسم دادهها بر روی نمودار است. در مبحث انرژیهای پیوند، تصویر زیر نحوه تغییرات انرژی یه هنگام نزدیک شدن دو اتم هیدروژن برای تشکیل پیوند کووالانسی را نشان میدهد.
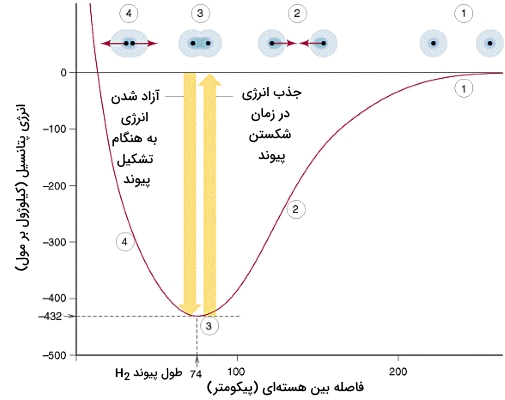
پیوندهای کووالانسی همچون و قطبی هستند چراکه الکترونهای پیوندی، به اتمهایی با الکترونگاتیوی بیشتر همچون کلر و ید جذب میشوند. به طور کلی، هرقدر اختلاف الکترونگاتیوی بیشتر باشد، قطبیت پیوند نیز بیشتر است. به طور ویژه، پیوندهای و به شدت قطبی هستند.
مثال برای محاسبه تغییرات آنتالپی استاندارد
اگر طول پیوند و انرژی در به ترتیب برابر با ۷۴ پیکومتر و و در برابر با ۲۲۸ پیکومتر و باشد. تغییرات آنتالپی استاندارد در واکنش زیر را حساب کنید.
به کمک مقادیر داده شده در بالا، جدول زیر را خواهیم داشت:
| تغییرات | |
| مجموع واکنشها و مقادیر | |
در روش دیگر نیز میتوان به صورت زیر عمل کرد. در این روش، انرژیهای پیوند را در زیر فرمول شیمیایی مینویسیم و به کمک بکارگیری اصل پایستگی انرژی، به پاسخ سوال دست پیدا میکنیم.
| پیوندهای تشکیل شده | پیوندهای شکسته شده | |
مرتبه و طول پیوند
همانطور که در ابتدای متن نیز به آن اشاره شد، مرتبه پیوند به تعداد پیوندهای شیمیایی بین یک جفت اتم میگویند و به کمک آن میتوان به بیان پایداری یک پیوند پرداخت. به طور مثال، در نیتروژن دواتمی ، مرتبه پیوند برابر با ۳ خواهد بود. در استیلن با فرمول ، مرتبه پیوند کربن-کربن نیز برابر با ۳ است اما مرتبه پیوند کربن-هیدروژن، مقداری برابر با ۱ دارد. مرتبه پیوند و طول پیوند بیانگر قدرت پیوند کووالانسی بین اتمها است. طول و مرتبه پیوند رابطه عکس با یکدیکر دارند به طوریکه با افزایش مرتبه پیوند، طول پیوند کاهش مییابد.
تعیین مرتبه پیوند
در بالا دیدیم که به تعداد پیوندهای بین دو اتم، مرتبه پیوند میگویند و دریافتیم که در یک پیوند کووالانسی بین دو اتم، پیوند یگانه دارای مرتبه ۱، پیوند دوگانه دارای مرتبه ۲ و پیوند سهگانه، مرتبه ۳ دارد. برای تعیین مرتبه پیوند بین دو اتم در پیوند کووالانسی، مراحل زیر را دنبال میکنیم.
- ساختار لوویس مولکول را رسم کنید.
- نوع پیوند بین دو اتم را تعیین کنید. اگر پیوندی وجود نداشت، مرتبه پیوند ۰ خواهد بود. در پیوندهای یگانه، دوگانه و سهگانه نیز مرتبه پیوندها به ترتیب برابر با ۲،۱ و ۳ خواهد بود.
اگر مرتبه پیوند برابر با صفر باشد، مولکولی تشکیل نخواهد شد. مراتب بالا در پیوند، بیانگر پایداری بیشتر در مولکول جدید است. در مولکولهایی با ساختار رزونانس، مرتبه پیوند ممکن است یک عدد صحیح نباشد.
مثال اول برای تعیین مرتبه پیوند
مرتبه پیوند را در سیانید تعیین کنید.
با رسم ساختار لوویس خواهیم داشت:

با تجوه به اینکه در ساختار لوویس مولکول بالا، یک پیوند سهگانه داریم در نتیجه، مرتبه پیوند برابر با ۳ خواهد بود.
مثال دوم برای تعیین مرتبه پیوند
مرتبه پیوند را برای گاز هیدروژن تعیین کنید.
با رسم ساختار لوویس برای مولکول گاز هیدروژن خواهیم داشت:

برای ساختار بالا، تنها یک پیوند یگانه را میتوان متصور شد که بیانگر مرتبه پیوند ۱ خواهد بود.
تعیین مرتبه پیوند در مولکولهای چند اتمی
اگر بیش از دو اتم در یک مولکول داشته باشیم، برای تعیین مرتبه پیوند باید به شکل زیر عمل کنیم:
- ساختار لوویس را رسم کنید.
- تعداد کل پیوندها را شمارش کنید.
- تعداد گروههای پیوندی را شمارش کنید.
- تعداد پیوندهای بین اتمها را بر تعداد کل گروههای پیوندی در مولکول تقسیم کنید.
مثال تعیین مرتبه پیوند در مولکول چند اتمی
مرتبه پیوند را در نیترات تعیین کنید.
ساختار لوویس نیترات به شکل زیر است:

دو پیوند یگانه و یک پیوند دوگانه داریم و بنابراین، تعداد کل پیوندها برابر با ۴ است.
تعداد گروههای پیوندی (تعداد پیوندها فارغ از یگانه، دوگانه و ...) بین اتمها برابر با ۳ خواهد بود.
با تقسیم تعداد پیوندها بر تعداد کل گروههای پیوندی خواهیم داشت:
بناراین، مرتبه پیوند برابر با 1/33 خواهد بود.
مثال دوم برای تعیین مرتبه پیوند در مولکولهای چند اتمی
مرتبه پیوند برای یون نیترونیوم با فرمول را تعیین کنید.
با رسم ساختار لوییس خواهیم داشت:
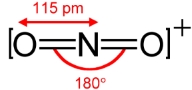
تعداد کل پیوندها برابر با ۴ است.
تعداد گروههای پیوندی در اتمها برابر با ۲ خواهد بود.
با تقسیم تعداد کل پیوندها بر تعداد گروههای پیوندی خواهیم داشت:
بنابراین، مرتبه پیوند در این مولکول برابر با ۲ خواهد بود.
روندهای تناوبی و پایداری پیوند
مرتبه پیوند بالاتر بیانگر جاذبه بیشتر بین الکترونها است. همچنین، مرتبه بالاتر پیوند بیانگر این است که اتمها با شدت بیشتری در کنار یکدیگر قرار گرفتهاند. زمانی که مرتبه پیوند کمی داشته باشیم، جاذبه کمتری بین الکترونها برقرار خواهد بود و همین امر موجب قرارگیری اتمها در کنار یکدیگر با شدت کمتری میشود. علاوه بر این، همانطور که گفته شد، مرتبه پیوند در بیان پایداری پیوند نیز کاربرد دارد. هر قدر مرتبه پیوند بیشتر باشد، الکترونهای بیشتری سبب نگهداری اتمها در کنار یکدیگر میشوند و به دنبال آن، پایداری بیشتری خواهیم داشت.
به هنگام بررسی روندهای تناوبی نیز باید ذکر کنیم که در هر تناوب از جدول تناوبی، با حرکت از چپ به راست، مرتبه پیوند افزایش پیدا میکند. همچنین در هر گروه از بالا به پایین، مرتبه پیوند کاهش پیدا میکند.

طول پیوند در جدول تناوبی
از آنجایی که طول پیوند با شعاع اتمی متناسب است، روند تناوبی برای طول پیوند، مشابه با روند تناوبی برای شعاع اتمی است. در هر تناوب از چپ به راست، طول پیوند کاهش و در هر گروه از بالا به پایین، طول پیوند افزایش پیدا میکند.

مثالهای تکمیلی مربوط به مرتبه و طول پیوند
در ادامه قصد داریم تا برای درک بهتر این مطلب، مثالهایی تکمیلی را در خصوص مرتبه و طول پیوند مطرح کنیم.
مثال 1
مرتبه پیوند در مولکول اکسیژن را تعیین کنید.
ابتدا ساختار لوویس را برای اکسیژن رسم میکنیم.

یک پیوند دوگانه بین دو اتم اکسیژن وجود دارد. بنابراین، مرتبه پیوند این مولکول برابر با ۲ خواهد بود.
مثال ۲
اگر شعاع کووالانسی کربن و نیتروژن در پیوند سهگانه، به ترتیب برابر با ۶۰ و ۵۴ پیکومتر باشد، طول پیوند کربن-نیتروژن در را محاسبه کنید.
برای پاسخ به این سوال، همانند قبل در ابتدا ساختار لوویس مولکول را رسم میکنیم.
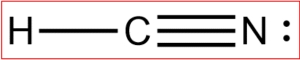
پیوند بین کربن و نیتروژن از نوع سهگانه است و بنابراین، طول این پیوند برابر با خواهد بود.













سلام
چرا اکسیژن در برخی مواقع میتونه پیوند دوگانه بده ولی بعضی جاها پیوند یه گانه؟
با سلام؛
برای پاسخ به این سؤال پیشنهاد میکنیم مطالب زیر را مطالعه کنید.
ساختار لوویس و نحوه رسم آن — به زبان ساده (+ دانلود فیلم آموزش گام به گام)
پیوند داتیو — به زبان ساده
با تشکر از همراهی شما با مجله فرادرس
با سلام
ببخشید چرا انتالپی پیوند دوگانه بین دو اتم دو برابر پیوند یگانه بین دو اتم نیس؟ دلیلش
دلتا اچ hbr نباید میشد منهای43؟
با سلام؛
جواب نهایی صحیح است اما اشکال تایپی در جدول وجود داشت که اصلاح شد.
با تشکر از ارائه بازخورد شما
با سلام؛
پیشنهاد میکنیم برای اطلاعات بیشتر مطلب «انرژی پیوند — به زبان ساده» را مطالعه کنید.
از همراهی شما با مجله فرادرس سپاسگزاریم.
شعاع کوالانسی، نصف طول پیوند یگانه است یا دوگانه یا سه گانه؟ ممنونم
با سلام؛
در تعریف اصلی شعاع کووالانسی، در رابطه با نوع پیوند (یگانه، دوگانه و …) صحبتی نشده است. برای آشنایی بیشتر با شعاع کووالانسی پیشنهاد میکنیم مطلب «شعاع اتمی عناصر چیست؟ — به زبان ساده» را مطالعه کنید.
با تشکر
سلام. اگر مولکول مورد نظر تک الکترون اضافه داشته باشد مثل رادیکال ها اون موقع باید چیکار کنیم مثل no . no2? چجوری باید مرتبه پیوند رو بدست بیاریم؟
با سلام؛
از همراهی شما با مجله فرادرس سپاسگزاریم. رادیکالهای آزاد همانطور که از نامشان پیداست، پیوندی تشکیل ندادهاند اما بسیار ناپایدار هستند و به سرعت پیوند تشکیل میدهند و مرتبه پیوند را میتوان بعد از تشکیل پیوند مورد بررسی قرار داد. برای آشنایی بیشتر با رادیکالهای آزاد پیشنهاد میکنیم مطلب «رادیکال آزاد — از صفر تا صد» را مطالعه کنید.
با تشکر