رفتار مولکول ها و توزیع الکترون ها در شیمی – به زبان ساده
رفتار و جهتگیری مولکول ها در میدانهای الکتریکی، بسته به توزیع الکترونیِ آنها متفاوت است. یعنی هر مولکولی، بسته به میزان قطبی یا ناقطبی بودنِ خود، نمایشی متفاوت بروز میدهد؛ از اینرو تشخیص قطبیت مولکولها با کمک ساختارهای لوییس، در پیشبینی رفتار آنها کمککننده است چراکه رفتار مولکول ها و توزیع الکترون ها، نتیجه نوع مولکول و ساختار آن است. در این مقاله قصد داریم به بررسی انواع مولکولها از جمله مولکولهای دو اتمی، از منظر قطبی و ناقطبی بودن و نحوه تفسیر نقشههای پتانسیل الکتروستاتیکی آنها مبتنی بر بارهای جزئی بپردازیم.
- میآموزید چگونه ساختار لوییس به پیشبینی رفتار مولکول کمک میکند.
- یاد خواهید گرفت انواع پیوندهای کووالانسی و نقش آنها را تحلیل کنید.
- میآموزید نقش تقارن و توزیع الکترونی در قطبیت مولکولها چیست.
- با مفهوم بار جزئی و نمادگذاری آن آشنا میشوید.
- میآموزید مقیاس رنگی نقشه پتانسیل چگونه روی تفسیر داده اثر میگذارد.
- خواهید آموخت عوامل کلیدی تعیینکننده قطبیت را شناسایی و ارزیابی کنید.


در ابتدای مطلب، مولکولهای دو اتمی را بررسی میکنیم و نقشههای پتانسیل الکترواستاتیک را نیز مرور میکنیم. در ادامه، اتمی های قطبی و ناقطبی و سپس تشخیص قطبی یا ناقطبی بودن آنها را بیان خواهیم کرد. در انتهای مطلب نیز چندین مثال را در رابطه با بررسی مولکولهای قطبی و ناقطبی بیان میکنیم.
رفتار مولکول ها و توزیع الکترون ها در مولکولهای دواتمی
مولکولهای دواتمی، مولکولهایی هستند که از دو اتم یکسان در هر مولکول تشکیل شده و از طریق پیوندهای شیمیایی اشتراکی یا کووالانسی به یکدیگر متصل شدهاند.
پیوندهای اشتراکی مذکور بین اتمها میتواند در حالات زیر باشد:
- پیوندهای یگانه
- پیوندهای دوگانه
- پیوندهای سهگانه
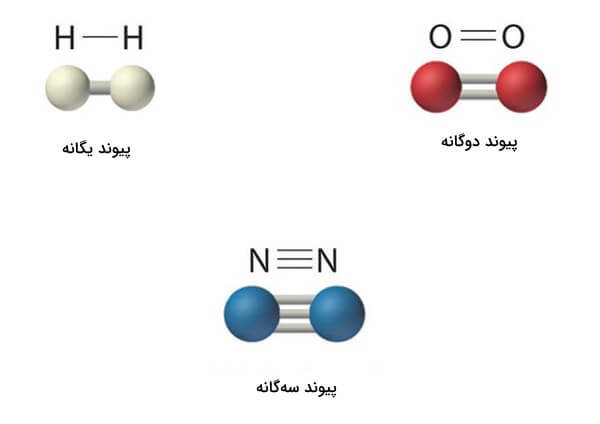
انواع مولکولهای دواتمی
بسته به نوع اتمهای سازنده مولکول دواتمی، دو نوع مولکولِ دواتمی خواهیم داشت:
- مولکولهای دواتمی جور هسته
- مولکولهای دواتمی ناجور هسته
مولکول دواتمی جور هسته
مولکولهای دواتمی جور هسته، از دو اتمِ یک عنصر شیمیایی تشکیل و با پیوند(های) اشتراکی به یکدیگر متصل شدهاند؛ بنابراین نوع اتمها در مولکولهای دواتمی جور هسته یکسان است. این مولکولها، بهعنوان یک ترکیب تکهستهای نیز شناخته میشوند.
عناصر شیمیایی که مولکولهای دواتمی جور هسته را تشکیل میدهند، بهطور معمول عبارتند از:
نکته: گازهای نجیب، مولکولهای دواتمی تشکیل نمیدهند.
نکته: مولکولهای دواتمی، بهدلیل بحث رفتار مولکول ها و توزیع الکترون ها، ناقطبی هستند که در ادامه بیشتر مورد بحث قرار خواهیم داد.
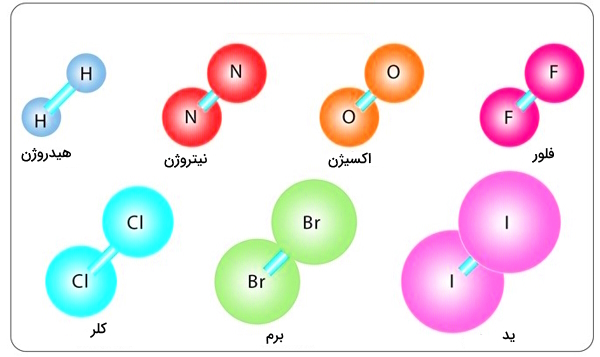
از نمونه مولکولهای دواتمی جور هسته و طبیعتا ناقطبی عبارتند از:
- مولکول هیدروژن () - دارای پیوند یگانه بین دو اتم هیدروژن
- مولکول اکسیژن () - دارای پیوند دوگانه بین دو اتم اکسیژن
- مولکول نیتروژن () - دارای پیوند سهگانه بین دو اتم نیتروژن
- مولکول کلر () - دارای پیوند یگانه بین دو اتم کلر
برخی از نمونههای دیگر این مولکولها را نیز در زیر در تصویر زیر میبینیم.
مولکولهای دواتمی ناجور هسته
مولکولهای دواتمی ناجور هسته، از دو اتم یا دو عنصر شیمیایی مختلف که از طریق پیوند(های) اشتراکی به یکدیگر پیوند میخورند، تشکیل شدهاند؛ یعنی اتمهای مولکولهای دواتمی ناجور هسته با یکدیگر متفاوت هستند.
نکته: مولکولهای دواتمی ناجور هسته، قطبی هستند که رفتار مولکول ها و توزیع الکترونی آنها، این امر را توجیه میکند که در ادامه به آن خواهیم پرداخت.
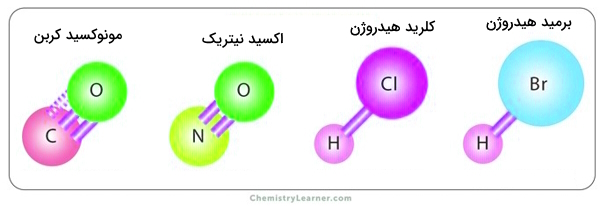
مثالهایی از مولکولهای دواتمی ناجور هسته قطبی عبارتند از:
- هیدروژن فلوراید () - دارای پیوند یگانه بین اتمهای هیدروژن و فلور
- اکسید نیتروژن () - دارای پیوند دوگانه بین اتم نیتروژن و اتم اکسیژن
- مونوکسید کربن () - دارای پیوند سهگانه بین اتمهای کربن و اکسیژن
- کلرید هیدروژن () - دارای پیوند یگانه بین اتمهای هیدروژن و کلر.
برخی از نمونههای تصویری این مولکولها را در زیر میبینیم.
شباهت مولکولهای دواتمی جور هسته و ناجور هسته
در راستای بررسی مولکولهای دو اتمی جور هسته و ناجور هسته در مبحث رفتار مولکول ها و توزیع الکترون ها، میتوانیم به شباهتهای زیر اشاره داشته باشیم:
- تعداد اتمها: هر دو نوع مولکول، دارای دو اتم در هر مولکول هستند.
- ساختار هندسی: هر دو نوع مولکول به لحاظ ساختار هندسی، شکل خطی دارند.
- پیوند شیمیایی: هر دو نوع مولکول، دارای پیوندهای شیمیایی از نوع اشتراکی هستند.
تفاوت مولکولهای دواتمی جور هسته و ناجور هسته
تفاوتهای این دو نوع مولکول را میتوانیم به قرار زیر بیاوریم:
نوع اتمها
تفاوت اصلی بین این دو نوع مولکول این است که در کنار یکسانی تعداد اتمها، نوع اتمها دارای تفاوت است بهاین صورت که:
- مولکولهای دواتمی جور هسته، اتمهای یکسانی دارند.
- مولکولهای دواتمی ناجور هسته، اتمهای متفاوتی دارند.
پیوند شیمیایی
به لحاظ تفاوت در پیوند شیمیایی میتوانیم بگوییم:
- مولکولهای دواتمی جور هسته، دارای پیوندهای اشتراکی ناقطبی هستند.
- مولکولهای دواتمی ناجور هسته، دارای پیوندهای اشتراکی قطبی هستند.
رفتار مولکول ها و توزیع الکترون ها
به لحاظ بررسی از منظر رفتار مولکول ها و توزیع الکترون ها:
- مولکولهای دواتمی جور هسته، دارای توزیع الکترونی متقارن بوده، در میدانهای الکتریکی جهتگیری نکرده و جزو مولکولهای ناقطبی محسوب میشوند.
- مولکولهای دواتمی ناجور هسته، دارای توزیع الکترونی نامتقارن بوده، در میدانهای الکتریکی دچار جهتگیری شده و مولکولهایی قطبی هستند.
نقشههای پتانسیل الکتروستاتیکی
در این قسمت میخواهیم اشارهای داشته باشیم به یکی از موارد مهم در تفسیر رفتار مولکول ها و توزیع الکترون ها و درنتیجه قطبی بودن مولکولها، یعنی نقشه پتانسیل الکتروستاتیک که لازم است قبل از آن با مفهوم بار جزئی آشنا شویم.
بار جزئی
بار جزئی () روی یک اتم، باری است با مقدار عددی کمتر از یک که برای نشان دادن توزیع نابرابر الکترونهای مشترکِ پیونداشتراکی، استفاده میشود.
قسمتهای عددیِ داخل کادر در تصاویر بالا، نشاندهنده علامت و مقدار بار جزئی است که برای داشتن دید بهتر، در اینجا بهصورت عددی آورده شده است تا وقتی بعد از این، صحبت از بارهای جزئیِ منفی یا بارهای جزئیِ مثبت میشود که با نمایش خواهیم داد، در نظر داشته باشیم که بهاین مقادیر جزئی مثبت یا منفی اشاره دارد. پس بهطور کلی میتوانیم بگوییم:
- بارهای جزئی با استفاده از حرف کوچک یونانی دلتا () نشان داده میشود.
- نشاندهنده بار جزئی منفی است.
- نشاندهنده بار جزئی مثبت است.
حال این تصاویر سهبعدی رنگی که بارهای جزئی را با آن به تصویر میکشیم، نقشههای پتانسیل الکتروستاتیکی مینامیم؛ بهعنوان مثال، نقشه پتانسیل الکتروستاتیکی کلرومتان را در تصویر زیر میبینیم.
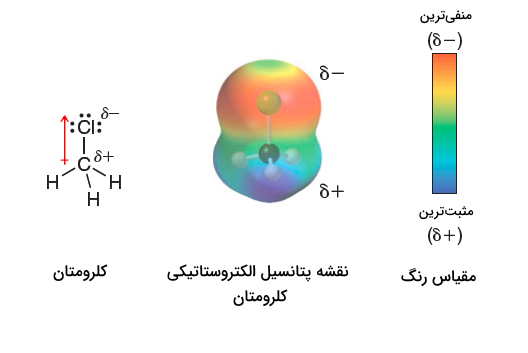
مقیاس رنگی
در نقشههای پتانسیل الکتروستاتیکی، از طیفهای رنگی برای نشاندادن مناطق و استفاده میکنیم که انتخاب رنگهای نمادین، بستگی به مقیاس رنگی انتخاب شده دارد و میتواند در منابع مختلف متفاوت باشد؛ بهعنوان مثال در تصویر بالا برای کلرومتان، همانطور که در مقیاس رنگی در سمت راست آورده شده، میبینیم:
- رنگ قرمز نشاندهنده منطقه است.
- رنگ آبی نشاندهنده منطقه است.
نکات بسیار مهم در مقیاس رنگیِ نقشهها
توجه به چند نکته بسیار مهم در ارتباط با نقشههای پتانسیل الکتروستاتیکی و بهکارگیری آنها ضروری است که از آن جمله میتوان به موارد زیر اشاره داشت:
- ممکن است از مقیاسهای رنگی مختلفی در ترسیم هر یک از نقشهها استفاده شود، حتی ممکن است رنگی در مقیاس رنگی نقشهای برای بار جزئی مثبت و در مقیاس رنگیِ نقشه دیگری، برای بار منفی لحاظ شده باشد.
- مقایسه هر دو نمونه از نقشههای پتانسیل الکتروستاتیکی، تنها در صورتی معتبر خواهد بود که هر دوی آنها با استفاده از مقیاسهای رنگی یکسانی تهیه شده باشند؛ بهعنوان مثال، مقایسه دو نقشه از صفحات مختلف یک کتاب با نقشهای از کتاب دیگر، مفید نخواهد بود؛ چون به احتمال بالا در مقیاسهای رنگی هرکدام تفاوتهایی خواهیم داشت.
- در مقاله حاضر نیز، چون نقشههای پتانسیل الکتروستاتیکی استفاده شده برای تشریح مطالب، الزاما از منابع یکسانی و با مقیاسهای رنگی یکسانی تهیه نشدهاند، تفاوتهایی در رنگبندی آنها خواهیم دید و در هر گروه، باید به مقیاس رنگی آورده شدهِ مربوط به آن توجه و بررسیها را مبتنی بر آن انجام بدهیم.
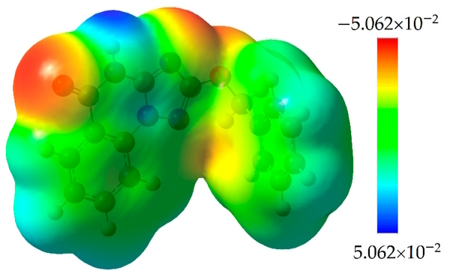 au تا au." width="450" height="277">
au تا au." width="450" height="277">
در تصویر بالا نیز مقیاس رنگی که نقشه پتانسیل الکتروستاتیکی مولکول مربوطه، مبتنی بر آن ترسیم شده و درجه رنگهای آن آورده شده است.
محاسبات نقشه پتاسیل الکتروستاتیکی
این نقشهها با استفاده از یک سری محاسبات ویژه ایجاد میشوند. بهاین صورت که یک نقطه فرضی با بار مثبت در نقاط مختلف در نظر گرفته و برای هر یک از این مکانها، انرژی پتانسیل ناشی از جاذبه بین بار مثبت نقطه مد نظر و الکترونهای اطراف آن را محاسبه میکنیم. جاذبه بزرگ نشاندهنده موقعیت و جاذبه کوچک نشاندهنده موقعیت است. سپس نتایج بررسیها و محاسبات را با استفاده از رنگها نمایش میدهیم.
اتم ناقطبی و قطبی
بار منفی الکترونهای اتم، بار مثبت پروتونهای آن را تعدیل میکند. اتمهایی که الکترونهای آنها بهطور متقارن در اطراف هسته توزیع شده، اتمهای ناقطبی هستند و برعکس.
مانند تصویر زیر که نقشه پتانسیل الکتروستاتیکی اتم هیدروژنِ ناقطبی را نشان میدهد. اگر به مقیاس رنگی توجه کنیم، در پایین تصویر، میبینیم که کد رنگ سبز، نشاندهنده محدوده ناقطبی است.
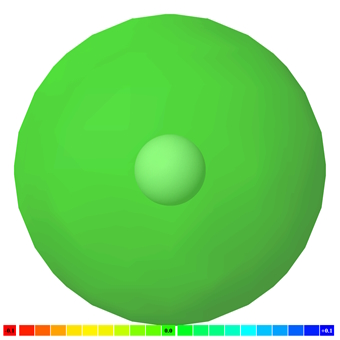
رفتار مولکول ها و توزیع الکترون ها در مولکول ناقطبی و قطبی
در این قسمت قصد داریم بررسی و نگاهی مبسوط داشته باشیم به مولکولهای ناقطبی و قطبی که نمونه آنها را در تصاویر مشاهده میکنیم.
بررسی شکل ظاهری این مولکولها، با مولکولهای قطبی در تصویر پایین، تاحدی به لحاظ بصری قدرت تشخیص اولیه این مولکولها را به ما میدهد ولی بررسی دقیقتر، مستلزم توجه به ابعاد بیشتری خواهد بود.
عوامل موثر در قطبیت مولکولها
عوامل مختلفی در قطبیت مولکولهای دارای پیوندهای اشتراکی، تعیینکننده است که سه مورد از مهمترین آنها عبارتند از:
- الکترونگاتیوی
- گشتاور دوقطبی
- هندسه مولکولی
در ادامه به بررسی یکبهیک این عوامل میپردازیم.
الکترونگاتیوی
الکترونگاتیوی اتم، به میل آن نسبت به الکترونها اشاره دارد. درست مانند آهنربایی که قطب ناهمنام آهنربای دیگری را جذب میکند، الکترونگاتیوی نیز توانایی یک اتم برای جذب جفتالکترون مشترک از پیوند اشتراکی است. نکات فهرست زیر را در رابطه با الکترونگاتیوی میتوان در نظر گرفت.
- در مولکولهای دواتمی جور هسته که اتمهای یک نوع عنصر با هم ترکیب میشوند و پیوند اشتراکی ایجاد میکنند، بهعنوان مثال و ، بارهای مثبت و منفی همچنان متقارن بوده و پیوند بهطور طبیعی ناقطبی است. یعنی هیچ قطب منفی و مثبتی ایجاد نمیشود، چون هیچ تفاوتی در الکترونگاتیوی بین اتمهای پیوندی وجود ندارد. بنابراین ابر الکترونی بهطور مساوی بین هر دو اتم تقسیم میشود. میدانیم توزیع بار نابرابر بین مراکز مختلف یک مولکول است که منجر به تشکیل مولکولهای قطبی میشود. پس هیچ پیوند اشتراکی صرفا ناقطبی نیست مگر اینکه از دو اتم یکسان تشکیل شده و در اصطلاح جور هسته باشد.
- در پیوند اشتراکی بین دو اتم غیرهمسان در مولکولهای ناجور هسته، مانند پیوند با مقایسه الکترونگاتیوی بین اتمهای و ، یک پیوند اشتراکی قطبی تشکیل میشود. چون تفاوت الکترونگاتیوی، ابر الکترونی مشترک را غیریکنواخت میکند، بهگونهای که یک اتم بار جزئی مثبت و دیگری بار جزئی منفی پیدا میکند، بنابراین، این پیوند بهعنوان پیوند اشتراکی قطبی شناخته میشود. بهعنوان مثال، در بررسی مولکول هیدروژن فلورید ()، اتم فلور الکترونگاتیوتر از اتم هیدروژن است. در نتیجه، فلور جفتالکترون پیوندی را در مولکول به سمت خود میکشد و بار جزئی منفی () روی اتم فلور و بار جزئی مثبت () روی اتم هیدروژن ایجاد میکند، پس پیوند قطبی است.
- بر اساس مقیاس پاولینگ ()، اگر اتمهای پیوندی دارای اختلاف الکترونگاتیوی بین ۰.۵ تا ۱.۶ واحد باشند، پیوند اشتراکی قطبی است.
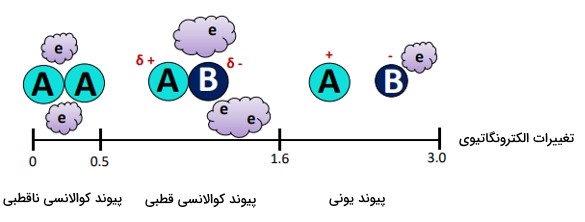
گشتاور دوقطبی
گشتاور دوقطبی کمیتی برداری است که جهت قطبیت یک پیوند یا یک مولکول قطبی را نشان میدهد.
در واقع این معیار، نشاندهنده جدایی بین دو اتمِ با بار مخالف در یک پیوند قطبی است. گشتاور دوقطبی را با یک علامت برداری نشان میدهیم که بر اساس قرارداد در شیمی، پیکان گشتاور را از انتهای مثبت به مرکز منفی نشان میدهیم.
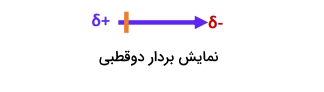
از لحاظ ریاضی و محاسباتی، گشتاور دوقطبی که دارای نماد است، بهصورت حاصلضرب بار الکتریکی () و جداسازی بار، یعنی طول پیوند () تعریف و در واحدهای دبای (Debye) محاسبه میشود که با نماد نشان میدهیم.
در رابطه بالا:
- با کولن () اندازهگیری میشود.
- در واحد فاصله، یعنی متر محاسبه میشود.
جابجایی الکترونها از یک نقطه به نقطه دیگر در یک پیوند اشتراکی منجر به قطبیت پیوند میشود.
هندسه یا شکل مولکولی
آرایش نامتقارن پیوندهای قطبی در شکل هندسی مولکولها، در نهایت به قطبیت کلی مولکول کمک میکند.
مولکول ناقطبی
بر اساس عوامل بالا، اگر مولکولها دارای توزیع بار خالصِ متعادل باشند، ناقطبی خواهند بود و این زمانی اتفاق میافتد که گشتاورهای دوقطبی پیوندهای قطبیِ جداگانه، بهدلیل شکل متقارن مولکول در جهات مخالف، خنثی شوند. به عبارت دیگر اگر مولکولهای دارای پیوندهای قطبی، بهشکلی متقارن دست یابند، بهطوری که چگالی کلی الکترونها، حول صفحهای عمود بر مرکز محور مولکول متعادل شود، چنین مولکولی بهطور کلی ناقطبی است. رفتار این مولکول ها به دلیل توزیع یکنواخت الکترونهای آنها متفاوت از مولکولهای ناقطبی خواهد بود.
مولکول قطبی
بر اساس عوامل مذکور، در صورتی یک مولکول قطبی خواهد بود که چگالی ابر الکترونیِ کلیِ غیر یکنواخت داشته باشد. یعنی چگالی الکترونی نامتقارن، مولکولهای قطبی را تشکیل میدهد.
تفاوت بین مولکول قطبی و ناقطبی
موارد بالا را بهطور خلاصه در جدول زیر میآوریم:
| نوع مولکول | قطبی | ناقطبی |
| الکترونگاتیوی اتمها | اتمها ممکن است مقادیر الکترونگاتیوی یکسان یا متفاوتی داشته باشند. | اتمها دارای مقادیر الکترونگاتیوی متفاوتی هستند. |
| توزیع بار | توزیع بار نابرابر در کل مولکول | توزیع بار یکسان در کل مولکول |
| گشتاور دوقطبی | گشتاور دوقطبی خالص بزرگتر از صفر است. | گشتاور دوقطبی خالص برابر با صفر است. |
| مثال | آب
اتانول آمونیاک دیاکسید گوگرد | اکسیژن
نیتروژن تریاکسید گوگرد |
تشخیص مولکول ناقطبی و قطبی مبتنی بر پیوند اتمها
در این قسمت میخواهیم با نحوه تشخیص قطبیتها، با توجه به نوع و تعداد پیوند آنها، برای بررسی رفتار مولکول ها و توزیع الکترون ها آشنا شویم.
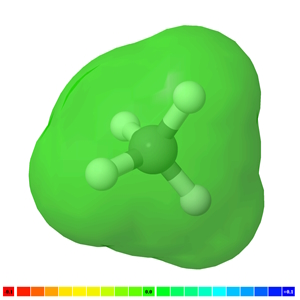
مولکول بدون پیوند قطبی: ناقطبی
اگر در مولکولی، پیوند قطبی وجود نداشته باشد، ناقطبی است. بهعنوان مثال: ، و نمونههایی از مولکولهای ناقطبی هستند. تصویر زیر، مولکول را با ابر الکترونی سبز رنگ نشان میدهد که نشاندهنده یک مولکول ناقطبی است.
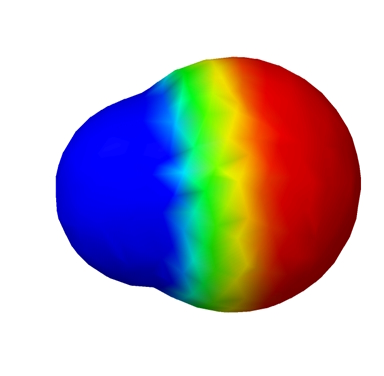
مولکول با یک پیوند قطبی: قطبی
اگر تنها یک پیوند قطبی در مولکول وجود داشته باشد، مولکول قطبی است. بهعنوان مثال، مولکول که در شکل زیر نشان داده شده است.
مولکول با بیش از یک پیوند قطبی: لازم به بررسی
اگر بیش از یک پیوند قطبی در یک مولکول وجود داشته باشد، بسته به تقارن مولکولی، احتمال قطبی یا ناقطبی بودن مولکول است.
- اگر مولکول متقارن باشد، بردار قطبی پیوندهای یگانه خنثی و مولکول ناقطبی میشود. بهعنوان مثال، در تصاویر زیر، مولکولهای متقارنی را نشان دادهایم که دارای پیوندهای قطبی بوده ولی پیوندهای قطبی یکدیگر را خنثی کرده و در نهایت مولکول ناقطبی است و همانطور که میدانیم رفتار این مولکول ها به دلیل توزیع الکترون های یکنواخت، متفاوت تر بوده و در میدان الکتریکی جهتگیری نمیکنند.
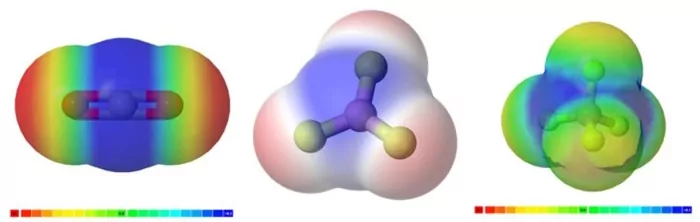
- اگر مولکولی دارای پیوندهای قطبی بوده و نامتقارن باشد، بردارهای قطبی خنثی نشده و مولکول قطبی است. نمونههایی از مولکولهای قطبی را در تصویر زیر میبینیم.
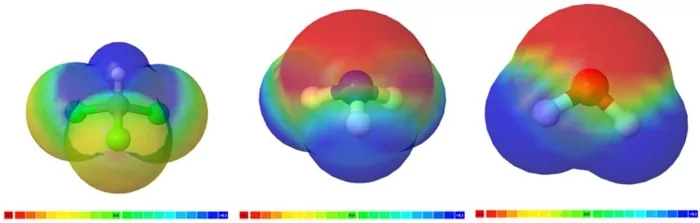
مولکولهای دواتمی ناقطبی و قطبی
حال که با مفهوم مولکولهای قطبی و ناقطبی بهطور اجمالی آشنا شدیم، میخواهیم بهطور ویژه این مبحث را در مورد مولکولهای دواتمی داشته باشیم. اینکه آیا مولکولهای دواتمی قطبی هستند یا ناقطبی؟ یا تحت چه شرایطی قطبی یا ناقطبی هستند؟
مولکول دواتمی جور هسته: مولکولهای ناقطبی
پیشتر اشاره کردیم، هر دو اتمِ مولکولهای دواتمی جور هسته، یکسان است، پس الکترونگاتیوی آنها نیز برابر بوده و جفتالکترونهای پیوندی بین دو اتم بهطور مساوی توزیع شده و گشتاور آنها صفر و به دلیل شکل متقارن، مولکول ناقطبی است که باعث عدم جهتگیری این مولکولها در میدانهای الکتریکی میشود و این مولکولها ناقطبی هستند.
مولکول دواتمی ناجور هسته: مولکولهای قطبی
بهدلیل تفاوت در اتمهای مولکولهای دواتمی ناجور هسته، الکترونگاتیوی آنها نیز با یکدیگر متفاوت است، زیرا هر اتم، به عناصر شیمیایی مختلف تعلق داشته و میدانیم عناصر شیمیایی مختلف دارای مقادیر الکترونگاتیوی متفاوتی هستند که این تفاوت الکترونگاتیوی باعث جذب جفتالکترونهای پیوندی توسط اتم با الکترونگاتیوی بالاتر شده و بین اتمها، پیوندهای شیمیایی قطبی تشکیل میشود که با لحاظ گشتاور دوقطبی و ساختار هندسی آنها، این مولکولها قطبی هستند.
بررسی ناقطبی و قطبی بودن در چند مولکول
در این قسمت قصد داریم، موارد یاد گرفته شده را بر روی نمونههایی پیادهسازی و آنها را به لحاظ قطبی و ناقطبی بودن و در حالت کلیتر، نوع رفتار مولکول ها بسته به توزیع الکترون ها مورد بررسی قرار بدهیم.
بررسی مولکول آب ()
آب با فرمول شیمیایی ، مادهای حیاتی و حلالی جهانی است که رنگ، طعم و بوی ترکیبات شیمیایی مختلفی را که در آن حل میشوند میپذیرد. بهدلیل اهمیت آب برای تمامی اشکال حیات بر روی زمین، مطالعه و بررسی شیمی آن نیز اهمیت دارد که قطبیت، یکی از این ویژگیهای شیمیایی است که در این قسمت قصد داریم به آن بپردازیم.
دانستیم سه عامل وجود دارد که قطبیت مولکولها از جمله مولکول را کنترل میکند:
- الکترونگاتیوی
- گشتاور دوقطبی
- هندسه یا شکل مولکولی
در ادامه، در مورد هر یک از این سه عامل زیر بحث مفصلی انجام میدهیم که به ما در درک بهتر ماهیت قطبی کمک میکند.
الکترونگاتیوی
مولکول آب دارای توزیع نابرابری از الکترونها است زیرا اکسیژن، ، بسیار الکترونگاتیوتر از هیدروژن، ، است. بهدلیل این تفاوت الکترونگاتیوی ۱٫۲۴ واحد، اکسیژن بهشدت ابر الکترونی مشترک را از هر یک از دو پیوند در مولکول جذب میکند. یعنی جاذبه یا کشش قویتری بر روی الکترونها نسبت به هیدروژن اعمال میکند.
میتوانیم این توزیع الکترونی و نیروهای اعمالی بر الکترونها را مانند بازی کشیدنِ طناب در نظر بگیریم که اکسیژن در نزدیکتر کردن الکترونهای مشترک به خود، بسیار قویتر از هیدروژن عمل کرده و منفیتر میشود.
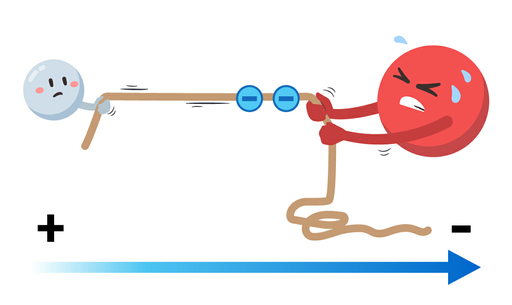
این فرایند بهاین معنی است که توزیع بار در سراسر مولکول آب غیر یکنواخت است. سمت اکسیژن در مولکول دارای بار جزئی منفی و سمت هیدروژن دارای بار جزئی مثبت خواهد بود و این توزیع نابرابر بار الکتریکی باعث میشود که مولکول قطبی باشد.
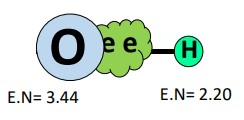
اکسیژن، بار جزئی منفی بهدست می آورد، در حالیکه هر یک از اتمهای هیدروژن، بار جزئی مثبت بهدست می آورند. بنابراین، پیوندهای در مولکول قطبی هستند.
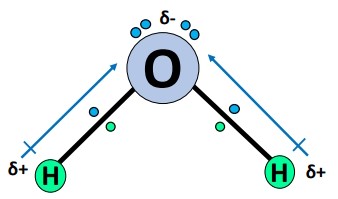
گشتاور دوقطبی
همانطور که در قسمت بالا دیدیم، هر یک از پیوندهای در مولکول قطبی است. این بدان معناست که پیوندهای دارای مقدار گشتاور دوقطبی خاصی هستند.
گشتاور دوقطبی پیوندهای ، از مرکز مثبت بهطرف مرکز منفی منتهی میشود و همانطور که در شکل زیر نشان داده شده است است.
هندسه مولکولی
مولکول آب، از دو پیوند اشتراکی یگانه تشکیل شده است. در مجموع ۸ الکترون ظرفیتی در مولکول وجود دارد. اتم اکسیژن دارای شش و اتم هیدروژن دارای یک الکترون ظرفیت است. اتم اکسیژن، از دو الکترون ظرفیت خود برای اتصال به هر یک از اتمهای هیدروژن، در هر دو طرف استفاده میکند. بدین ترتیب، اتم اکسیژن به آرایش الکترونی هشتگانه پایدار دست مییابد (هشتتایی خود را کامل میکند)، در حالیکه هر یک از اتمهای هیدروژن به آرایش الکترونی دوتایی میرسند. میدانیم دو جفت تکالکترون دیگر نیز بر روی اتم مرکزی، اکسیژن، وجود دارند که میخواهیم وضعیت آنها نیز مشخص شود.
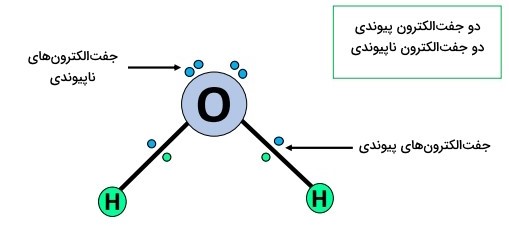
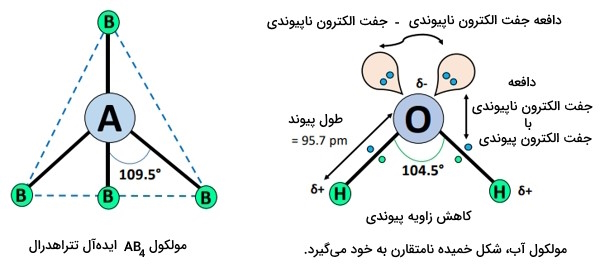
بر اساس نظریه دافعه جفتالکترون لایه ظرفیت که بهاختصار VSEPR نامیده میشود، مولکولی از نوع است؛ بهاین صورت که در اطراف اتم اکسیژن مرکزی ()، دو جفت پیوند () و دو جفت تک الکترون () وجود دارد.
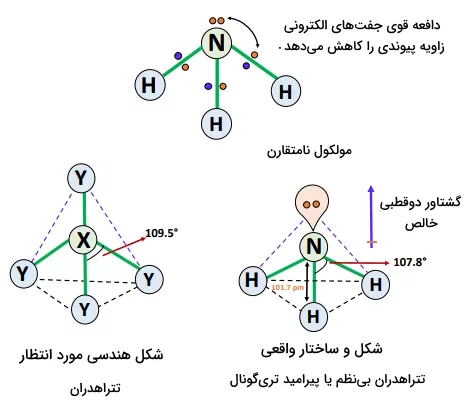
هندسه الکترونی ایدهآل برای یک مولکول نوع چهاروجهی است، اما وجود دو جفتالکترون تنها در منجر به دافعههای «جفت تنها - جفت تنها» و «جفت تنها - جفت پیوندی» میشود که آن هم بهنوبه خود منجر به کاهش زاویه پیوند از ۱۰۹٫۵ درجه به ۱۰۴٫۵ درجه میشود.
در تصویر زیر، قطبیت بالای مولکول آب به همراه گشتاور دوقطبی خالص آورده شده است.
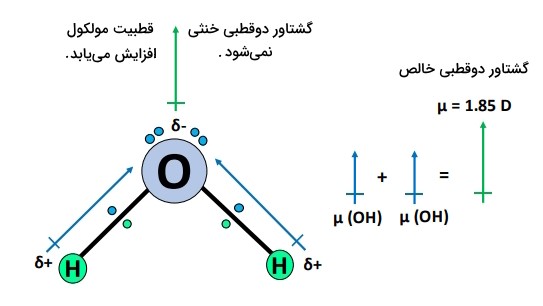
در ادامه فرآیندهای بالا، مولکول بهشکل خمیده نامتقارن در میآید؛ با توجه به آرایش نامتقارن اتمها، تاثیر گشتاورهای دوقطبی افزایش مییابد؛ بنابراین، بهطور کلی یک مولکول قطبی با گشتاور دوقطبی خالص D ۱٫۸۵ است.
خلاصه
با توجه به موارد طرح و تشریح شده در بالا، نتیجه میگیریم مولکول :
- طبیعتی بسیار قطبی دارد.
- دارای دو پیوند است که بهدلیل اختلاف الکترونگاتیوی بین اتمهای و ، این پیوندها قطبی است.
- شکل نامتقارن یا خمیده مولکول آب، قطبیت پیوندهای را حفظ و قطبیت آب را بیشتر حفظ میکند.
- دو جفتالکترون ناپیوندی موجود روی اتم اکسیژن، باعث ایجاد اثر دافعه میشوند، بهطوری که مولکول آب بهشکل خمیده با زاویه پیوند 104.5 درجه و طول پیوند 95.7 pm تبدیل میشود.
- گشتاورهای دوقطبی پیوندهای خنثی نمیشوند، بلکه بهدلیل شکل نامتقارن مولکول، اثر آنها افزایش مییابد.
- در نهایت مولکول ، یک مولکول قطبی با گشتاور دوقطبی خالص ۱٫۸۵ دبای است.
بررسی مولکول آمونیاک ()
احتمالا با بوی تندی که هنگام کار در نزدیکی هود آزمایشگاه شیمی میآید آشنا هستیم؛ این بوی تندِ معمول، متعلق به یک ترکیب شیمیایی با نام آمونیاک، با فرمول شیمیایی است. آمونیاک گازی بیرنگ و بدبو و مولکولی بسیار مهم با خواص شیمیایی جالب و کاربردهای مهم و مفید است. در این قسمت، در مورد یکی از ویژگیهای شیمیایی بسیار مهم ، یعنی قطبیت آن که موضوع مقاله ما است بحث میکنیم. بهطور کلی، آمونیاک () یک مولکول قطبی است که به بررسی مرحله به مرحله آن میپردازیم.
الکترونگاتیوی
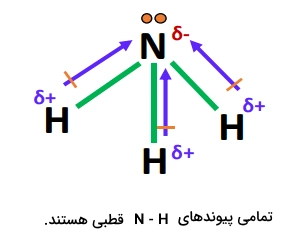
اتم نیتروژن، ، نسبت به اتم هیدروژن،، بسیار الکترونگاتیوتر است و میبینیم که بین این دو اتم، اختلاف الکترونگاتیوی ۰٫۸۴ واحد وجود دارد؛ بنابراین، بارهای روی اتمهای نیتروژن و هیدروژن، بهطور نابرابر و غیریکنواخت توزیع میشوند؛ بهاین صورت که سه اتم هیدروژن () در مولکول، از طریق پیوندهای اشتراکی یگانه، به اتم نیتروژن مرکزی متصل میشوند و نیتروژن که خود دارای ۵ الکترون ظرفیت است، اکتت خود را کامل میکند، در حالیکه هر یک از اتمهای هیدروژن، از طریق تشکیل به آرایش الکترونی دوتایی دست مییابد.
در نهایت نیتروژن با قدرت بیشتری ابر الکترونی مشترک از هر پیوند را جذب کرده و بار جزئی منفی بهدست میآورد، در حالیکه اتمهای هیدروژن، بار جزئی مثبت دست میآورند؛ بنابراین، پیوندهای قطبی بوده و ابر الکترونی بهطور نابرابر بین اتمهای نیتروژن و هیدروژن توزیع میشود.
| اتم | آرایش الکترونی | تعداد الکترونهای ظرفیت |
| نیتروژن | ۵ | |
| هیدروژن | ۱ |
قطبی بودن پیوندهای در تصویر زیر نمایش داده شده است.

گشتاور دوقطبی
با در نظر گرفتن تفاوت الکترونگاتیوی بین اتمهای و ، هر پیوند در مولکول با گشتاور دوقطبی ۰٫۸۴ دبای، قطبی است. جهت گشتاور دوقطبی هر پیوند از هیدروژن () بهطرف نیتروژن () است. اگر گشتاور دوقطبی خالص سه پیوند را جمع کنیم، ۱٫۴ دبای بهدست میآوریم که مقداری بالاتر از صفر است.
هندسه مولکولی
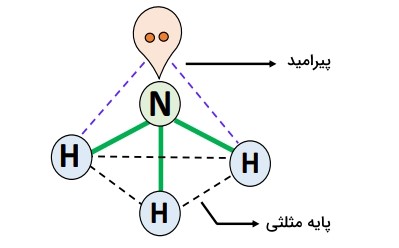
دارای شکل هندسی هرمی مثلثی () است؛ بهاین حالتکه اتم نیتروژن () در راس و سه اتم هیدروژن، هرکدام در گوشههای قاعده مثلثیِ هرم قرار دارند.
طبق نظریه ، مولکولی از نوع است که سه جفت پیوندی () و یک جفتالکترون () در اطراف اتم نیتروژن مرکزی () وجود دارد.
اتم نیتروژن مرکزی، هیبرید شده است؛ بنابراین هندسه الکترونی ایدهآل چهاروجهی است؛ اما وجود جفتالکترونهای ناپیوندی، الکترونهای پیوندی را بهگونهای دفع میکنند که شکل هندسی چهاروجهی مخدوش یا هرمی مثلثی بهدست میآورد و زاویه پیوند از ۱۰۹٫۵ درجه به ۱۰۷٫۸ درجه کاهش مییابد. طول پیوند نیز برابر با ۱۰۱٫۷ پیکومتر است.
خلاصه
با توجه به موارد طرح شده در بالا، نتیجه میگیریم مولکول :
- یک مولکول قطبی است.
- در ، پیوندهای یگانه قطبی هستند؛ زیرا اتم نیتروژن الکترونگاتیوتر از اتم هیدروژن بوده و گشتاور دوقطبی از به است.
- شکل نامتقارن است؛ بنابراین، سه پیوند دوقطبی که از به هدایت میشوند، خنثی نشده و از بین نمیروند.
- گشتاور دوقطبی خالص سه پیوند دوقطبی در یک جهت، ۱.۴۶ دبای است، بنابراین، مولکول قطبی آمونیاک بهدست میآید.
در جدول زیر چکیده ای از مواردی را که در خصوص بررسی قطبیت مولکول آمونیاک مورد بررسی قرار خواهیم داد، آورده شده است.
| نام مولکول | آمونیاک () |
| نوع پیوند | اشتراکی قطبی |
| هندسه مولکولی | هرمی مثلثی |
| قطبی یا ناقطبی؟ | قطبی |
| ممان دوقطبی | ۱.۴۶ |
| زاویه پیوند | ۱۰۷.۸ درجه |
)">بررسی مولکول کلروفرم ()
نام برای تری کلرومتان () و نام تجاری رایج آن کلروفرم (Chloroform) است. کلروفرم مایعی بیرنگ و متراکم، با بوی بسیار قوی است. نامگذاری برای کلروفرم نشان میدهد که از سه اتم کلر تشکیل شده است که در مرکز به یک اتم کربن پیوند دارند؛ یعنی کلروفرم زمانی تشکیل میشود که ۳ اتم هیدروژنِ متان () با سه اتم هالوژن () جایگزین شوند. کلروفرم () مولکولی قطبی است که به بررسی عوامل موثر بر قطبیت که آن را به مولکولی قطبی با توزیع ابر الکترونی غیریکنواخت تبدیل میکنند، میپردازیم.
الکترونگاتیوی
، شکل یا هندسه ظاهرا متقارن چهاروجهی دارد؛ با این حال، گشتاورهای دوقطبی پیوندهای قطبی مجزا حتی در این شکل چهاروجهی خنثی نمیشوند و چگالی ابر الکترونی نامتعادل کلی در مولکول وجود دارد؛ بنابراین مولکولی قطبی با گشتاور خالص بیشتر از صفر است () ؛ یعنی با اینکه تفاوت الکترونگاتیوی کوچکی بین اتم کربن، ، و اتم هیدروژن، ، وجود دارد، و تفاوت الکترونگاتیوی ۰.۳۵ < ۰.۵ است، اما همچنان پیوند در کمی قطبی است؛ ولی علت چیست؟
| اتم | آرایش الکترونی | تعداد الکترونهای ظرفیت |
| کربن | ۴ | |
| هیدروژن | ۱ | |
| کلر | ۷ |
هالوژنهای موجود در گروه VII A (گروه ۱۷) جدول تناوبی، عناصری بسیار الکترونگاتیو هستند و برای تکمیل آرایش الکترونی هشتگانه خود یک الکترون کم دارند؛ بنابراین ابر الکترونی مشترک از پیوند اشتراکی را بهشدت جذب میکنند.
کلر یک هالوژن با الکترونگاتیوی بالا، ، است که تفاوت الکترونگاتیوی بالایی بین اتم کربن و اتم کلر وجود دارد، یعنی ؛ بنابراین هر پیوند در مولکول قطبی است.
سه اتم کلر نهتنها ابر الکترونی مشترک هر یک از سه پیوند ، بلکه پیوند را نیز جذب میکنند و این تفاوتهای الکترونگاتیوی، قطبهای مثبت و منفی را در مولکول کلروفرم ایجاد میکنند.
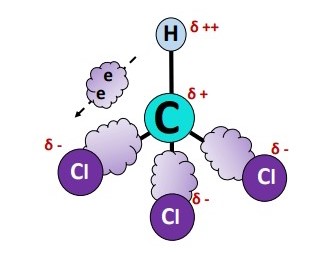
گشتاور دوقطبی
گشتاور دوقطبی پیوند از مرکز با بار جزئی مثبت در اتم کربن () بهطرف مرکز با بار جزئی منفی در اتم کلر () اشاره میکند؛ از طرف دیگر اتم کربن نسبتا الکترونگاتیوتر از اتم هیدروژن است؛ بنابراین گشتاور دوقطبی پیوند از اتم کربن () بهطرف اتم هیدروژن () خواهد بود.
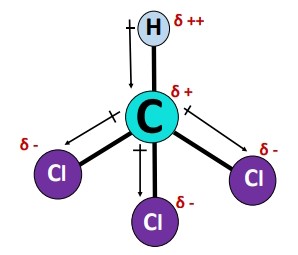
هندسه مولکولی
کربن متعلق به گروه ۱۴ جدول تناوبی و دارای ۴ الکترون ظرفیتی برای برقراری پیوند است. در ، کربن مرکزی به یک اتم هیدروژن و سه اتم کلر پیوند دارد؛ بدین ترتیب، کربن و همچنین تمامی اتمهای کلر، به آرایش الکترونی هشتگانه پایدار دست مییابند و اتم هیدروژن نیز دوتایی خود را کامل میکند.
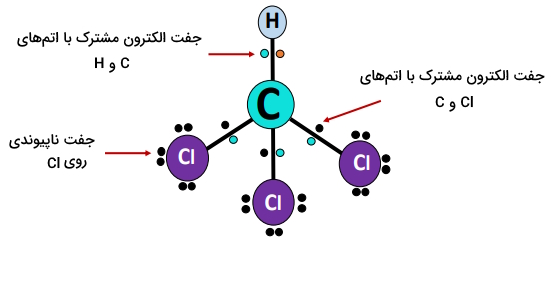
تمامی الکترونهای ظرفیتِ کربن در تشکیل پیوند اشتراکی در درگیر میشوند؛ بنابراین، ۴ جفت پیوندی () در اطراف اتم کربن مرکزی () وجود دارد و هیچ جفت تکی وجود ندارد؛ چنین مولکولی با توجه به تئوری ، بهعنوان مولکول نوع شناخته میشود.
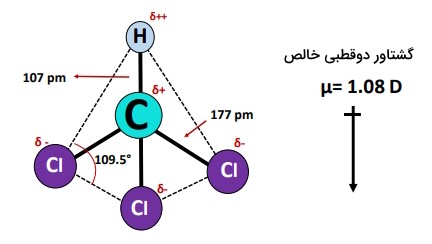
مولکول دارای هندسه چهاروجهی با زاویه پیوند متقابل ۱۰۹.۵ درجه است؛ اگرچه چهاروجهی از نظر هندسی یک شکل متقارن است، زیرا ۴ اتم در چهارگوشه یک چهاروجهی وجود دارد، اما در این مورد، پیوندهای رو به پایین، ابر الکترونی مشترک پیوند را نیز علاوهبر الکترونهای هریک از پیوندهای ، جذب میکنند.
خلاصه
با توجه به موارد طرح و بررسی شده در مورد مولکول نتیجه میگیریم:
- مولکولی قطبی است.
- کلروفرم دارای سه اتم کلر و یک اتم هیدروژن است که در مرکز مولکول با اتم کلر پیوند دارند.
- در کلروفرم، تفاوت الکترونگاتیوی قابل توجهی (۰.۶۱ واحد) بین اتمهای پیوند کربن و کلر وجود دارد.
- اتم کلر، در پیوند ، ابر الکترونی را با شدت بیشتری جذب میکند.
- تفاوت الکترونگاتیوی کمی بین اتمهای کربن و کلر وجود دارد؛ بنابراین کلر، ابر الکترونی پیوند را جذب میکند.
- هندسه و شکل الکترونی مولکول چهاروجهی با زاویه پیوند متقابل ۱۰۹.۵ درجه است؛ اما ابر الکترونی مشترک مولکول بهطور کلی متعادل نیست.
- دارای گشتاور دوقطبی خالص ۱.۰۸ دبای است.
و اگر بخواهیم موارد را در جدول قرار دهیم خواهیم داشت:
| نام مولکول | تری کلرومتان یا کلروفرم () |
| نوع پیوند | اشتراکی قطبی |
| هندسه مولکولی | چهاروجهی |
| قطبی یا ناقطبی؟ | قطبی |
| ممان دوقطبی | ۱.۰۸ |
| زاویه پیوند | ۱۰۹.۵ درجه |
بررسی مولکول تتراکلرید کربن ()
فرمول شیمیایی مایعی بیرنگ و خوشبو بهنام تتراکلرید کربن () است که گاهی آنرا با نام تتراکلرومتان () نیز میشناسیم. تترا به معنای چهار است؛ بنابراین میفهمیم که در تتراکلرید کربن چهار اتم کلر به اتم کربن متصل است. حال میخواهیم به بررسی این موضوع برویم که آیا ماهیت قطبی دارد یا ناقطبی.
الکترونگاتیوی
کلر () هالوژنِ موجود در گروه (گروه ۱۷) جدول تناوبی و دارای ۷ الکترون ظرفیتی است؛ بنابراین تمایل بالایی برای بهدست آوردن یک الکترونِ بیشتر و دستیابی به آرایش الکترونی هشتگانه پایدار دارد که این میل شدید به الکترون، حاکی از الکترونگاتیوی بالای اتم کلر است.
| اتم | آرایش الکترونی | تعداد الکترونهای ظرفیت |
| کربن | ۴ | |
| کلر | ۷ |
قبلا یاد گرفتیم که تمامی پیوندهای اشتراکی، با اختلاف الکترونگاتیوی بالاتر از ۰.۵ بین اتمهای پیوندی، ماهیت قطبی دارند و هرچه اختلاف الکترونگاتیوی بیشتر باشد، قطبیت پیوند بیشتر خواهد بود؛ در اینجا، اتم کلر، ، الکترونگاتیوتر از اتم کربن، ، است، اختلاف الکترونگاتیوی ۳.۱۶ - ۲.۵۵ = ۰.۶۱ واحد و اتم کلر بهدلیل الکترونگاتیوی بالاتر، ابر الکترونی مشترک از هر پیوند در مولکول را بهشدت جذب میکند و جابجایی ابر الکترونی مشترک به سمت اتم کلر، تا حد زیادی باعث ایجاد قطبهای باردار مخالف در مولکول میشود.
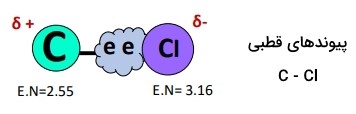
در نتیجه در اتم کلر بهدلیل مقدار بیشتر الکترون، بار جزئی منفی () و در هر اتم کربن بهدلیل کمبود جزئی الکترون، بار جزئی مثبت () ایجاد میشودِ؛ بنابراین، هر یک از پیوندهای در مولکول ، بهطور جداگانه یک پیوند قطبی است.
گشتاور دوقطبی
جهت گشتاور دوقطبی هر یک از پیوندهای در مولکول ، از اتم کربن () بهطرف اتم کلر () است. مقدار این گشتاور تقریبا برابر با اختلاف الکترونگاتیوی بین اتمهای پیوندی است.
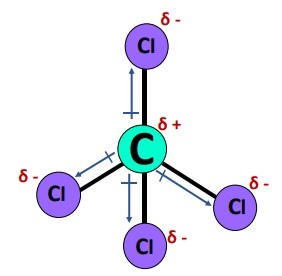
دیدیم که هریک از پیوندهای در مولکول ، قطبی و دارای مقدار گشتاور دوقطبی خاصی هستند؛ با این حال چرا بهطور کلی یک مولکول ناقطبی است؟ علت آن را در عامل بعدی، یعنی هندسه مولکولی بررسی میکنیم.
هندسه مولکولی
اینکه چرا بهطور کلی یک مولکول ناقطبی است در حالیکه هریک از پیوندهای در مولکول ، قطبی است، جایی است که نقش غالب این عامل سوم ِمهم، یعنی هندسه و شکل مولکولی خود را نشان میدهد. در ، ۴، اتم کلر از طریق پیوندهای اشتراکی یگانه، به یک اتم کربن در مرکز متصل میشوند؛ هر اتم کلر ۱ الکترون ظرفیت دارد در حالیکه اتم کربن هر ۴ الکترون ظرفیت خود را برای تشکیل پیوند به اشتراک میگذارد؛ بهاین ترتیب، تمامی اتمهای پیوندی به آرایش الکترونی هشتگانه در مولکول دست مییابند.
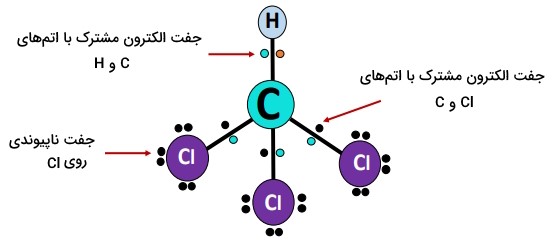
با توجه به تئوری پیوند شیمیایی ()، ، یک مولکول از نوع است؛ یک اتم کربن () و چهار اتم کلر با هم پیوند دارند () و در اتم مرکزی هیچ جفت تنها وجود ندارد؛ بنابراین دارای یک هندسه یا شکل متقارن، چهاروجهی است.
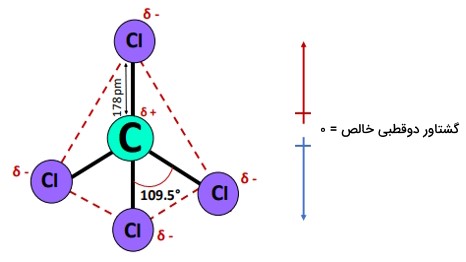
اثر گشتاور دوقطبی خالصِ سه پیوند ، به سمت پایین، فلش آبی، با ممان دوقطبی پیوند ، فلش قرمز، خنثی میشود که این خنثی شدن گشتاورهای دوقطبی در جهات مخالف باعث میشود بهطور کلی یک مولکول ناقطبی با مقدار گشتاور دوقطبی خالص صفر (µ=۰) باشد.
خلاصه
با توجه به موارد طرح و بررسی شده در مورد مولکول ، نتیجه میگیریم:
- تتراکلرید کربن () یک مولکول ناقطبی با است.
- بهدلیل اختلاف الکترونگاتیوی ۰٫۶۱ واحد بین اتمهای و پیوند یافته، هر پیوند در مولکول قطبی است.
- گشتاورهای دوقطبی پیوندهای یگانه در جهات مخالف، بهدلیل هندسه مولکولی چهاروجهی متقارن خنثی میشوند.
- توزیع بار کلی در مولکول در تعادل است.
- طول پیوند در مولکول ۱۷۸ pm است.
- دارای زاویه پیوند متقابل ۱۰۹٫۵ درجه است.
و اگر بخواهیم موارد را در قالب جدولی پیادهسازی کنیم خواهیم داشت:
| نام مولکول | تتراکلرید کربن () |
| نوع پیوند | اشتراکی قطبی |
| هندسه مولکولی | چهاروجهی |
| قطبی یا ناقطبی؟ | ناقطبی |
| ممان دوقطبی | ۰ |
| زاویه پیوند | ۱۰۹.۵ درجه |
بررسی مولکول دیاکسید کربن ()
گرم شدن کره زمین در سراسر جهان رو به افزایش است و دیاکسید کربن () اصلیترین گاز گلخانهای است که بهاین پدیده بحرانی کمک میکند. گازی بیرنگ با بوی تند و اسیدی است که از سوختن سوختهای فسیلی در خودروها و در بخشهای صنعتی آزاد میشود. دیاکسید کربن () مولکولی ناقطبی است که علت آن را مورد بررسی قرار میدهیم.
الکترونگاتیوی
مولکول از دو پیوند اشتراکی دوگانه تشکیل شده است؛ کربن در مرکز وجود دارد، در حالیکه دو اتم اکسیژن به آن متصل هستند؛ یکی در هر طرف. کربن () متعلق به گروه IV-A (گروه ۱۴) جدول تناوبی و دارای ۴ الکترون ظرفیت و اتم اکسیژن دارای ۶ الکترون ظرفیت برای برقراری پیوند است.
| اتم | آرایش الکترونی | تعداد الکترونهای ظرفیت |
| کربن | ۴ | |
| اکسیژن | ۶ |
درتصویر زیر اطلاعات مربوط به اتمهای کربن و اکسیژن آورده شده است.
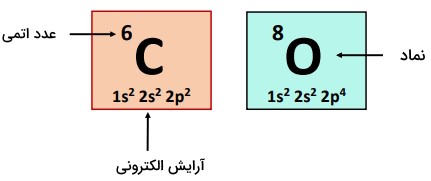
اکسیژن، ، الکترونگاتیوتر از کربن، ، بوده و از اینرو ابر الکترونی مشترک از هر پیوند را بهشدت جذب میکند. اختلاف الکترونگاتیوی بیشتر از ۰.۵ () بوده و هریک از پیوندهای در مولکول قطبی است.
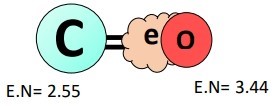
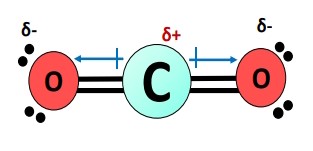
کربن مرکزی به بار جزئی مثبت میرسد؛ در حالیکه اتمهای اکسیژن در هر دو انتها، بار جزئی منفی بهدست آورده و منجر به پدیده قطبیت پیوند در مولکول میشوند.
گشتاور دوقطبی
هر یک از پیوندهای در مولکول قطبی است؛ بنابراین مقدار گشتاور دوقطبی تقریبا برابر با اختلاف الکترونگاتیوی بین دو اتم یعنی ۰.۸۹ است که از کربن به سمت اکسیژن است.
هندسه مولکولی
همانطور که قبلا بحث کردیم، هریک از پیوندهای در بهطور جداگانه قطبی و دارای مقدار گشتاور دوقطبی خاصی هستند؛ پس چرا کل مولکول ناقطبی است؟
این بهدلیل سومین عامل بسیار مهم یعنی هندسه متقارن و شکل مولکول است. بر اساس تئوری ، یک مولکول از نوع است؛ اتم مرکزی کربن () با دو اتم اکسیژن () پیوند دارد؛ در مجموع ۱۶ الکترون ظرفیتی در مولکول وجود دارد. تمامی الکترونهای ظرفیت اتم کربن در تشکیل پیوند نقش دارند؛ بنابراین هیچ جفتالکترونی روی اتم کربن وجود ندارد؛ ولی ۲ جفتالکترون ناپیوندی، در هریک از اتمهای اکسیژن وجود دارد و بهاین ترتیب هر سه اتم به آرایش الکترونی الکترونی هشتگانه کامل میرسند.
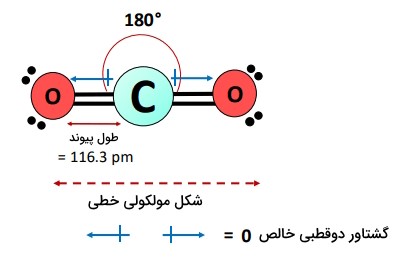
شکلی خطی با زاویه پیوند متقابل ۱۸۰ درجه دارد. آرایش متقارن اتمها، گشتاورهای دوقطبی پیوندهای در جهات مخالف را خنثی میکند؛ بنابراین گشتاور دوقطبی خالص صفر بوده و بهطور کلی یک مولکول ناقطبی است.
خلاصه
با توجه به موارد طرح و بررسی شده در مورد مولکول ، نتیجه حاصل کردیم:
- یک مولکول ناقطبی است.
- پیوندهای موجود در بهدلیل اختلاف الکترونگاتیوی بین اکسیژن و کربن قطبی هستند.
- شکل بهشکل هندسه خطی متقارن است. همه اتمها در یک صفحه قرار می گیرند و یک زاویه پیوند متقابل ۱۸۰ درجه تشکیل میدهند که گشتاورهای دوقطبی پیوندهای را در جهت مخالف خنثی میکند.
- موارد فوق منجر به گشتاور دوقطبی خالص صفر در میشود؛ بنابراین، کل مولکول ماهیت ناقطبی دارد؛ اگرچه پیوندهای موجود در آن قطبی هستند.
و در قالب جدول خواهیم داشت:
| نام مولکول | دیاکسید کربن () |
| نوع پیوند | اشتراکی قطبی |
| هندسه مولکولی | خطی |
| قطبی یا ناقطبی؟ | ناقطبی |
| ممان دوقطبی | صفر |
| زاویه پیوند | ۱۸۰ درجه |
جمعبندی
در مقاله حاضر، به بررسی مفهوم رفتار مولکول ها و توزیع الکترونی آنها که منجر به پدیده قطبی یا ناقطبی شدن در مولکولها میشود پرداخته و عوامل دخیل در این پدیده را یکبهیک مورد بررسی قرار دادیم. مولکولهای قطبی، بهعکس مولکولهای ناقطبی در میدانهای الکتریکی جهتگیری میکنند. ازجمله مولکولهای ناقطبی مهم، مولکولهای دواتمی جور هسته و ازجمله مولکولهای قطبی مهم، مولکولهای دواتمی ناجور هسته هست. از ابزارهای نرمافزاری که برای تحلیل و بررسی پدیده قطبیت مورد استفاده قرار میدهیم، نقشه پتانسیل الکتروستاتیکی است که مبتنی بر بارهای جزئی مثبت و منفی، قطبهای مثبت و منفی در مولکولها را نمایان و میتوانیم رفتار مولکول ها و توزیع الکترونی آنها را بررسی کنیم. در ادامه مبحث، موارد آموخته شده در قالب مثالهایی از مولکولهای آب، آمونیاک، کلروفرم، تتراکلرید کربن و دیاکسید کربن مورد شرح و بررسی قرار گرفت.












