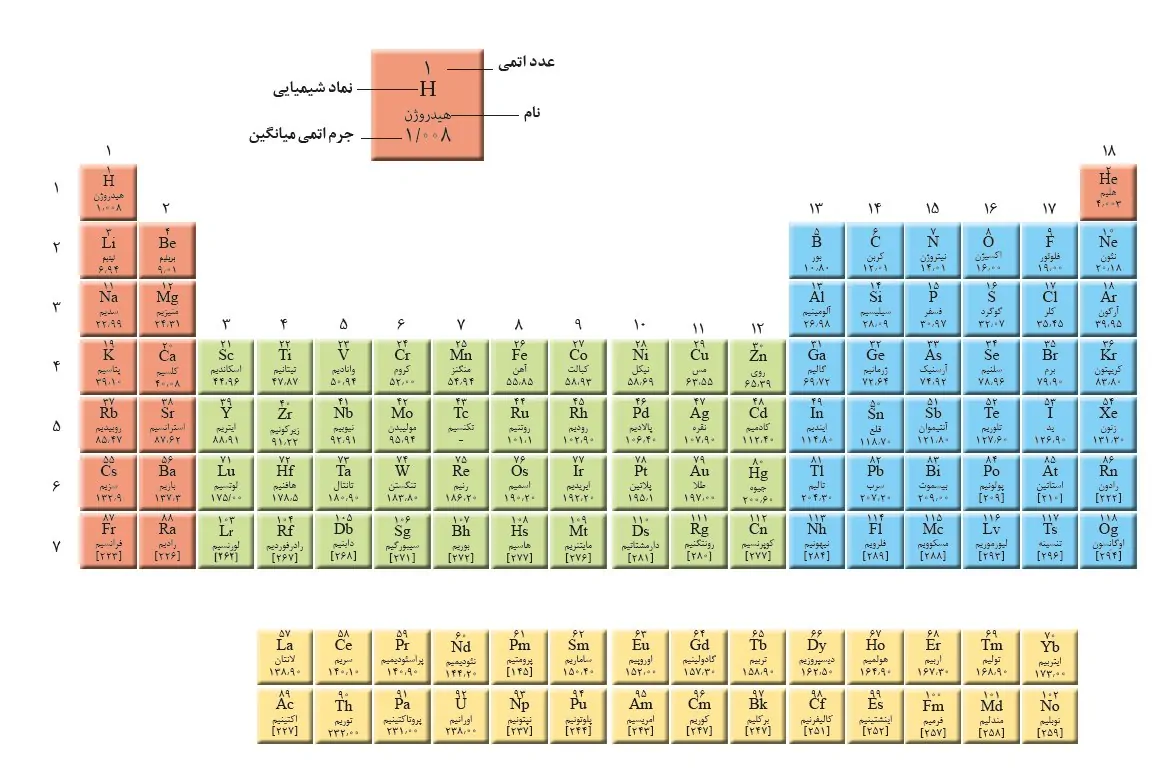
گروه های جدول تناوبی (+ PDF و عکس فارسی)
در آموزشهای قبلی مجله فرادرس، بعد از آن که جدول تناوبی را به خوبی شناختیم، روشهای حفظ کردن جدول تناوبی را نیز بیان کردیم. شناخت کلی از گروه های جدول تناوبی یکی از مهمترین قدمها در شناخت خواص عناصر این جدول است. زمانی که گروههای جدول تناوبی را به خوبی بشناسیم، میتوانیم خصوصیات عناصر مختلف را در قالب این گروهها بررسی کنیم. در این آموزش از مجله فرادرس قصد داریم تا با گروه های جدول تناوبی آشنا شویم تا با یادگیری آنها، درک مسائل شیمی سادهتر شوند.
- یاد میگیرید مفهوم گروههای جدول تناوبی چیست.
- میتوانید عکس جدول تناوبی و پیدیاف آن را برای استفاده و چاپ دانلود کنید.
- با خواص، عناصر و ویژگیهای هر گروه جدول تناوبی آشنا میشوید.
- میآموزید طبقهبندی عناصر در جدول تناوبی بر چه اساسی است.
- با فلزات، نافلزات و شبهفلزات و خواص آن ها آشنا میشوید.
- الکترونهای ظرفیت را در هر گروه جدول تناوبی بررسی میکنید.


در ابتدای این مطلب بررسی میکنیم گروه های جدول تناوبی کدامند و چگونه دستهبندی شدهاند. سپس، هریک از گروههای جدول تناوبی را به ترتیب از گروه فلزات قلیایی تا گروه گازهای نجیب بررسی میکنیم. سپس ساختار جدول تناوبی و علت چینش اینگونه عناصر را توضیح میدهیم و طبقهبندی و نام عناصر را در این جدول نام میبریم. همچنین، به سایر طبقهبندی عناصر مانند فلزات پس واسطه را توضیح داده و الکترون ظرفیت هریک از گروه های جدول تناوبی را میشماریم. در نهایت، شکل دیگری از جدول تناوبی را بررسی کرده و جدول تناوبی کتاب درسی را مورد بررسی قرار میدهیم. با مطالعه این مطلب تا انتها میتوانید با ویژگیهای گروههای جدولی تناوبی به شکلی کامل آشنا شوید.
گروه های جدول تناوبی چیست؟
در اواخر قرن نوزدهم بود که شیمیدان روسی، «دمیتری مندلیف» (Dmitrti Mendeleev) اولین تلاشهای خود را در گروهبندی عناصر شیمیایی بر اساس جرم اتمی، در مقالهای به چاپ رساند. در آن زمان تنها ۶۰ عنصر کشف شده بود اما مندلیف متوجه شد زمانی که عناصر را بر اساس جرم آنها مرتب کنیم، عناصر در دورههای منظمی در کنار یکدیگر قرار میگیرند.
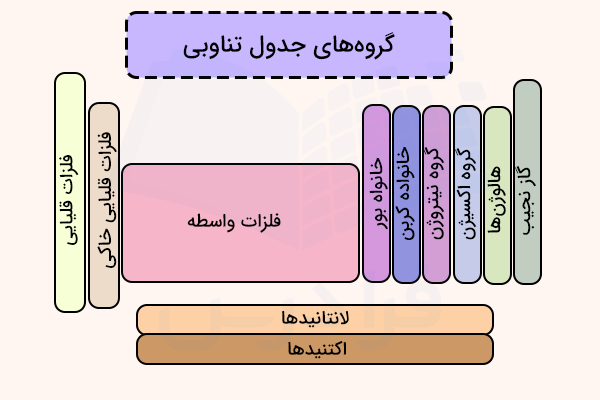
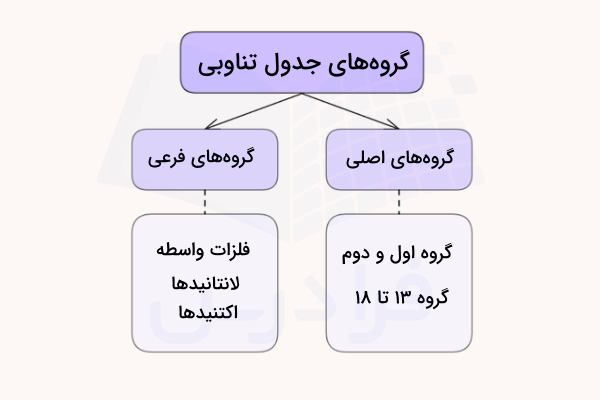
جدول تناوبی عناصر از ۱۸ گروه تشکیل شده است که اتمهای هریک از این گروهها تعداد برابری الکترون ظرفیت دارند. برخی از این گروهها نامهای خاصی دارند و برخی دیگر تنها با اعداد مشخص میشوند. در ادامه این گروهها را نام میبریم.
- گروه اول (گروه فلزات قلیایی)
- گروه دوم ( گروه فلزات قلیایی خاکی)
- گروه ۳ تا ۱۵ (گروه فلزات واسطه)
- گروه ۱۳ (گروه خانواده بور)
- گروه ۱۴ (گروه خانواده کربن)
- گروه ۱۵ (گروه خانواده نیتروژن)
- گروه ۱۶ (گروه خانواده اکسیژن)
- گروه ۱۷ ( گروه هالوژن ها)
- گروه ۱۸ (گروه فلزات نجیب)
امروزه، بعد از ۱۵۰ سال، دانشمندان ۱۱۸ عنصر را کشف کردهاند که ۴ عنصر جدید تا سال ۲۰۱۶ کشف شده است و همچنان به نوعی از همان جدول مندلیف استفاده میکنند که از سادهترین اتم، یعنی هیدروژن آغاز میشود و سایر عناصر در این جدول، بر اساس عدد اتمی مرتب شدهاند. برای آشنایی بیشتر و بهتر با عدد اتمی میتوانید مطلب «عدد اتمی چیست ؟ — از صفر تا صد» از مجله فرادرس که لینک آن در ادامه آمده است را مطالعه کنید.
هر گروه در جدول تناوبی، شامل یک ستون از جدول است و عنصرها در هر گروه جدول تناوبی دارای خواص مشابهی هستند. جدول تناوبی از هشت گروه اصلی تشکیل شده است که با نامهای ۱، ۲ و ۱۳ تا ۱۸ شناخته میشوند. در ادامه، هر کدام از گروه های جدول تناوبی را بررسی خواهیم کرد. لازم به ذکر است که به غیر از هشت گروه اصلی، گروه ۳ تا ۱۲ نیز مورد بررسی قرار میگیرند. در ادامه هریک از این گروهها را بررسی خواهیم کرد.
یادگیری شیمی دهم با فرادرس
شناخت جدول تناوبی عناصر و گروههای آن از اولین قدمها برای شناخت شیمی و واکنشهای شیمیایی است. جدول تناوبی عناصر یکی از کاملترین منابع برای دسترسی به ویژگیهای اتمها و عناصر موجود در جهان است و میتوان اطلاعات مفیدی را از آن دریافت کرد. با شناسایی گروه های جدول تناوبی میتوان مفهومهای پیچیدهتری مانند ایزوتوپها، جرم اتمی و جرم اتمی میانگین را درک کرد و ساختار اتمها و آرایش الکترونی آنها را بررسی کرد. پیشنهاد میکنیم برای یادگیری بهتر این مباحث به مجموعه فیلم آموزش دروس پایه دهم، بخش شیمی فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه گروه های جدول تناوبی دسترسی داشته باشید.
- فیلم آموزش شیمی معدنی ۱ جامع و کاربردی
- فیلم آموزش شیمی دبیرستان نکته و حل تست کنکور
- فیلم آموزش شیمی ۱ پایه دهم حل سوالات تشریحی امتحانات نهایی
دانلود عکس فارسی جدول تناوبی
برای دانلود عکس جدول تناوبی فارسی کافی است تا بر روی تصویر زیر کلیک و عکس جدول تناوبی با کیفیت بالا را دانلود کنید.
دانلود فایل PDF جدول تناوبی
فایلهای تقلبنامه جدول تناوبی و PDF جدول تناوبی با کیفیت بالا از لینکهای زیر قابل دسترس هستند:
- دانلود فایل تقلبنامه (PDF) جدول تناوبی عناصر جدول تناوبی
- دانلود فایل PDF جدول تناوبی با اسم فارسی عنصرها
- دانلود عکس سیاه و سفید جدول تناوبی فارسی برای پرینت سیاه و سفید
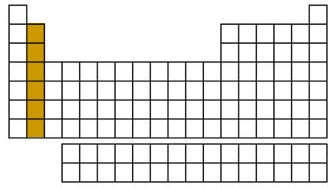
گروه ۱
گروه اول جدول تناوبی یا گروه «فلزات قلیایی» (Alkali Metals) که به «خانواده لیتیوم» نیز معروف است، تمامی عناصر ستون اول، به جز هیدروژن را شامل میشود. این عناصر، براق هستند و به دلیل خاصیت نرمی که دارند، به راحتی با چاقو برش میخورند.
این گروه، از عنصر لیتیوم شروع شده و به عنصر فرانسیم ختم میشود. عناصر گروه اول به شدت واکنشپذیر هستند و در تماس با آب، به صورت انفجاری واکنش میدهند و تولید شعله میکنند. به همین دلیل، شیمیدانها این عناصر را در داخل نفت، روغن یا گازهای بیاثر قرار میدهند. آرایش الکترونی لایه آخر عناصر این گروه به صورت است.
گروه ۲
گروه دوم جدول تناوبی یا گروه «فلزات قلیایی خاکی» (Alkali Earth Metals)، گروه دوم جدول تناوبی را تشکیل میدهند. این گروه که به «خانواده بریلیم» نیز معروف است، از عنصر بریلیم (Be) شروع شده و به عنصر رادیم ختم میشود. هر کدام از این عناصر، در خارجیترین لایه (سطح انرژی) خود، تنها دارای دو الکترون هستند. به همین دلیل، عناصر این گروه نیز واکنشپذیری بالایی دارند و به ندرت به صورت خالص در طبیعت یافت میشوند.
البته واکنشپذیری آنها به شدتِ فلزات قلیایی نیست. واکنش شیمیایی این عناصر به آهستگی انجام میشود و گرمای کمتری نسبت به فلزات قلیایی تولید میکنند. آرایش الکترونی لایه ظرفیت این گروه به شکل است.
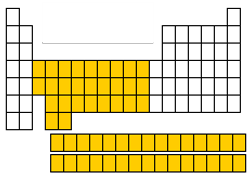
گروه فلزات واسطه
گروه های ۳ تا ۱۲ جدول تناوبی یا گروه عناصر واسطه یا «فلزات واسطه» (Transition Metals)، عناصری هستند که زیرلایه d آنها به صورت جزئی پر شده است. همچنین، لانتانیدها و اکتینیدها نیز جزو این گروه قرار می گیرند. عناصر واسطه، فلزاتی سخت، چکشخوار (شکلپذیر)، براق و رسانای خوب الکتریسیته هستند. در حقیقت، زمانی که واژه فلز را بکار میبریم، اولین چیزی که به ذهن میآید، شکل و خواص فلزات واسطه است که از آنجمله میتوان به طلا، نقره، آهن، مس و پلاتین اشاره کرد. در ادامه به بررسی برخی از خواص لانتانیدها و اکتنیدها میپردازیم.
لانتانیدها
گروه سوم، طولانیتر از آن است که بتواند به طور کامل در ستون سوم جای بگیرد. به همین دلیل، این گروه با نام لانتانیدها را از جدول خارج میکنند و به صورت سطری، در پایین جدول تناوبی قرار میدهند. لانتانیدها، عناصر ۵۷ تا ۷۱ جدول تناوبی را تشکیل میدهند. عناصر این گروه، رنگی سفید-نقرهای دارند و در تماس با هوا، تیره میشوند. آرایش الکترونی لایه ظرفیت این عناصر به شکل است.
اکتینیدها
اکتینیدها نیز مشابه لانتانیدها، در خارج از جدول قرار گرفتهاند و عناصر ۸۹ تا ۱۰۳ جدول تناوبی را تشکیل میدهند. در میان این عناصر، تنها توریم (Th) و اورانیوم (U)، به مقدار قابل توجهی در طبیعت یافت میشوند و همگی این عناصر، رادیواکتیو هستند. لانتانیدها و اکتینیدها، گروهی موسوم به «فلزات واسطه داخلی» (Inner Transition Metals) را تشکیل میدهند. آرایش الکترونی لایه ظرفیت این عناصر به شکل است.
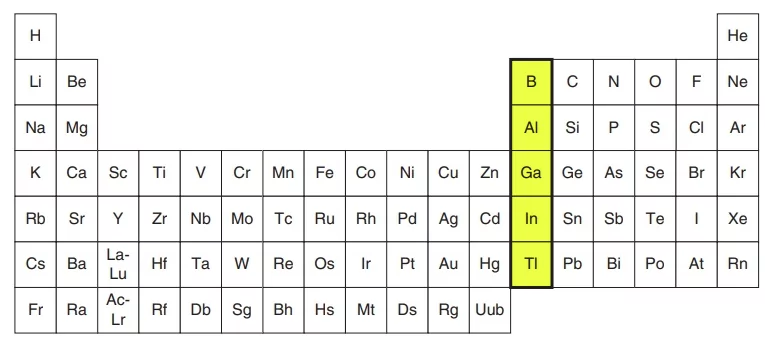
گروه خانواده بور
گروه ۱۳ جدول تناوبی یا گروه «خانواده بور» (Boron Family)، گروه سیزدهم از گروه های جدول تناوبی را تشکیل میدهد. این گروه شامل شبه فلز بور (B) و فلزات آلومینیوم، گالیم، ایندیم و تالیم است. چهار عنصر آخر، ۳ الکترون در خارجیترین لایه خود دارند که آرایش لایه ظرفیت آنها به صورت ذکر میشود. عناصر خانواده بور، اعداد اکسایشی به صورت یا دارند. به غیر از عناصر سنگینتر مانند تالیم، تمایل بقیه عناصر به داشتن عدد اکسایش است.
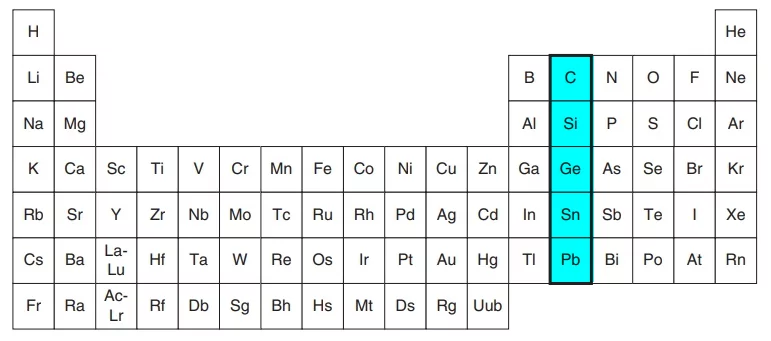
خانواده کربن
گروه ۱۴ جدول تناوبی یا گروه خانواده کربن شامل چهاردهمین گروه از گروه های جدول تناوبی است. عناصر کربن، سیلیکون (سیلیسیم)، ژرمانیوم، قلع و سرب، ۵ عنصر این گروه را تشکیل میدهند. عنصر «فلروویم» (Flerovium) نیز انتظار میرود رفتاری مشابه سایر عناصر این گروه داشته باشد و به همین دلیل، آنرا در گروه ۱۴ جای میدهند. گروه کربن در نزدیکی مرکز جدول تناوبی قرار دارد که در سمت راست آن، نافلزات و در سمت چپ آن، فلزات قرار دارند.
در گذشته، این گروه موسوم به «تترلها» (Tetrels) یا «تتراژنها» (Tetragens) بود چراکه هر کدام از اتمهای این گروه، ۴ الکترون ظرفیت داشتند. همچنین، نام دیگر این گروه، «کریستالوژنها» نام داشت. آرایش الکترونی لایه ظرفیت گروه ۱۴ جدول تناوبی به شکل است.
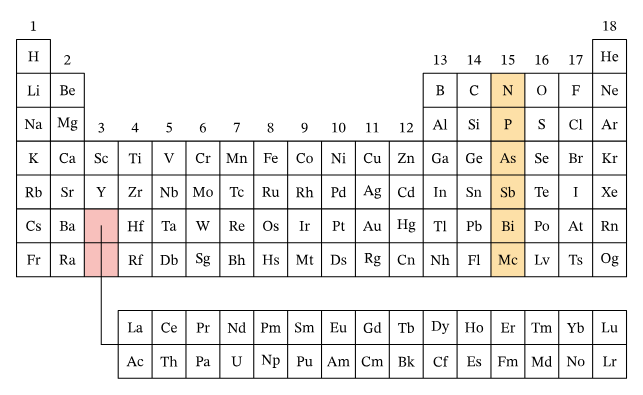
گروه نیتروژن
گروه ۱۵ جدول تناوبی یا گروه خانواده نیتروژن که به «نیکتوژن» (Pnictogen) نیز معروف است، به ترتیب، عناصر نیتروژن، فسفر، آرسنیک، آنتیموان، بیسموت و همچنین عنصر مصنوعی «مسکوویم» (Moscovium) را تشکیل میدهد. آرایش الکترونی عناصر این گروه، همگی به صورت هستند.
گروه اکسیژن (کالکوژنها)
شانزدهمین گروه از گروه های جدول تناوبی متعلق به گروه اکسیژن است. این گروه را با نام خانواده اکسیژن یا «کالکوژنها» (Chalcogens) میشناسند. عناصر این گروه شامل اکسیژن، گوگرد، سلنیوم، تلوریم و پولونیوم است. سه عنصر اول، نافلز و دو عنصر آخر، شبه فلز هستند. در این میان، پولونیوم، عنصری رادیواکتیو به شمار میآید و سرگروه این گروه، یعنی اکسیژن، به همراه نیتروژن، عناصر اصلی در لایههای جو را تشکیل میدهند.
هالوژنها
۵ یا ۶ عنصر گروه ۱۷ موسوم به هالوژنها هستند. فلوئور، کلر، برم، ید و استاتین همگی در گروه هالوژنها قرار دارند. در این میان، عنصر «تنسین» (Tennessine) نیز ممکن است خواصی مشابه با هالوژنها داشته باشد. با وجود اینکه عنصر تنسین، در گروه هالوژنها جای دارد، اما بیشتر دانشمندان بر این عقیدهاند که عنصر تنسین، رفتاری مشابه شبهفلزات دارد اما با توجه به اینکه مقادیر کمی از این عنصر به تولید رسیده است، نتایج قابل استنادی را نمیتوان تا این لحظه ارائه کرد.
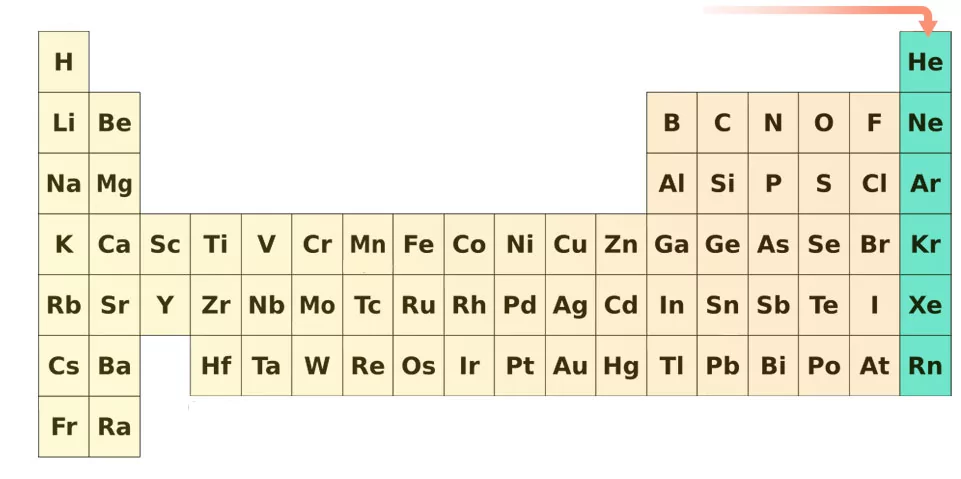
گازهای نجیب
گروه ۱۸ جدول تناوبی یا گروه گازهای نجیب همگی بیرنگ، بیبو و تقریبا بیاثر (غیر واکنشپذیر) هستند. یکی از ۴ عنصری که به تازگی کشف شده، «اوگانسون» (Oganesson) است که دانشمندان اعتقاد دارند باید خواصی همچون سایر گازهای نجیب داشته باشد اما با توجه به اینکه این عنصر، نیمه عمری در حد میلیثانیه دارد، هیچکس تا به امروز، به طور دقیق خواص آنرا اندازهگیری نکرده است.
با ساخت مصنوعی اوگانسون، تناوب هفتم از جدول تناوبی تکمیل میشود. میتوان پیشبینی کرد که اگر در آینده، عنصری کشف یا ساخته شود، تناوب هشتم از جدول تناوبی آغاز خواهد شد. آرایش الکترونی لایه ظرفیت اتمهای گروه گازهای نجیب به شکل است. به دلیل این کامل بودن آرایش الکترونی است که این اتمها تمایلی برای واکنش با سایر اتمها را از خود نشان نمیدهند.
ساختار جدول تناوبی
این جدول، ۷ سطر و ۱۸ ستون دارد. که در ادامه، در خصوص سطرها و ستونها به بحث میپردازیم. همچنین، ویژگیهای جدول تناوبی را بررسی میکنیم.
سطرهای جدول تناوبی
هر سطر بیانگر یک دوره یا «تناوب» (Period) است. عدد تناوب یک عنصر، بیان میکند که چه تعداد از سطوح انرژی، دارای الکترون هستند. به طور مثال، اتم سدیم در تناوب سوم قرار دارد و به این معناست که این اتم، به طور معمول، در سه سطحِ اول انرژی خود دارای الکترون است. با حرکت از بالا به پایین در جدول، طول دورهها بیشتر میشوند. زیرا لایههای الکترونی با ظرفیت بیشتری برای اشغال شدن توسط الکترون در دسترس اتمها قرار میگیرد.
ستون های جدول تناوبی
ستونهای جدول بیانگر گروهها یا عناصر همخانواده هستند. عناصر گروه های جدول تناوبی به طور معمول رفتاری مشابه دارند چراکه تعداد الکترون یکسانی را در خارجیترین لایه خود (لایه ظرفیت) شامل میشوند. به طور مثال، گروه ۱۸، در سمت راست جدول، لایههای خارجی پرشده و کاملی از الکترون دارد و به همین دلیل خیلی کم در واکنشهای شیمیایی شرکت میکنند.
طبقهبندی عناصر
عنصرها را به طور معمول در دو دسته فلز و نافلز تقسیم میکنند اما نمیتوان مرز دقیق و مشخصی بین آنها تعیین کرد. عناصر فلزی به طور معمول، هادی خوب الکتریسیته و حرارت هستند. سایر زیرگروههای فلزی نیز بر اساس همین خواص مشترک شیمیایی بنا شدهاند. به همین دلیل، انواع عناصر را در قالب گروه های جدول تناوبی بررسی میکنند.
سایر طبقهبندیها در جدول تناوبی
برای بررسی جدول تناوبی، دستهبندیهای دیگری نیز ارائه میشوند که مختص به یک ستون یا گروه نیستند و به کمک آنها میتوان درک بهتری از عناصر و خواص مشترک بین برخی از آنها پیدا کرد. در ادامه قصد داریم تا این دستهبندیها را بیان کنیم.
فلزات پس واسطه
«فلزات پسواسطه» (Post Transition Metals) عبارتند از: آلومینیوم، گالیم، ایندیم، تالیم، قلع، سرب و بیسموت که این عناصر در بین گروههای ۱۳ تا ۱۷ پراکنده شدهاند. این فلزات، خواصی همچون فلزات واسطه دارند اما نرمتر و رسانای ضعیفتری نسبت به سایر فلزات واسطه هستند.
شبه فلز ها در جدول تناوبی
شبه فلزات، عناصر بور، سیلیسیم، ژرمانیوم، آرسنیک، آنتیموان، تلوریم و پولونیوم را شامل میشوند. در برخی موارد، «شبه فلزات» (Metalloids)، رفتاری همچون نیمههادی دارند که از آنجمله باید به عناصر بور، سیلیسیم و ژرمانیم اشاره کرد.
نافلزات در جدول تناوبی
به طور کلی ۱۷ عنصر را در دسته نافلزات قرار میدهند: بیشتر گازها شامل هیدروژن، هلیوم، نیتروژن، اکسیژن، فلوئور، نئون، کلر، آرگون، کریپتون، زنون و رادون در این دسته قرار میگیرند. برم و برخی جامدات مانند کربن، فسفر، گوگرد، سلنیوم و ید نیز به عنوان نافلزات شناخته شدهاند.

الکترون ظرفیت گروه های جدول تناوبی
الکترونهایی که در بیرونیترین لایه الکترونی وجود دارند به طور معمول با نام الکترونهای ظرفیت یا «الکترونهای والانس» (Valance Electrones) شناخته میشوند. در جدول زیر، تعداد الکترون ظرفیت عناصر در گروههای جدول تناوبی آورده شده است. البته توجه داشته باشید که روش کلی برای شمارش الکترونهای ظرفیت، به طور معمول برای فلزات واسطه کاربرد ندارد. همچنین، در گروه ۱۸، الکترونهای ظرفیت هلیوم شامل دو الکترون است.
| گروه های جدول تناوبی | الکترونهای ظرفیت |
| گروه ۱ (فلزات قلیایی) | ۱ |
| گروه ۲ (فلزات قلیایی خاکی) | ۲ |
| گروه ۳ - ۱۲ (فلزات واسطه) | ۲ |
| گروه ۱۳ | ۳ |
| گروه ۱۴ | ۴ |
| گروه ۱۵ | ۵ |
| گروه ۱۶ | ۶ |
| گروه ۱۷ | ۷ |
| گروه ۱۸ | ۸ |
شکل دیگر جدول تناوبی
با توجه به خاصیت تناوبی این جدول، برخی از دانشمندان، جدول تناوبی عناصر را به شکل یک دایره و همانند تصویر زیر پیشنهاد دادهاند. دانشمندان اعتقاد دارند که چینش عناصر به شکل دایرهای، درک بهتری از اندازه نسبی اتمها بدست میدهد به گونهای که هرقدر اتمها به مرکز دایره نزدیکتر باشند، اندازه کوچکتر یا به عبارت بهتر، شعاع کمتری دارند. همچنین، با قرار دادن اتمهای هلیوم و هیدروژن در مرکز این دایره، مشکلِ قرار دادن این عنصرها در جدول تناوبی اصلی برطرف خواهد شد.
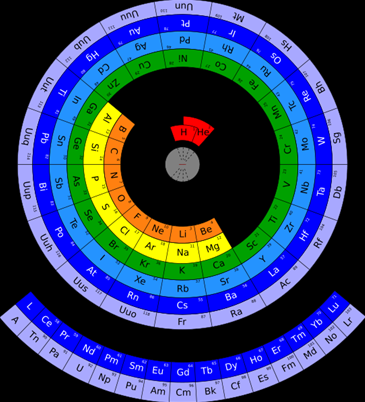
البته از نقاط ضعف این جدول باید به نحوه خوانش آن اشاره کرد زیرا برای خوانش این جدول باید آن را بچرخانیم که این امر در کتابهای مرجع و صفحات کامپیوتر امکانپذیر نیست.
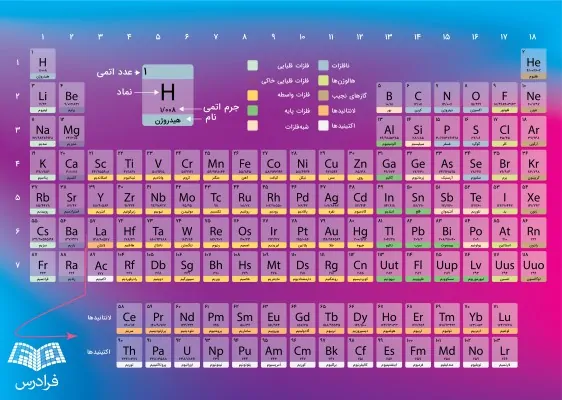
جدول تناوبی کتاب درسی
در کتابهای درسی، جدول تناوبی تفاوتهای کمی با تصاویر نشان داده شده در بالا دارند. با این وجود، تصاویر موجود در کتاب درسی نیز صحیح هستند اما سعی شده است تا شکل بهروز این جدول بررسی شود. با این وجود، در تصویر زیر میتوانید جدول تناوبی موجود در کتابهای درسی را نیز مشاهده کنید.
آزمون گروههای جدول تناوبی
۱. کدام ویژگی ساختاری مشترک باعث تمایز عناصر یک گروه جدول تناوبی از سایر گروهها میشود؟
تعداد لایههای انرژی مساوی
عدد اتمی برابر
جامد بودن تمامی عناصر در دمای اتاق
آرایش الکترونی شبیه در لایه ظرفیت (Valence shell)
عناصر یک گروه جدول تناوبی به دلیل داشتن آرایش الکترونی شبیه در لایه ظرفیت (valence shell) از سایر گروهها متمایز میشوند. این آرایش الکترونی مشابه موجب خواص شیمیایی نزدیک آنها میشود. «تعداد لایههای انرژی مساوی» ویژگی دورههای جدول تناوبی و نه گروهها است. «عدد اتمی برابر» درباره عناصر مختلف صدق نمیکند و «همه جامد بودن در دمای اتاق» برای برخی گروهها مثل گازهای نجیب یا هالوژنها درست نیست. بنابراین، فقط آرایش الکترونی شبیه در لایه ظرفیت باعث تمایز یک گروه میشود.
۲. بر اساس آرایش الکترونی، چرا فلزات قلیایی واکنشپذیری بیشتری نسبت به فلزات قلیایی خاکی دارند؟
فلزات قلیایی خاکی الکترون ظرفیت بیشتری دارند و دیرتر واکنش میدهند.
فلزات قلیایی یک الکترون ظرفیت دارند که راحتتر از دست میدهند.
فلزات قلیایی بهدلیل آرایش الکترونی کامل خود بیاثرند.
فلزات قلیایی خاکی الکترونهای لایه درونی بیشتری دارند.
دلیل واکنشپذیری بالای فلزات قلیایی وجود یک الکترون ظرفیت (ns¹) است که بهآسانی از دست میرود، بنابراین این فلزات تمایل زیادی به واکنش نشان میدهند. در مقابل، فلزات قلیایی خاکی دو الکترون ظرفیت دارند و پایداری بیشتری دارند و واکنشپذیریشان کمتر است. برخلاف «آرایش الکترونی کامل» یا «الکترونهای لایه درونی بیشتر»، آنچه تعیینکننده است، تعداد کم الکترون ظرفیت در فلزات قلیایی و سهولت از بین رفتن آن است.
۳. تعداد الکترون ظرفیت (Valence Electrons) در گروههای اصلی جدول تناوبی چگونه با شماره هر گروه مرتبط است؟
تعداد الکترون ظرفیت برای تمام گروهها یکسان است.
تعداد الکترون ظرفیت برابر با عدد دوره است.
تعداد الکترون ظرفیت با شماره یکان گروه برابر است.
تعداد الکترون ظرفیت همان عدد گروه منهای ده است.
در گروههای اصلی جدول تناوبی، تعداد الکترون ظرفیت هر عنصر با شماره گروه آن رابطه مستقیم دارد. یعنی عدد گروه همان تعداد الکترون در لایه ظرفیت است. عبارت «تعداد الکترون ظرفیت با شماره یکان گروه برابر است» این ارتباط را بیان میکند. گزینههای دیگر صحیح نیستند: تعداد الکترون ظرفیت به شماره دوره بستگی ندارد، عدد گروه منهای ده همیشه درست نیست و همه گروهها تعداد یکسانی از الکترون ظرفیت ندارند.
۴. اگر دانشآموزی بخواهد عنصری را انتخاب کند که تقریبا بیاثر بوده و معمولا با سایر عناصر واکنش نمیدهد، بر اساس ساختار جدول تناوبی کدام دسته را باید بررسی کند؟
گروه هالوژنها (Halogens)
گروه فلزات قلیایی (Alkali Metals)
گروه فلزات واسطه (Transition Metals)
گروه گازهای نجیب (Noble Gases)
«گروه گازهای نجیب (Noble Gases)» دارای آرایش الکترونی کامل در لایه ظرفیت هستند که باعث میشود این عناصر تقریبا بیاثر بوده و تمایل کمی به شرکت در واکنشهای شیمیایی داشته باشند. در مقابل، گروه فلزات قلیایی و هالوژنها بسیار واکنشپذیرند و فلزات واسطه نیز خواص شیمیایی فعال و متنوع دارند. بنابراین تنها انتخاب مناسب برای یافتن عنصر بیاثر، انتخاب از میان گازهای نجیب است.
۵. عنصری با آرایش الکترونی ns²np³ معمولا در کدام بخش جدول تناوبی قرار دارد و این آرایش به چه ویژگی گروهی اشاره دارد؟
در گروه اکسیژن (Chalcogen) قرار دارد و شش الکترون ظرفیت دارد.
در گروه کربن (Carbon group) قرار دارد و چهار الکترون ظرفیت دارد.
در گروه بور (Boron group) قرار دارد و سه الکترون ظرفیت دارد.
در گروه نیتروژن (Pnictogen) قرار دارد و پنج الکترون ظرفیت دارد.
آرایش الکترونی ns²np³ نشان میدهد که عنصر پنج الکترون در لایه ظرفیت خود دارد، که مشخصه گروه نیتروژن یا Pnictogen جدول تناوبی است. این گروه شامل عناصر نیتروژن، فسفر، آرسنیک و ... است و همگی این آرایش را دارند. پاسخهایی مانند «در گروه اکسیژن قرار دارد و شش الکترون ظرفیت دارد» یا «در گروه کربن قرار دارد و چهار الکترون ظرفیت دارد» صحیح نیستند چرا که آرایش آنها متفاوت است. همچنین «در گروه بور و سه الکترون ظرفیت دارد»، با این آرایش مطابقت ندارد.
۶. در مقایسه ویژگیهای کلیدی فلزات واسطه و فلزات گروه اول جدول تناوبی، کدام مورد صحیح است؟
فلزات واسطه بیشتر خاصیت چکشخواری و رسانایی الکتریکی دارند.
فلزات گروه اول نرمتر اما کمتر رسانا از فلزات واسطه هستند.
فلزات گروه اول نسبت به فلزات واسطه واکنشپذیری شیمیایی پایینتری دارند.
فلزات واسطه معمولا به دلیل داشتن یک الکترون ظرفیت واکنش انفجاری با آب دارند.
فلزات واسطه ویژگیهایی مانند سختی، جلای فلزی، رسانایی الکتریکی و چکشخواری بالاتر نسبت به فلزات گروه اول دارند و این تفاوت، دلیل استفاده بیشتر آنها در صنایع است. در مقابل، فلزات گروه اول بسیار نرم و واکنشپذیرند و معمولا رسانایی و سختی کمتری نسبت به فلزات واسطه دارند. ادعای نرم بودن گروه اول همراه با کمتر رسانا بودن نادرست است، زیرا رسانایی آنها معمولا کمتر از فلزات واسطه است اما کل تفاوت محدود به همین یک ویژگی نمیشود. همچنین واکنشپذیری بالاتر فلزات گروه اول نسبت به واسطههاست، نه بالعکس. وجود یک الکترون ظرفیت با رفتار انفجاری ویژه گروه اول است و برای فلزات واسطه معمولا چنین رفتاری گزارش نشده است.
۷. حضور شبهفلزها (metalloids) در گروههایی مانند گروه ۱۳ یا ۱۴ جدول تناوبی چه اثری بر ویژگیهای کلی این گروهها دارد؟
همه عناصر گروه رفتار یکسان و خالص فلزی خواهند داشت.
ویژگیهای شیمیایی عناصر گروه کاملا یکنواخت و مشابه میشود.
تمام عناصر گروه فقط ویژگیهای نافلزی نشان میدهند.
باعث میشود خواص گروه ترکیبی از فلزی و نافلزی باشد.
وقتی شبهفلزها (metalloids) در گروهی از جدول تناوبی حضور دارند، ویژگیهای کلی آن گروه ترکیبی از خواص فلزی و نافلزی خواهد بود. برای نمونه، در گروه بور یا کربن، شبهفلزهایی مانند بور و سیلیسیم حضور دارند که نه کاملا فلز هستند و نه نافلز؛ بنابراین این تنوع ساختاری باعث میشود اعضای گروه خواص ترکیبی و متغیر داشته باشند. برخلاف عبارت «همه عناصر گروه رفتار یکسان و خالص فلزی خواهند داشت» یا «تمام عناصر گروه فقط ویژگیهای نافلزی نشان میدهند»، وجود شبهفلزها مانع یکنواختی کامل رفتار شیمیایی میشود. به همین دلیل عبارت «ویژگیهای شیمیایی عناصر گروه کاملا یکنواخت و مشابه میشود» نیز درست نیست.













با درود و عرض ادب
تشكر ميكنم بابت اطلاعات جدول تناوبي كه يكجا بود و بسيار مفيد واقع شد.
خیلی عالی
ببخشید منظور از عناصر اصلی چیه؟
با سلام و روز شما بهخیر؛
در متن اشاره شده است که اکسیژن و نیتروژن عناصر اصلی لایههای جو زمین هستند. این گفته به این معناست که بخش عمده جو را این دو عنصر گازی تشکیل میدهند و گازهای دیگر با مقادیر کمتری در کنار اینها حضور دارند.
بسیار خوشحالیم که با مجله فرادرس همراه هستید.
سلام بسیار ممنون
بارهای گروه ۱و۲و۱۶و ۱۸ جدول تناوبی میشه بگید؟
با سلام؛
برای این موضوع میتوانید به تیتر انتهای مطلب یعنی «الکترون ظرفیت گروه های جدول تناوبی» مراجعه کنید یا اینکه مطلب زیر را برای آشنایی بیشتر با عدد اکسایش مطالعه کنید.
عدد اکسایش و تعیین آن — به زبان ساده
با تشکر از همراهی شما با مجله فرادرس
عالی بود . خیلی خیلی ممنون
سلام مطالب مفیدی ارائه کردید
اگه میشه ضرفیت گروه هارو هم بگین
ممنون
با سلام؛
از بازخورد شما سپاسگزاریم. این موضوع با تیتر «الکترون ظرفیت گروه های جدول تناوبی» در قالب جدولی به مطلب اضافه شد.
با تشکر از همراهی شما با مجله فرادرس
با سلام و تشکر از توضیحات متن بالا که بسیار مفید بود استفاده کردم . ممنون
با سلام؛
خوشحالیم که مطالعه این متن برای شما مفید بوده است.
با تشکر از همراهی شما با مجله فرادرس
سوالم اینکه ؛ مگه شبه فلزات 6 تا نیس!
و اون عناصری که به ندرت شبه فلز محسوب می شوند : سلنیم ، اکتاتین ، پولونیم هستند.
میشه توضیحی بدین…
خیلی مفید بود
با سلام؛
با کمی دقت در تصویر جدول تناوبی موجود در متن میتوان این عناصر را تشخیص داد. در این جدول، تعداد شبهفلزات، هفت عنصر است.
با تشکر از همراهی شما با مجله فرادرس
عالی بود واقعا ممنون.
اما فکر میکردم فایل pdf این مطلب هم موجود باشه و خیلی خوب میشه اگه این و هم در اختیار ما بگذارین??لطفا
خیلی مفید و کاربردی بود. ممنونم
محل دقیق لانتانیدها و اکتینیدها کجاست ؟
میگن جزو گروه سوم و دوره های ۶ و ۷ جدولن اما
لوتسیم و لورنسیم جاشونو گرفتن اصلا تصور محل دقیقشون برام آسون نیست
با سلام؛
از شما به دلیل همراهی با مجله فرادرس سپاسگزاریم.
محل دقیق لانتانیدها و اکتینیدها در حقیقت باید در تناوب ۶ و ۷ باشد اما اگر این عناصر را در جدول قرار دهیم، ترتیب جدول تناوبی بهم میریزد و تمامی روندهایی که به دنبال آن بودیم از بین میروند. به بیان دیگر، اگر این عناصر در داخل جدول باشند، جدول بسیار بزرگی خواهیم داشت که درک روابط بین عناصر برای ما دشوار میشوند.
به همین دلیل، ۱۴ عنصر بعد از لانتان (La) و اکتینیم (Ac) را جدا میکنند و در زیر جدول قرار میدهند تا روندهای مورد نظر حفظ شوند. پس جایگاه لانتانیدها و اکتینیدها مشخص شد اما سوالی که در بیشتر موارد پیش میآید این است که لانتانیدها و اکتینیدها چه عناصری را شامل میشوند. اگر به تصویر ابتدای این مطلب نگاه کنید میبینید که لانتان و اکتینیم، جزو لانتانیدها و اکتینیدها نیستند اما در بسیاری از منابع دیگر، این دو عنصر نیز در پایین و بین لانتانیدها و اکتینیدها قرار دارند. پاسخ اینجاست که واژه لانتانید به معنای «شبیه لانتانیوم» است و نمیتوان عنصر لانتانیوم (لانتان) را یک لانتانید دانست و در برخی منابع، این عنصر را در گروه ۳ جدول تناوبی قرار میدهند اما آیوپاک، این عنصر را نیز به دلیل استفاده رایج آن، در دسته لانتانیدها قرار داده است. بنابراین، در معنای اصلی، لانتان و اکتینیوم جزو لانتانیدها و اکتینیدها نیستند اما به دلیل رواج استفاده از آنها، این عناصر را نیز میتوان در این دستهها قرار داد.
اگر باز هم این مفهوم برای شما دشوار بود، پیشنهاد میکنیم مطلب «جدول تناوبی (+ PDF، عکس فارسی و فیلم آموزش رایگان)» را مطالعه کنید چراکه در این مطلب به تفصیل در خصوص نحوه بوجود آمدن جدول تناوبی صحبت شده است و با دیدن جداول قبل از جدول تناوبی عناصر، به خوبی مشکل شما برطرف خواهد شد.
با تشکر
این سایت و مطالبش واقعا مفید بودن برام ??بهترین سایتی که دیدم?
خیلی ممنون?
بهترین سایتی که دیدم واقعا ممنون