عنصر گوگرد و کاربردهای آن – از صفر تا صد
گوگرد یا سولفور، عنصری شیمیایی با نماد S و عدد اتمی ۱۶ در جدول تناوبی عناصر است. این عنصر چند ظرفیتی و نافلز، تحت شرایط استاندارد، مولکولهایی حلقوی با فرمول شیمیایی میسازد. این ماده در حالت عنصری، به رنگ زرد روشن (لیمویی) و در دمای اتاق، جامدی بلوری است.


از نظر جرمی، این ماده دهمین عنصر فراوان در کیهان و پنجمین عنصر در زمین به شمار میآید. با وجود اینکه در برخی موارد، گوگرد به صورت خالص نیز وجود دارد، اما در بیشتر مواقع به شکلهای سولفید و سولفات دیده میشود. باتوجه به فراوانی این عنصر در طبیعت، از دوران باستان، آنرا میشناسند. امروزه، تقریبا تمامی گوگرد تولیدی به صورت محصولات فرعی حاصل از حذف مواد آلاینده از گاز طبیعی و نفت بدست میآید. بیشترین کاربرد این عنصر در تولید سولوفوریک اسید برای کودهای سولفاته و فسفاته است. از این ماده در کبریتها، حشرهکشها و قارچکشها استفاده میشود.
بسیاری از ترکیبات گوگرد، بوی بدی دارند. این بوی بد را میتوان در گاز طبیعی، راسوها، گریپفروت و سیر حس کرد. به طور معمول، هیدروژن سولفید بوی بدی شبیه به تخم مرغ خراب دارد و در بیشتر موارد به کمک این بو شناسایی میشود.
خواص فیزیکی گوگرد
گوگرد، مولکولهای چنداتمی بسیاری تولید میکند. شناختهشدهترین آلوتروپ آن، اکتاسولفور با فرمول است. اکتاسولفور به رنگ زرد روشن و بیبو است اما نمونههای ناخالص آن، بویی شبیه به گوگرد دارند. نقطه ذوب و جوش آن به ترتیب 115/21 و 444/6 درجه سانتیگراد است و به سادگی تصعید میشود.
گوگرد مذاب در دمای بالای ۲۰۰ درجه سانتیگراد، رنگ قرمز تیره دارد. لازم به ذکر است که تمامی آلوتروپهای پایدار این عنصر، عایق خوبی برای الکتریسته هستند.
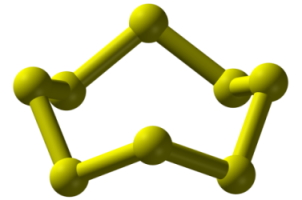
ترکیبات شیمیایی
به هنگام سوختن گوگرد، شعله آبی به همراه دیاکسید سولفور تولید میشود که بوی بسیار نامطبوعی دارد. این ماده در آب نامحلول و در کربن دیسولفید، محلول است. همچنین، در سایر ترکیبات آلی ناقطبی همچون بنزن و تولوئن نیز حل میشود. اعداد اکسایش و ، نسبت به عدد معمولتر هستند.
گوگرد تقریبا با تمامی عناصر به جز گازهای نجیب واکنش میدهد که برخی از این واکنشها در دمای بالا انجام میشوند.
آلوتروپهای گوگرد
این ماده با داشتن ۳۰ آلوتروپ جامد، بیشترین تعداد آلوتروپ را در بین عناصر دارد. در کنار مولکول حلقوی ، حلقههای دیگری نیز شناخته شدهاند. حذف یک اتم از ، مولکول را بدست میدهد که رنگ تیرهتری دارد. کروماتوگرافی HPLC برای عنصر گوگرد، مخلوطی تعادلی را نشان میدهد که بیشتر، از و مقادیر کمی از و تشکیل شده است.
با سرد کردن سریع گوگرد مذاب، به گوگرد آمورف یا پلاستیکی میرسیم. بلورشناسی اشعه ایکس نشان میدهد که این آمورف میتواند ساختاری مارپیچ داشته باشد که در هر پیچ آن، هشت اتم کربن حضور دارد.
ایزوتوپهای گوگرد
این عنصر دارای ۲۳ ایزوتوپ شناخته شده است که از این میان، تنها چهار ایزوتوپ، پایدار هستند. در اکوسیستمهای جنگل، سولفاتها به طور عمده از اتمسفر مشتق میشوند. در حقیقت، هوازدگی سنگمعدنها و عمل تبخیر، موجب تولید گوگرد خواهد شد.
ترکیبات گوگرد
اعداد اکسایش معمول در گوگرد به صورت تا وجود دارند و همانطور که گفته شد، گوگرد، ترکیبات پایداری را با تمامی عنصرها به جز گازهای نجیب تشکیل میدهد.
پلیکاتیون
پلیکاتیونهای گوگرد، زمانی تولید میشوند که این ماده با عوامل اکسنده ملایمی در یک محلول اسیدی قوی واکنش دهد.
سولفیدها
واکنش سولفور و هیدروژن، هیدروژن سولفید بدست میدهد و به هنگام انحلال در آب، محلولی با خاصیت اسیدی ملایم تشکیل میشود. لازم به ذکر است که گاز هیدروژن سولفید و آنیون هیدروسولفید، برای پستانداران بسیار سمی و خطرناک است چراکه ظرفیت حمل اکسیژن هموگلوبین را مختل میکند.
کاهش عنصر گوگرد، پلیسولفیدها را تولید میکند که شامل زنجیری از اتمهای گوگرد هستند:
واکنش بالا، یکی از ویژگیهای اصلی گوگرد، یعنی «زنجیری شدن» (Catenate) را نشان میدهد. همچنین، کاهش گوگرد، نمکهای سولفید را بدست میدهد:
اکسیدها، اکسیاسیدها و اکسیآنیونها
اکسیدهای سولفور را از طریق سوزاندن آن بدست میآورند:
دیاکسید گوگرد :
تریاکسید گوگرد:
به اسیدی که اکسیژن داشته باشد، اکسیاسید میگویند. برخی از اکسی اسیدهای گوگرد را نمیتوان از طریق روشهای معمول، جداسازی کرد و تنها به کمک نمکهایشان شناخته میشوند. دیاکسید گوگرد و سولفیتها ، مرتبط با ترکیب ناپایدار سولفوروس اسید با فرمول هستند. تریاکسید گوگرد و سولفاتها نیز به سولفوریک اسید ارتباط دارند.

هالیدها و اکسی هالیدها
بسیاری از هالیدهای گوگرد، در صنایع مدرن اهمیت بسیاری دارند. به طور مثال، گازی با چگالی بالا است که به عنوان گاز عایق در ترانسفورماتورهای ولتاژ بالا مورد استفاده قرار میگیرد. از به طور معمول به دلیل خاصیت سمی آن استفاده نمیشود. از جمله ترکیبات صنعتی و مهم میتوان به و اشاره کرد.
ترکیبات شامل نیتروژن
از جمله ترکیبات معروف شامل نیتروژن ، میتوان را نام برد که حرارت دادن آن موجب تشکیل نیترید گوگرد پلیمری با فرمول میشود. این ماده پلیمری، با وجود اینکه هیچ اتم فلزی در خود ندارد، اما دارای خاصیت فلزی است. تیوسیاناتها شامل گروه هستند و اکسیداسیون این مواد موجب تولید تیوسیانوژن خواهد شد.
سولفیدهای فلزی
سنگ معدنهای مس، روی، نیکل، کبالت، مولیبدن و سایر فلزات به صورت سولفید هستند. این مواد، نیمههادیهای تیرهرنگی هستند که به سادگی با اسیدها و آب وارد واکنش نمیشوند. این مواد در آزمایشگاه توسط واکنش هیدروژن سولفید با نمکهای فلزی بدست میآیند. از جمله این نیمههادیها میتوان به اشاره کرد که به عنوان یکسوساز جریان در دستگاههای رادیویی کاربرد داشت.
ترکیبات آلی
برخی از مهمترین دستهبندیهای ترکیبات آلی شامل گوگرد در زیر آورده شدهاند:
- تیولها یا مرکاپتانها: موادی آلی با فرمول عمومی که مشابه الکلها هستند.
- تیواترها: گروههای عاملی به شکل
- یونهای سولفونیم: یونهایی هستند که درآنها، سه گروه مختلف به گوگرد کاتیونی مرکزی متصل شدهاند.
- سولفوکسید و سولفونها: تیواترهایی هستند که در آنها به ترتیب ۱ و ۲ اتم اکسیژن به اتم گوگرد متصل شده است.
- سولفونیک اسیدها: اسیدهای با فرمول هستند که در بسیاری از شویندهها مورد استفاده قرار میگیرند.
کاربردهای گوگرد
در ادامه، برخی از کاربردهای این عنصر را مورد بررسی قرار میدهیم.
تولید سولفوریک اسید
شکل عنصری این ماده به عنوان پریکرسر (پیشماده) برای تولید سایر مواد شیمیایی استفاده میشود. بیش از 80 درصد این ماده به تولید سولفوریک اسید اختصاص دارد.
کاربرد اصلی سولفوریک اسید در تولید کودهای کشاورزی است. همچنین سولفوریک اسید در پالایش نفت، تصفیه آب و استخراج مواد معدنی کاربرد دارد.
سایر مواد شیمیایی
گوگرد به طور مستقیم با متان وارد واکنش میشود که حاصل آن، کربن دیسولفید با فرمول است و در تولید سلفون کاربرد دارد. همچنین، بسیاری از سورفکتانتها و مواد شوینده، مشتقات سولفات هستند. سالانه بیش از 100 میلیون تن کلسیم سولفات آبدار برای استفاده در ترکیب سیمان پرتلند مورد استفاده قرار میگیرد.

کودهای کشاورزی
از این ماده به طور عمده در تولید کودهای کشاورزی استفاده میکنند که مهمترین شکل آن به صورت ماده معدنی کلسیم سولفات است. شکل عنصری این گوگرد، آبگریز است و بنابراین به طور مستقیم توسط گیاهان به مصرف نمیرسند. با گذشت زمان، باکتریهای خاک، این ماده را به مشتقات محلول در آب تبدیل میکنند که توسط گیاه مصرف خواهد شد. این عنصر سبب افزایش عملکرد سایر مواد مغذی مورد نیاز گیاه از جمله نیتروژن و فسفر میشود. مواد گوگردی که از طریق فرآیندهای بیولوژیکی به تولید میرسند، بر خلاف حالت قبل، آبدوست هستند و قابلیت جذب بالایی توسط گیاه دارند.
پزشکی
بسیاری از ترکیبات گوگردی در تولید داروها کاربرد دارند. از نمونههای ابتدایی آنها میتوان به سولفانامیدهای آنتیباکتریال اشاره کرد. همچنین در آنتیبیوتیکها، پنیسیلینها و بسیاری داروهای دیگر از این عنصر بهره میگیرند. علاوه بر این، برای تولید کرمهای صورت بمنظور درمان آکنه، از این ماده کمک میگیرند.
ضدقارچ و آفت کش
از گذشته، پودر گوگرد را به عنوان ضدقارچ و آفتکش استفاده میکردند. این پودر در آفتکشی محصولاتی همچون انگور، سیب، توتفرنگی، سبزیجات و بسیاری محصولات کشاورزی دیگر بکار گرفته میشود و کاربرد زیادی در کنترل حشراتی همچون مایت (هیره) و کنه دارد.
موارد ایمنی
این ماده به شکل عنصری خود سمی نیست. زمانی که گوگرد در معرض هوا شروع به سوختن کند، تولید خواهد شد. همچنین در حضور آب، سولفوروس اسید و سولفیت تولید میکند. در غلظتهای بالا، این اسیدها به ریهها، چشمها و سایر بافتهای بدن آسیب میرسانند. در موجودات زندهای همچون گیاهان و حشرات که فاقد ریه هستند، غلظت بالای این اسیدها، دریافت اکسیژن توسط این جانداران را با مشکل مواجه خواهد کرد.
و سولفوریک اسید نیز در حضور آب، اسیدهایی بسیار خورنده محسوب میشوند. سولفوریک اسید، عامل آبگیری بسیار قدرتمندی است که در فرآیندهای حذف آب از بافتهای آلی و شکر، کاربرد دارد. سوزاندن نفت خام و زغالسنگ توسط صنایع مختلف، موجب تولید خواهد شد که با آب و اکسیژن موجود در اتمسفر واکنش میدهد و سولفوریک اسید و سولفوروس اسید تولید میکند. این اسیدها، از جمله اجزای بارانهای اسیدی هستند که با کاهش pH خاک، سبب تخریب محیط زیست و فرسایش خاک میشوند. به همین دلیل، استانداردهایی که برای تولید سوخت وجود دارند، به شدت به حذف گوگرد از سوخت توصیه میکنند.

هیدرژون سولفید با فرمول ، مادهای کشنده و بسیار سمی است. البته به دلیل بوی بسیار نامطبوعی که این ماده دارد، به طور معمول تنفس آن در مقادیر بسیار زیاد، کمتر اتفاق میافتد. گرچه لازم به ذکر است که تنفس هیدروژن سولفید به سرعت موجب از بین رفتن حس بویایی میشود به طوریکه قربانی با تنفس مقادیر بیشتر آن، متوجه دریافت این ماده نخواهد شد. سولفیدهای محلول و هیدروسولفید نیز با مکانیسمی مشابه به عنوان موادی سمی در نظر گرفته میشوند.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:













جناب اقای مهندس
با سلام
چگونه می تونم بدون خطر گوگرد را تبخیر کنم
سلام. گوگرد هنگام رطوبت با فلز مس واکنش نشون میده و باعث خورندگی این فلز میشه
چطور میشه؟ در هوای با رطوبت بالا از فلز مس در مقابل گوگرد حفاظت حداکثری کرد؟؟؟؟
سلام وقت شما بخیر
آقای بحر کاظمی لطف میکنید برای فروش گوگرد در داخل کشور راهنمایی بفرمایید برای پیدا کردن بازار فروش داخلی چه اقدامی باید بکنیم به چه شرکت ها و صنایعی مراجعه کنیم گوگرد تولیدی ما گوگرد حاصل از گاز (گوگرد مذاب) که در نهایت گوگرد بی شکل تولید میکنیم. با تشکر