آمونیاک و فرآیند هابر – از صفر تا صد
فرآیند هابر در تولید صنعتی آمونیاک از نیتروژن و هیدروژن کاربرد دارد. این فرآیند شامل ترکیب نیتروژن دریافتی از هوا با هیدروژن است. برای تامین گاز هیدروژن، از یک گاز طبیعی مانند متان بهره میگیرند. این ترکیب در نهایت به تولید آمونیاک منتج میشود. این واکنش، گرمازا و برگشتپذیر است. واکنش کلی برای تولید آمونیاک به صورت زیر است:
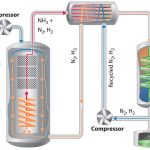
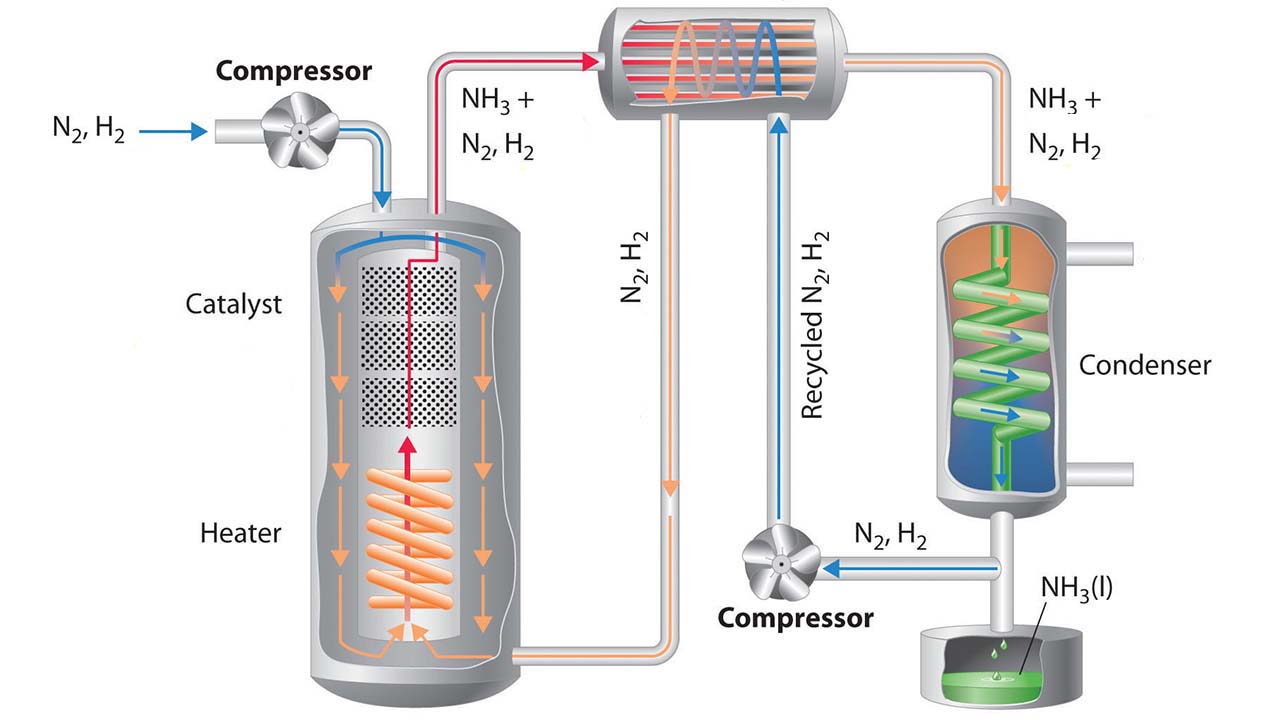
نمای کلی از فرآیند هابر در تصویر زیر دیده میشود:
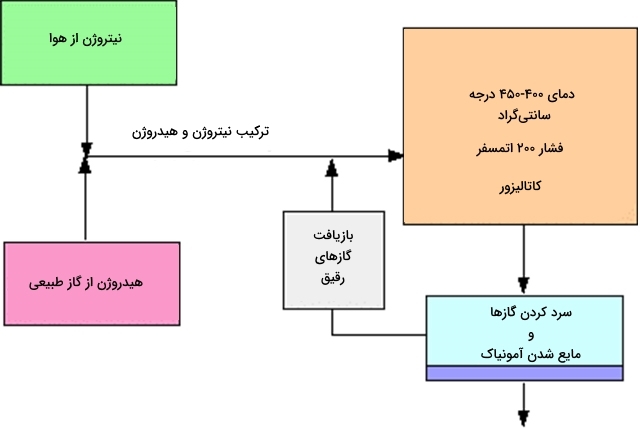
شرایط کلی فرآیند هابر
- کاتالیزور: در حقیقت، کاتالیزور مورد استفاده در این فرآیند، پیچیدهتر از نوع خالص آهن است. برای بهبود تولید، به این کاتالیزگر پتاسیم هیدروکسید اضافه میکنند که نقش راهانداز (Promoter) دارد.
- فشار: فشار از یک کارخانه به کارخانه دیگر متفاوت است اما معمولا این واکنش در فشار بالا اتفاق میافتد.
- بازیافت: در هر عبور گاز از واکنش، تنها پانزده درصد نیتروژن و هیدروژن به آمونیاک تبدیل میشوند. اگر به طور مداوم نیتروژن و هیدروژنی که در واکنش شرکت نکردهاند به چرخه واکنش بازگردانی شوند، در نهایت ۹۸ درصد از واکنشدهندهها به آمونیاک تبدیل خواهند شد.
نسبت ترکیبات در تولید آمونیاک
مخلوط نیتروژن و هیدروژن وارد شده به فرآیند به نسبت 1 به ۳ است، یعنی ۱ حجم از نیتروژن در مقابل ۳ حجم از هیدروژن به راکتور وارد میشود. قانون آووگادرو بیان میکند که حجمهای مساوی از گازها در دما و فشار یکسان، با تعداد مولکولهای آن برابر است. در نتیجه، نسبت گازهای ورودی به راکتور به صورت یک مولکول از نیتروژن در مقابل ۳ مولکول از هیدروژن توصیف میشود. این نسبتها در حقیقت همان ضرایب استوکیومتری واکنش هستند.
در برخی واکنشها ممکن است یکی از واکنشدهندهها به مقدار اضافی وارد واکنش شود. این مورد در شرایطی بوجود میآید که نیاز به مصرف حداکثری دیگر واکنشدهنده(ها) باشد. به طور مثال اگر یکی از واکنشدهندهها گرانقیمت باشد، میتوان از این شرایط بهره برد. البته این حالت برای فرآیند هابر مناسب نیست چراکه ممکن است مولکولهای گذرنده از راکتور در هیچ واکنشی شرکت نکنند زیرا واکنشدهندهای برای آنها فراهم نیست. این مورد سبب اشغال فضای راکتور یا به عبارت دیگر اشغال فضای کاتالیزور میشود.

دما
افزایش یا کاهش دمای واکنش موجب افزایش یا کاهش تولید فرآورده میشود که میتوان موارد مختلفی را برای آن مدنظر قرار داد:
- ملاحظات تعادلی: باید در حد امکان، جهت پیشرفت واکنش به طرف تولید فرآورده حرکت کند. به عبارت بهتر، هر قدر جهت واکنش به سمت راست باشد، محصول بیشتری خواهیم داشت. این واکنش گرماده بوده و آنتالپی آن برابر با است. بر اساس اصل لوشاتلیه، این شرایط با کاهش دما امکانپذیر خواهد بود. در حقیقت با تولید گرما در این واکنش، سیستم ممکن است به جهت عکس پیشروی کند. برای حداکثر تولید آمونیاک باید تا حد امکان دما کم شود. البته دمای 400-450 درجه سانتیگراد دمای پایینی نیست.
- ملاحظات سرعت: هر قدر دمای مورد استفاده پایینتر باشد، سرعت واکنش نیز کاهش مییابد. برای یک کارخانه بهتر است تا اندازهای که میتواند آمونیاک تولید کند. در این مورد به گازهایی نیاز است تا در کوتاهترین زمان تماس با کاتالیزور به تعادل برسند.
به طور کلی میتوان گفت دمای بین 400-450 درجه سانتیگراد دمای مناسبی است که در زمان کوتاهی، نسبتهای زیادی از آمونیاک را در مخلوط تعادلی تولید میکند.
فشار
دقت کنید که در فرمول اصلی واکنش، ۴ مولکول در سمت چپ و تنها ۲ مولکول در سمت راست واکنش قرار دارند. بنا بر اصل لوشاتلیه، با افزایش فشار، سیستم در پاسخ به این افزایش فشار، فرآوردههای کمتری تولید میکند. این امر موجب میشود تا دوباره فشار در سیستم کاهش بیابد.
به منظور تولید هرچه بیشتر آمونیاک در مخلوط تعادلی، باید به اندازه کافی فشار سیستم بالا باشد. فشار مناسب برای فرآیند هابر در حدود 200 اتمسفر پیشبینی شده است.
- ملاحظات سرعت: افزایش فشار سبب نزدیکی بیشتر مولکولها به یکدیگر میشود. این امر به برخورد مولکولها و چسبیدن آنها به سطح کاتالیزور و انجام واکنش کمک میکند. هر قدر فشار بیشتر باشد، سرعت واکنش گازها بیشتر خواهد بود.
- ملاحظات اقتصادی: انجام واکنش در شرایط فشار زیاد از دو جنبه بسیار پرهزینه است. در نگاه اول، استفاده از فشار بالا، نیازمند تجهیزات و لولهکشیهای مناسب با فشار بالا خواهد بود که خود، هزینههای بسیاری را تحمیل میکند. علاوه بر این، تعمیرات و نگهداری این تجهیزات برای عملکرد مناسب در شرایط فشار زیاد هم نیازمند صرف هزینههای بسیاری است.
با توجه به مسائل مطرح شده، میزان بهینه فشار در حدود 200 اتمسفر توصیه میشود. با افزایش فشار، هزینه تولید، از اختلاف میزان گاز تولیدی، بیشتر خواهد شد.

کاتالیزور
استفاده از کاتالیزور در افزایش سرعت واکنش موثر است اما نیازمند ملاحظات متعددی است:
ملاحظات تعادلی: کاتالیزور هیج نقشی در نقطه تعادلی واکنش ندارد. به عبارت دیگر، اضافه کردن کاتالیزور به واکنش تاثیری بر میزان حجم آمونیاک تولید شده نخواهد داشت. تنها کاربردی که در فرآیند هابر دارد، افزایش سرعت واکنش است.
ملاحظات سرعت: در غیاب کاتالیست، سرعت واکنش آنقدر پایین است که گویی در زمان معمول هیچ واکنشی رخ نمیدهد. استفاده از کاتالیزور موجب میشود تا سرعت واکنش به نحوی افزایش یابد که انجام واکنش به هنگام حضور کوتاه مدت گازها در راکتور صورت گیرد.
جداسازی آمونیاک: به هنگام خروج گازها از راکتور، دما و فشار آنها بسیار بالا است. آمونیاک تنها در شرایطی به مایع تبدیل میشود که دمای پایینی داشته باشد. بنابراین، دمای مخلوط را به اندازه کافی پایین میآورند تا تبدیل آمونیاک به مایع صورت بگیرد. گازهای نیتروژن و هیدروژن در این دما به حالت گاز قرار دارند و به سادگی از آمونیاک جدا میشوند.
با مخلوط کردن آمونیاک تولیدی با هوا و در حضور کاتالیزور، طی سه مرحله، آمونیاک به نیتریک اسید تبدیل میشود:
نیتریک اسید تولیدی، ماده اولیه در نیتراتها است. از نیتراتها برای تولید مواد منفرجه و مهمات جنگی بهره میگیرند. در طول جنگ جهانی اول، با توجه به اینکه انگلستان به منابع عظیمی از نیترات سدیم دسترسی داشت که از کشور شیلی تامین میشد و بنابراین با مشکلی در ساخت مهمات جنگی روبرو نبود؛ اما آلمان هیچگونه دسترسی به منابع نیترات نداشت، از اینرو، فرآیند هابر در تامین ماده اولیه جنگافزارهای آلمان نقش اساسی پیدا کرد.
جنبههای زیست محیطی و اقتصادی
فرآیند هابر که به فرآیند هابر-بوش نیز موسوم است، موجب تولید سالانه 450 میلیون تن کود به شکلهای آمونیاک، «آمونیوم نیترات» و «اوره» میشود. این فرآیند، مصرف ۳-۵ درصد گاز طبیعی تولید شده در جهان را به خود اختصاص میدهد. مصرف آمونیاک به عنوان کود به همراه آفتکشها موجب افزایش تولید و بهرهوری از زمینهای کشاورزی شده است.
البته استفاده از این مواد خطراتی را نیز به همراه دارد به گونهای که نفوذ نیتراتها به سفرههای آب زیرزمینی، رودخانهها و دریاچهها موجب پایین آمدن کیفیت آب و به تبع آن مردابی شدن این مناطق شده است. علاوه بر این، رسوب نیتراتها و آمونیاک بر اکوسیستم تاثیرگذار خواهد بود و موجب انتشار بیشتر «نیتروس اکسید» میشود. این گاز به عنوان سومین گاز گلخانهای بعد از گاز متان و دیاکسید کربن ذکر شده است.
اگر مطلب بالا برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای مهندسی شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش هایسیس HYSYS برای شبیهسازی فرایندهای شیمیایی
- کلوئید — به زبان ساده
- محلول ها — به زبان ساده
^^













سلام از اين واكنش به عنوان مولد گرما ميتوان استفاده كرد
عااالی، کااامل.ممنون. جواب سوالاتم را یافتم.?
سلام
ممنون از اطلاعات
فرمول های دیگه ای از تولید فرآیند آمونیاک رو میخواستم ؟