رادیو ایزوتوپ چیست؟ – به زبان ساده + کاربردها
به ایزوتوپهای رادیواکتیو یک عنصر، رادیو ایزوتوپ گفته میشود و برخلاف ایزوتوپهای پایدار هستند. این ایزوتوپهای رادیواکتیو در تعداد نوترونهای موجود در هسته اتم با یکدیگر تفاوت دارند و وجود اختلاف در تعداد نوترونهای آنها باعث ناپایداری این اتمها میشود. در این مطلب از مجله فرادرس میآموزیم رادیو ایزوتوپ چیست و در مورد ویژگیها و کاربردهای آنها در حوزههای مختلف مانند صنایع، پزشکی و کشاورزی صحبت میکنیم.
- میآموزید رادیو ایزوتوپ چیست و چه تفاوتی با ایزوتوپ پایدار دارد.
- یاد میگیرید نیمهعمر چیست و واپاشی پرتوزا چگونه انجام میشود.
- خواهید آموخت ویژگیهای تابش آلفا، بتا و گاما را مقایسه کنید.
- کاربردهای رادیو ایزوتوپ در پزشکی، صنعت و کشاورزی را میآموزید.
- یاد خواهید گرفت ریسکهای بیولوژیک و جنبههای ایمنی رادیو ایزوتوپها را توضیح دهید.
- تأثیر تاریخی و اخلاقی رادیو ایزوتوپها را بررسی خواهید کرد.


رادیو ایزوتوپ چیست ؟
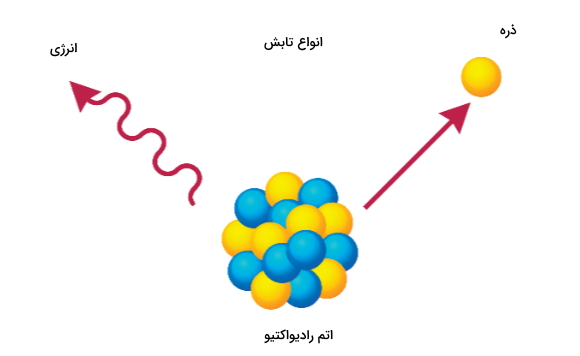
رادیو ایزوتوپ برای اشاره به ایزوتوپهای رادیواکتیو یک عنصر استفاده میشود. همچنین میتوان رادیو ایزوتوپ را به عنوان اتمی معرفی کرد که ترکیبی ناپایدار از تعداد نوترون و پروتون یا انرژی مازادی در هسته اتم خود دارد.
رادیوایزوتوپهای یک عنصر دارای تعداد برابری از پروتون در هسته خود هستند اما در تعداد نوترون با یکدیگر تفاوت دارند. از رادیو ایزوتوپ گاهی به عنوان ایزوتوپ ناپایدار یا اتم پرتوزا نیز نام برده میشود.
منبع رادیو اکتیو
منابع رادیواکتیوی که رنگ جهانی اختصاصی آنها زرد است، به صورت مهر و موم شده وجود دارند و شامل مقادیری از اتمهای رادیو ایزوتوپ در داخل کپسولهای بهخصوص هستند که توانایی ساطع کردن تابشهای یونساز را دارند. در کاربردهای صنعتی معمولا این رادیو ایزوتوپها پرتو گاما را میتابانند.

نیمه عمر چیست ؟
نیمه عمر، زمان مورد نیاز برای انجام واپاشی پرتوزا و رسیدن به پایداری برای نیمی از اتمهای یک رادیو ایزوتوپ است. در ادامه تعریفی از واپاشی پرتوزا را بررسی میکنیم.

واپاشی پرتوزا
اتمهایی که هسته ناپایدار دارند با از دست دادن ذرات و انرژی خود به صورت تابش به پایداری میرسند. به این فرایند که شامل ساطع کردن تابش است واپاشی پرتوزا میگوییم. توجه داشته باشید که چگونگی انجام آن برای هر هسته منحصربهفرد است و به وسیله بازه زمانی اندازهگیری میشود. به این مقیاس نیمهعمر گفته میشود.
رادیو ایزوتوپ های شاخص
هر عنصر یک یا چند ایزوتوپ رادیواکتیو دارد که در تعداد نوترون با دیگر ایزوتوپها تفاوت دارد. در ادامه میآموزیم برخی از مهمترین و پرکاربردترین مثالهای رادیو ایزوتوپ چیست.
امروزه بیش از ۳۰۰۰ رادیو ایزوتوپ مختلف شناسایی شده است. هر رادیو ایزوتوپ مادر در نهایت به یک یا تعداد بیشتری ایزوتوپهای پایدار که به آنها به اصطلاح ایزوتوپ دختر میگوییم، تفکیک میشود. تمام هستههای شامل بیشتر از ۸۴ نوترون رادیواکتیو هستند و هستههایی با تعداد کمتر از نوترون میتوانند در دو حالت پایدار و ناپایدار حضور داشته باشند.
رادیو ایزوتوپ فسفر
عنصر فسفر ایزوتوپهای بسیاری با عدد جرمی از ۲۵ تا ۴۷ را دارد اما تنها ایزوتوپ با عدد جرمی ۳۱ آن پایدار است. دو رادیو ایزوتوپ این عنصر نیمهعمرهای طولانیتری نسبت به بقیه دارند. رادیو ایزوتوپ فسفر-۳۳ بیشترین نیمهعمر را دارد که برابر با ۲۵٫۳۴ روز است و سپس رادیو ایزوتوپ فسفر-۳۲ وجود دارد که نیمهعمری برابر با ۱۴٫۲۶۸ روز دارد.
بقیه رادیو ایزوتوپهای این عنصر نیمهعمری کمتر از ۲٫۵ دقیقه دارند. فسفر-۲۵ کوتاهترین نیمهعمر را دارد که برابر با ۳۰ نانوثانیه است.
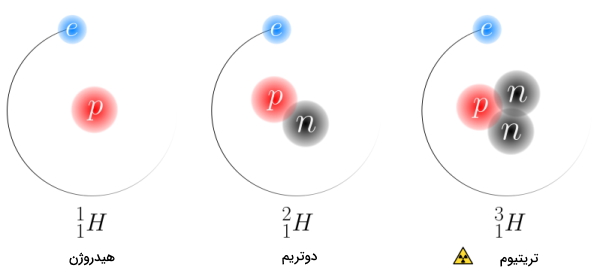
رادیو ایزوتوپ هیدروژن
هیدروژن به عنوان کوچکترین و سبکترین عنصر جدول تناوبی عناصر، ۳ ایزوتوپ دارد.
- هیدروژن با ۱ پروتون و ۰ نوترون
- دوتریم با ۱ پروتون و ۱ نوترون
- تریتیوم با ۱ پروتون و ۲ نوترون
از این ۳ ایزوتوپ هیدروژن تنها تریتیوم رادیواکتیو است و دوتا دیگر، پایدار هستند.
رادیو ایزوتوپ تکنسیم
تکنسیم یکی از دو عنصر جدول تناوبی با عدد جرمی زیر ۸۳ است که هیچ حالت پایداری ندارد. (عنصر دیگر پرومتیوم با نماد Pm است). این عنصر تنها به میزان جزئی در طبیعت وجود دارد و به طور عمده به روشهای مصنوعی تولید میشود. این ایزوتوپ تعداد زیادی رادیو ایزوتوپ با نیمهعمر متفاوت دارد که برخی در حد نانوثانیه و برخی در حد سالیان است.
رادیو ایزوتوپ آهن
عنصر آهن در طبیعت به ۴ فرم ایزوتوپی پایدار وجود دارد و از آن ۲۴ رادیو ایزوتوپ تا کنون شناخته شده است. از این بین دو رادیو ایزوتوپ با بیشترین نیمهعمر وجود دارند که در زیر آورده شدهاند.
- آهن-۶۰ با نیمهعمری برابر ۲٫۶ میلیون سال
- آهن-۵۵ با نیمهعمری برابر با ۲٫۷ میلیون سال
تشکیل رادیو ایزوتوپ
در قسمت قبل آموختیم رادیو ایزوتوپ چیست. در ادامه بررسی میکنمی روش تشکیل رادیو ایزوتوپ چیست.
- برخی به صورت طبیعی وجود دارند.
- برخی از تغییرات در اتم عنصرها به وجود میآیند.
برخی ایزوتوپهای طبیعی مانند رادیوم، توریم و اورانیوم در سنگها و خاک حضور دارند. اورانیوم و توریم به میزان بسیار اندکی در آب نیز پیدا میشود. رادون، رادیو ایزوتوپی که از واپاشی پرتوزا رادیوم به وجود میآید در هوا وجود دارد. همچنین مواد معدنی ممکن است شامل مقادیر جزئی از پتاسیم و کربن باشند.
در بخش بعد درمیآموزیم این انواع رادیوایزوتوپ چیست.
رادیو ایزوتوپ طبیعی
شناخته شدهترین رادیو ایزوتوپی که به صورت طبیعی وجود دارد اورانیوم است. بخش عمده اورانیوم موجود در سیاره زمین از نوع اورانیوم-۲۳۸ است. تنها ۰٫۷٪ باقیمانده از اورانیوم-۲۳۵ است که پایداری کمتر و رادیواکتیویته بیشتری دارد. تفاوت این دو اورانیوم همانطور که اشاره کردیم تنها در تعداد نوترونهای هسته آنهاست. در این مورد اورانیوم ناپایدار ۲۳۵، ۳ نوترون کمتر دارد.

رادیو ایزوتوپ های غیر طبیعی
تمامی رادیو ایزوتوپهای مورد استفاده در صنعت و پزشکی در طبیعت وجود ندارند. برخی از آنها توسط بشر ساخته میشوند. در بعضی موارد از راکتورهای هستهای و گاهی نیز از شتابدهندههای حلقوی (Cyclotron) برای تولید رادیو ایزوتوپها استفاده میشود.
استفاده از راکتورهای هستهای برای ایزوتوپهای غنی از نوترون بسیار کارآمد است. از این مورد میتوان به مولیبدن-۹۹ام اشاره کرد. در حالیکه برای ایزوتوپهای غنی از پروتون بهتر است از شتابدهنده استفاده شود. به عنوان مثال برای فلوئور-۱۸ این گزینه مناسبتر است.
تابش پرتوزای رادیو ایزوتوپ
در قسمتهای قبل آموختیم رادیو ایزوتوپ چیست. رادیو ایزوتوپها با تعداد نوترون متفاوت ذرات ناپایداری هستند و نیمهعمری از چند ثانیه تا چند میلیون سال دارند. این ذرات انرژی مازاد خود را به صورت تابش از دست میدهند و از طریق تغییر در هسته خود به پایداری میرسند. این تابشها شامل موارد زیر هستند:
- آلفا با نماد
- بتا با نماد
- گاما با نماد
در جدول زیر میآموزید تفاوتهای این سه نوع تابش رادیو ایزوتوپ چیست.

واپاشی آلفا
این تابش در واقع هسته هلیوم-۴ است. به فرایندی که در آن از هسته اتمی رادیواکتیو تابش آلفا ساطع میشود واپاشی آلفا گفته میشود. نمونهای از هستهای که دچار این فروپاشی میشود اورانیوم-۲۳۸ است. واکنش فروپاشی آن را به صورت زیر نشان میدهیم.
$${_{92}^{238}U} \rightarrow {_2^4He} + {_{90}^{234}Th} \label{\alpha1}$$
در این واپاشی اتم اورانیوم تبدیل به یک اتم تریوم شد و یک ذره آلفا نیز آزاد کرد. به نماد ذره آلفا دوباره نگاه کنید. عدد پایینی نشاندهنده تعداد پروتونها است، یعنی این ذره در خود ۲ پروتون دارد که همراه آن +2 بار نیز وجود دارد. عدد بالایی نشاندهنده جمع تعداد پروتونها و نوترونها ذره است. از آنجا که این ذره ۲ پروتون دارد، ۲تای باقیمانده نشاندهنده تعداد نوترونهای آن است. ذرات آلفا همیشه همین ساختار را دارند.
معادله بالا نمونهای از معادله شکافت هستهای است و مشابه معادلههای شیمیایی است. به مثالی دیگر از تابش آلفا توجه کنید.
$${_{90}^{230}Th} \rightarrow {_2^4He} + {_{88}^{226}Ra} \label{\alpha2}$$
واپاشی بتا
دومین تابشی که رادیو ایزوتوپها از خود ساطع میکنند واپاشی بتا نام دارد. این تابش در واقع الکترونی با انرژی بسیار بالا است. همانطور که میدانیم هسته شامل الکترون نیست با این حال در تابش بتا از هسته، الکترون خارج میشود. در همان زمان خارج شدن الکترون، نوترونی تبدیل به پروتون میشود. میتوانیم اینطور تصور کنیم که در این فرایند نوترون شکسته شده و از خود یک پرتون و یک الکترون برجا میگذارد. این برداشت با اینکه قضیه را ساده میکند اما دقیقا اتفاقی نیست که رخ میدهد. با اینحال برای تسهیل این فرض را درست در نظر میگیریم.
پس فرض بر این است که در تابش بتا ذره نوترونی شکسته شده و از خود یک پروتون و یک نوترون به جا میگذارد. پروتون داخل هسته باقی میماند و عدد اتمی آن را افزایش میدهد و الکترون به فرم تابش بتا خارج میشود.
برای قرار دادن الکترون در معادله شکافت هستهای الکترون را با عدد اتمی و جرم اتمی نشان میدهیم. جرم اتمی اختصاص داده شده به الکترون ۰ خواهد بود که با توجه به تعریف آن، جمع تعداد نوترونها و پروتونهای هسته، منطقی است. همچنین عدد اتمی هر الکترون برابر با ۱- خواهد بود زیرا با وارد کردن الکترون در معادله شکافت هستهای امکان موازنه اعداد اتمی را میدهد. پس نماد ذره بتا به صورت زیر خواهد بود.
یا
$${_{-1}^0\beta} \label{\beta1}$$
در ادامه واپاشی پرتوزایی را مشاهده میکنیم که شامل یک ذره بتا است.
$${_{90}^{234}Th} \rightarrow {_{-1}^0e} + {_{91}^{234}Pa} \label{\beta2}$$
واپاشی گاما
اغلب اوقات تابش گاما در کنار بقیه تابشها در معادلههای هستهای وجود دارد. مثلا در واپاشی اورانیوم-۲۳۸ دو اشعه گاما با انرژی متفاوت نیز ساطع میشود. این معادله شکافت هستهای را به صورت زیر نشان میدهیم.
با توجه به نکاتی که در این قسمت گفتیم تقریبا تمامی معادلههای هستهای که در این بخش آوردیم شامل تابش گاما نیز هستند که برای سهولت کار نشان داده نمیشوند.
معادله شکافت هسته ای
معادلههای هستهای شبیه به معادلههای شیمیایی هستند با این تفاوت که در آنها فرایند شکافت هسته رادیو ایزوتوپها و ایجاد تابش نشان داده میشود. واکنشهای هستهای مقادیر بسیار بیشتری از انرژی را نسبت به واکنشهای شیمیایی آزاد میکنند.
این اختلاف در انرژی به این دلیل است که در واکنش شیمیایی مقدار تفاوت انرژی بین محصولها و مواد اولیه آزاد میشود که آن را به صورت ضریبی از نشان میدهیم اما در واکنش هستهای هم انرژی حاصل از تفکیک پیوندها آزاد میشود و هم تبدیل ذره به انرژی صورت میگیرد. انرژی آزاد شده در واکنش هستهای را به صورت ضریبی از نشان میدهیم. با نگاهی به این اعداد متوجه میشویم که واکنش هستهای یک میلیون بار انرژی بیشتری به ازای هر اتم آزاد میکند.
نحوه نوشتن معادله شکافت هسته ای
در این بخش به چند قانون کلی اشاره میکنیم که در نوشتن معادله شکافت هستهای به شیوه صحیح کمککننده هستند.
- جمع اعداد جرمی در سمت راست معادله باید برابر با جمع اعداد جرمی در سمت چپ باشد. (اعداد جرمی در بالای هر نماد نشان داده میشود.)
- جمع اعداد اتمی نیز در دو طرف معادله باید با هم برابر باشند. (اعداد اتمی در قسمت پایین هر نماد وجود دارد.)
برای فهم بهتر در قسمت بعد چند تمرین را در این زمینه بررسی خواهیم کرد.
مثال ۱
در این مثال میخواهیم معادله ناقص زیر را کامل کنیم. و سپس موازنه بودن آن را از نظر جرم اتمی و عدد اتمی بررسی کنیم.
با نگاه به معادله شکافت هستهای داده شده متوجه میشویم که از نوع تابش آلفا است. برای حل این تمرین میتوانیم از یکی از دو روش زیر کمک بگیریم.
روش اول: وقتی اتمی در معادله شکافت هستهای ذرهای آلفا از خود میتاباند، عدد اتمی آن ۲ واحد و عدد جرمی آن ۴ واحد کاهش مییابد. با نگاهی به جدول تناوبی عناصر متوجه میشویم عنصری با عدد اتمی ۸۴ پولونیم نام دارد که با نماد نمایش داده میشود.
روش دوم: پیشتر اشاره کردیم که هر معادله شکافت هستهای باید دارای عدد اتمی و عدد جرمی برابر در دو طرف خود باشد. بنابراین از معادلههای زیر میتوان به جواب رسید.
- جرم اتمی: /
- عدد اتمی: /
میبینیم که جواب جای خالی طرف دوم واکنش عنصری با جرم اتمی ۲۰۶ و عدد اتمی ۸۴ است. میتوانیم معادله بالا را به صورت زیر کامل کنیم.
مثال ۲
در این تمرین میخواهیم معادله شکافت هستهای کربن-۱۴ را به صورتی که در آن تابش بتایی صورت بگیرد بنویسیم.
میدانیم که هر ذره بتا را با نماد نشان میدهند. پس تابش یک ذرهی بتا باعث افزایش عدد اتمی به میزان ۱ واحد میشود و جرم اتمی را دستنخورده باقی میگذارد. در این مرحله نیاز به مراجعه به جدول تناوبی عناصر داریم و باید دنبال عنصری بگردیم که دارای عدد اتمی ۷ و عدد جرمی ۱۴ باشد. این عنصر همان نیتروژن با نماد N است. معادله شکافت هستهای این تمرین را میتوانیم به صورت زیر نمایش دهیم.
مثال ۳
در این تمرین میخواهیم معادله شکافت هستهای اورانیوم-۲۳۸ () را به صورتی که در آن تابش آلفایی صورت بگیرد بنویسیم.
همانطور که پیشتر توضیح دادیم هر ذره آلفا را با نماد نمایش میدهیم. بنابراین تابش هر ذره آلفا باعث کاهش عدد اتمی به میزان ۲ واحد و عدد جرمی به میزان ۴ واحد خواهد شد و با مراجعه به جدول تناوبی عناصر متوجه میشویم که خانه با عدد اتمی ۹۰ و عدد جرمی ۲۳۴ مربوط به عنصر توریم است. معادله شکافت هستهای به وقوع پیوسته در این تمرین را به صورت زیر نشان میدهیم.
مثال ۴
واکنش هستهای زیر را در نظر بگیرید.
میخواهیم موازنه بودن این معادله را بررسی کنیم. مقادیر جرم اتمی و عدد اتمی را در دو طرف واکنش با هم مقایسه میکنیم.
جرم اتمی:
عدد اتمی:
این معادله شکافت هستهای بهدرستی نوشته شده است زیرا جمع اعداد اتمی و جرمهای اتمی در دو طرف آن با یکدیگر برابر است. این مثال نمونهای از واکنش هستهای با تابش ذره آلفا بود.
مثال ۵
واکنش هستهای زیر را در نظر بگیرید.
میخواهیم موازنه بودن این معادله را بررسی کنیم. باید مقادیر جرم اتمی و عدد اتمی در دو طرف واکنش را با یکدیگر مقایسه کنیم.
- جرم اتمی:
- عدد اتمی:
همانطور که میبینید جرم اتمی در دو طرف واکنش برابر است زیرا یک نوترون از دست داده و یک پروتون به دست آورده است، بنابراین جمع پروتون و نوترون که همان جرم اتمی باشد تغییری نمیکند و این معادله شکافت هستهای بهدرستی نوشته شده و نشاندهنده تابش بتا است.
مثال ۶
معادله شکافت هستهای زیر را در نظر بگیرید.
برای پیبردن به صحت این معادله شکافت هستهای نیاز است که برابر بودن جرم اتمی و عدد اتمی مجموع را در دو طرف واکنش با یکدیگر مقایسه کنیم.
- جرم اتمی:
- عدد اتمی:
همانطور که میبینید دو طرف معادله شکافت هستهای از نظر عدد اتمی و جرم اتمی با یکدیگر موازنه هستند و معادله بهدرستی نوشته شده است.
موازنه بار در معادله شکافت هسته ای
میدانیم که ذرههای آلفا و بتا هر دو دارای بار هستند اما موازنه بار در دو طرف معادله شکافت هستهای برخلاف معادله شیمیایی اهمیتی ندارد. از این نظر بین موازنه در واکنشی شیمیایی و موازنه در معادله شکافت هستهای تفاوتهایی وجود دارد. بنابراین در نوشتن معادله شکافت هستهای میتوان موازنه بار را در نظر نگرفت و تنها روی موازنه اعداد جرمی و اتمی تمرکز کرد.
قدرت تابش
در قسمت های قبل آموختیم رادیو ایزوتوپ چیست و واپاشی پرتوزا چه ارتباطی با آن دارد. قدرت هر تابش و در نتیجه اثرگذاری آن به دو فاکتور مهم بستگی دارد.
- قدرت یونیزاسیون
- قدرت نفوذ
هر تابش بنابر ماهیت خود تفاوتهایی در این ویژگیها دارد. در ادامه این موارد را بررسی میکنیم.
قدرت یونیزاسیون
به توانایی هر تابش در آسیب رساندن به مولکولها قدرت یونیزاسیون آن میگوییم. در زمان برهمکنش تابش با اتم، ممکن است اتم با از دست دادن الکترونهایش تبدیل به یون شود. هر چه این یونیزاسیون بیشتر صورت بگیرد آسیب وارده نیز بیشتر خواهد بود.
قدرت نفوذ
آسیب وارده از هر تابش بستگی مستقیم به میزان نفوذ آن در اتم و مولکول دارد. به توانایی نفوذ هر تابش در جسم مورد نظر قدرت نفوذ آن گفته میشود. واضح است که هر چه میزان این نفوذ بیشتر باشد، جسم در معرض خطر بزرگتری قرار دارد. به طور کلی هرچه جرم ذره تابش بیشتر باشد قدرت یونیزاسیون آن بیشتر و قدرت نفوذ آن کمتر خواهد بود.
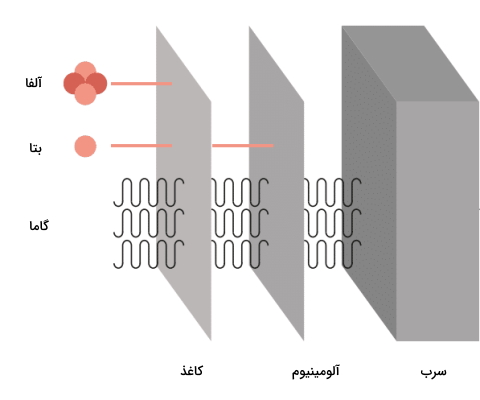
مقایسه قدرت یونیزاسیون تابش های آلفا، بتا و گاما
در این قسمت میخواهیم قدرت یونیزاسیون سه تابش بررسی شده در این مطلب را با یکدیگر مقایسه کنیم. ذره آلفا در این بین بیشترین جرم را دارد به صورتی که جرم آن ۴ برابر یک پروتون و نوترون است. در مقام مقایسه ذره آلفا جرمی ۸۰۰۰ بار بیشتر از یک ذره بتا دارد. به همین دلیل بیشترین قدرت یونیزاسیون را به خود اختصاص میدهد و در نتیجه میزان آسیب وارده نیز افزایش مییابد.
قدرت آلفا
اندازه ذره آلفا باعث میشود قدرت نفوذ آن به شدت کاهش پیدا کند به صورتی که با سرعت به اجسام برخورد میکند، دو الکترون به دست میآورد و فوری تبدیل به اتم بیخطر هلیوم میشود. در نتیجه ذره آلفا کمترین قدرت نفوذ را دارد و میتوان با لایهای لباس یا برگی کاغذ جلوی آن را گرفت. جالب است بدانید حتی لایه سلولهای مرده پوست انسان نیز از پیشروی آن جلوگیری میکند.
با این حال نباید خطرهای تابش آلفا برای انسان را دستکم گرفت. در صورت وقوع انفجار اتمی و پخش شدن مواد رادیواکتیو در محیط، امکان استنشاق آن وجود دارد. همچنین میتواند از طریق غذا و آب وارد بدن انسان شود. در این مواقع بدن ایمنی خود را در برابر این تابش از دست میدهد.
قدرت بتا
ذرههای بتا اندازه بسیار کوچکتری نسبت به آلفا دارند بنابراین قدرت یونیزاسیون آنها و در نتیجه آسیب وارده به بافت نیز خیلی کمتر خواهد بود اما این کوچک بودن ذره باعث افزایش قدرت نفوذ آن میشود. بیشتر منابع معتقدند که لایه آلومینیومی با ۶۴ سانتیمتر جلوی نفوذ این تابش را میگیرد. باید بدانیم که این جلوگیری تنها در زمانی ممکن است که تابش بیرون بدن انسان باشد و با وارد شدن آن در بدن کار زیادی از دست ما بر نمیآید.
قدرت گاما
تابش گاما در واقع تابشی الکترومغناطیس است و به فرم ذره وجود ندارد، بنابراین دارای بار و جرم نیستند. (مانند اشعه ایکس اما با قدرت بسیار بیشتر) تابش گاما قدرت نفوذ بسیار بالایی دارد و لایهای بسیار قطور از سرب برای جلوگیری از نفوذ آن نیاز است. تابش گاما بدون هیچ مانعی از بدن انسان عبور میکند بنابراین آن را تابشی با بیشترین قدرت نفوذ و کمترین قدرت یونیزاسیون میدانند.
| ذره | آلفا | بتا | گاما |
| نماد | |||
| جرم | ۴ amu | ۱٫۲ amu | صفر (ماهیت انرژی دارد) |
| قدرت نفوذ | بسیار کم | متوسط | بسیار زیاد |
| قدرت یونیزاسیون | بسیار زیاد | متوسط | بسیار کم |
| سپر محافظ | کاغذ/ پوست | آلومینیوم | سرب با قطر ۵٫۵ سانتیمتر |
بهترین وضعیت برای بدن انسان جلوگیری کامل از قرار گرفتن در معرض این تابشها است اما ممکن است این وضعیت ایدهال امکانپذیر نباشد. پیشنهاد بعدی این است که افرادی که با این موارد سروکار دارند، تا جای امکان زمان قرارگیری در معرض تابش را کاهش و فاصله خود را با منبع تابش افزایش دهند.

زنجیره واپاشی چیست ؟
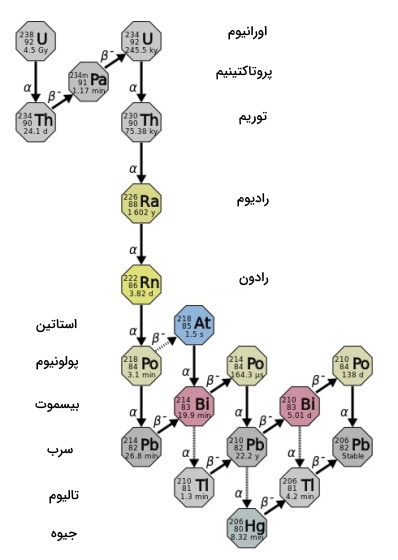
در قسمتهای قبل آموختیم ارتباط واپاشی پرتوزا با رادیو ایزوتوپ چیست. همانطور که گفتیم واپاشی رادیو ایزوتوپها برای ساطع کردن تابش جهت رسیدن به پایداری است اما در بیشتر موارد انجام تنها یک واپاشی ذره را به پایداری نمیرساند. در چنین مواردی رادیو ایزوتوپ وارد چندین واپاشی زنجیرهای میشود تا به هدف غایی خود یعنی داشتن پایداری برسد.
در این مورد میتوان به واپاشی رادیو ایزوتوپ اورانیوم-۳۸ اشاره کرد. این رادیو ایزوتوپ تا رسیدن به پایداری و تبدیل به سرب-۲۰۶، ۱۴ واپاشی را به صورت متوالی از سر میگذراند. رادیو ایزوتوپهایی مثل اورانیوم-۲۳۵ و توریم-۲۳۲ نیز واپاشیهای زنجیرهای مشابهی را طی میکنند. به طوری که به ترتیب تبدیل به سرب-۲۰۷ و سرب-۲۰۸ میشوند. در تصویر زیر حالت کلی پیمایش این زنجیره نشان داده شده است.
کاربرد رادیو ایزوتوپ
از عنصرهای رادیو ایزوتوپ در حیطههای بسیاری از جمله صنعتی، پزشکی و علمی استفاده میشود. رادیو ایزوتوپها باعث پیشرفت در بسیاری صنایع هستند به طوری که قابل جایگزینی با ماده دیگری نیستند. در ادامه میآموزیم کاربرد رادیو ایزوتوپ چیست.
رادیو ایزوتوپ در پزشکی
رادیو ایزوتوپ جزء جداییناپذیر در حیطه پزشکی هستهای است. در واقع بیشتر از ۳۰ سال است که از این مواد در داروها استفاده میشود. بعضی از رادیو ایزوتوپهایی که در پزشکی هستهای مورد استفاده قرار میگیرند نیمهعمر کوتاهی دارند و این نیمهعمر کوتاه باعث میشود که سریع از هم بپاشند، بنابراین برای تشخیص مناسب هستند. از طرفی رادیو ایزوتوپهایی با نیمهعمر طولانی برای اهداف درمانی مورد استفاده قرار میگیرند.
تولید رادیو ایزوتوپ های پزشکی
اهمیت این مواد تا جایی است که برخی بیمارستانها شتابدهندههای حلقوی اختصاصی برای تولید آنها دارند. بیشتر رادیو ایزوتوپهایی که از این طریق تولید میشوند نیمهعمر بسیار کوتاهی در حد دقیقه و حتی ثانیه دارند بنابراین همانطور که پیشتر گفتیم مصرف تشخیصی دارند. به طور کلی این رادیو ایزوتوپها از بمباران اجسام توسط نوترون در راکتور و توسط پروتون در شتابدهنده حلقوی به وجود میآیند.

رادیو ایزوتوپ برای تشخیص بیماری
گفتیم که یکی از موارد مصرف رادیو ایزوتوپها در علم پزشکی برای موارد تشخیصی است. در این موارد از مقدار ناچیزی رادیو ایزوتوپ برای جمع آوری اطلاعات در مورد عضو خاصی از بدن فرد بیمار استفاده میشود. در برخی موارد برای تشخیص میزان پیشرفت بیماری از رادیو ایزوتوپ استفاده میشود. با داشتن اطلاعات حاصل از این روش میتوان تا حد زیادی دقت تشخیص پزشک را بالا برد و در نتیجه سلامت جامعه بهبود پیدا میکند.
رادیو دارو
در قسمت قبل آموختیم کاربردهای دارویی و پزشکی رادیو ایزوتوپ چیست. رادیو داروها مولکولهایی هستند که از دو جزء تشکیل میشوند.
- ردیاب رادیوایزوتوپی
- یک مولکول دارویی
این مولکولهای برچسبگذاری شده توسط رادیو ایزوتوپها بعد از وارد شدن در بدن انسان در ارگانی خاص یا بافتی که دارای تومور است تجمع میکنند. سپس رادیو ایزوتوپ متصل به مولکول دارویی دچار واپاشی شده و از خود مقدار مشخصی تابش ساطع میکند که پزشکها از آن برای تشخیص نوع و میزان حاد بودن بیماری استفاده میکنند.
چیزی که در این روش بسیار مهم است میزان رادیو ایزوتوپ وارد شده به فرد بیمار است به طوری که خود باعث به وجود آمدن مشکلات بیشتر برای فرد نشود.
رادیو داروهای متدوال
تعدادی رادیو دارو هستند که از کاربرد و اهمیت بیشتری برخوردارند. در این قسمت برخی از آنها را بررسی خواهیم کرد.
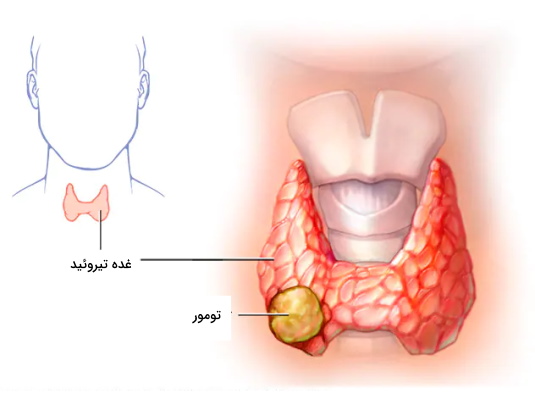
یکی از این رادیو داروها ید-۱۳۱ است که نیمهعمری برابر با ۸ روز دارد. این رادیو ایزوتوپ تابش ذرات بتا با انرژی بالایی دارد و در درمان سرطان تیروئید مورد استفاده قرار میگیرد. از آنجا که وظیفه غده تیروئید در بدن تامین ید مورد نیاز است، با تزریق ید-۱۳۱ این غده آن را به خود جذب میکند. سپس این رادیو ایزوتوپهای تجمع یافته در تیروئید دچار واپاشی شده و تابش ساطع از آن به سلولهای سرطانی اطراف حمله میکند. چیزی که در اینجا اهمیت دارد استفاده از میزان بهینه این رادیو دارو برای کاهش عوارض جانبی بر سلولهای سالم اطراف است.
رادیو داروی دیگری که کاربرد فراوانی دارد تکنسیم-۹۹ام با نیمهعمر ۶ ساعت است. از آنجا که این رادیو ایزوتوپ تابشی ضعیف از اشعه گاما دارد برای عکسبرداری از اعضای بدن ایدهال است زیرا باعث آسیب به نقاط دیگر بدن فرد نمیشود.
رادیو داروهای دیگر
در قسمت قبل آموختیم برخی از مهمترین داروهای رادیو ایزوتوپ چیست. رادیو داروهای از تنوع بالایی برخوردار هستند. در دو جدول زیر به ترتیب رادیو داروهای تولید شده در راکتور و رادیوداروهای تولید شده در شتابدهنده حلقوی را به همراه نیمهعمر و کاربرد هر کدام مشاهده میکنید.
| رادیو ایزوتوپ | نماد رادیو ایزوتوپ | نیمهعمر |
| فسفر-۳۲ | ۱۴٫۲۶ روز | |
| کروم-۵۱ | ۲۷٫۷ روز | |
| ایتریم-۹۰ | ۶۴ ساعت | |
| مولیبدن-۹۹ | ۶۵٫۹۴ ساعت | |
| ساماریم-۱۵۳ | ۴۶٫۲۸ ساعت | |
| لوتتیم-۱۷۷ | ۶٫۶۵ روز | |
| ایریدیم-۱۹۲ | ۷۳٫۸۳ روز |
در ادامه کاربرد هر رادیو دارو را بررسی میکنیم.
- فسفر-۳۲: برای درمان گلبول قرمز خون مازاد کاربرد دارد.
- کروم-۵۱: از این رادیو دارو برای برچسب زدن به گلبول قرمز خون و تشخیص میزان هدررفت پروتئین از دستگاه گوارش استفاده میشود.
- ایتریم-۹۰: برای درمان سرطان کبد مورد استفاده قرار میگیرد.
- مولیبدن-۹۹: از این رادیو ایزتوپ به عنوان پیشماده برای تکنسیم-۹۹ام که پرکاربردترین رادیو دارو است استفاده میشود.
- ساماریم-۱۵۳: از این رادیو دارو برای کاهش درد ناشی از متاستاز استخوانی تومورهای نوع اول استفاده میشود.
- لوتتیم-۱۷۷: این رادیو ایزوتوپ در درمان انواع سرطان مانند سرطان پروستات کاربرد دارد.
- ایریدیم-۱۹۲: از این رادیو ایزوتوپ در درمان سرطانهای بهخصوصی مثلا سرطان سینه و سر استفاده میشود.
| رادیو ایزوتوپ | نماد رادیو ایزوتوپ | نیمهعمر |
| کربن-۱۱ | ۲۰٫۳۳ دقیقه | |
| نیتروژن-۱۳ | ۹٫۹۷ دقیقه | |
| اکسیژن-۱۵ | ۲٫۰۴ دقیقه | |
| فلوئور-۱۸ | ۱٫۸۳ ساعت | |
| مس-۶۴ | ۱۲٫۷ ساعت | |
| گالیم-۶۷ | ۷۸٫۲۸ ساعت | |
| ید-۱۲۳ | ۱۳٫۲۲ ساعت | |
| تالیم-۲۰۱ | ۷۳٫۰۱ ساعت |
در ادامه کاربرد هر رادیو دارو را بررسی میکنیم.
- کربن-۱۱: در تشخیص مشکلات قلبی و برخی سرطانها به کار گرفته میشود.
- نیتروژن-۱۳: از این رادیو دارو در پرتونگاری انتشار پوزیترون برای ردیابی فشار خون و در مطالعات مربوط به قلب استفاده میشود.
- اکسیژن-۱۵: برای برچسب زنی به اکسیژن، کربن دیاکسید و آب در پرتونگاری انتشار پوزیترون برای ردیابی فشار، حجم و اکسیژن مصرفی خون کاربرد دارد.
- فلوئور-۱۸: این رادیو ایزوتوپ پرکاربردترین در روش پرتونگاری انتشار پوزیترون است. از موارد استفاده آن میتوان به برچسبزدن به گلوکز برای تشخیص تومور مغزی از طریق افزایش سوخت و ساز گلوکز اشاره کرد.
- مس-۶۴: برای مطالعه روی بیماريهای ژنتیکی موثر بر سوخت و ساز بدن و در پرتونگاری انتشار پوزیترون کاربرد دارد.
- گالیم-۶۷: در تصویربرداری برای تشخیص تومور و عفونت به کار میرود.
- ید-۱۲۳: برای تصویربردار جهت بررسی عملکرد غده تیروئید و تشخیص عملکرد مختل غده فوق کلیوی کاربرد دارد.
- تالیم-۲۰۱: در تصویربرداری برای تشخیص مکان دقیق عضلات آسیبدیده قلب استفاده میشود.
تصویر برداری هسته ای
تصویربرداری هستهای به روشی از تصویربرداری گفته میشود که از تابش اشعه گاما برای این کار بهره میبرد. در این روش ابتدا به فرد بیمار رادیو دارویی را به یکی از روشهای خوراکی، تزریقی و یا از طریق استنشاق میدهند. سپس با کمک دوربینی که اشعه گاما را نشان میدهد و تصویر ارتقا یافته آن دوربین در کامپیوتر، بیماری توسط پزشک تشخیص داده میشود. توجه داشته باشید که این روش تصویر واضحی از ساختار بدن و اعضای آن به دست نمیدهد بلکه در مواردی که عملکردی باید اندازهگیری شود (مثلا در اندازهگیری فشار خون) کاربرد دارد.
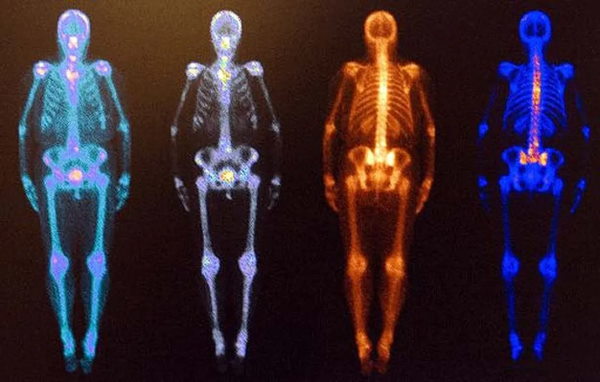
کاربرد تصویربرداری هسته ای
اطلاعات به دست آمده از این روش برای پزشک جهت تشخیص بیماری کمک شایانی میکند. مثلا با کمک این روش میتوان از استخوان تصویربرداری کرد و به گسترش سرطان نوع دوم پی برد. در شرایط مشابه تشخیص این روش از روش تصویربرداری با اشعه ایکس بهتر است. زیرا دقت بسیار بالاتری دارد.
تفاوت تصویربرداری هسته ای با روش های دیگر تصویربرداری
این روش تصویربرداری با دیگر روشها مانند مانند تصویربردای سیتیاکسن (CT scan)، امآرآی (MRI) و اشعه ایکس (X-ray) تفاوت زیادی دارد. مهمترین تفاوت این نکته است که در این روش منبع تابش برخلاف روشهای دیگر در داخل بدن فرد است و تصویربرداری به موقعیت و غلظت رادیو ایزوتوپ اعمال شده بستگی دارد. از این روش هم برای بافتهای نرم و هم برای استخوان میتوان استفاده کرد. عموما نقاطی از بدن که دچار عفونت یا درگیر سرطان باشند این تابش را به میزان بیشتری نشان میدهند.
پرتونگاری صنعتی
استفاده از رادیوایزوتوپها در پرتونگاری بسیار متداول است. در این روش از منبع تابش گاما برای امتحان جوشخوردگی قطعهها و میزان تحمل فشار استفاده میشود. به عنوان مثال این روش برای امتحان استحکام توربین موتور هواپیماها کاربرد دارد.

مورد کاربرد دیگری که رادیو ایزوتوپها در صنایع دارند برای اندازهگیری میزان مایع در مخزن یا قطر مصالح است. مثالی از این مورد را در ادامه بررسی خواهیم کرد. از رادیو ایزوتوپها برای بررسی احتمال وجود گرفتگی و ترشح در لولههای آب و نفت استفاده میشود. روند کار به صورت زیر است.
- مقدار بسیار کمی از یک رادیو ایزوتوپ، مثلا سدیم-۲۴، را درون توپ کوچک بستهای قرار میدهند.
- این توپ حاوی رادیو ایزوتوپ را در جریان مایع رها میکنند.
- توپ در مسیر خود توسط یک آشکارساز رادیو ایزوتوپ کنترل میشود.
- اگر توپ هر جا از مسیر خود توقف کند متوجه میشویم مسیر حرکت آب مسدود شده است.
رادیو ایزوتوپ در تولید الکتریسیته
یکی از کاربردهای رایج از رادیو ایزوتوپها برای تولید الکتریسیته است، به عنوان مثال رادیو ایزوتوپ پلوتونیوم-۲۳۸ در فضاپیماها به کار گرفته میشود. در این روش از گرمای به دست آمده از واپاشی پرتوزا برای تولید الکتریسیته استفاده میشود. برای این منظور از مدارهای اتصال ترموالکتریک بهره میگیرند.
تحقیق های علمی
کاربرد دیگر رادیو ایزوتوپهای در تحقیقات است و این کاربرد بسیار متنوع است. مثلا برای ردیابی جریان آلودگی در سیستمهای بیولوژیکی برای اندازهگیری متابولیسم مورد استفاده قرار میگیرد.
رادیو ایزوتوپ در کشاورزی
از روشهای هستهای در کشاورزی و صنایع غذایی برای پیشگیری از بیماریهای مرتبط در جهات بسیاری استفاده میشود. قرار دادن غذا در معرض تابش انرژی قدمت زیادی دارد. انسانهای همیشه برای جلوگیری از فاسد شدن میوه، گوشت و ماهی آنها را در معرض نور خورشید قرار میدادند و به اصطلاح خشک میکردند تا ماندگاری آنها افزایش پیدا کند. از رادیو ایزوتوپها برای ردیابی میزان باقی مانده سموم و کودها در محصولات کشاورزی استفاده میشود. میوههایی که تحت تابش قرار گرفته باشند حدود ۷ روز دیرتر رسیده میشوند. این مزیت بسیار مهم برای محصولهایی است که فاصله بین مبدا و مقصد طولانی دارند.
همچنین از رادیو ایزوتوپها برای ایجاد تغییرات ژنتیکی در دانههای مواد خوراکی مانند برنج و گندم استفاده میشود. این تغییرات باعث بهبود نژاد، افزایش بازدهی و مقاومت آنها در برابر بیماریها میشود.
جالب است بدانید که سیبزمینیهای تحت تابش قرارگرفته را میتوان در دمای بالاتری (در حدود ۱۵ درجه سانتیگراد) نگهداری کرد که باعث صرفهجویی در مصرف انرژی میشود. همچنین از شیرین شدن سیبزمینی که امری رایج در دمای پایین است جلوگیری میکند.

موارد امنیتی
رادیو ایزوتوپهای از طرف سازمانهای بینالمللی ناظر بر فعالیتهای هستهای برای شناسایی فعالیتهای زیرزمینی و غیرقانونی در تولید سلاحهای هستهای کاربرد دارد.

کاربرد رادیو ایزوتوپ ها در حوزه مشخص
در قسمتهای قبل آموختیم برخی از مهم ترین کاربردهای رادیوایزوتوپ چیست. در ادامه میآموزیم کاربرد رادیو ایزوتوپ در حوزههای خاص چیست.
رادیو ایزوتوپ های طبیعی در صنعت و تحقیقات
گفتیم که برخی رادیو ایزوتوپها در طبیعت وجود دارند. در جدول زیر لیستی از رادیو ایزوتوپهای طبیعی را مشاهده میکنید که در صنعت و تحقیقات علمی از آنها استفاده میشود.
| رادیو ایزوتوپ | نماد رادیو ایزوتوپ | نیمهعمر (سال) |
| هیدروژن-۳ (تریتیوم) | ۱۲٫۳۲ | |
| کربن-۱۴ | ۵۷۰۰ | |
| کلر-۳۶ | ۳۰۱۰۰۰ | |
| سرب-۲۱۰ | ۲۲٫۲ |
به علاوه کاربرد بهخصوص هر کدام را در ادامه میآوریم.
- هیدروژن-۳: از این رادیو ایزوتوپ برای اندازهگیری سن آبهای زیرزمینی بالای ۳۰ سال استفاده میشود.
- کربن-۱۴: برای اندازهگیری سن مواد معدنی بالای ۵۰۰۰۰ سال به کار گرفته میشود.
- کلر-۳۶: این رادیو ایزوتوپ علاوه بر اینکه منبعی برای یون کلرید است، برای اندازهگیری عمر آبهای بالای ۲ میلیون سال کاربرد دارد.
- سرب-۲۱۰: برای تخمین سن شن و ماسه و خاک بالای ۸۰ سال به کار گرفته میشود.
رادیو ایزوتوپ های مصنوعی در صنعت و تحقیقات
تعدادی رادیو ایزوتوپ وجود دارند که برای استفادههای صنعتی به صورت مصنوعی تولید میشوند. در جدول زیر تعدادی از آنها را مشاهده میکنید.
| رادیو ایزوتوپ | نماد رادیو ایزوتوپ | نیمهعمر |
| هیدروژن-۳ (تریتیوم) | ۱۲٫۳۲ سال | |
| کروم-۵۱ | ۲۷٫۷ روز | |
| منگنز-۵۴ | ۳۱۲٫۱۲ روز | |
| کبالت-۶۰ | ۵٫۲۷ سال | |
| روی-۶۵ | ۲۴۳٫۶۶ روز | |
| تکنسیم -۹۹ام | ۶٫۰۱ ساعت | |
| سزیم-۱۳۷ | ۳۰٫۰۸ سال | |
| ایتربیم-۱۶۹ | ۳۲٫۰۳ روز | |
| ایریدیم-۱۹۲ | ۷۸٫۸۳ روز | |
| طلا-۱۹۸ | ۲٫۷ روز | |
| امریسیم-۲۴۱ | ۴۳۲٫۵ سال |
به علاوه کاربرد بهخصوص هر کدام را در ادامه میآوریم.
- هیدروژن-۳: از این رادیو ایزوتوپ به صورت آب تریتیومدار برای مطالعه میزان هدررفت مایعات و فاضلاب استفاده میشود.
- کروم-۵۱: برای پیگیری شن و ماسه و پی بردن به میزان فرسایش سواحل از آن استفاده میشود.
- منگنز-۵۴: از این رادیو ایزوتوپ برای پیشبینی رفتار ترکیبات حاوی فلزاتی سنگینی که از تصفیه پساب به جا میماند، استفاده میکنند. این رادیو ایزوتوپ در راکتور به وجود میآید.
- کبالت-۶۰: این رادیو ایزوتوپ منبعی از تابش گاما برای اندازهگیریها و ضدعفونی کردن تجهیزات پزشکی است. همچنین جایگزینی برای آفتکشهای سمی برای از بین بردن تخم حشرات در کشاورزی است. این رادیو ایزوتوپ در راکتور تولید میشود.
- روی-۶۵: از این رادیو ایزوتوپ برای پیشبینی رفتار ترکیبات حاوی فلزاتی سنگینی که از تصفیه پساب به جا میماند، استفاده میکنند. این رادیو ایزوتوپ در شتابدهنده حلقوی به وجود میآید.
- تکنسیم-۹۹ام: برای مطالعه حرکات پساب مورد استفاده قرار میگیرد. این رادیو ایزوتوپ از واپاشی پرتوزا مولیبدن-۹۹ در ژنراتور تولید میشود. خود مولیبدن-۹۹ نیز در راکتور به وجود میآید.
- سزیم-۱۳۷: از این رادیو ایزوتوپ به عنوان ردیاب پرتویی برای تشخیص منبع فرسودگی خاک و همچنین اندازهگیری قطر قطعات استفاده میشود. این رادیو ایزوتوپ در راکتور به وجود میآید.
- ایتربیم-۱۶۹: این رادیو ایزوتوپ منبع تابش اشعه گاما در رادیوگرافی است.
- ایریدیم-۱۹۲: این رادیو ایزوتوپ که در راکتور تولید میشود به عنوان منبع تابش اشعه گاما در رادیوگرافی و همچنین برای مطالعه فرسایش سواحل کاربرد دارد.
- طلا-۱۹۸: برای پیگیری حرکات شن و ماسه در کف رودخانه و اقیانوس و همچنین مطالعه فرسایش سواحل کاربرد دارد. همچین از آن برای پیگیری آلایندههای صنعتی که باعث آلودگی اقیانوسها میشوند استفاده میشود. این رادیو ایزوتوپ در راکتور به وجود میآید.
- امریسیم-۲۴۱: این رادیو ایزوتوپ در راکتور تولید میشود و برای اندازهگیری نوترون استفاده میشود. همچنین به عنوان ردیاب دود کاربرد دارد.
تاثیر رادیو ایزوتوپ بر بدن انسان
با در نظر گرفتن وجود منابع رادیواکتیو طبیعی و مصنوعی نگرانی در مورد تاثیرهای آنها بر بدن انسان موجه است زیرا این تابشهای در برخورد با اندامهای بدن، سلولها و مولکولها باعث تغییر آنها میشوند. با تغییر ساختار مولکول عملکرد آن نیز مختل میشود یا تغییر میکند. در واقع آن عملکردی که موظف به انجام آن هستند ناقص میماند. برای نمونه تاثر مواد رادیواکتیو بر دیانایها (DNA) به این صورت است که ذخیره و انتقال اطلاعات به مشکل بر میخورد.
همچنین اگر انسان در معرض تابش زیادی قرار بگیرد احتمال مرگ او وجود دارد. در بیشتر مواقع تابش رادیواکتیو باعث تخریب دیواره سلول میشود یا تولید مجدد آن را مختل میکند. میزان تاثیر تابش رادیو ایزوتوپها را بر بدن با دو فاکتور قدرت یونیزاسیون و قدرت نفوذ میسنجند که پیشتر آنها را بررسی کردیم.

تاثیر تابش بر مواد
در این قسمت میخواهیم تغییری که در مواد تحت تابش ایجاد میشود را بررسی کنیم.
- تابش باعث چگال شدن روغن میشود و به آن حالتی صمغ مانند میدهد.
- پلاستیک بسته به نوع خود سفتتر یا نرمتر میشود.
- بتن تحت تابش قرار گرفته افزایش دما خواهد داشت.
- تاثیر تابش بر روی فلزها متغیر است و بستگی به نوع و میزان تابش دارد.
- پلیمرهای تحت تابش تغییرات بسیار زیادی را تجربه میکنند که باعث تغییر در ویژگیهای شیمیایی، الکتریکی و مکانیکی آنها میشود.
رادیو ایزوتوپ در تاریخ
اولین فردی که رو ی رادیو ایزوتوپها و بحث تابش کار کرد دانشمندی به نام ویلهلم کُنراد رونتگِن آلمانی بود که در سال ۱۹۰۱ برنده اولین جایزه نوبل فیزیک شد. او کاشف پرتو ایکس بود و نام آن را به دلیل ناشناخته بودنش ایکس گذاشت.

متاسفانه در طول تاریخ از ردیو ایزوتوپها برای تولید بمب شیمیایی استفاده شده است. این اتفاق اولین بار آگوست سال ۱۹۴۵ در ژاپن اتفاق افتاد. آمریکا در جنگ جهانی دوم اولین قدرتی بود که از این انرژی استفاده کرد. بعد از پایان جنگ نگرانیهای بسیاری در مورد استفاده از تجهیزات ایجاد شده وجود داشت که برخی در سالهای بعد در تولید و پیشرفت بهکارگیری رادیو ایزوتوپها در پزشکی و صنایع قدم برداشتند.

سوالات متدوال
در این قسمت به تعدادی سوال پرتکرار در مورد رادیو ایزوتوپها پاسخ میدهیم.
چند رادیو ایزوتوپ وجود دارد ؟
در حالیکه تنها ۲۵۴ ایزوتوپ پایدار وجود دارد، تعداد رادیو ایزوتوپهای شناختهشده به بیش از ۳۰۰۰ میرسد. از این تعدا تنها ۸۴ رادیو ایزوتوپ به صورت طبیعی وجود دارند.
ماندگاری رادیو ایزوتوپ های پزشکی در بدن چقدر است ؟
ماندگاری رادیو داروها در بدن بستگی به نوع رادیو ایزوتوپ استفاده شده دارد اما بیشتر آنها تا ۱ روز در بدن باقی میمانند. تعدادی بعد از ۳ روز و تعداد اندکی هفتهها ماندگاری خواهند داشت.
جمعبندی
رادیو ایزوتوپ به ایزوتوپهایی از عنصرها گفته میشود که ناپایدار هستند و طبق نیمهعمری که دارند دچار واپاشی پرتوزا شده و تابشی را از خود ساطع میکنند. از این مواد در پزشکی استفادههای بسیاری میشود، به عنوان مثال برای تصویربرداریهای تشخیصی کاربرد وسیعی دارند. همچنین در صنایع دیگر از جمله کشاورزی کاربرد دارند.












