توزیع الکترون ها در لایه ها و زیرلایه ها – از صفر تا صد
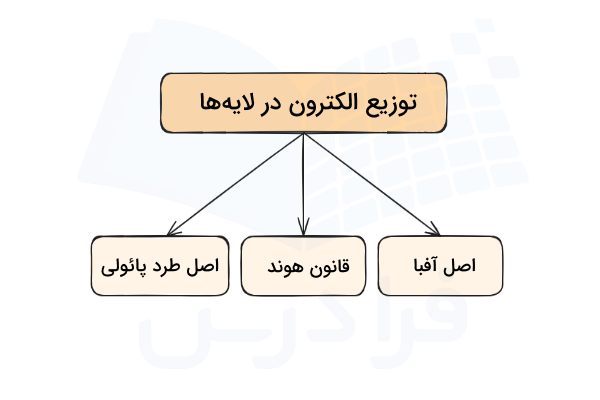
هر عنصر تعدادی الکترون، پروتون و نوترون دارد. نوترون و پروتون هر عنصر در هسته آن قرار دارد و الکترونهای آن در لایههای الکترونی و زیرلایهها و اوربیتالها قرار دارند. هر لایه و زیرلایه الکترونی سطح انرژی مشخصی دارد. الکترونها با ترتیب خاصی این لایهها و زیرلایهها را پر میکنند تا کمترین انرژی ممکن را داشته باشند و پایدار باشند. الکترون ها در لایه ها اصولی مانند قانون آفبا، قانون هوند و اصل طرد پائولی را رعایت میکنند. در این مطلب از مجله فرادرس میآموزیم توزیع الکترون ها در لایه ها و زیرلایه ها چگونه است.
- با توزیع الکترونها در لایهها و زیرلایهها آشنا میشوید.
- مفهوم لایه، زیرلایه و اوربیتال الکترونی را یاد میگیرید.
- نقش قوانین آفبا، هوند و طرد پائولی را در تعیین آرایش الکترونی میآموزید.
- با ۴ عدد کوانتومی هر الکترون و روش تعیین آنها آشنا میشوید.
- میتوانید موقعیت عناصر در جدول را با توجه به توزیع الکترونی مشخص کنید.
- با آرایش الکترونی یونها و رفتار اتمها بر اساس توزیع الکترونی آشنا میشوید.


در ابتدای این مطلب میآموزیم توزیع الکترون ها در لایه ها و زیرلایهها چگونه است. سپس لایهها، زیرلایهها و اوربیتالهای الکترونی را بررسی میکنیم. پس از آن به بررسی قوانین آفبا، هوند و اصل طرد پائولی پرداخته و اعداد کوانتومی و آرایش الکترونی را میشناسیم. در ادامه میآموزیم ظرفیت عناصر را تعیین کنیم، موقعیت آنها را بیابیم و آرایش الکترونی یونهای آنها را رسم کنیم.با مطالعه این مطلب میتوانید به شکلی کامل بیاموزید توزیع الکترون در لایهها چیست.
توزیع الکترونها در لایه ها و زیرلایه ها
توزیع الکترون ها در لایه ها و زیرلایههای الکترونی از اصل آفبا پیروی میکند. هر اتم از تعدادی لایه، زیر لایه و اوربیتال الکترونی تشکیل شده است که الکترونها به ترتیب از نزدیکترین لایه الکترونی به هسته در آنها قرار میگیرند. این الکترونها در سطوح انرژی مشخصی به نام زیرلایه و در اوربیتالهایی درون زیرلایهها قرار دارند. به دلیل انرژی جاذبه هسته مثبت اتم، هرچه الکترونها به هسته نزدیکتر باشند انرژی کمتری دارند و پایدارترند و هرچه از آن دورتر باشند انرژی بیشتری دارند.
این مطلب به این معنی است که دورترین الکترونها از هسته اتم، ناپایدارترین هستند و اصطلاحا به این الکترونها الکترون ظرفیت گفته میشود که مشخص کننده رفتار اتمها در تشکیل پیوند و واکنشهای شیمیایی هستند. درک توزیع الکترون در لایهها و زیرلایههای الکترونی، کلید درک رفتار اتمها در ترکیبات و واکنشهای شیمیایی است.

بدین ترتیب، توزیع الکترون ها در لایه ها ابتدا به ترتیب از کمانرژیترین لایه، نزدیکترین به اتم، و سپس کم انرژیترین زیرلایه، و پس از آن اوربیتالها و با پیروی از قانونهای هوند، آفبا و اصل طرد پائولی است. در ادامه، مفهوم و توزیع الکترون در لایهها و زیر لایهها و اوربیتالهای الکترونی را توضیح میدهیم.
لایههای الکترونی
لایههای الکترونی در واقع سطوح مشخص کوانتیده انرژی هستند که الکترونها میتوانند در آنها وجود داشته باشند. این لایهها با حرف انگلیسی (n) نمایش داده میشوند. هر لایه الکترونی، تعداد مشخص و محدودی الکترون را در خود جای میدهد. طبق مدل اتمی بور، لایههای الکترونی همان مدارهایی هستند که در اطراف اتم رسم میشوند.
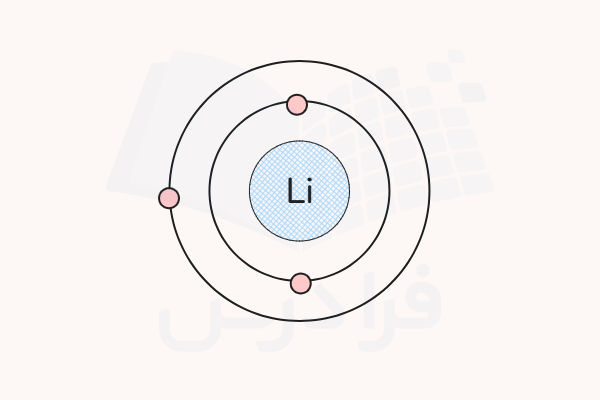
الکترونهای موجود در لایه اول الکترونی، نزدیکترین الکترونها به هسته هستند و کمترین انرژی را دارند. الکترونهایی که در آخرین لایه الکترونی توزیع شدهاند، دورترین الکترونها از هسته هستند و بیشترین انرژی و ناپایداری را دارند. توزیع الکترون در لایهها به تعداد الکترونهای هر اتم بستگی دارد. برای مثال، توزیع الکترون در لایهها برای لیتیوم با ۳ الکترون به شکل زیر است. ۲ الکترون در لایه اول و ۱ الکترون در لایه دوم قرار میگیرد.
تعداد الکترون ها در لایههای الکترونی
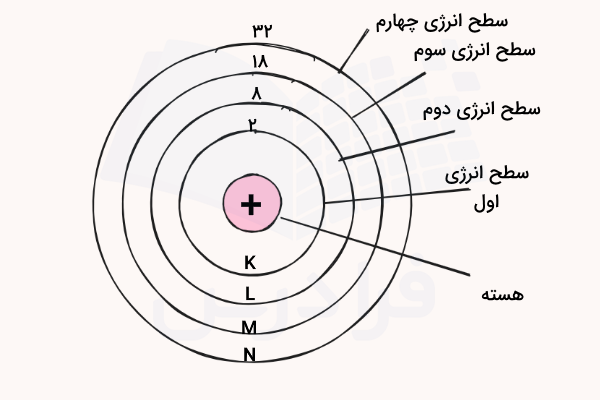
هر لایه الکترونی میتواند تعداد الکترون را در خود جای دهد که n برابر با شماره لایه الکترونی است. برای مثال، لایه اول الکترونی به اندازه ۲ الکترون و لایه دوم الکترونی به اندازه ۸ الکترون، ظرفیت دارند. هر لایه الکترونی با نام عدد کوانتومی اصلی مشخص میشود که نمایانگر لایه هر الکترون در اتم است. عدد کوانتومی اصلی یکی از پارامترهای مهم در تعیین آرایش الکترونی عناصر است.
نام لایههای الکترونی
لایههای الکترونی بسته به نزدیکی آنها به هسته با حروف انگلیسی مشخص میشوند. برای مثال، لایه اول الکترونی (نزدیکترین به هسته) با حرف انگلیسی K و لایه دوم با حرف N نمایش داده میشود. در جدول زیر، نام لایههای الکترونی و تعداد الکترونهای موجود در آنها مشخص شده است.
| نام لایه الکترونی | تعداد الکترون ها |
| لایه اول: K | ۲ |
| لایه دوم: L | ۸ |
| لایه سوم: M | ۱۸ |
| لایه چهارم: N | ۳۲ |
| لایه پنجم: O | ۵۰ |
| لایه ششم: P | ۷۲ |
| لایه هفتم: Q | ۹۸ |
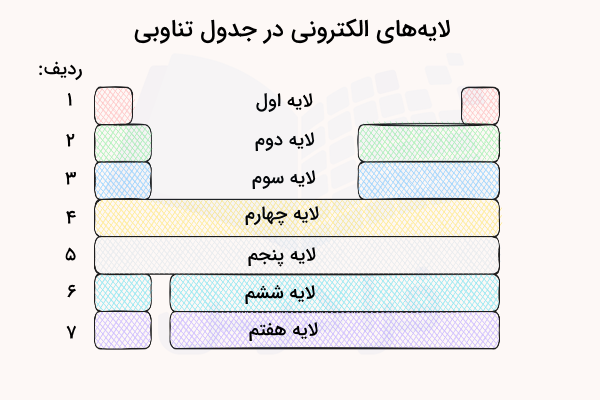
لایههای الکترونی در جدول تناوبی
در جدول تناوبی عناصر، اتمها به ترتیب افزایش عدد اتمی (تعداد الکترون و پروتون) قرار گرفتهاند. هر ردیف جدول تناوبی عناصر نشاندهنده یک لایه الکترونی است. بدین ترتیب، ۷ ردیف جدول تناوبی، نمایانگر ۷ لایه الکترونی در اتم هستند. اتمهایی با تعداد بیشتری لایه الکترونی تا کنون کشف نشدهاند و اتمهای ردیفهای پایینی جدول تناوبی به خودی خود ناپایدار هستند.
تصویر زیر نمایانگر لایههای الکترونی در جدول تناوبی و توزیع الکترون ها در این لایه ها است.
یادگیری شیمی دهم با فرادرس
برای درک بهتر شیوه توزیع الکترونها در لایهها نیاز است ابتدا با مفاهیمی چون یکای جرم اتمی، جرم اتمی میانگین، ساختار اتم، حالت پایه اتم و آرایش آفبا آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مفاهیم به مجموعه فیلم آموزش دروس پایه دهم بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه توزیع الکترون ها در لایه ها و زیرلایه ها دسترسی داشته باشید.
- فیلم آموزش شیمی ۲ پایه یازدهم فرادرس
- فیلم آموزش شیمی ۲ پایه یازدهم حل سوالات تشریحی امتحانات نهایی فرادرس
- فیلم آموزش شیمی ۳ پایه دوازدهم فرادرس
زیرلایههای الکترونی
هر لایه الکترونی به زیر مجموعههایی به نام زیر لایه تقسیم شده است. لایههای الکترونی تعداد مشخصی زیرلایه دارند که هر یک حاوی تعداد مشخصی اوربیتال با شکلهای مشخص هستند. این لایهها هرکدام میتوانند n زیر لایه داشته باشد. برای مثال، لایه اول تنها یک زیرلایه 1s را دارد. لایه دوم دو زیر لایه 2s و 2p را دارد. هر یک از این زیرلایهها بسته به تعداد الکترون اتم و اوربیتالهای خود، تعداد الکترونهای مشخصی از لایه را در خود جای میدهند.
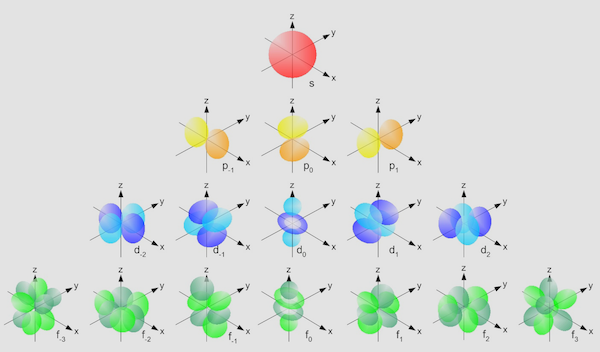
زیر لایههای الکترونی میتوانند از نوع s (کروی)، p (دمبلی)، d و f (شکل پیچیده) باشند. در ادامه نحوه توزیع الکترون در زیرلایههای الکترونی را توضیح میدهیم.
توزیع الکترون در زیر لایه ها
هر زیر لایه الکترونی با یک حرف انگلیسی و یک عدد نمایش داده میشود. حروف مشخص شده نمایانگر شکل فضایی زیر لایه و عدد مشخص شده نمایانگر لایه الکترونی و بزرگی اوربیتال هستند. به عبارتی، برای هر الکترون مجموعه اعداد کوانتومی اصلی و فرعی نمایانگر شکل، لایه و بزرگی اوربیتال زیرلایه است که در آن قرار دارند. برای درک بهتر این موضوع به جدول زیر دقت کنید. در این جدول، نام زیر لایهها و تعداد الکترونی که در خود جای میدهند را مشخص کرده است.
به هر زیرلایه الکترونی یک پارامتر به نام عدد کوانتومی فرعی تعلق میگیرد که با حرف انگلیسی (l) نمایش داده میشود. هر زیرلایه الکترونی، (2l+1)2 الکترون را در خود جای میدهد. برای مثال، زیر لایه p با l=۱، شش الکترون را در خود جای میدهد.
| نام زیر لایه | تعداد الکترون |
| s (l=0) | ۲ |
| p (l=1) | ۶ |
| d (l=2) | ۱۰ |
| f (l=3) | ۱۴ |
زیرلایه هایی با تعداد بیشتری الکترون (مانند 5g با ۱۸ الکترون) در حالت پایه اتم خنثی هیچ عنصری دیده نشدهاند.
اوربیتالهای الکترونی
هر زیرلایه الکترونی از اوربیتالهای اتمی تشکیل شده است. اوربیتالهای اتمی بر اساس نوع و مقدار انرژی آنها مشخص میشوند و هرزیرلایه الکترونی تعداد مشخصی اوربیتال دارد و میتواند تعداد مشخصی الکترون را در خود جای دهد. هر زیرلایه تعدادی (l+ تا -l) اوربیتال را در خود جای میدهد و هر اوربیتال تا ۲ الکترون با اسپین مخالف را میپذیرد. برای درک بهتر این مفاهیم به جدول زیر دقت کنید.
| زیرلایه و عدد کوانتومی فرعی | تعداد اوبیتال و تعداد الکترون |
| s (l=0) | ۱ اوربیتال و ۲ الکترون |
| p (l=1) | ۳ اوربیتال و ۶ الکترون |
| d (l=2) | ۵ اوربیتال و ۱۰ الکترون |
| f (l=3) | ۷ اوربیتال و ۱۴ الکترون |
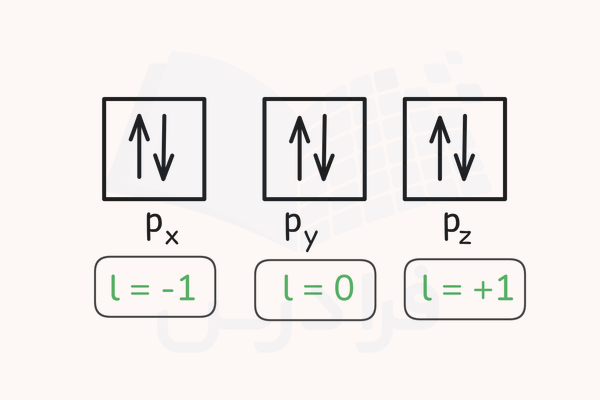
برای مثال، اوربیتال p که مقدار عدد کوانتومی فرعی برای آن برابر با l=1 است، ۳ اوربیتال با مقادیر l- تا l+ را دارد. این سه اوربیتال میتوانند ۶ الکترون را در خود جای دهند. طبق اصل طرد پائولی، الکترونهای قرار گرفته در این اوربیتالها باید با اسپین (جهت مخالف) قرار بگیرند تا پایدار باشند. توزیع الکترونها در زیرلایه p به شکل زیر خواهد بود.
قوانین آفبا، هوند و اصل طرد پائولی
در قسمتهای قبل آموختیم که هر عنصر الکترون هایی دارد که در لایهها و زیرلایههای الکترونی توزیع شدهاند و انرژی این لایهها و اوربیتالها متفاوت است. آرایش الکترونی اتم روشی برای توصیف محل قرارگیری و سطح انرژی الکترونهای هر اتم است. توزیع الکترون در لایهها و زیرلایههای الکترونی از اصول آفبا، هوند و اصل طرد پائولی پیروی میکند.
مجموعه این قوانین، منجر به پایداری الکترونها در توزیع الکترونی اتم میشود. مجموعه این قوانین به صورت زیر خلاصه میشود.
- الکترونها ابتدا کم انرژیترین سطوح انرژی الکترونی را پر میکنند.
- ترتیب پر شدن الکترونها به شکل زیر است.
- هیچ دو الکترونی در یک اتم نمیتوانند مقادیر کاملا مشابه اعداد کوانتومی را اختیار کنند و حداقل مقدار عدد کوانتومی اسپین الکترون آنها متفاوت خواهد بود.
- الکترونها پیش از جفت شدن در اوربیتالهای الکترونی، ابتدا به صورت تکی و با اسپین مثبت اوربیتالها را پر میکنند.
در ادامه هر یک از این قوانین را به شکل کامل بررسی میکنید.
اصل آفبا
بر اساس اصل آفبا، الکترونها ابتدا سطوح انرژی پایینتر را پر میکنند. بر اساس این اصل، ترتیب سطول انرژی لایهها و یزرلایهها باه شکل زیر است.
این ترتیب پر شدن زیر لایهها در واقع نمایش دهنده افزایش سطح انرژی آنها است. بنابراین الکترونها به شکلی در اوبیتالها جای میگیرند که انرژی سیستم حداقل باشد. برای مثال، اوربیتالهای 3s و 3p تا زمانی که اوربیتالهای قبلی 1s، 2s و 2p پر نشده باشند، الکترون نمیپذیرند. برای مثال، آرایش الکترونی عناصر سدیم، منیزیم، فلوئور و مس به شکل زیر است.
سدیم:
منیزیم:
فلوئور:
مس:
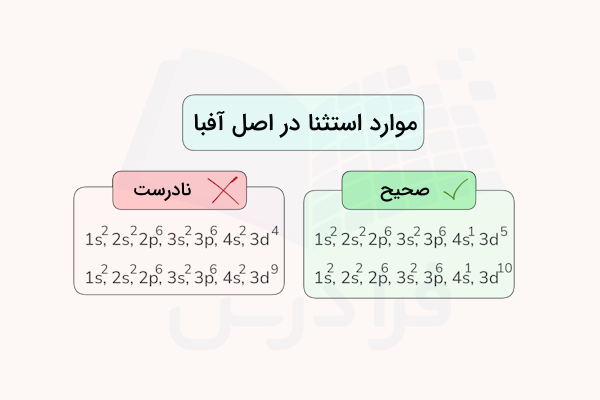
موارد استثنا
در مورد دستهای از اتمها با اوربیتالهای d نزدیک به پر و نیمهپر، قانون آفبا رعایت نمیشود. در این موارد، به دلیل پایداری بیشتر اتم، الکترونها ابتدا به آرایشی پر یا نیمه پر در اوربیتال d میرسند و سپس اوربیتال s را پر میکنند. برای اطمینان از درستی این موارد باید به خاطر داشته باشیم که آرایش الکترونی و وجود ندارد و در این موارد، یک الکترون اوربیتال s در اوربیتال d جای میگیرد تا آرایش پایدارتری داشته باشند. برای مثال، به موارد زیر دقت کنید.
قانون n+l
بعد از اوربیتال 3p، ترتیب آرایش الکترونی کمی پیچیدهتر میشود. اوربیتال s سطح انرژی بالاتر، انرژی کمتری نسبت به اوربیتالهای d سطح انرژی قبلی دارد. برای مثال، اوربیتال 4s قبل از 3d پر میشود. برای درک بهتر این سطح انرژیها باید از قاعده n+l استفاده کنیم. در این قانون، هر اوربیتالی که جمع n+l برای آن کمتر باشد زودتر پر میشود.
برای مثال، برای اوربیتال 4s، مقدار n برابر ۴ و مقدار l برابر ۰ است. در اوربیتال 3d مقدار n برابر ۳ و مقدار l برابر ۲ است. بنابراین جمع مقدایر n و l برای اوربیتال 4s کمتر از 3d است. پس اوربیتال 4s زودتر پر میشود. اگر مقدار n+l برای دو اوربیتال برابر باشد، اوربیتالی که مقدار n کمتری دارد اول پر میشود. پیشنهاد می کنمی برای درک بهتر نحوه پر شدن لایهها و زیرلایههای الکترونی و نوشتن آرایش الکترونی عناصر، فیلم آموزش آرایش الکترونی عناصر فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
اصل طرد پائولی
طبق اصل طرد پائولی، هیچ دو الکترونی در یک اتم مشخص، نمیتوانند اعداد کوانتومی کاملا برابری داشته باشند. به بیان دیگر، حداقل یکی از اعداد کوانتومی برای دو الکترون یک اتم در یک زیرلایه و یک اوربیتال با انرژی برابر، باید متفاوت باشد. این عدد کوانتومی، عدد کوانتوومی اسپین الکترون است. اسپین یک کمیت کوانتومی است که به الکترونها نسبت داده میشود.
در رسم اوربیتالها و آرایش الکترونی اتمها، اسپین آنها با جهت (فلش) رو به بالا یا پایین نمایش داده میشود. الکترونهایی با عدد کوانتومی اسپین (ms) برابر با فلش رو به بالا و الکترونهایی با عدد کوانتومی اسپین (ms) برابر با فلش رو به پایین نمایش داده میشوند.
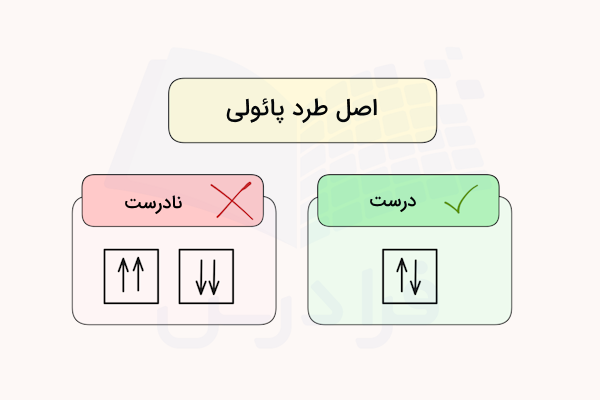
طبق اصل طرد پائولی، در هر اوربیتال، الکترونهای دوتایی باید با اسپین (جهت) مخالف هم قرار بگیرند. این قانون در تصویر بالا نمایش داده شده است.
قانون هوند
قانون هوند بیان میکند که الکترونها ابتدا به صورت تکی اوربیتالهای یک زیرلایه را پر میکنند و پس از پر شدن هر اوربیتال با یک الکترون، باقی الکترونها به صورت جفت غیر همجهت، در کنار هم قرار میگیرند. به بیان دیگر، اوربیتالها، باید تعداد بیشینه الکترونهای هم اسپین را داشته باشند. برای مثال، به تصویر زیر دقت کنید.
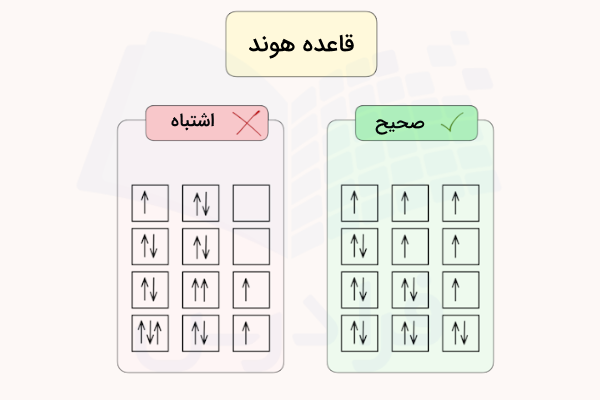
در اوربیتال p ۶ الکترون جای میگیرند. الکترون اول تا سوم به صورت هم اسپین و تکی اوربیتالها را اشغال میکنند و الکترون چهارم تا ششم با اسپین مخالف (طبق اصل طرد پائولی) در کنار آنها جفت میشوند. بنابراین، توزیع الکترون ها در لایه ها و زیرلایهها باید از قانون هوند پیروی کند تا اتم آرایش الکترونی پایداری را داشته باشد.
اعداد کوانتومی
در قسمتهای قبل آموختیم نحوه توزیع الکترون در لایهها و زیرلایهها چگونه است. هر لایه الکترونی با عدد کوانتومی اصلی n تعیین شده و مقدار عدد کوانتومی فرعی، زیرلایه و شکل فضایی آن را تعیین میکند. در ادامه، مجموعه ۴ عدد کوانتومی که موقعیت یک الکترون و نحوه توزیع آن در لایهها را تعیین میکند را بررسی میکنیم.
- عدد کوانتومی اصلی n: اعداد صحیح بین ۱ تا ۷ را میپذیرد و شماره لایه الکترون (سطح انرژی) را مشخص میکند.
- عدد کوانتومی فرعی l: عدد کوانتومی فرعی تکانه زاویهای، زیرلایه الکترون (s, p, d, f) و شکل آن را مشخص میکند و میتواند اعداد صحیح n-1 را داشته باشد.
- عدد کوانتومی مغناطیسی ml: این عدد کوانتومی، اوربیتالهای هر زیرلایه را مشخص میکند. عدد کوانتومی مغناطیسی مقادیر صحیح l- تا l+ را دارد و این مقادیر، تعداد زیرلایهها را تعیین میکنند.
- عدد کوانتومی اسپین الکترون ms: این عدد کوانتومی اسپین الکترون را تعیین کرده و میتواند مقادیر (اسپین بالا) و (اسپین پایین) را داشته باشد.
بدین ترتیب میتوان از روی آرایش الکترونی عناصر، مقادیر این اعداد کوانتومی را برای هر الکترون تعیین کرد.
تعیین اعداد کوانتومی
در قسمت قبل آموختیم هر الکترون و توزیع الکترون ها در لایه ها با ۴ عدد کوانتومی تعیین میشود. بنابراین باید بتوان از روی آرایش الکترونی عناصر، این اعداد کوانتومی را برای الکترونهای آنها تعیین کرد. برای مثال میخواهیم اعداد کوانتومی مربوط به آخرین الکترون موجود در اتم سدیم را تعیین کنیم. برای این کار ابتدا آرایش الکترون عنصر و توزیع الکترون ها در لایه ها را برای آن رسم میکنیم.
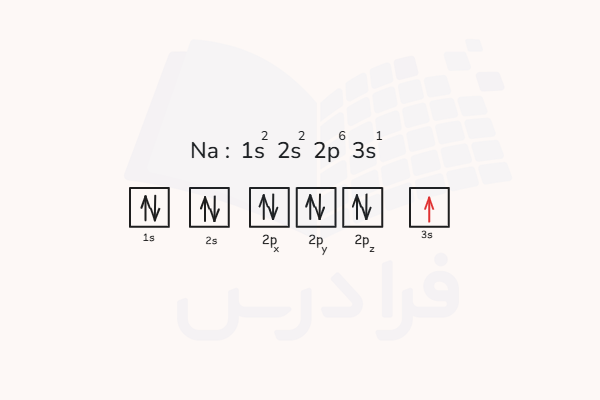
همانطور که در تصویر مشخص شده است، آخرین الکترون این اتم، در لایه سوم و در زیرلایه s قرار دارد. بنابراین، عدد کوانتومی اصلی این الکترون n=۲ است و عدد کوانتومی فرعی آن l=۰ مربوط به زیرلایه s است. عدد کوانتومی مغناطیسی زیرلایه s تنها مقدار ۰ را میپذیرد. (l- تا l+) و با توجه به اسپین بالای این تک الکترون، عدد کوانتومی اسپین الکترون آن برابر با است.
برای درک بهتر این فرآیند، به مثال زیر دقت کنید.
مثال تعیین اعداد کوانتومی
اعداد کوانتومی آخرین الکترون اتم کبالت را بیابید.
پاسخ
ابتدا آرایش الکترونی و ساختار اوربیتالهای اتم را رسم میکنیم. عدد اتمی کبالت ۲۷ است.
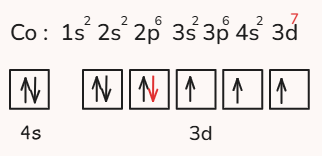
آخرین الکترون این اتم الکترون است که در لایه سوم الکترونی و در زیرلایه d و در اوربیتال دوم با اسپین پایین قرار میگیرد. پس اعداد کوانتومی برای این الکترون به شرح زیر هستند.
- عدد کوانتومی اصلی n: لایه سوم پس n=۳
- عدد کوانتومی فرعی l: زیرلایه d پس l=۲
- عدد کوانتومی مغناطیسی ml: اوربیتال دوم پس ml = -۱
- عدد کوانتومی اسپین الکترون ms: اسپین پایین پس ms=
رسم آرایش الکترونی و اوربیتال اتم ها
در قسمتهای قبل آموختیم توزیع الکترون ها در لایه ها و زیرلایهها چگونه است. همچنین، اهمیت قوانین آفبا، هوند و اصل طرد پائولی را در تعیین ساختار الکترونی اتمها آموختیم. حال میتوانیم با مجموعه این مفاهیم و قوانین، آرایش الکترونی و اوربیتالهای الکترونی را برای اتمها رسم کنیم.
برای مثال، به توزیع الکترون ها در لایه ها و زیرلایههای اتم اکسیژن با عدد اتمی ۸ (۸ الکترون) دقت کنید. برای رسم آرایش الکترونی این اتم، ابتدا طبق ترتیب قانون آفبا، آرایش الکترونی را مینویسیم. ۸ الکترون این اتم به ترتیب در اوربیتالهای 1s، 2s، 2p جای میگیرند. آرایش الکترونی اکسیژن مطابق زیر است.
سپس شکل اوربیتالهای این اتم را رسم کرده و الکترونها را طبق قوانین هوند و طرد پائولی در آن جای میدهیم.
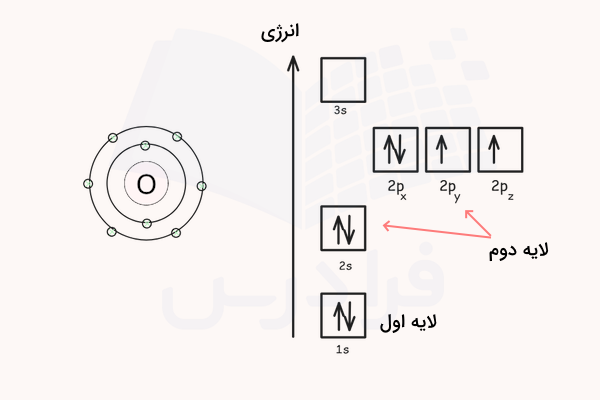
بنابراین، ۲ الکترون در لایه اول و زیرلایه s و اوربیتال 1s این اتم وجود دارد. ۶ الکترون دیگر در لایه دوم الکترونی، زیرلایههای s و p و اوربیتالهای 2s و 2p توزیع شدهاند. قوانین هوند و اصل طرد پائولی برای تمامی اوربیتالهای این اتم رعایت شدهاند. برای درک بهتر نحوه بکارگیری این مفاهیم و قوانین، به مثالهای زیر دقت کنید.
مثال ۱
آرایش الکترونی و اوربیتالهای عنصری با عدد اتمی ۱۵ را رسم کنید.
پاسخ
طبق جدول تناوبی عناصر، عدد اتمی ۱۵ مربوط به عنصر فسفر است که ۱۵ الکترون در ساختار خود دارد. ابتدا آرایش الکترونی آن را طبق آرایش آفبا مینویسیم.
سپس طبق این آرایش الکترونی، اوربیتالهای آن را مطابق قبل رسم میکنیم. باید دقت داشته باشیم که در هنگام رسم اوربیتالها، ترتیب انرژی زیرلایهها و قوانین هوند و طرد پائولی رعایت شوند.
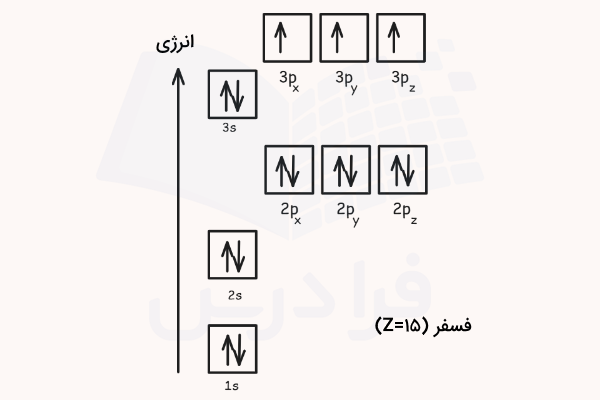
۲ الکترون این اتم در لایه اول و اوربیتال 1s قرار دارند. ۸ الکترون این اتم در لایه دوم الکترونی و اوربیتالهای 2s و 2p قرار دارند. ۵ الکترون باقی مانده نیز در اوربیتالهای 3s و 3p توزیع شده اند.
مثال ۲
آرایش الکترونی و اوربیتالهای عنصری با عدد اتمی ۲۰ را رسم کنید.
پاسخ
طبق جدول تناوبی عناصر، عدد اتمی ۲۰ مربوط به عنصر کلسیم است که ۲۰ الکترون در ساختار خود دارد. ابتدا آرایش الکترونی آن را طبق آرایش آفبا مینویسیم.
سپس طبق این آرایش الکترونی، اوربیتالهای آن را مطابق قبل رسم میکنیم. باید دقت داشته باشیم که در هنگام رسم اوربیتالها، ترتیب انرژی زیرلایهها و قوانین هوند و طرد پائولی رعایت شوند.
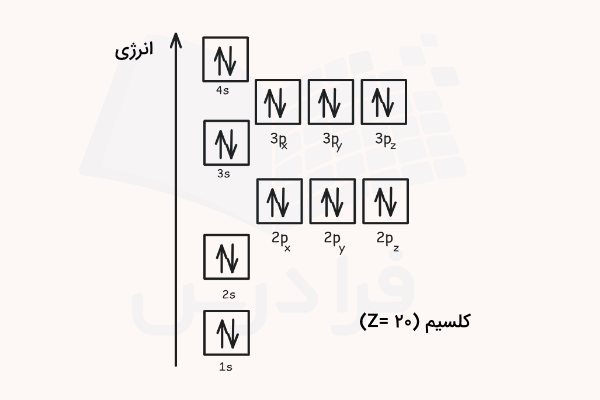
۲ الکترون این اتم در لایه اول و اوربیتال 1s قرار دارند. ۸ الکترون این اتم در لایه دوم الکترونی و اوربیتالهای 2s و 2p قرار دارند. ۸ الکترون در لایه سوم الکترونی و اوربیتالهای 3s و 3p قرار دارند. ۲ الکترون باقیمانده در اوربیتال 4s توزیع شده است. دقت داشته باشید که طبق اصل آفبا، اوربیتال 4s انرژی پایینتری نسبت به اوربیتال 3d دارد و زودتر پر میشود.
مثال ۳
آرایش الکترونی و اوربیتالهای عنصری با عدد اتمی ۳۴ را رسم کنید.
پاسخ
طبق جدول تناوبی عناصر، عدد اتمی ۳۴ مربوط به عنصر سلنیم است که ۳۴ الکترون در ساختار خود دارد. ابتدا آرایش الکترونی آن را طبق آرایش آفبا مینویسیم.
دقت داشته باشید که طبق اصل آفبا، اوربیتال 4s قبل از اوربیتال 3d پر میشود. سپس طبق این آرایش الکترونی، اوربیتالهای آن را مطابق قبل رسم میکنیم.
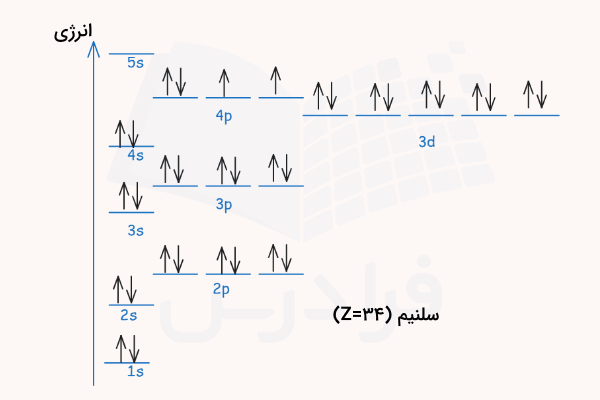
۲ الکترون این اتم در لایه اول و اوربیتال 1s قرار دارند. ۸ الکترون این اتم در لایه دوم الکترونی و اوربیتالهای 2s و 2p قرار دارند. ۱۸ الکترون در لایه سوم الکترونی و اوربیتالهای 3s و 3p و 3d قرار دارند. ۶ الکترون در لایه چهارم الکترونی و اوربیتالهای 4s و 4p توزیع شده است.
آرایش الکترونی فشرده
یکی از روشهای نمایش آرایش الکترونهای عناصر، استفاده از آرایش الکترونی فشرده با استفاده از نماد گاز نجیب دوره قبل آنها است. در این روش، قسمتی از آرایش الکترون عنصر که مشابه با آرایش الکترونی گاز نجیب دوره قبل از آن عنصر است، در یک براکت ( [ ] ) نوشته شده و پس از آن، ادامه آرایش الکترونی نوشته میشود.
این روش برای اجتناب از نوشتن کل آرایش الکترونی اتمهایی با تعداد الکترون بالا استفاده میشود. برای مثال، به موارد زیر دقت کنید.
آرایش الکترونی اتم کربن و هلیم:
آرایش الکترونی فشرده اتم کربن:
آرایش الکترونی اتم کلسیم و آرگون:
آرایش الکترونی فشرده اتم کلسیم:
آرایش الکترونی اتم آهن و آرگون:
آرایش الکترونی فشرده اتم آهن:
بدین صورت، آرایش الکترونی عناصر خلاصه میشود.
تعیین ظرفیت عناصر بر اساس توزیع الکترون ها
آخرین الکترونهای موجود در دورترین لایه (لایههای) الکترونی از هسته، وظایفی مانند تشکیل یون، تشکیل پیوند و تعیین واکنش پذیری عناصر را دارند. به این الکترونها الکترون ظرفیت و به آخرین لایه الکترونی عناصر، لایه ظرفیت گفته میشود. در رسم آرایش الکترونی میتوان تعداد الکترونهای ظرفیت لایه آخر عناصر را به دست آورد. برای مثال در تصویر زیر ظرفیت گروههای مختلف جدول تناوبی بر اساس آرایش الکترونی آنها مشخص شده است.
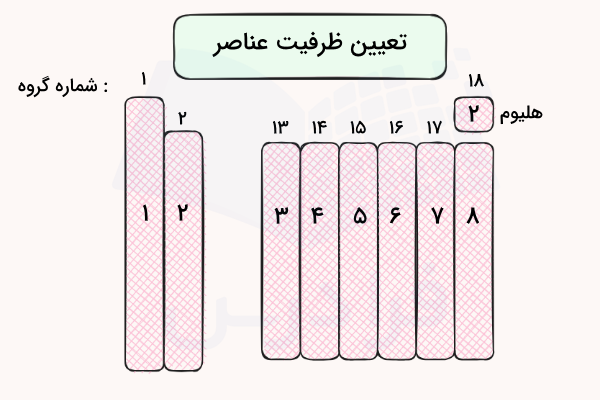
برای مثال، گروه فلزات قلیایی و قلیایی خاکی با آرایش الکترونی مختوم به و به ترتیب ۱ و ۲ الکترون ظرفیت دارند. همچنین، عناصر موجود در گروههای ۱۳ تا ۱۴ نیز که به p ختم میشوند، به ترتیب بین ۳ تا ۸ الکترون ظرفیت دارند. تعیین ظرفیت عناصر فلزات واسطه مقداری مشکل است زیرا این عناصر اوربیتال d در حال پر شدن دارند و معمولا میتوانند چندین حالت اکسایش داشته باشند. پیشنهاد میکنیم برای درک بهتر حالات اکسایش این عناصر و آرایش الکترونی آنها، مطلب عدد اکسایش و تعیین آن در مجله فرادرس را مطالعه کنید.
برای درک بهتر نحو تعیین ظرفیت عناصر با توجه به توزیع الکترون ها در لایه ها به مثالهای زیر دقت کنید.
مثال ۱
تعدا الکترونهای ظرفیتهای عناصر فسفر و کلسیم را تعیین کنید.
پاسخ
برای تعیین ظرفیت این عناصر ابتدا آرایش الکترونی آنها را مینویسیم.
فسفر:
کلسیم:
برای تعیین الکترون ظرفیت مواد به آخرین لایه الکترونی آنها توجه میکنیم. در دسته عناصری که آرایش الکترونی آنها به s یا s و p ختم میشود، مجموع الکترونهای موجود در این زیرلایهها در لایه آخر برابر با الکترون ظرفیت عناصر خواهد بود. بنابراین، عنصر فسفر ۵ الکترون ظرفیت و عنصر کلسیم ۲ الکترون ظرفیت دارد.
مثال ۲
تعدا الکترونهای ظرفیتهای عناصر آهن و مس را تعیین کنید.
پاسخ
برای تعیین ظرفیت این عناصر ابتدا آرایش الکترونی آنها را مینویسیم.
آهن:
مس:
برای تعیین الکترون ظرفیت مواد به آخرین لایه الکترونی آنها توجه میکنیم. در دسته عناصری که آرایش الکترونی آنها به ختم میشود، معمولا تعداد الکترون ظرفیت جمع تعداد الکترونهای زیرلایه s لایه آخر و تعداد الکترونهای d در لایه قبل از آن است. زیرا معمولا الکترونهای زیرلایه d نیز در این عناصر در تشکیل پیوند و واکنشهای شیمیایی شرکت میکنند.
بنابراین، تعداد الکترونهای ظرفیت عنصر آهن برابر با ۸ الکترون و تعداد الکترونهای ظرفیت عنصر مس برابر با ۱۱ الکترون است.
رسم ساختار الکترون نقطه عناصر
با استفاده از رسم آرایش الکترونی و تعیین تعداد الکترونهای ظرفیت عناصر میتوان ساختار الکترون نقطه آنها را رسم کرد. بدین ترتیب که پس از به دست آوردن تعداد الکترونهای ظرفیت، با نوشتن نماد شیمیایی عنصر و سپس رسم این الکترونها به صورت نقطههایی در اطراف نماد آن، ساختار الکترون نقطه (لوویس) عنصر رسم میشود.
برای مثال، به ساختار الکترون نقطه عناصر سدیم، کلسیم، آلومینیوم، کربن، نیتروژن، اکسیژن، کلر و آرگون با توجه به آرایش الکترونی و توزیع الکترون ها در لایه های آنها دقت کنید.

رسم ساختار لوییس یکی از مهمترین و اولین قدمها برای درک واکنشپذیری، تشکیل پیوند و نحوه انجام واکنشهای شیمیایی است.
تعیین موقعیت عناصر با آرایش الکترونی
با توجه به آرایش الکترونی هر عنصر میتوان به راحتی موقعیت آن اتم را در جدول تناوبی به دست آورد. برای این کار باید آرایش الکترونی عنصر نوشته شود و با توجه به آخرین لایهها و زیرلایههای الکترونی موقعیت آن تعیین میشود. تعداد الکترونهای موجود در آخرین لایه (لایهها)ی الکترونی، نوع عنصر و شماره گروه و ردیف آن را مشخص میکند. به تصویر زیر دقت کنید.
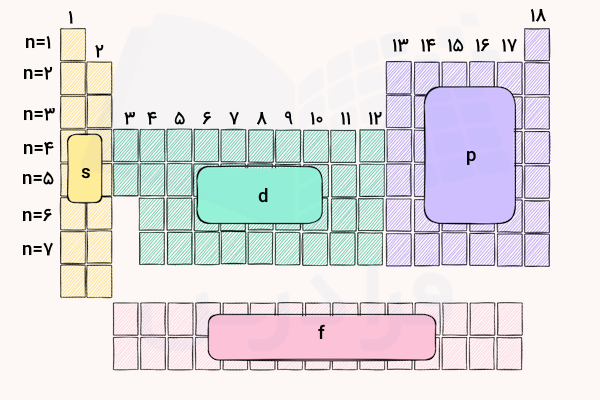
جدول تناوبی به ترتیب افزایش عدد اتمی در ۱۸ گروه و ۷ ردیف تنظیم شده است. ردیفهای جدول تناوبی نشاندهنده تعداد لایههای الکترونی عناصر هستند. در دو گروه اول و دوم جدول، آخرین الکترونهای عناصر در زیرلایه s قرار دارند. فلزات واسطه شامل زیرلایه d و لانتانیدها و اکتنیدها زیرلایه f را پر میکنند. عناصر گروههای ۱۳ تا ۱۸ نیز در آخرین لایه خود زیرلایههای s و p را دارند.
روش تعیین موقعیت عناصر
برای تعیین موقعیت یک عنصر کافی است آرایش الکترونی آن را بنویسیم و با توجه به لایه ظرفیت آن موقعیت عنصر به شکل زیر مشخص میشود.
| الکترون لایه ظرفیت عنصر | گروه عنصر |
| گروه ۱ | |
| گروه ۲ | |
| تا | فلزات واسطه (شماره گروه: ۲ + تعداد الکترون d) |
| تا | لانتانیدها و اکتنیدها |
| گروه ۱۳ | |
| گروه ۱۴ | |
| گروه ۱۵ | |
| گروه ۱۶ | |
| گروه ۱۷ (هالوژنها) | |
| گروه ۱۸ (گازهای نجیب) |
در فلزات واسطه برای تعیین شماره گروه اتم کافی است تعداد الکترونهای زیرلایه d را با عدد ۲ جمع کنیم. برای مثال، عناصری با لایه ظرفیت شامل در گروه ۶ جدول تناوبی قرار دارند. در عناصر قطعه p جدول تناوبی کافی است تعداد الکترونهای p و s را با عدد ۱۰ جمع کنیم تا شماره گروه به دست آید. برای مثال، عناصری با لایه ظرفیت شامل در گروه ۱۷ جدول تناوبی قرار دارند.
برای درک بهتر این شیوه تعیین موقعیت عناصر به مثالهای زیر دقت کنید.
مثال ۱
موقعیت عنصری با عدد اتمی ۳۹ را در جدول تناوبی بیابید.
پاسخ
ابتدا آرایش الکترونی عنصر را طبق اصل آفبا مینویسیم.
با توجه به این آرایش الکترونی، لایه ظرفیت عنصر شامل است. پس این عنصر در ردیف پنجم و گروه سوم قرار دارد.
مثال ۲
موقعیت عنصری با عدد اتمی ۲۶ را در جدول تناوبی بیابید.
پاسخ
ابتدا آرایش الکترونی عنصر را طبق اصل آفبا مینویسیم.
با توجه به این آرایش الکترونی، لایه ظرفیت عنصر شامل است. پس این عنصر در ردیف ۴ جدول تناوبی و گروه ۸ قرار دارد.
مثال ۳
موقعیت عنصری با عدد اتمی ۵۶ را در جدول تناوبی بیابید.
پاسخ
ابتدا آرایش الکترونی عنصر را طبق اصل آفبا مینویسیم.
با توجه به این آرایش الکترونی، لایه ظرفیت عنصر شامل است. پس این عنصر در قسمت p جدول تناوبی، ردیف پنجم و گروه ۱۶ قرار دارد.
آرایش الکترونی یون ها
به آرایش الکترونی گروه ۱۸ جدول تناوبی (گازهای نجیب) دقت کنید. این عناصر به دلیل داشتن زیرلایه پر از پایداری بالایی برخوردارند. در آرایش الکترونی این عناصر، تمامی اوربیتالها پر شدهاند و به همین دلیل این مواد تمایلی به از دست دادن یا گرفتن الکترون و تشکیل پیوند و شرکت در واکنش شیمیایی ندارد.
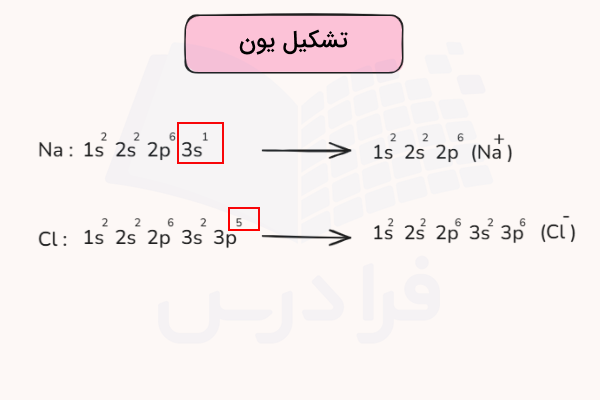
سایر عناصر جدول تناوبی که یون تشکیل میدهند، با از دست دادن الکترون (تشکیل کاتیون) یا دریافت الکترون (تشکیل آنیون) تمایل دارند به آرایش الکترونی گاز نجیب رسیده و پایدار شوند. برای مثال، به آرایش الکترونی عناصر زیر و یونهای تشکیل شده آنها دقت کنید.
یادگیری شیمی عمومی با فرادرس
برای درک بهتر شیوه توزیع الکترون ها در لایه ها نیاز است ابتدا با مفاهیمی چون ایزوتوپها، مدل اتمی بور، معادله شرودینگر، ترازهای انرژی و الکترونخواهی آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مفاهیم به مجموعه فیلم آموزش شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه توزیع الکترون ها در لایه ها و زیرلایهها دسترسی داشته باشید.
رفتار شیمیایی اتم بر اساس توزیع الکترون ها
در این مطلب از مجله فرادرس آموختیم توزیع الکترون ها در لایه ها چگونه است. توزیع الکترون ها در لایه ها و زیرلایهها، کلید اصلی درک رفتار شیمیایی اتمها و مولکولها در تشکیل پیوند و شرکت در واکنش شیمیایی است. در واقع، با دانستن آرایش الکترونی عناصر میتوانید دریابیم که آیا اتم یون تشکیل میدهد یا خیر، حالت اکسایش اتمها کدامند و چگونه پیوند شیمیایی برقرار میکنند. برای مثال، اتمهایی که یون تشکیل میدهند پیوند یونی تشکیل داده و اتمهای دیگر معمولا از طریق پیوند شیمیایی کوالانسی وارد واکنش میشوند.












