تاثیر غلظت بر سرعت واکنش در شیمی – به زبان ساده + مثال و تمرین
سرعت واکنش شیمیایی بیان کننده سرعت تبدیل واکنش دهنده به فراورده است. این سرعت به شکل مستقیم نمیتواند اندازهگیری شود و معمولا به شکل اندازهگیری تغییرات یکی از پارامترهای واکنش در طول زمان انجام واکنش بیان میشود. عوامل مختلفی بر سرعت واکنشهای شیمیایی تاثیر میگذارند. یکی از مهمترین این عوامل موثر بر سرعت واکنش، غلظت واکنش دهندهها است. هرچه غلظت مواد در واکنش شیمیایی افزایش یابد، سرعت واکنش نیز زیاد میشود. در واقع با افزایش غلظت واکنش دهندهها، حرکت ذرات و تعداد ذرات شرکت کننده در واکنش بیشتر میشود. رابطه سرعت واکنش و غلظت واکنش دهندهها بسته به مرتبه واکنش میتواند خطی یا نمایی باشد. یعنی برای مثال با دوبرابر کردن غلظت واکنش دهندهها لزوما سرعت دوبرابر نمیشود. در این مطلب از مجله فرادرس درباره تاثیر غلظت بر سرعت واکنش شیمیایی توضیح میدهیم و مثالها و تمرینهایی را برای فهم بهتر این موضوع ارائه میکنیم.
- تاثیر غلظت مواد بر سرعت واکنش شیمیایی را متوجه میشوید.
- با قانون سرعت، مرتبه واکنش و ثابت سرعت آشنا میشوید.
- توانایی طراحی آزمایش برای تعیین مرتبه واکنش بر اساس دادهها را کسب میکنید.
- تفسیر نمودارهای سرعت و غلظت را یاد میگیرید.
- یاد میگیرید نقش عوامل دیگری مانند دما، کاتالیزور و فشار چیست.
- میآموزید چگونه مفاهیم سینتیک را در مهندسی و فرآیندهای صنعتی بهکار گیرید.

در ابتدای این مطلب با مفهوم سرعت واکنشهای شیمیایی و تاثیر غلظت بر واکنشهای شیمیایی صحبت خواهیم کرد. به اهمیت بررسی سرعت واکنشهای شیمیایی در صنایع میپردازیم و سپس قانون و معادله سرعت و پارامترهای آن را بررسی خواهیم کرد و درباره مرتبه واکنش و انواع تعیین سرعت بر حسب مرتبه آنها میآموزیم. درباره نظریه برخورد و نمودارهای غلظت بر حسب زمان صحبت میکنیم و با مثالهای متفاوت این مفاهیم را میآموزیم. در ادامه این مطلب، تفاوت سرعت لحظهای و میانگین را بررسی میکنیم و یاد میگیریم چگونه از روی نمودار، سرعت لحظهای را به دست آوریم. در انتها سایر عوامل تاثیرگذار بر سرعت واکنش را بررسی میکنیم. با مطالعه این مطلب تا انتها این مباحث را به شکلی عمیق و به زبانی ساده بیاموزید.
سرعت واکنشهای شیمیایی
همانطور که قبلا اشاره شد، سرعت در واکنشهای شیمیایی، مدت زمان تبدیل واکنش دهندهها به فراوردههاست. این سرعت میتواند به روشهای مختلفی اندازهگیری شود و عواملی مانند غلظت، دما، اندازه ذرات، فشار و کاتالیزور(کاتالیست) میتوانند مقدار سرعت را تغییر دهند. برای مثال یک واکنش ممکن است در دمای بالا با سرعت بیشتر انجام شود و به همین دلیل گرم کردن بشر آزمایش، یکی از راههای افزایش سرعت واکنش باشد. غلظت واکنش دهندهها یکی از مهمترین عوامل تاثیرگذار بر سرعت واکنش است. بدین صورت که قوانین سرعت واکنشهای شیمیایی بر حسب تغییر غلظت واکنش دهندهها بیان میشود. فرمول محاسبه سرعت واکنشهای شیمیایی، که یکی از فرمولهای کتاب شیمی یازدهم است، به شکل زیر نوشته میشود.
در این معادله «rate» میزان سرعت و k ثابت سرعت است. حروف m و n و p مرتبههای واکنش را نسبت به واکنش دهندههای A و B و C نشان میدهند.
هرچند معادله یک واکنش شیمیایی میتواند اطلاعات مهمی درباره مواد شرکت کننده در واکنش و فراوردههایی که تولید میشوند بدهد، اما هیچ اطلاعاتی درباره شرایط و سرعت انجام واکنش در اختیار ما قرار نمیدهد. دستیابی به این اطلاعات تنها با مطالعه سینتیک واکنش امکان پذیر است. سینتیک واکنش شامل اطلاعاتی درباره دمای انجام واکنش، حالات فیزیکی مواد، سطح ذرات واکنش دهندهها، حلال و ویژگیهای کاتالیزور است.
تاثیر غلظت بر سرعت واکنش
قبلا گفتیم که هرچه غلظت مواد در واکنش شیمیایی افزایش یابد، سرعت واکنش نیز زیاد میشود. با مطالعه سینتیک واکنش، میتوانیم به اطلاعات ارزشمندی درباره چگونگی کنترل شرایط واکنش و به دست آوردن فراورده مطلوب دست یابیم.
عموما سرعت واکنشهای شیمیایی با جلو رفتن زمان کاهش مییابد زیرا غلظت واکنش دهندهها طی زمان و تبدیل آنها به فراوردهها، کاهش مییابد. سرعت واکنش شیمیایی معمولا با افزایش غلظت واکنش دهندهها افزایش مییابد.
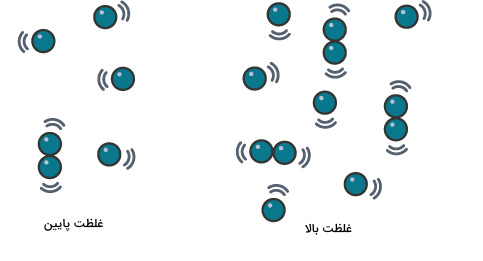
در بررسی اثر غلظت بر سرعت واکنشهای شیمیایی باید با مفهومی به نام قانون سرعت آشنا شویم. این قانون رابطه بین سرعت مصرف واکنش دهندهها و سرعت تولید فراوردهها بر حسب غلظت را مشخص میکند. قوانین سرعت روابط ریاضی برگرفته از آزمایشهای تجربی را مشخص میکنند.
یادگیری تاثیر غلظت بر سرعت و مهندسی واکنش با فرادرس
یکی از مهم ترین خروجی های یادگیری تاثیر غلظت بر سرعت واکنش، مهندسی و پیشبینی بازده واکنش است. با یادگیری این مباحث در مراحل پیشرفتهتر میتوان راکتورهایی صنعتی را برای کاربردهای مختلف طراحی کرد. با مراجعه به مجموعه فیلم آموزش مهندسی شیمی از دروس دانشگاهی تا کاربردی میتوانید این مباحث را بیاموزید. خصوصا فیلم آموزش مهندسی واکنشهای شیمیایی سینتیک و طراحی راکتور که به آموزش مباحثی چون سینتیک شیمیایی، تقسیم بندی واکنش ها، مشخص کردن سرعت واکنش و ... میپردازد.
همچنین برای فراگیری آموزشهای مرتبط بیشتر میتوانید به صفحات زیر مراجعه کنید.
- فیلم آموزش مقدمه ای بر مهندسی واکنش های شیمیایی
- فیلم آموزش مهندسی واکنش های فوتوکاتالیستی مبانی و مقدمات
- فیلم آموزش طراحی رآکتورهای شیمیایی مرور و حل تست کنکور ارشد
اهمیت بررسی سرعت واکنشها در صنایع
واکنشهای شیمیایی یکی از اساسیترین بخشهای بسیاری از صنایع هستند. بررسی سرعت واکنش، یکی از روشهای بررسی کارایی و تاثیرگذاری پروسهی صنعتی درحال انجام است. سرعت واکنشهای شیمیایی که بیان کننده سرعت تبدیل واکنش دهندهها به فراوردهها است، تاثیر بسیار زیادی در بررسی روند پیشرفت صنایع مختلف دارد.
یکی از اصلیترین هدفهای شیمی صنعتی، بررسی و بهبود بازده صنایع و فرایندهای شیمیایی برای رسیدن به بالاترین حد کارایی است. سرعت واکنشهای شیمیایی یکی از فاکتورهای کلیدی برای دستیابی به این اطلاعات است. معمولا واکنشهای سریعتر، بازده بالاتری نیز دارند. برای مثال در فرایند تولید مواد شیمیایی مانند آمونیاک، سرعت واکنش یکی از مهم ترین عوامل رسیدن به بازده بالا و فراورده بیشتر و به سبب آن کمترین حد ضایعات است.
همچنین یکی دیگر از صنایعی که به شدت به سرعت واکنشها وابسته است، صنایع داروسازی است. در داروسازی، سرعتی که در آن یک دارو جذب خون و متابولیزه میشود در تصمیمگیری میزان و زمان مصرف دوزهای بعدی دارو بسیار موثر است. همانطور که اشاره شد، با تغییر شرایطی مانند دما و غلظت، و بررسی تاثیر غلظت بر سرعت واکنشهای شیمیایی در صنایع مختلف تنظیم میشوند تا فرایندها به بالاترین بازده ممکن برسند.
قانون سرعت
در مبحث قبل آموختیم که قوانین سرعت، معادلات ریاضی هستند که رابطه بین غلظت واکنش دهندهها و روند پیشرفت واکنش را نشان میدهند. برای یک واکنش ساده با واکنش دهندههای A و B و C و... قانون سرعت (معادله سرعت) عمومی به شکل زیر نوشته میشود.
در این معادله «rate» میزان سرعت و k ثابت سرعت است. حروف m و n و p مرتبههای واکنش را نسبت به واکنش دهندههای A و B و C نشان میدهند. هر کدام از این پارامترها به تفصیل در ادامه آورده شده است.
قانون سرعت دیفرانسیلی و انتگرالی
قوانین سرعت ممکن است به دو صورت متفاوت بیان شوند. قانون سرعت دیفرانسیلی (تفاضلی) بیان میکند سرعت واکنش بر اساس تغییر غلظت یک یا تعداد بیشتری از واکنش دهندهها طی زمان تعیین میشود. درحالی که قانون سرعت تجمعی بیان میکند سرعت واکنش شیمیایی بر اساس غلظت اولیه و غلظت اندازهگیری شده واکنش دهندهها پس از یک مدت زمان مشخص اندازهگیری میشود. سرعت طبق این قوانین بیشتر برحسب مول بر لیتر بر ثانیه اندازهگیری میشود.
قانون سرعت تفاضلی، سرعت واکنش را بر حسب تغییرات غلظت یک یا چند واکنش دهنده در طول زمان مشخص بیان میکند. از طرف دیگر، قانون سرعت انتگرالی، سرعت واکنش را بر حسب غلظت اولیه و غلظت اندازهگیری شده واکنش دهندهها [R] پس از مدت زمان مشخصی (t) بیان میکند. قوانین سرعت انتگرالی با استفاده از انتگرالگیری از قانون سرعت تفاضلی به دست میآیند.
متغیرهای معادله سرعت
در قانون سرعت، سرعت به غلظت واکنش دهندهها وابسته است. R (سرعت واکنش) یک متغیر وابسته است که تغیر غلظت هریک از مواد واکنش دهنده را برحسب زمان نشان میدهد. این متغیر همچنین میتواند به عنوان سرعت مصرف واکنش دهندهها یا سرعت تولید فراوردهها نیز تعریف شود.
غلظت مواد [A] و [B] و [C] و ... متغیرهای غیروابسته و مستقلی هستند. متغیر وابسته، متغیری است که نسبت به تغییر حساس است و با تغییر شرایط تغییر میکند. متغیر مستقل یا غیر وابسته، متغیری است که درحال تغییر است. برای مثال غلظت در بررسی روند تغییر سرعت یک متغیر مستقل است.
برای مطالع بیشتر درباره متغیر های وابسته و مستقل پیشنهاد میکنیم مطلب زیر از مجله فرادرس را مطالعه کنید.
مرتبه واکنش
مرتبه واکنش یکی از مهمترین پارامترها در معادله سرعت واکنش و بررسی تاثیر غلظت بر سرعت واکنش است. مرتبههای یک واکنش همواره از طریق اندازهگیری تجربی به دست میآیند. مقادیر m و n در این معادله واکنش از اندازهگیریهای تجربی تغییر غلظت واکنش دهندهها به دست میآیند و مرتبه واکنش را مشخص میکنند. مرتبهای که مشخص میکند سرعت چگونه با غلظت واکنش دهندهها در ارتباط است. m و n باید اعداد صحیح باشند. برای مثال معادله بالا به ما میگوید که از واکنش دهنده A مرتبه m ام و واکنش دهنده B مرتبه n ام را داریم.
مرتبه کلی واکنش
مرتبه کلی واکنش، جمع مرتبههای واکنش است که با علامت یونانی تتا نشان داده میشود.
برای مثال اگر داشته باشیم مرتبه کلی واکنش بابر است با
ثابت K
ثابت سرعت درواقع همیشه مقدار ثابتی ندارد. مقدار ثابت سرعت تنها در صورتی ثابت است که شرایط واکنش بجز غلظتها تغییر نکند. این ثابت تابعی از دما است و اگر دما در طول واکنش تغییر کند، میتواند مقادیر متفاوتی داشته باشد. ثابت سرعت همچنین به مرتبه کلی واکنش نیز وابسته است. اگر واحدهای اندازهگیری را بدون درنظر گرفتن مقادیر عددی در نظر بگیریم میدانیم که سرعت، واحدی از تغییرات غلظت تقسیم بر زمان است. همچنین هر غلظت در معادله سرعت، واحدی از غلظت به توان مرتبه واکنش است. در نهایت اگر غلظت بر حسب غلظت مولی و زمان بر حسب ثانیه باشد، واحد اندازهگیری ثابت سرعت برابر با مقدار زیر خواهد بود.

سرعت بر حسب غلظت
دو ماده نمیتوانند با یکدیگر واکنش دهند مگر اینکه ذرات آنها با یکدیگر تماس پیدا کنند. اگر تماسی وجود نداشته باشد، واکنشی نیز صورت نمیگیرد. این مسئله به خوبی اثر غلظت بر سرعت واکنش را در واکنشهای شیمیایی توضیح میدهد. هرچه غلظت مواد بیشتر باشد، بدان معناست که تعداد ذرات بیشتری از آن ماده وجود دارند. هرچه تعداد ذرات موجود بیشتر باشد، امکان پیشرفت واکنش و برخورد ذرات نیز بیشتر میشود. در نتیجه هرچه غلظت مواد در واکنش بیشتر باشد، سرعت واکنش نیز بیشتر میشود.
تغییر غلظت واکنش دهندهها باعث تغییر سرعت واکنش شیمیایی میشود. معادله سرعت واکنش معادلهای است که این تغییر سرعت بر اساس غلظت را به صورت ریاضی نشان میدهد. در ادامه معادله سرعت واکنش و اصطلاحات و مفاهیم مربوط به آن را بررسی میکنیم.
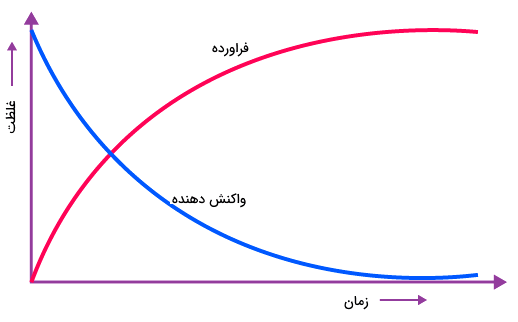
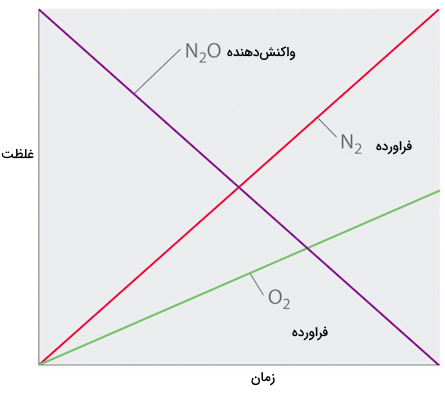
روشهای زیادی برای اندازهگیری سرعت واکنشهای شیمیایی وجود دارد. برای مثال اگر یک گاز در طول واکنش تولید شود ، سرعت واکنش میتواند به عنوان میزان حجمی از گاز که در طول هر ثانیه از واکنش تولید میشود در نظر گرفته شود. روش عمومیتر اندازهگیری سرعت واکنش شیمیایی اندازهگیری تغییر غلظت واکنش دهندهها برحسب زمان است. غلظت واکنش دهندهها همواره طی زمان کاهش یافته و با مصرف شدن آنها کم میشود. اگر نموداری از تغییرات غلظت واکنش دهندهها و فراوردهها بر حسب زمان رسم کنیم، مشاهده میکنیم که نمودار غلظت واکنش دهندهها با شیب زیادی کاهش یافته و غلظت فراوردهها نیز مانند همان نمودار افزایش میيابند. شکل زیر مثالی است که تاثیر غلظت بر سرعت واکنش را با تغییر تعداد مولکولهای فراورده و واکنش دهندهها را طی زمان در یک مثال فرضی و غیر واقعی رسم کرده است.
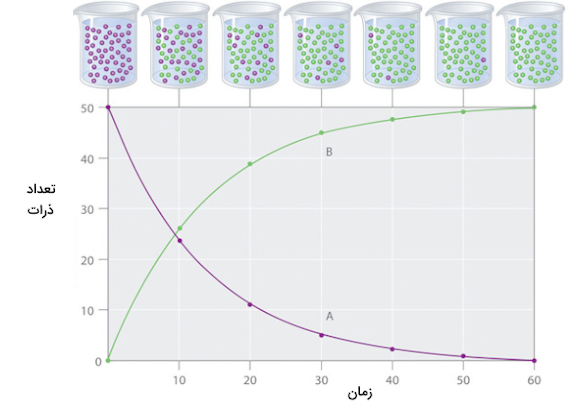
پیشرفت واکنش سادهی تبدیل واکنش دهنده A به فراورده B طی زمان در نمودار بالا نشان داده شده است. اگر بخواهیم به سادگی سرعت واکنش را بر حسب تغییر غلظت یا تغییر تعداد ذرات واکنش دهنده یا فراورده بیان کنیم معادله زیر را خواهیم داشت. عبارت «rate» به معنای سرعت است.
$$\textrm{rate}=\dfrac{\Delta [\textrm B]}{\Delta t}=-\dfrac{\Delta [\textrm A]}{\Delta t} \label{Eq1}$$
براکتهای رسم شده در معادله بالا نشاندهنده غلظت مولار واکنش دهنده یا فراوردهها هستند. علامت یونانی دلتا نشان دهنده تغییرات با علامت مثبت است.
برای مثال تصور کنید واکنشی با دو ماده A و B دارید و میتوان غلظت یکی از آنها را در طول واکنش اندازهگیری کرد. در این مثال واکنش دهندهها به فرم محلول یا گاز هستند.
برای اندازهگیری سرعت این واکنش میتوان بررسی کرد غلظت یکی از مواد برای مثال A با چه سرعتی کاهش مییابد. برای مثال چه غلظتی از آن در ثانیه مصرف میشود. برای درک بهتر این مسئله به مثالهای بعد توجه کنید.
مثال ۱
میخواهیم با استفاده از معادله بالا و جدول دادههای زیر سرعت هیدرولیز آسپرین (استیل سالیسیلیک اسید) را به دست آوریم. این واکنش از ترکیب آب با مولکول آسپرین تشکیل شده و سالسیلیک اسید و استیک اسید به وجود میآورد.
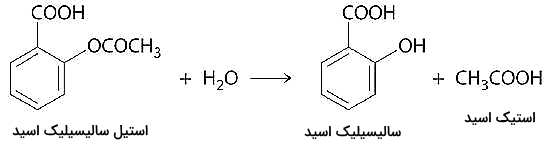
به این دلیل که سالسیلیک اسید یک فراورده قطعی این واکنش است که باعث کاهش درد و کاهش تب و التهاب میشود، تحقیقات زیادی روی بازده و سرعت این واکنش انجام شده است. جدول اطلاعات داده این واکنش در ادامه آورده شده است.
| غلظت مولار سالسیلیک اسید | غلظت مولار آسپرین | زمان بر حسب ساعت |
| ۰ | ۵٫۵۵ | 0 |
| ۰٫۰۴ | ۵٫۵۱ | ۲ |
| ۰٫۱۰ | ۵٫۴۵ | ۵ |
| ۰٫۲ | ۵٫۳۵ | ۱۰ |
| ۰٫۴ | ۵٫۱۵ | ۲۰ |
| ۰٫۵۹ | ۴٫۹۶ | ۳۰ |
| ۰٫۷۷ | ۴٫۷۸ | ۴۰ |
| ۰٫۹۴ | ۴٫۶۱ | ۵۰ |
| ۱٫۷۲ | ۳٫۸۳ | ۱۰۰ |
با رسم نموداری از غلظت آسپرین و سالیسیلیک اسید بر حسب زمان شکل زیر را خواهیم داشت.
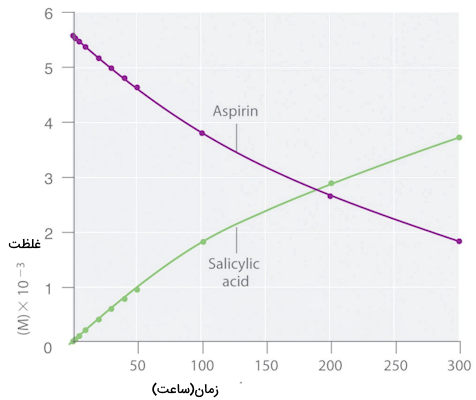
سرعت میانگین واکنش برای یک بازه زمانی مشخص میتواند از اختلاف غلظت یکی از مواد واکنش دهنده یا فراورده در ابتدا و انتهای آن بازه زمانی به دست بیاید. برای مثال سرعت واکنش در دو ساعت اول واکنش از روی محاسبه غلظت سالیسیلیک اسید یا آسپرین میتواند به دست بیاید. فرمول این محاسبات در ادامه آورده شده است.
همچنین اگر بخواهیم سرعت متوسط واکنش را در بازه ۲۰۰ تا ۳۰۰ ساعت نهایی به دست آوریم باز هم به همین روش خواهیم داشت:
مثال ۲
محاسبه سرعت تخمیر ساکارز یکی از مسائل مهم در بیوشیمی است. معادله واکنش این فرایند به شکل زیر است.
$$\underset{\textrm{sucrose}}{\mathrm{C_{12}H_{22}O_{11}(aq)}}+\mathrm{H_2O(l)}\rightarrow\mathrm{4C_2H_5OH(aq)}+4\mathrm{CO_2(g)} \label{Eq2}$$
در این معادله واکنش ضرایب واکنش دهندهها و فراوردهها برابر یک نیست و اتانول و کربن دی اکسید ضریب ۴ دارند. برای محاسبه سرعت این واکنش باید توجه کنیم که هر یک مولکول ساکاروز ۴ مولکول کربن دی اکسید و اتانول تولید میکند. در نتیجه این مواد ۴ برابر سریعتر از مصرف ساکاروز تولید میشوند. پس برای معادله سرعت خواهیم داشت:
$$\dfrac{\Delta[\mathrm{C_2H_5OH}]}{\Delta t}=-\dfrac{4\Delta[\textrm{sucrose}]}{\Delta t} \label{Eq3}$$
روشهای تعیین قوانین سرعت
یکی از روشهای تعیین قوانین سرعت، اندازهگیری غلظت یک یا چند واکنش دهنده یا محصول به عنوان تابعی از زمان است. به عنوان مثال، برای واکنش ، میتوان غلظت B را ثابت نگه داشت و غلظت A را تغییر داد و سرعت اولیه واکنش را اندازهگیری کرد.
چه از قانون سرعت تفاضلی استفاده کنید و چه از قانون سرعت انتگرالی، بهتر است که قانون سرعت مول در لیتر بر ثانیه (M/s) باشد.
ثابت تناسب (k) به نام ثابت سرعت نامیده میشود و مقدار آن وابسته به شرایط واکنش است. یک واکنش خاص دارای مقدار ثابت سرعت خاصی تحت مجموعهای از شرایط، مانند دما، فشار و حلال است. تغییر دما یا حلال معمولا مقدار ثابت سرعت را تغییر میدهد. با این حال مقدار عددی k، در حین پیشرفت واکنش تحت یک مجموعه از شرایط ثابت تغییر نمیکند.
بنابراین، سرعت واکنش به ثابت سرعت برای مجموعه شرایط واکنش خاص و غلظتهای A و B به توانهای m و n بستگی دارد. مقادیر m و n از اندازهگیریهای تجربی تغییرات در غلظتهای واکنش دهندهها بر اساس زمان بهدست میآیند و مرتبه واکنش را نشان میدهند، یعنی درجهای که سرعت واکنش به غلظت هر واکنش دهنده بستگی دارد. مهم است به یاد داشته باشید که n و m به ضرایب استوکیومتری a و b در معادله شیمیایی موازنه شده مربوط نمیشوند و باید تجربی تعیین شوند.
اگرچه قوانین سرعت تفاضلی معمولا برای توصیف آنچه در سطح مولکولی در حین واکنش رخ میدهد استفاده میشود، قوانین سرعت انتگرالی برای تعیین مرتبه واکنش و مقدار ثابت سرعت از اندازهگیریهای تجربی استفاده میشوند.
برای نشان دادن چگونگی تفسیر شیمیدانان از قانون سرعت تفاضلی، قانون سرعت تجربی برای هیدرولیز برومید ت-بوتیل در استون آبی ۷۰٪ را در نظر بگیرید. این واکنش طبق معادله زیر، ت-بوتانول تولید میکند.
از ترکیب معادله سرعت کلی و معادله سرعت میانگین به معادله زیر خواهیم رسید.
سپس معادلهی قانون سرعت تفاضلی را نیز بهه آن اضافه میکنیم.
با جایگزینی فرمول واکنش دهندهها در معادله سرعت واکنش، درک بهتری از روند تاثیر غلظت بر سرعت واکنش خواهیم داشت.
آزمایشها برای تعیین قانون سرعت برای هیدرولیز برومید ت-بوتیل نشان میدهد که سرعت واکنش به طور مستقیم متناسب با غلظت است اما به غلظت آب وابسته نیست. بنابراین، m و n در معادله بالا به مرتبه ۱ و ۰ هستند و معادله سرعت به شکل زیر میشود.
از آنجا که توان واکنش دهنده در این واکنش برابر با ۱ است، واکنش در از نوع مرتبه اول است. این واکنش در آب از نوع صفرم است زیرا توان برابر با ۰ است. بنابراین، مرتبه کلی واکنش است. مرتبه واکنشها به طور عملی بیان میکند که دو برابر کردن غلظت باعث دو برابر شدن سرعت واکنش هیدرولیز میشود، نصف کردن غلظت باعث نصف شدن سرعت واکنش میشود و به همین مرتبه روند سرعت تغییر خواهد کرد. به عبارت دیگر، افزایش یا کاهش غلظت آب تاثیری بر سرعت واکنش ندارد.

هنگام کار با قوانین سرعت، هیچ رابطه سادهای بین استوکیومتری واکنش و قانون سرعت وجود ندارد. مقادیر k، m و n در قانون سرعت باید تجربی تعیین شوند. واحد ثابت سرعت ثانیه معکوس است زیرا سرعت واکنش در واحدهای غلظت بر واحد زمان (M/s) تعریف شده است. واحدهای ثابت سرعت به قانون سرعت برای یک واکنش خاص بستگی دارد.
برای مثال تحت شرایط مشابه مثال قبل برای واکنش برومید ت-بوتیل، قانون سرعت تفاضلی تجربی برای هیدرولیز متیل برومید به شرح زیر است.
این واکنش همچنین دارای مرتبه کلی واکنش ۱ است، اما ثابت سرعت در بالا تقریباً ۱۰۶ بار کوچکتر از ثابت سرعت برای برومید ت-بوتیل است. بنابراین، متیل برومید حدود یک میلیون بار کندتر از تی-بوتیل برومید هیدرولیز میشود و این اطلاعات به شیمیدانان میگوید که واکنشها از نظر مولکولی چگونه تفاوت دارند و تاثیر غلظت بر سرعت واکنش چگونه است.
بیشتر مواقع تغییرات در شرایط واکنش، تغییراتی در قانون سرعت به وجود میآورد. در واقع، شیمیدانان اغلب شرایط واکنش را تغییر میدهند تا رفتار واکنش را مطالعه کنند. به عنوان مثال، وقتی تی- بوتیل برومید در محلول استون محلول در آب حاوی یونهای هیدرولیز میشود، قانون سرعت تفاضلی برای واکنش هیدرولیز تغییر نمیکند. در مقابل، برای متیل برومید، قانون سرعت تفاضلی به صورت با مرتبه کلی واکنش ۲ انجام میشود. با اینکه این دو واکنش در محلول خنثی به طور مشابه پیش میروند، در حضور یک باز به طور بسیار متفاوتی رفتار میکنند و سرنخهایی درباره نحوه تفاوت واکنشها از نظر مولکولی فراهم میکنند.
تمرین و مثال قانون سرعت
در زیر سه واکنش و قوانین سرعت تفاضلی تجربی آنها آمده است. برای هر واکنش، واحدهای ثابت سرعت را مشخص کنید، مرتبه واکنش را نسبت به هر واکنش دهنده بگویید، مرتبه کلی واکنش را تعیین کنید و پیشبینی کنید که با دو برابر شدن غلظت اولین گونه در هر معادله شیمیایی چه اتفاقی میافتد.
مثال ۱
با توجه به فرمول واکنش و معادله سرعت آن، موارد خواسته شده را به دست آورید.
- واحدهای ثابت سرعت:
- مرتبه واکنش نسبت به A برابر با ۲ است.
- مرتبه واکنش نسبت به B برابر با ۱ است.
- مرتبه کلی واکنش: ۳
- دو برابر شدن غلظت A: سرعت واکنش چهار برابر میشود.
مثال ۲
با توجه به فرمول واکنش و معادله سرعت آن، موارد خواسته شده را به دست آورید.
- واحدهای ثابت سرعت:
- مرتبه واکنش نسبت به A برابر با ۱ است.
- مرتبه واکنش نسبت به B بابر با ۲ است.
- مرتبه کلی واکنش: ۳
- دو برابر شدن غلظت B: سرعت واکنش چهار برابر میشود.
مثال ۳
با توجه به فرمول واکنش و معادله سرعت آن، موارد خواسته شده را به دست آورید.
- واحدهای ثابت سرعت:
- مرتبه واکنش نسبت به A برابر ۲ است.
- مرتبه واکنش نسبت به B برابر صفر است.
- مرتبه کلی واکنش: ۲
- دو برابر شدن غلظت A: سرعت واکنش چهار برابر میشود.
تاثیر غلظت بر سرعت واکنشها با مراتب متفاوت
در قسمتهای قبل آموختیم که مرتبه واکنش یکی از مهمترین پارامترها در معادله سرعت واکنش و بررسی تاثیر غلظت بر سرعت واکنش است. مرتبههای یک واکنش همواره از طریق اندازهگیری تجربی به دست میآیند. تنها با نگاه کردن به فرمول یک واکنش هیچ اطلاعاتی درباره مرتبههای واکنش به دست نمیآید.
مرتبه واکنش
تصور کنید یک واکنش شیمیایی را انجام دادهاید که ماده A یکی از واکنش دهندهها است. یکی از اتفاقاتی که ممکن است این است که سرعت واکنش نسبتی از غلظت واکنش دهنده A باشد. این بدان معناست که اگر غلظت واکنش دهنده را دوبرابر کنید سرعت واکنش نیز دوبرابر شود. اگر غلظت را ۴ برابر کنید سرعت هم ۴ برابر شود. اما روابط سرعت و غلظت همواره بدین شکل نیستند.
برای یک واکنش شیمیایی با فرمول کلی زیر یک قانون سرعت تجربی خواهیم داشت.
طبق این قانون سرعت واکنش از طریق فرمول زیر به دست میآید که در آن k ثابت سرعت نام دارد.
مقدار ثابت سرعت
مقدار k به نوع واکنش و شرایط واکنش بستگی دارد. یک واکنش مشخص، مقدار ثابت سرعتی مشخص دارد که این مقدار به عواملی مانند دما، فشار، کاتالیزور و حلال وابسته است. متفاوت بودن دما و حلال معمولا باعث تغییر ثابت سرعت میشود. هرچند مقدار عددی k طی پیشرفت واکنش تحت دستهای از شرایط ثابت باقی میماند. در واقع اگر تمامی شرایط واکنش بجز غلظتها ثابت باشند، ثابت سرعت، ثابت میماند.
قانون سرعت یک تابع بسیار پرکاربرد برای به دست آوردن تاثیر غلظت بر سرعت واکنش است. این قانون برای شرایط واکنش در دمای ثابت بیان شده است. A در این رابطه بیانگر غلظت واکنش دهندهها (معمولا بر حسب مولاریته) و m و n مرتبه واکنش هستند. پس به این مرتبه قانون سرعت بیان میکند که سرعت واکنش چگونه به غلظت واکنش دهندهها مربوط میشود. اگر در واکنش انجام شده ۳ واکنش دهنده داشته باشیم، قانون سرعت به شکل زیر تغییر خواهد کرد.
مقادیر m و n در این معادله واکنش از اندازهگیریهای تجربی تغییر غلظت واکنش دهندهها به دست میآیند و مرتبه واکنش را مشخص میکنند. مرتبهای که مشخص میکند سرعت چگونه با غلظت واکنش دهندهها در ارتباط است. m و n باید اعداد صحیح باشند. برای مثال در معادله بالا به ما میگوید که از واکنش دهنده A مرتبه m ام و واکنش دهنده B مرتبه n ام را داریم. مرتبه کلی واکنش از جمع مرتبههای واکنش دهندهها به دست میآید.

گفتیم برای واکنشی با معادله کلی زیر قانون سرعت مشخصی وجود دارد که در زیر توضیح داده میشود.
قانون سرعت در این گونه واکنشها معمولا به صورت زیر نوشته میشود. این معادله تلثیر غلظت بر سرعت واکنش را نشان میدهد.
در اینجا، k ثابت سرعت است که مقدار آن برای واکنش و شرایط واکنش متفاوت است. m و n، به ترتیب، مرتبه واکنش نسبت به A و B هستند و باید به صورت تجربی تعیین شوند. مرتبه کلی (m+n) واکنش مجموع تمام توانهای موجود در قانون سرعت است. در ادامه برای درک بهتر قوانین سرعت و تاثیر غلظت بر سرعت واکنش مثالهایی آورده شده است. تحت مجموعهای از شرایط، مقدار ثابت سرعت در حین پیشرفت واکنش تغییر نمیکند.
به عنوان نمونه، قانون سرعت تفاضلی برای هیدرولیز t- بوتیل برمید به صورت زیر است.
این واکنش مرتبه اول نسبت به t- بوتیل برمید است زیرا توان غلظت آن برابر با ۱ است.
واکنشهای مرتبه صفر
یک واکنش مرتبه صفر، واکنشی است که سرعت آن مستقل از غلظت واکنش دهندهها است. قانون سرعت تفاضلی آن به صورت rate = k نوشته میشود. این واکنشها به دلیل اینکه میتوانیم آنها را با نمایی از صفر در قانون سرعت بنویسیم، به نام واکنشهای صفرم شناخته میشوند.
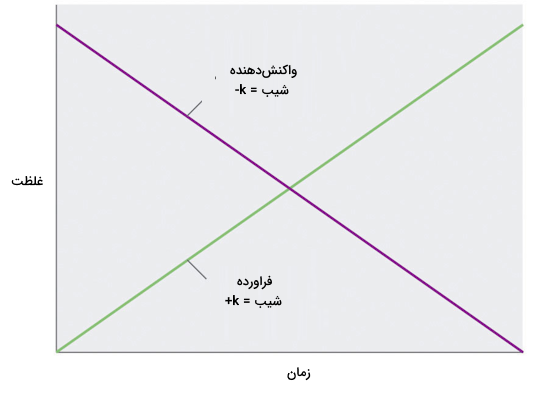
از آنجا که سرعت واکنش به غلظت واکنش دهندهها وابسته نیست، نمودار تغییرات غلظت هر واکنش دهنده به عنوان تابعی از زمان یک نمودار خطی با شیب k- است. مقدار k منفی است زیرا غلظت واکنش دهنده با گذشت زمان کاهش مییابد. به طور معکوس، نمودار تغییرات غلظت هر فراورده به عنوان تابعی از زمان یک نمودار خطی با شیب k+ است.
قانون سرعت انتگرالی برای واکنشهای صفرم نیز یک خط راست تولید میکند و به صورت زیر است.
که در آن غلظت اولیه واکنش دهنده A است. معادله بالا به فرم معادله جبری برای یک خط راست، ، است که در آن و و است. در واکنشهای صفرم، ثابت سرعت باید واحدهای مشابه با سرعت واکنش که معمولا مول در لیتر در ثانیه است، داشته باشد.
مثال واکنش مرتبه صفر
اگرچه ممکن است به نظر برسد که عدم وابستگی سرعت واکنش به غلظت واکنش دهندهها غیرمنطقی است، این واکنشها نسبتا رایج هستند. آنها اغلب زمانی اتفاق میافتند که سرعت واکنش توسط سطح تماس موجود تعیین میشود. به عنوان مثال، تجزیه روی سطح پلاتین (Pt) برای تولید و که در دماهای بین ۲۰۰ تا ۴۰۰ درجه سانتیگراد اتفاق میافتد خواهیم داشت:
بدون سطح پلاتین، واکنش نیاز به دماهای بالای ۷۰۰درجه سانتیگراد دارد، اما در دماهای بین ۲۰۰ تا ۴۰۰ درجه، تنها عاملی که سرعت تجزیه را تعیین میکند، میزان سطح Pt موجود است (نه میزان Pt). تا زمانی که مقدار به اندازه کافی برای واکنش با تمام سطح Pt وجود داشته باشد، دو برابر کردن یا چهار برابر کردن غلظت تاثیری بر سرعت واکنش ندارد. در غلظتهای بسیار پایین که تعداد مولکولها برای اشغال کل سطح Pt کافی نیست، سرعت واکنش به غلظت وابسته است. سرعت واکنش در این شرایط به صورت زیر است:
بنابراین، سرعت مصرف و سرعت تولید و مستقل از غلظت هستند. تغییرات در غلظتهای همه گونهها با زمان خطی است.
یک واکنش صفرم دیگر که در فرایندهای بیولوژیکی رخ میدهد، اکسیداسیون اتانول به استالدهید است که توسط آنزیم الکل دهیدروژناز کاتالیز میشود. در غلظتهای بالای اتانول، این واکنش نیز یک واکنش صفرم است. معادله کلی واکنش به صورت زیر است.
که در آن و اشکال اکسیده و کاهش یافته، به ترتیب، از یک گونه هستند که در ارگانیسمهای تمام موجودات برای حمل الکترونها استفاده میشود. غلظت اتانول در این واکنش با سرعت ثابت کاهش مییابد تا به صفر برسد. بر خلاف باور عمومی، کافئین موجود در قهوه بر کاتالیز و اکسیداسیون اتانول تاثیری ندارد. وقتی اتانول به طور کامل اکسید شده و غلظت آن به صفر میرسد، سرعت اکسیداسیون نیز به سرعت کاهش مییابد.
این مثالها دو نکته مهم را نشان میدهند.
- در یک واکنش صفرم، سرعت واکنش به غلظت واکنش دهندهها وابسته نیست.
- تغییر خطی در غلظت با زمان نشانه واضحی از یک واکنش صفرم است.
واکنشهای مرتبه اول
در واکنشهای مرتبه اول، سرعت واکنش بهطور مستقیم با غلظت یکی از واکنش دهندهها نسبت دارد. واکنشهای مرتبه اول معمولا به شکل عمومی هستند. قانون سرعت تفاضلی برای یک واکنش مرتبه اول به صورت زیر است.
اگر غلظت A دو برابر شود، سرعت واکنش نیز دو برابر میشود. اگر غلظت A ده برابر شود، سرعت واکنش نیز ده برابر خواهد شد و به همین ترتیب سرعت واکنش تغییر خواهد کرد. از آنجا که واحدهای سرعت واکنش همیشه مول بر لیتر بر ثانیه هستند، واحدهای ثابت سرعت برای واکنشهای مرتبه اول معکوس ثانیه است.
قانون سرعت انتگرالی برای یک واکنش مرتبه اول میتواند به دو شکل مختلف نوشته شود. یکی با استفاده از توابع نمایی و دیگری با استفاده از لگاریتمها. فرم نمایی به صورت زیر است:
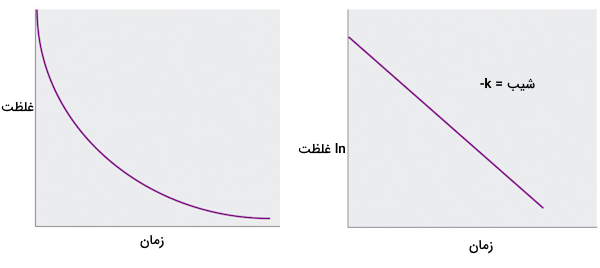
که در آن غلظت اولیه واکنش دهنده A در است. k ثابت سرعت است و e پایه لگاریتمهای طبیعی است که مقدار آن ۲٫۷۱۸ است. قانون سرعت انتگرالی رابطه بین غلظت واکنش دهنده و زمان را نشان میدهد و پیشبینی میکند که غلظت A به صورت منحنی نمایی صاف در طول زمان کاهش مییابد. با گرفتن لگاریتم طبیعی از هر دو طرف معادله و مرتبهدهی مجدد، یک بیان لگاریتمی از رابطه بین غلظت A و t به دست میآید.
از آنجا که معادله فوق به فرم معادله جبر خطی است، با و ، نمودار در مقابل t برای یک واکنش مرتبه اول باید خطی با شیب باشد. برای تعیین اینکه آیا یک واکنش خاص از نوع اول است یا خیر، میتوان از هر یک از قوانین سرعت تفاضلی یا انتگرالی استفاده کرد.
مثال واکنش مرتبه اول
واکنشهای مرتبه اول بسیار رایج هستند. دو مثال از واکنشهای مرتبه اول شامل هیدرولیز آسپرین و واکنش تری بوتیل برمید با آب برای تولید تری بوتانول است که پیشتر بررسی شد. یکی دیگر از واکنشهایی که به نظر میرسد از سینتیکهای مرتبه اول پیروی میکند، هیدرولیز داروی ضدسرطان سیس- پلاتین است. فرم کلی معادله واکنش هیدرولیز پلاتین به شکل زیر است.
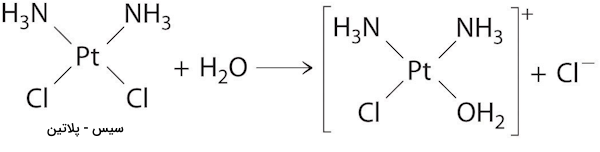
در ادامه مثالی برای درک بهتر واکنشهای مرتبه اول و روند تغییر سرعت آنها آمده است.
در دماهای بالا، اتیل کلرید، کلریدریک اسید و اتیلن تولید میکند. معادله این واکنش به صورت زیر است.
با استفاده از دادههای سرعت داده شده واکنش در دمای ۶۵۰ درجه سانتی گراد، مرتبه واکنش نسبت به غلظت اتیل کلرید را محاسبه کنید و ثابت سرعت را تعیین کنید.
| سرعت بر حسب مول بر لیتر بر ثانیه | غلظت بر حسب مول بر لیتر |
| ۱٫۶ | ۰٫۰۱ |
| ۲٫۴ | ۰٫۰۱۵ |
| ۴٫۸ | ۰٫۰۳ |
| ۶٫۴ | ۰٫۰۴ |
مرتبه واکنش نسبت به اتیل کلرید با بررسی اثر تغییرات غلظت اتیل کلرید بر سرعت واکنش تعیین میشود. مقایسه دادههای آزمایشهای مختلف نشان میدهد که تغییر در غلظت اتیل کلرید به طور مستقیم با سرعت واکنش نسبت دارد، که نشاندهنده واکنش مرتبه اول است. ثابت سرعت را با استفاده از قانون سرعت تفاضلی برای واکنش مرتبه اول و دادههای هر ردیف جدول میتوان محاسبه کرد. روش این محاسبه در ادامه نوشته شده است.
همچین میتوان با استفاده از قوانین سرعت انتگرالی میزان سرعت را برای معادله واکنشهای مرتبه اول محاسبه کرد.
فرم نمایی قانون سرعت انتگرالی برای یک واکنش مرتبه اول به شکل زیر است.
برای درک بهتر این موضوع به یک مثال دیگر توجه کنید.
اگر نمونهای از اتیل کلرید با غلظت اولیه ۰٫۰۲۰۰ M در دمای ۶۵۰ درجه سانتیگراد گرم شود، غلظت اتیل کلرید پس از ۱۰ ساعت چقدر خواهد بود؟ و چه مدت باید بگذرد تا غلظت به ۰٫۰۰۵۰ M کاهش یابد؟
با توجه به معادله سرعت انتگرالی برای واکنش مرتبه اول و جایگذاری غلظت اتیل کلراید، مقدار ثابت سرعت و زمان، میتوانیم غلظت اتیل کلراید را به دست آوریم.
این معادله میتوانست به فرم لگاریتمی نیز نوشته و حل شود و پاسخی مشابه به دست میآمد. برای محاسبه زمان لازم برای رسیدن به غلظت داده شده، باید معادله قانون سرعت انتگرالی را به فرم زیر برای زمان حل کنیم.
پس با استفاده از مقدار اولیه و ثابت سرعت داده شده، میتوان غلظت واکنش دهنده را در زمان معین محاسبه کرد. همچنین، برای تعیین زمان لازم برای رسیدن به غلظت معین، معادله سرعت انتگرالی را برای زمان حل کنید.
نمودارهای سرعت بر حسب غلظت بر اساس مرتبه واکنش
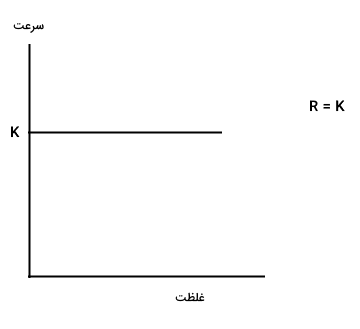
اگر مرتبه واکنش صفر باشد، سرعت واکنش، با تغییر غلظت واکنش دهندهها تغییر نمیکند و نمودار سرعت بر حسب زمان آن به شکل زیر میشود.
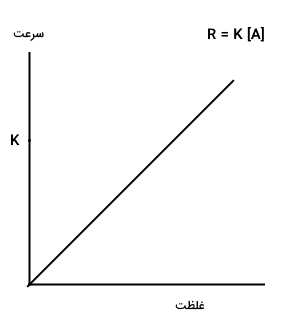
اگر مرتبه واکنش یک باشد، سرعت واکنش به صورت خطی با تغییر غلظت واکنش دهندهها تغییر میکند و نمودار سرعت آن به شکل زیر رسم میشود.
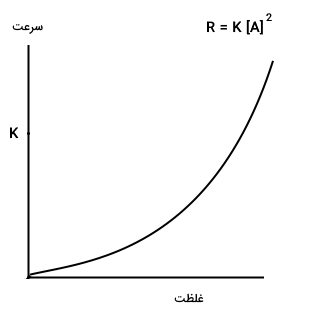
و اگر مرتبه واکنش ۲ باشد، سرعت واکنش به صورت نمایی با تغییر غلظت واکنش دهندهها تغییر خواهد کرد. نمودار سرعت بر حسب غلظت این نوع واکنشها به شکل زیر است. تاثیر غلظت بر سرعت واکنش در این واکنشها به صورت نمایی است.
اندازهگیری تجربی تاثیر غلظت روی سرعت واکنش
تا اینجا آموختیم که سرعت واکنش یک پارامتر وابسته است که از پارامترهای وابسته و غیروابسته دیگری تشکیل شده است. اگر در یک واکنش بیش از یک واکنش دهنده داشته باشیم باید تعداد پارامترهای تاثیرگذار غیروابسته در معادله سرعت را به یک کاهش دهیم.
اگر تصور کنیم که مرتبههای هر واکنش دهنده روی یکدیگر تاثیر نمیگذارند و مستقل از یکدیگرند، میتوانیم آزمایشهایی را طراحی کنیم که در آن تنها غلظت یک واکنش دهنده تغییر میکند تا بتوانیم از تغییر غلظت آن و فراورده برحسب زمان، سرعت کلی واکنش را به دست آوریم. با درست انجام دادن این آزمایش برای هریک از واکنش دهندهها به صورت جداگانه، میتوانیم مرتبه واکنش برای هریک از واکنش دهندهها را به دست آوریم.
این مسئله با طراحی یک آزمایش با تنها یک واکنش دهنده و سپس نشان دادن روش کاهش تعداد واکنش دهندهها به یک واکنش دهنده انجام میشود.
قانون سرعت برای واکنش با یک واکنش دهنده
اگر یک واکنش ساده داشته باشیم که در آن واکنش دهنده A به فراورده B تبدیل میشود، معادله واکنش و قانون سرعت به شکل زیر خواهد بود:
برای به دست آوردن مرتبه واکنش با استفاده از دادههای آزمایشگاهی، باید از روش لگاریتم استفاده کنیم. برای مثال، دادههای زیر را در نظر بگیرید و مقدار m را به دست آورید.
برای به دست آوردن مقدار m باید به روش زیر عمل کنیم:
پس در حالت کلی به این دلیل که معادله قانون سرعت یک معادله نمایی است، برای به دست آوردن مرتبه واکنش باید از لگاریتم استفاده کنیم. در معادله کلی سرعت برای به دست آوردن مرتبه واکنش m برای واکنش دهنده A از دو طرف معادله لگاریتم میگیریم.
سپس خواهیم داشت:
و
با آنتیلوگ k گرفتن از هر دو طرف، معادله زیر به دست میآید.
آزمایش ساعت یدی
یکی از آزمایشهایی که برای بررسی اثر غلظت روی سرعت انجام واکنش صورت میگیرد، آزمایش ساعت یدی است. در این آزمایش واکنش یون پرسولفات و یون ید، محصولات یون سولفات و مولکول ید خنثی را تولید میکند و انجام گرفتن واکنش از روی تشکیل رنگ آبی محلول قابل تشخیص است. واکنش این آزمایش به شکل زیر است.
در بخش اول آزمایش، معادله سرعت با بررسی تاثیر غلظت واکنشدهندهها بر روی سرعت واکنش پرسولفات-یدید تعیین خواهد شد. در بخش دوم، انرژی فعالسازی با مطالعه اثرات تغییر دما و اضافه کردن کاتالیزور به سیستم واکنش محاسبه خواهد شد.
در قسمت های قبل آموختیم که در یک معادله واکنش عمومی به شکل سرعت واکنش به وسیله معادله سرعت به دست میآید.
در اینجا، k ثابت سرعت (یا ضریب سرعت) است. n و m به ترتیب مرتبه واکنش نسبت به واکنشدهندههای A و B هستند. و مجموع n+m مرتبه کل واکنش است. برخلاف ضرایب استوکیومتری که با محاسبه به دست میآیند، مراتب واکنش بر اساس سینتیک واکنش تعیین میشوند. مراتب واکنش با مکانیسم واکنش، که توصیفی از مراحل واقعی ترکیب مولکولها است، تعریف میشوند. مراتب فقط به صورت تجربی قابل تعیین هستند.
در این آزمایش، سینتیک واکنش بین یونهای پرسولفات و یدید مورد بررسی قرار میگیرد.
سرعت واکنشها از طریق دنبال کردن ظاهر شدن یک محصول یا ناپدید شدن یک واکنشدهنده اندازهگیری میشود. در این آزمایش، سرعت مصرف ید برای تعیین سرعت واکنش اندازهگیری خواهد شد. همانطور که واکنش بالا ادامه مییابد، مقدار یدی که از این واکنش تولید میشود، با استفاده از واکنش زیر دنبال میشود.
ید تولید شده از واکنش پرسولفات-یدید بلافاصله توسط یونهای تیوسولفات کاهش یافته و به یدید تبدیل میشود. مقدار مشخصی از یونهای تیوسولفات به ظرف واکنش اضافه میشود که به نوبه خود ید را بهمحض تولید مصرف میکند. این فرایند ادامه مییابد تا تمام تیوسولفات به تتراتيونات تبدیل شود و سپس ید آزاد شروع به تشکیل شدن در محلول از طریق واکنش بالا میکند. از آنجا که مقدار تیوسولفات اضافه شده را میدانیم، میتوانیم مقدار ید تولید شده از واکنش را به صورت استوکیومتری محاسبه کنیم. هنگامی که تمام تیوسولفات مصرف شد، ید آزاد شروع به تشکیل شدن در محلول میکند. با اندازهگیری زمانی که برای مصرف مقدار مشخصی تیوسولفات صرف شده است، میتوان سرعت تولید ید در آن زمان را محاسبه کرد.
رنگ ید تشکیل شده ممکن است به قدری شدید باشد که خود به عنوان شناساگر عمل کند. با این حال، برای نتایج بهتر، به واکنش نشاسته اضافه میشود که یک کمپلکس آبی نشاسته-ید عمیق تولید میکند.

سرعت واکنش در دمای ثابت و قدرت یونی ثابت میتواند به عنوان تغییر در غلظت یک واکنشدهنده یا محصول نسبت به تغییر در زمان بیان شود و میتوان آن را با معادله قانون سرعت محاسبه کرد. برای این واکنش معادله سرعت به شکل زیر است.
در این آزمایش از روش سرعت اولیه برای یافتن مرتبه واکنش نسبت به پرسولفات (m) و مرتبه واکنش نسبت به یدید (n) استفاده میشود. با لگاریتم گرفتن از معادله سرعت و ثابت نگه داشتن غلظت اولیه هریک از یونها مراتب واکنش به دست میآیند و سپس میتوان معادله سرعت را حل کرد و مقدار سرعت واکنش را به دست آورد.
سرعت لحظهای
سرعت لحظهای یک واکنش، سرعت آن در یک نقطه از زمان انجام واکنش است. برای محاسبه سرعت لحظهای واکنش، شیب خط مماس رسم شده بر نمودار سرعت واکنش است.
تمایز بین سرعت لحظهای و میانگین سرعت واکنش مانند بررسی تفاوت بین سرعت لحظهای و میانگین سرعت یک ماشین است. سرعت میانگین، در یک بازه زمانی به دست آمده و سرعت لحظهای سرعت ماشین در همان لحظه است.
مثال
سرعت واکنش را برای معادله زیر که در دمای ۵۶ درجه سانتی گراد انجام شده است به دست آورید.
| زمان بر حسب ثانیه | غلظت مولار | غلظت مولار | غلظت مولار |
| ۲۴۰ | ۰٫۰۳۸۸ | ۰٫۰۳۱۴ | ۰٫۰۰۷۹۲ |
| ۶۰۰ | ۰٫۰۱۹۷ | ۰٫۰۶۹۹ | ۰٫۰۱۷۵ |
با توجه به معادله واکنش برای محاسبه سرعت خواهیم داشت:
با در نظر گرفتن تغییر غلظت واکنش دهنده خواهیم داشت:
پس سرعت واکنش بر اساس سرعت مصرف واکنش دهنده برابر خواهد بود با:
حال برای اطمینان، سرعت واکنش را بر اساس تولید فراوردهها نیز محاسبه میکنیم.
سرعت واکنش بر حسب سرعت تولید برابر خواهد بود با:
همچنین سرعت واکنش بر حسب تولید اکسیژن نیز برابر خواهد بود با:
به دست آوردن سرعت واکنش از روی نمودار
برای به دست آوردن سرعت از روی نمودار غلظت بر حسب زمان باید یک مماس بر منحنی نمودار رسم شود. میزان تغییرات غلظت اتفاق افتاده در زمان مشخص شده از روی نمودار مشخص میشود. میزان سرعت واکنش عبارت است از تغییرات غلظت بر حسب زمان که در واقع همان شیب خط مماس رسم شده است. این مسئله در شکل زیر توضیح داده شده است.
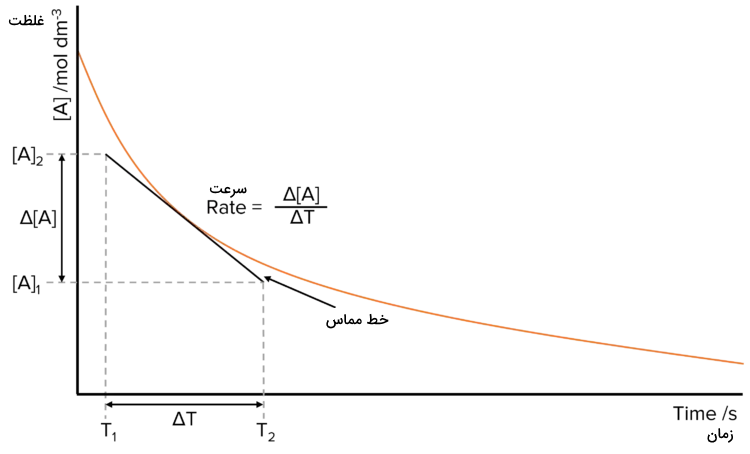
استفاده از تکنیک دو حالت
اگر اطلاعات به دست آمده از آزمایش مقادیری قطعی و مطمئن داشته باشد، میتوان از اطلاعات به دست آمده برای دو زمان متفاوت استفاده کرد و سرعت واکنش را به دست آورد. برای این کار میتوانیم با استفاده از یک غلظت اولیه سرعت اولیه را به دست آوریم و سپس این کار را برای حالت دوم تکرار کرده و نسبتی از دو حالت را به دست آوریم. بدین مرتبه میتوانیم مرتبه واکنش را بیابیم.
نظریه برخورد
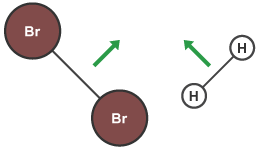
برای انجام گرفتن یک واکنش شیمیایی، مولکولهای مواد واکنش دهنده باید با انرژی کافی به یکدیگر برخورد کنند. نظریه برخورد بیان میکند هر عاملی که باعث افزایش احتمال برخورد اتمها یا مولکولها در یک واکنش شود، میتواند احتمال پیشرفت واکنش را افزایش دهد. به بیان دیگر، افزایش احتمال برخورد در یک واکنش شیمیایی، باعث افزایش سرعت میشود. به همین دلیل است که برای مثال افزایش دما یا غلظت، سرعت واکنش را افزایش میدهد. در بررسی تاثیر غلظت بر سرعت واکنشهای شیمیایی این موضوع را مشاهده می کنیم. کمترین انرژی مورد نیاز برای انجام گرفتن یک واکنش شیمیایی انرژی فعالسازی نام دارد که با نماد مشخص میشود. مثال زیر مراحل انجام یک واکنش بین مولکولهای برم و هیدروژن را بر اساس نظریه برخورد نشان میدهد.
ابتدا مولکولهای واکنش دهندهها به یکدیگر نزدیک میشوند. برای آن که این مواد بتوانند با یکدیگر واکنش دهند باید به میزان کافی انرژی اولیه داشته باشند. این انرژی برای غلبه بر نیروی پیوند بین اتمی واکنش دهندهها است.
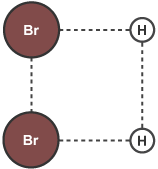
پس از برخورد مولکولها و برقراری پیوند بین مولکولهای آنها، پیوندهای بین اتمی واکنش دهندهها شروع به شکستن میکند.
سپس با تشکیل پیوندهای جدید انرژی مولکول پایین آمده و فراوردهها پایدار میشوند.
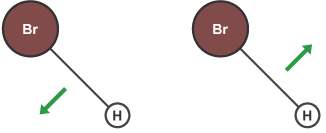
افزایش غلظت واکنش دهندهها باعث ازدیاد تعداد مولکولها در محیط واکنش و درنتیجه افزایش احتمال برخورد آنها میشود. بدین صورت افزایش غلظت واکنش دهندهها، سرعت واکنش را افزایش میدهد.
سایر عوامل تاثیرگذار بر سرعت واکنش
علاوه بر غلظت عوامل دیگری نیز میتوانند بر سرعت واکنش شیمیایی تاثیر بگذارند. در ادامه این مطلب از مجله فرادرس به این موارد پرداختهایم.
طبیعت واکنش
سرعت واکنش تا حد زیادی بر طبیعت و نوع واکنش بستگی دارد. برخی از واکنش ها به صورت طبیعی به آهستگی انجام میشوند مانند اکسیداسیون و خوردگی آهن و برخی از فرایندها با سرعت و شدت انجام میشوند مانند فرایندهای سوختن.
دما
اگر دما در طول یک واکنش شیمیایی افزایش یابد، انرژی بیشتری به ذرات واکنش منتقل شده در نتیجه جنبش مولکولی و برخورد افزایش مییابد. این مسئله باعث افزایش سرعت واکنش میشود.

اندازه ذرات
با کاهش اندازه ذرات واکنش دهنده، مساحت سطح آن افزایش مییابد. در نتیجه احتمال برخورد افزایش مییابد.
فشار
فشار واکنش دهندههایی که در فرم گازی هستند اگر افزایش یابد، احتمال برخود و درنتیجه سرعت واکنش افزایش مییابد.
استفاده از کاتالیزور
استفاده از کاتالیستها باعث میشود واکنشها در زاویهای که بیشترین احتمال برخورد را برای آنها فراهم میکند نگه داشته شوند و این باعث میشود سرعت واکنش بالاتر رود.
جمع بندی
سرعت یک واکنش شیمیایی بیان کننده سرعت تبدیل واکنشدهندهها به فراوردهها است و مستقیما قابل اندازهگیری نیست. تغییرات غلظت واکنشدهندهها یکی از اصلیترین روشهای اندازهگیری سرعت واکنش است. با استفاده از معادله سرعت و ثابت نگه داشتن همه پارامترها بجر غلظت، میتوان سرعت واکنشها را اندازهگیری کرد. بررسی تاثیر غلظت روی سرعت واکنش مبحثی بسیار مم برای بررسی و بهبود روند پروسهها در بسیاری از صنایع به شمار میآید.