الکترونگاتیوی – از صفر تا صد
الکترونگاتیوی یک خاصیت شیمیایی و بیانگر تمایل یک اتم به جذب جفت الکترون اشتراکی به سمت خود است. الکترونگاتیوی یک اتم با عدد اتمی و فاصله الکترون لایه آخر از هسته ارتباط دارد. هرقدر الکترونگاتیوی بیشتر باشد، میزان جذب الکترون در یک اتم یا «گروههای جانشین» (Substituent) نیز بیشتر است. در مباحث پایه، الکترونگاتیوی با عواملی همچون بار هسته و تعداد الکترونها در اوربیتالهای اتم توصیف میشود. به بیان بهتر، هرقدر یک اتم، پروتون بیشتری داشته باشد، میزان نیرو برای جذب الکترون در آن بیشتر است و به همین صورت هرقدر یک اتم الکترون بیشتری داشته باشد، این الکترونها در فواصل بیشتری از هسته قرار دارند و تاثیر کمتری از بار مثبت هسته میگیرند.


مفهوم مقابل الکترونگاتیوی، «الکتروپوزتیوی» (Electropositivity) است که معیاری برای سنجش توانایی یک عنصر برای به اشتراک گذاشتن الکترونها است. نافلزات خصلت نافلزی و تمایل به جذب الکترون (الکترونگاتیوی) بالایی دارند.

مطالعات اولیه
این مفهوم توسط دانشمندان بسیاری همچون آووگادرو مطالعه شده بود اما اولین بار در سال 1811 توسط «جونس یاکوب برزیلیوس» (Jöns Jacob Berzelius) ارائه شد. با توسعه نظریه پیوندهای والانسی، در سال 1932، مقیاسهای دقیق الکترونگاتیوی به عنوان یک مفهوم از پیوندهای والانسی، توسط «لاینس پاولینگ» (Linus Pauling) پیشنهاد شد که وابسته به انرژیهای پیوند بود.
این مقیاس روابطی را با خواص شیمیایی دیگر عناصر بیان میکرد که به طور مستقیم قابل اندازهگیری نبود و باید از طریق دیگر خواص فیزیکی و مولکولی محاسبه میشد. روشهای مختلفی برای اندازهگیری و مقایسه الکترونگاتیوی بیان شده است که همگی با اختلاف کم، وجود روندهای تناوبی بین عناصر را تایید میکنند.

معروفترین روش اندازهگیری الکترونگاتیوی، توسط لاینس پاولینگ معرفی شد. این مقیاس شامل یک مقدار بدون بعد، معروف به مقیاس پاولینگ، از 0/79 تا 3/98 است. در این میان، الکترونگاتیوی هیدروژن برابر با 2/20 ذکر شده است.
بیان بهتر الکترونگاتیوی
علیرغم مفهوم کلی، الکترونگاتیوی خاصیت یک اتمِ تنها نیست، بلکه خاصیت یک اتم در مولکول است. خواص یک اتم در بیشتر مواقع شامل انرژی یونش و الکترونخواهی است. انتظار میرود که مقدار الکترونگاتیوی یک عنصر در ارتباط با فضاهای مختلف شیمیایی متفاوت باشد، اما به طور معمول این مقدار متفاوت به عنوان یک عدد ثابت در نظر گرفته میشود.
کمترین و بیشترین میزان الکترونگاتیوی
سزیم، یک فلز قلیایی با کمترین میزان الکترونگاتیوی (0/79) و فلوئور، یک هالوژن با بیشترین الکترونگاتیوی (3/98) است. در ابتدا میزان الکترونگاتیوی هر دو عنصر سزیم و فرانسیم، 0/7 در نظر گرفته شده بود. بعدها مقدار دقیقتر 0/79 برای سزیم گزارش شد اما هیچ مقدار دقیقی در دادههای آزمایشگاهی برای فرانسیم ذکر نشد.
البته فرانسیم به سبب پایداری کوانتومی بیشتر، انرژی یونش بیشتری دارد که این امر بیانگر الکترونگاتیوی بیشتر از سزیم است.
روش محاسبه الکترونگاتیوی
در سال 1932، پاولینگ مفهوم الکترونگاتیوی را اینگونه بیان کرد که پیوندهای کووالانسی بین دو اتم مختلف A و B، از متوسط قدرت پیوندهای دو اتم مشابه (A_A) و (B-B) بیشتر است. بر اساس نظریه پیوندهای والانسی، پایداری بیشتر موکولهای دو اتمی (یا بیشتر) به دلیل سهم «ساختار یونی» (Ionic Canoncial Form) در پیوند است.
در نهایت، تفاوت الکترونگاتیوی بین دو اتم A و B به صورت زیر بیان شد:
در این رابطه:
- : انرژی تفکیک پیوندهای A_B، A_A و B_B بر حسب الکترونولت است.
- ضریب به منظور بدون بعد کردن رابطه آورده شده است.
از آنجایی که تفاوت کمی در مقادیر اندازهگیری شده این خاصیت با روشهای مختلف وجود دارد، بنابراین در بیان این مقیاس، به یک سری مقادیر قراردادی نیاز است. با توجه به اینکه هیدروژن با بسیاری از عناصر دیگر، پیوندهای هیدروژنی تشکیل میدهد، الکترونگاتیوی آن به عنوان مرجع در نظر گرفته شد. این عدد در ابتدا 2/1، و سپس 2/20 ذکر شد.
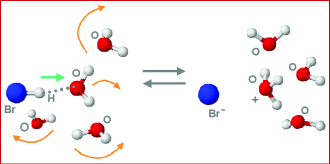
علاوه بر این، باید در نظر گرفت که کدام عنصر الکترونگاتیوتر است. معمولا برای این کار از یک شم (حس) شیمیایی استفاده میشود. به طور مثال در خصوص «هیدروژن برمید» (Hydrogen Bromide) میتوان در نظر گرفت که با حل آن در آب به یونهای و تبدیل و فرض میشود که برمید الکترونگاتیوتر از هیدروژن است. اما به توجه به اینکه به همین شکل باید برای دیگر پیوندها مفروضاتی در نظر گرفته شود، احتمال وجود خطا در محاسبات بیشتر میشود. بنابراین استفاده از مقادیر قراردادی برای هیدروژن و فلوئور برای دستیابی به یک عدد معین توصیه میشود.
محاسبه الکترونگاتیوی پاولینگ
برای محاسبه الکترونگاتیوی پاولینگِ یک عنصر، به انرژیهای تفکیک پیوند حداقل دو نوع از پیوندهای کووالانسی آن عنصرها نیاز است. در این خصوص، دادههای پاولینگ برای استفاده بهتر در ترمودینامیک، توسط «آلرد» (A. L. Allred) بهبود داده شد. امروزه بیشتر از این مقادیر در رابطه استفاده میشود.
از نقاط قوت معادله پاولینگ باید به رابطه نسبتا دقیق برای انرژیهای تفکیک پیوند اشاره کرد:
که با یک تقریب دقیق میتوان آن را به صورت زیر نمایش داد:
رابطه بالا یک معادله با تقریب دقیق است. پاولینگ در دستیابی این معادله بیان کرد که یک پیوند به طور تقریبی میتواند به صورت مجموع آثار مکانیک کوانتومی یک پیوند کووالانسی و دو پیوند یونی بیان شود. به بیان دقیقتر، الکترونگاتیوی حاصل جمع دو انرژی است: انرژی کووالانسی یک پیوند و انرژی خواص یونی. انرژی کووالانسی یک پیوند در مولکول - که از طریق محاسبات مکانیک کوانتومی بدست میآید - میانگین هندسی دو انرژی کووالانسی پیوند در یک مولکول است. علاوه بر این، انرژی دیگری از خواص یونی عنصرها وجود دارد که میتوان به عنوان نمونه به خاصیت قطبی یک پیوند اشاره کرد.
در حقیقت میانگین هندسی (رابطه دوم)، تقریبا با میانگین حسابی (رابطه اول)، برابر است. این حالت زمانی بوجود میآید که مقادیر انرژیهای تفکیک با یکدیگر اختلاف کمی داشته باشند. زمانی که این مقادیر اختلاف زیادی با یکدیگر داشته باشند از میانگین هندسی استفاده میشود که جواب دقیقتری بدست میدهد.

رابطه الکترونگاتیوی با خواص دیگر
الکترونگاتیوی بیشتر در توصیف قطبیت یک پیوند کاربرد دارد. به طور کلی، هرقدر اختلاف الکترونگاتیوی بین دو اتم بیشتر باشد، قطبیت پیوند حاصل از آن دو اتم بیشتر است. اتم با الکترونگاتیوی بیشتر، سر منفی پیوند را تشکیل میدهد. روابط متعددی بین اسپکتروسکوپی اشعه فروسرخ پیوندها و الکترونگاتیوی بیان شده است. تمامی اندازهگیریها با چگالی الکترون اوربیتال s در هسته ارتباط دارد. این مقادیر نشان میدهد که الکترونگاتیوی، توانایی اتم در یک مولکول، برای جذب الکترون به سمت خود است.
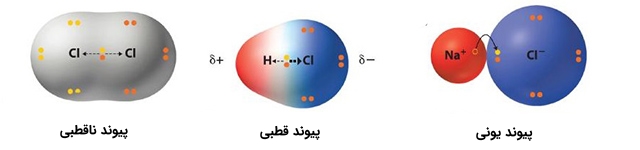
پیوند دو اتم با الکترونگاتیوی یکسان
در صورتی که دو اتم با الکترونگاتیوی یکسان با یکدیگر پیوند تشکیل دهند، تمایل هر دو اتم برای جذب الکترونهای پیوندی یکسان است. این نوع از پیوند به عنوان پیوند کووالانسی خالص شناخته میشود که در آن، الکترونها به طور مساوی بین دو اتم به اشتراک گذاشته شدهاند.

پیوند یک اتم با مقدار جزئی الکترونگاتیوی بیشتر
اگر اتمی مانند B وجود داشته باشد که الکترونگاتیوی بیشتری نسبت به اتم A داشته باشد، در این صورت، مولکول شامل یک سر مثبت و یک سر منفی خواهد بود. بخش منفی مربوط به اتم با مقدار بیشتر الکترونگاتیوی و بخش مثبت مربوط به اتم با مقدار کمتر است. در حقیقت در این نوع از پیوند، اتمهای A و B دارای مقداری جزئی بار مثبت و منفی هستند. پیوند کووالانسی این نوع از پیوند را شامل میشوند.

اگر در شرایطی، اتم B نسبت به اتم A به شدت الکترونگاتیو باشد، به تبع آن، جفت الکترون پیوندی به سمت اتم B کشیده میشود. به بیان بهتر، اتم A الکترون خود را از دست میدهد و اتم B کنترل کاملی بر الکترونها دارد. در این شرایط یونها و همینطور پیوند یونی تشکیل میشود.
روندهای تناوبی
فاصله الکترونها از هسته در هر ردیف از جدول تناوبی تقریبا ثابت است؛ اما این مقدار در هر ستون یکسان نیست. نیروی وارد شده بین دو بار الکتریکی از رابطه زیر، موسوم به قانون کولن محاسبه میشود:
- = بار الکتریکی
- = فاصله بین دو بار الکتریکی
- = یک عدد ثابت
با بررسی رابطه بالا میتوان دریافت که با افزایش فاصله بین دو بار الکتریکی، نیروی وارد شده بین آنها به شدت کاهش مییابد. به طور کلی در هر تناوب از چپ به راست، الکترونگاتیوی افزایش و در هر گروه جدول تناوبی از بالا به پایین کاهش پیدا میکند. با در نظر نگرفتن گازهای نجیب، فلوئور دارای بیشترین الکترونگاتیوی و سزیم کمترین در بین عناصر است. با این تعریف، «سزیم فلوراید» ترکیبی با بیشترین خاصیت پیوند یونی است.
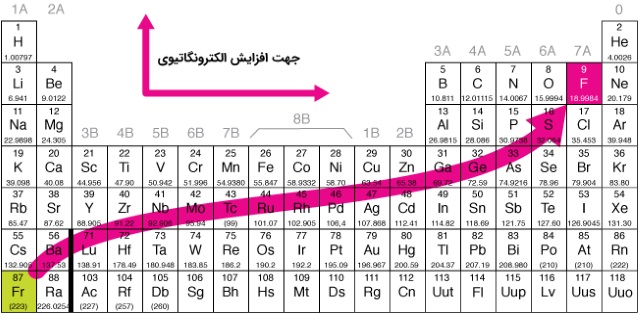
روند کلی برای این خاصیت در جدول تناوبی به صورت قطری از چپ به طرف راست است. این قانون برای همه عناصر صدق نمیکند. گالیم و ژرمانیم به ترتیب الکترونگاتیوی بیشتری از آلومینیوم و سزیم دارند. این خاصیت به دلیل آرایش الکترونی کامل در بلوک d این عناصر قابل توصیف است. الکترونگاتیوی شدید سرب در مقایسه با تالیم و بیسموت، حاصل تغییرات الکترونگاتیوی بر اساس عدد اکسایش است. اگر عدد اکسایش این عنصر را در نظر بگیریم، توجیه بهتری برای الکترونگاتیوی نسبت به در نظر گرفتن عدد بدست میآید.
با توجه به اینکه روندها در برخی موارد شامل استثناء است، میتوان رابطه زیر را در خصوص الکترونگاتیوی عناصر از فلوئور تا فلزات به خاطر سپرد:
فلزات
عوامل روندهای تناوبی
میزان تمایل الکترونها برای جذب شدن به هسته و تشکیل پیوند به عوامل زیر بستگی دارد:
- تعداد پروتونهای هسته
- فاصله الکترون از هسته
- میزان پوشش توسط الکترونهای لایههای داخلی
دلیل افزایش الکترونگاتیوی در هر دوره تناوب
سدیم و کلر را در ابتدا و انتهای تناوب سوم جدول تناوبی و پیوند سدیم کلرید را به عنوان یک پیوند قطبی در نظر بگیرید. هسته کلر ۶ پروتون بیشتر از سدیم دارد. با توجه به این موضوع، طبیعی است که جفت الکترون پیوندی به سمت کلر جذب شود و در ازای آن یون تشکیل شود. به بیان بهتر، این خاصیت در هر تناوب از چپ به راست افزایش پیدا میکند زیرا به همان نسبت میزان بار مثبت هسته افزایش مییابد.
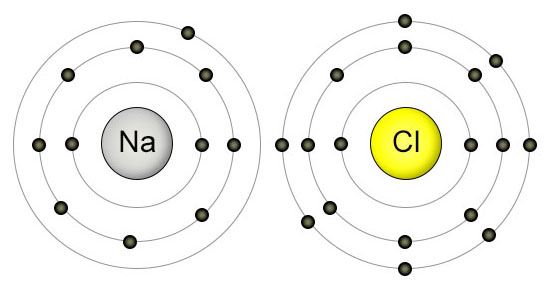
دلیل کاهش الکترونگاتیوی در هر گروه از بالا به پایین
با حرکت از بالا به پایین در هر گروه، فاصله الکترونهای پیوندی از هسته بیشتر میشود. مولکولهای و را در نظر بگیرید. الکترونهای پیوندی در مولکول تنها توسط الکترونهای پوشیده میشوند. اما در خصوص هیدروژن کلرید، الکترونهای پیوندی توسط لایههای پوشیده میشوند. در هر مورد، نوعی کشش از طرف هسته برای جذب الکترون وجود دارد و هر دو عنصر فلوئور و کلر تنها نیازمند یک الکترون برای رسیدن به پایداری هستند. با توجه به لایههای بیشتری که در مقابل الکترون پیوندی برای اتم کلر در مقایسه با فلوئور وجود دارد، میتوان نتیجه گرفت هر قدر الکترونها به هسته نزدیکتر باشند، میزان جذب الکترون و الکترونگاتیوی بیشتر است.
تغییرات الکترونگاتیوی با عدد اکسایش
در شیمی غیرآلی، بیشتر مواقع میتوان یک عدد ثابت را برای مقادیر الکترونگاتیوی در نظر گرفت. اگرچه این روش سبب سادگی محاسبات میشود اما واضح است که الکترونگاتیوی یک عنصر عددی متغیر است و با افزایش عدد اکسایش، بر مقدار آن افزوده میشود. «آلرد» (Allred) از روش پاولینگ در محاسبه الکترونگاتیوی عناصر با اعداد اکسایش مختلف استفاده کرد. با این وجود، ترکیبات متنوع کووالانسی که انرژی تفکیک پیوند در آنها شناخته شده باشند وجود نداشت تا این مطالعات کاملتر شوند. میتوان نتیجه گرفت که هرقدر عدد اکسایش بالاتر باشد، خاصیت اسیدی بیشتر و هرقدر عدد اکسایش پایینتر باشد خاصیت اسیدی کمتر است.

افزایش الکترونگاتیوی با عدد اکسایش بویژه در ساختار و خاصیت اسیدی اکسیدها و هالیدها قابل مشاهده است. در این خصوص، و اکسیدهای اسیدی با نقطه ذوب پایین هستند در حالیکه ، یک آمفوتر و یک اکسید بازی است.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:













با تشکر ،ایا میتونیم بگیم که رابطه مستقیم بین الکترونگاتیوی و الکترون خواهی وجود داره ،یعنی اینکه عنصری که انرژی بیشتری در الکترون خواهی ازاد میکنه الکترونگاتیوی بیشتر دارد و برعکس؟یعنی ایا این دو عنوان با یکدیگر معادل و هم ارز هستند
ممنون
سلام و روز شما بهخیر؛
در بسیاری موارد مفهوم الکترونگاتیوی و الکترونخواهی به جای یکدیگر گرفته میشوند اما باید به تفاوت این دو دقت کرد. اولین تفاوت این دو مفهوم این است که الکترونگاتیوی توانایی یک الکترون برای جذب به یک اتم اما الکترونخواهی مربوط به آزاد شدن انرژی در زمان افزوده شدن یک الکترون به اتم است. این دو مفهوم بسیار نزدیک به یکدیگر هستند اما نمیتوان آنها را به جای یکدیگر به کار گرفت. هرچند که هر دو به حرکت الکترون مرتبط هستند اما الکترونخواهی در نتیجه تغییر در مقادیر انرژی به وجود میآید.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس
عالی بود ممنونم
فقط کلا مقالا فرادرس در عین حال که می تونه ساده فهم تر باشه سخت فهمه
بازم ممنون عالی بود …
سلام در کتاب شیمی دوازدهم این ترتیب رو به صورت زیر آورده
F>O>N>Cl>Br>I>C>H
ولی شما Cl رو بیشتر از N قرار دادید
کدوم درسته ؟
با سلام؛
الکترونگاتیوی کلر از نیتروژن بیشتر است. با وجود این، برای پاسخ به سوالات، حتما از کتاب درسی به عنوان منبع اصلی امتحانات مدارس استفاده کنید.
با تشکر از همراهی شما با مجله فرادرس
عالی بود . مرسی ممنونم . به خصوص تیکه آخر که متوجه شدم الکترونگاتیوی با شعاع اتمی رابطه عکس داره و با انرژی یونش رابطه مستقیم داره
بسیار بسیار ممنونم