ppm چیست و چطور اندازه گیری می شود؟ – به زبان ساده + تعریف و فرمول
ppm بیانگر قسمت در میلیون و یکی از واحدهای اندازهگیری است. واحد ppm یا واحد «قسمت در میلیون» معمولا برای اندازهگیری غلظت مواد مختلف بیان میشود. این واحد همچنین میتواند برای اندازهگیریهای مربوط به جرم نیز استفاده شود. این مقدار که واحد بسیار کوچکی است در بسیاری از زمینههای آزمایشگاهی و صنعتی برای مشخص کردن غلظت مواد مختلف استفاده میشود. یک قسمت در یک میلیون در بیان غلظت یعنی یک قسمت ماده حلشونده در یک میلیون قسمت ماده محلول وجود دارد. عبارت «قسمت در» یک کمیت بدون واحد است. در این مطلب از مجله فرادرس میآموزیم ppm چیست و روشهای تبدیل و حل مسئله آن به چه صورت است.
- مفهوم ppm و جایگاه آن در اندازهگیری غلظت را یاد میگیرید.
- فرمول محاسبه ppm و روش جایگذاری مقادیر را خواهید آموخت.
- مهارت تبدیل ppm به دیگر واحدهای غلظت را کسب میکنید.
- فرایند حل مسائل عددی ppm را با مثالهای کاربردی تمرین میکنید.
- روش تبدیل ppm و مولاریته با استفاده از جرم مولی را میآموزید.
- با شیوههای سنجش ppm در آزمایشگاه و صنعت آشنا میشوید.


در این مطلب ابتدا با مفهوم واحد اندازهگیری ppm آشنا میشویم و میآموزیم ppm چیست و با چه واحدهای اندازهگیری از غلظت بیان میشود. سپس محاسبات مربوط به واحد ppm را بررسی میکنیم. بعد از آن برای آشنایی با محاسبات مربوط به ppm، روش تبدیل این واحد را به واحدهای دیگر اندازهگیری غلظت توضیح میدهیم. در ادامه مثالهایی را برای درک این محاسبات ارائه میکنیم. پس از آن از اهمیت شناخت ppm صحبت میکنیم و میآموزیم محاسبه ppm در چه مواردی و برای چه اندازهگیریهایی کاربرد دارد. در نهایت کاربرد این واحد اندازهگیری را در صنایع مختلف نام میبریم. با مطالعه این مطلب تا انتها با این واحد مهم آشنا شوید و انجام محاسبات مربوط به آن را بیاموزید.
ppm چیست؟
غلظت یکی از راههای بیان کردن این موضوع است که چه میزان از ماده حلشونده در ذرات محلول وجود دارد. در بسیاری از زمینههای شیمیایی و محیط زیستی، اندازهگیری انواع غلظت برخی از مواد بسیار مهم است و گاهی این کمیتهای اندازهگیری شده واحدی بسیار کوچک دارند. غلظت در میلیون یا ppm یکی از واحدهای اندازهگیری مواد است که در این زمینهها کاربرد دارد. ppm بیان میکند که در یک میلیون واحد از یک محلول چه مقدار حلشونده وجود دارد.
برای بیان غلظت محلولها، استفاده از کمیت ppm برای بیان واحدهایی مانند واحدهای زیر ترجیح داده میشود.
- میکرو حجم به حجم
- میکلرولیتر بر لیتر
- میلیگرم بر کیلوگرم
- میکرومول بر مول
- میکرومتر بر متر
- میلیگرم بر لیتر
تمامی این مواد نشاندهنده نسبت قسمت در میلیون هستند و میتوان به جای آنها از واحد ppm استفاده کرد. در علم شیمی از عبارت « قسمت در میلیون» بیشتر برای بیان واحد کمیتهای ماده حلشونده در محلولهای رقیق استفاده میشود. مفهوم این واحد به تنهایی مبهم است و جزء واحدهای سیستم استتاندارد SI محسوب نمیشود. علت مبهم بودن این مفهوم به تنهایی این است که غلظت بیان شده بر حسب ppm به واحدهای اصلی غلظت اندازهگیری شده بستگی دارد. برای مثال اگر بیان کنیم محلول ۱ ppm سدیم کلرید، مشخص نیست که غلظت محلول سدیم کلرید با کدام یک از واحدهای مولاریته، نرمالیته، غلظت حجمی حجمی و ... اندازهگیری شده است.
به دلیل اینکه صورت و مخرج این کسر معمولا از یک نوع واحد اندازهگیری هستند،این کمیت خود بدون واحد است. واحدهای دیگری نیز مانند ppth، ppb و ppt برای اندازهگیری مقادیر بسیار کم حلشونده در محلولهای مختلف استفاده میشوند. در جدول پایین این واحدهای اندازهگیری به همراه ضریبهای آنها معرفی شدهاند.
| نام واحد | علامت واحد | ضریب واحد |
| درصد | ٪ | |
| قسمت در هزار | ppth | |
| قسمت در میلیون | ppm | |
| قسمت در میلیارد | ppb | |
| قسمت در تریلیون | ppt |
فرمول ppm
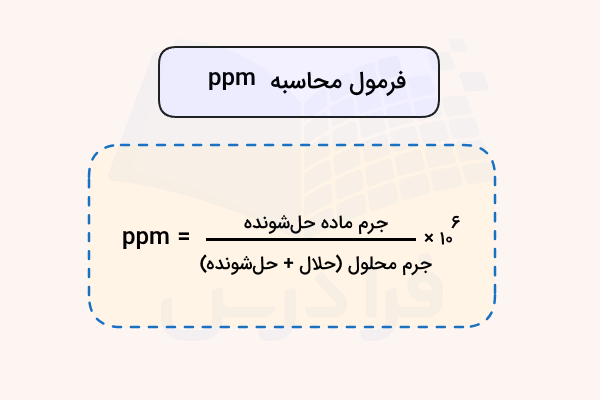
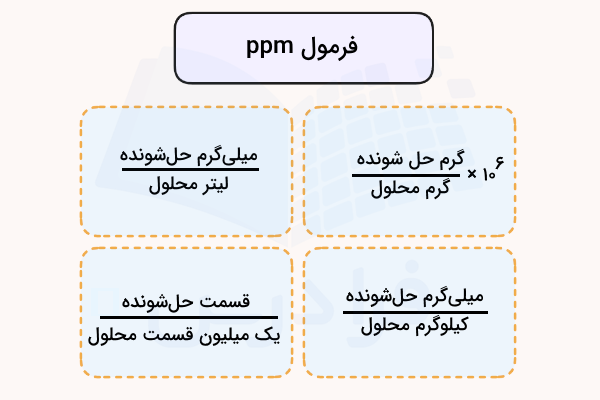
همانطور که قبلا اشاره شد ppm یک کمیت بدون واحد است و برای بیان واحدهای غلظت مواد مختلف استفاده میشود. کلیترین فرمول محاسبه غلظت یک ماده بر حسب ppm این است که یک ذره از حلشونده را در یک میلیون ذره در محلول درنظر بگیریم. بر اساس این تعریف فرمول ppm بر حسب گرم یا میلیلیتر حلشونده و محلول به شکل زیر نوشته میشود.
در فرمول بالا عبارت «solute» بیانگر ماده حلشونده و «solution» بیانگر محلول است.
محاسبات ppm
در قسمتهای قبلی آموختیم که ppm چیست و چگونه برای بیان واحد غلظت محلولهای مختلف بهکار برده میشود. در محاسبات مربوط به غلظت باید به این نکته که غلظت در واقع مقدار ماده حلشونده تقسیم بر مقدار محلول است توجه داشته باشیم. برای درک بهتر مفهوم ppm، محاسبات به دست آوردن ppm را برای مواد مختلف در واحد حجم و جرم بررسی میکنیم. برای یادگیری محاسبات مربوط به ppm به مثال زیر توجه کنید.
برای مثال تصور کنید ۱ لیتر آب داریم که ۰٫۲ گرم نمک در آن حل شده است. برای به دست آوردن ppm این محلول ابتدا باید مقادیر واحدها را یکی کنیم. از آنجا که یک لیتر آب برابر با ۱ کیلوگرم آب است (چگالی آب برابر با ۱ کیلوگرم بر لیتر است)، میتوانیم محاسبات زیر را در نظر بگیریم.
غلظت نمک بر حسب گرم نمک بر گرم آب به روش زیر محاسبه میشود.
حال برای تبدیل این واحد به ppm کافی است آن را در واحد ppm یعنی ضرب کنیم. پس خواهیم داشت:

یادگیری واحد ppm با فرادرس
واحد اندازهگیری ppm یکی از مهمترین واحدهای اندازهگیری غلظت است که در بسیاری از محاسبات مربوط به واکنشهای شیمیایی خصوصا در بخش بررسی محلولها بیان و استفاده میشود. برای یادگیری و استفاده درست این موضوع که ppm چیست باید با انحلالپذیری مواد ، روشهای بیان غلظت مواد و غلظت کلی محلولها آشنا شوید. همچنین شناخت یونهای چند اتمی، انحلال ترکیبات یونی در آب از مباحث مهم برای شناخت ppm و دیگر واحدهای غلظت هستند. پیشنهاد میکنیم برای یادگیری این مفاهیم به مجموعه فیلم آموزش دروس پایه دهم فرادرس، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح و بررسی این مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در زیر آمده است میتوانید به آموزشهای بیشتری در زمینه واحد اندازهگیری ppm دسترسی داشته باشید.
- فیلم آموزش محلول سازی در آزمایشگاه
- فیلم آموزش آشنایی با تصفیه آب به روش اسمز معکوس RO با نرم افزار روزا ROSA
- فیلم آموزش شیمی دبیرستان نکته و حل تست کنکور
تبدیل واحد ppm به سایر واحدها
واحد ppm یکی از پرکاربردترین واحدهای اندازهگیری غلظت است. به همین دلیل، پس از یادگیری این وضوع که ppm چیست، یادگیری تبدیل این واحد به سایر واحدها بسیار حائز اهمیت است. در ادامه روش انجام این تبدیل واحدها را بررسی میکنیم.
تبدیل واحد ppm و گرم حلشونده بر حلال
برای تبدیل واحد ppm به واحد گرم حلشونده بر گرم حلال باید آن را در ضرب کنیم. اگر نسبت گرم حلشونده بر حلال را در عدد ۱۰۰ ضرب کنیم، میزان درصد جرمی ماده حلشونده به دست میآید.
مثال تبدیل ppm به درصد جرمی
مقدار درصد جرم آب اکسیژنه در یک محلول با ۱٫۶۷ گرم آب اکسیزنه و ۵۵٫۳۵ گرم نمونه چقدر است؟ این مقدار را بر حسب ppm نیز به دست آورید.
پاسخ
در به دست آوردن درصد جرمی مواد، باید میزان گرم ماده حلشونده را بر گرم محلول تقسیم کرده و در ۱۰۰ ضرب کنیم. پس برای حل این سوال خواهیم داشت:
و برای به دست آوردن غلظت بر حسب ppm باید کسر جرم حلشونده بر جرم محلول در یک میلیون ضرب شود.
با توجه به این مثال میتوانید به رابطه بین درصد جرمی و ppm نیز پی ببرید. برای تبدیل درصد جرمی به ppm کافی است آن را در عدد ۱۰۰۰۰ ضرب کنیم.

تبدیل واحد ppm و میلیگرم بر لیتر
در برخی از مسائل غلظت محلول بر حسب میلیگرم یا گرم بر لیتر بیان شده است. حال میخواهیم بررسی کنیم روش تبدیل این واحدها به ppm چیست. در مسائلی که میزان غلظت بر حسب گرم بر لیتر خواسته شده است و چگالی محلول برابر با چگالی آب (۱ گرم بر میلی لیتر) در نظر گرفته شده، میزن ppm میتواند با میلیگرم حلشونده بر لیتر محلول برابر در نظر گرفته شود.
برای تبدیل ppm به گرم مواد کسر گرم حلشونده «solute» به گرم محلول «solution» را طبق معادله زیر بررسی کردیم.
از آنجا که هر ۱۰۰۰ گرم آب برابر با ۱ لیتر آب است (چگالی آب برابر با ۱ گرم بر میلیلیتر است) فرمول محاسبه ppm به شکل زیر درمیآید.
پس واحد ppm برابر با میلیگرم ماده حلشونده بر ۱ لیتر محلول(آب) خواهد بود.

مثال تبدیل واحد ppm و میلیگرم بر لیتر
یک دانشآموز، محلولی ۵۰۰ میلیلیتری از محلول ۶۰۰ ppm ساکارز آماده کرده است. چه حجمی از این محلول میزان ۰٫۱۵ گرم ساکارز خواهد داشت؟
پاسخ
در قسمتهای قبل آموختیم که میزان ppm با میزان میلیگرم حلشونده در ۱ لیتر محلول برابر است. برای حل این مسئله ابتدا باید میزان گرم ساکارز را به میلیگرم تبدیل کنیم تا بتوانیم با استفاده از فرمول ppm میزان حجم را به دست آوریم.
با توجه به فرمول، ۶۰۰ ppm برابر با ۶۰۰ میلیگرم حلشونده بر لیتر حلال است. پس میتوان حجم حلال برای ۱۵۰ میلیگرم حلشونده را به راحتی محاسبه کرد.
حال تنها باید حجمی که به لیتر به دست آوردهایم را به میلیلیتر تبدیل کنیم.
تبدیل واحد ppm و درصد
برای تبدیل واحد درصد حجمی یا جرمی به ppm باید آن را در عدد ۱۰۰۰۰ ضرب کنیم. محاسبات این تبدیل واحد در ادامه توضیح داده شده است.
به همین ترتیب برای تبدیل ppm به واحد درصد باید مقدار ppm را بر ۱۰۰۰۰ تقسیم کنیم.
مثال تبدیل واحد ppm و درصد
یک محلول آزمایشگاهی ۱۲٪ حجمی اتانول دارد. غلظت اتانول این محلول بر حسب ppm چیست؟
پاسخ
میزان اتانول این محلول ۱۲ واحد حجمی (میلیلیتر، لیتر و ...) در هر واحد حجم حلال (میلیلیتر، لیتر و ...) است. این غلظت بر حسب درصد بیان شده است. طبق معادلات زیر به راحتی میتوانیم میزان غلظت اتانول این محلول را بر حسب ppm به دست اوریم.
در فرمول بالا عبارت «percentage (v/v)» بیانگر درصد حجمی است. پس برای حل این مثال کافی است میزان درصد حجمی را در ۱۰۰۰۰ ضرب کنیم.
تبدیل واحد ppm و مول بر لیتر
برای این تبدیل واحد باید بدانیم که غلظت مولی یا مول بر لیتر محلولها یکی از مهمترین واحدهای بیان غلظت است. در این محاسبات اگر میزان ماده حل شده بر حسب گرم داده شده باشد باید از کمیت جرم مولی ترکیبات برای به دست آوردن تعداد مول آنها استفاده کنیم. این محاسبات در ادامه توضیح داده شدهاند.
در قسمتهای قبل بیان کردیم که میزان ppm میتواند برابر با واحد میلیگرم بر لیتر مواد در نظر گرفته شود. مقدار جرم مولی هر ماده میزان گرم ان بر تعداد مول آن است.
حال با استفاده از تعریف مولاریته که مول ماده حلشونده بر لیتر است و با توجه به واحد میلیگرم بر لیتر ماده که برابر با ppm است میتوانیم به کسر زیر برسیم.
در عبارت بالا منظور از molarity غلظت مولار و molar mass جرم مولی است.
به همین ترتیب برای تبدیل مولاریته به ppm مطابق فرمول زیر عمل میکنیم.
مثال تبدیل واحد ppm و مولاریته
میزان غلظت یک محلول ۰٫۰۱ مولار کلسیم کربنات بر حسب ppm چیست؟
برای تبدیل غلظت مولاریته کلسیم کربنات ابتدا باید میزان جرم مولی آن را محاسبه کنیم. با توجه به جدول تناوبی جرم مولی اتمهای کربن، کلسیم و هیدروژن را به دست اورده و میزان جرم مولی کلسیم کربنات را محاسبه میکنیم.
حال با توجه به جرم مولی کلسیم کربنات و غلظت مول بر لیتر آن میتوانیم میزان جرم کلسیم کربنات هر لیتر محلول را محاسبه کنیم.
در قسمتهای قبلی آموختیم غلظت ppm برابر با میلیگرم حلشونده بر لیتر حلال است. حال با داشتن غلظت گرم بر لیتر حلال کافی است میزان گرم را با ضرب کردن در ۱۰۰۰ به میلیگرم تبدیل کنیم.

جدول تبدیل واحد ppm
در ادامه جدولی برای آشنایی با این موضوع که ppm چیست و تبدیل واحدهای مختلف مربوط به ppm چیست، ارائه شده است.
| نوع تبدیل واحد | فرمول تبدیل واحد |
| تبدیل ppm به ppb | |
| تبدیل ppm به ppt | |
| تبدیل ppm به درصد | $$\text{%}= \frac{\text{ppm}}{10^6}$$ |
| تبدیل ppm به میلیگرم بر لیتر | |
| تبدیل ppm به گرم بر لیتر | |
| تبدیل ppm به میلیگرم بر کیلوگرم | |
| تبدیل ppm به مولاریته | بسته به جرم مولی تغییر میکند |
مثال های ppm
در ادامه مثالهای بیشتری را برای درک محاسبات مربوط به ppm ارائه میکنیم.
مثال ۱
میزان فلوئورید آب لولهکشی برابر با ۴٫۰ ppm است. میزان فلوراید مصرفی انسان اگر بیش از ۵ گرم شود، باعث مسمومیت میشود. با فرض اینکه آب مصرف شده در بدن باقی بماند و یک فرد در هر روز ۶ لیوان آب (هر لیوان ۰٫۴ لیتر) مصرف کند، چند روز زمان میبرد تا مصرف او به ۵ گرم فلوئورید کلی برسد؟
پاسخ
میزان فلوراید آب برابر با ۴ ppm است این بدان معنی است که در هر ۱ میلیون گرم آب میزان ۴ گرم فلوئورید وجود دارد. برای محاسبه میزان فلوئورید هر لیتر آب به شکل زیر عمل میکنیم.
پس درهر لیتر آب میزان ۰٫۰۰۴ گرم فلوراید وجود دارد. سپس باید میزان لیتر آب مصرف شده در هر روز را محاسبه کنیم و میزان فلوراید مصرفی هر روز را به دست بیاوریم.
پس در هر روز میزان ۲٫۴ لیتر آب مصرف میشود که حاوی ۰٫۰۰۹۶ گرم فلوراید است. در نهایت میزان ۵ گرم را بر این مقدار تقسیم میکنیم و تعداد روزها به دست میآید.

مثال ۲
یک نمونه ۵۰ گرمی از فاضلاب حاوی ۰٫۴۸ میلیگرم جیوه بوده است. غلظت جیوه بر حسب ppm و ppb چیست؟
پاسخ
میزان ppm جیوه برابر با جرم جیوه در یک میلیون جرم نمونه است. ابتدا، جرم جیوه را به گرم تبدیل میکنیم و سپس آن را بر جرم نمونه تقسیم کرده و در ضرب میکنیم تا غلظت بر حسب ppm به دست اید.
برای محاسبه ppb نیز به همین روش اقدام میکنیم. و گرم به دست آمده را در یک میلیارد ضرب میکنیم.

مثال ۳
اگر میزان ۱٫۳ میلیگرم سلینم در ۲۵۰۰ کیلوگرم خاک وجود داشته باشد، میزان غلظت سلنیم بر حسب ppm چیست؟
پاسخ
با توجه به فرمول ppm مطابق زیر غلظت سلنیم به دست خواهد آمد.
مثال ۴
یک اتاق با ۴۰٫۰ متر مکعب هوا پر شده است. غلظت گاز دی هیدروژن سولفید در این اتاق ۰٫۵۰۰ ppm بر حسب حجم است. حجم دی هیدروژن سولفید را بیابید.
پاسخ
برای به دست آوردن حجم از رابطه ppm استفاده میکنیم. این رابطه بر حسب حجم بر حجم هوای اتاق به دست میآید.
از آنجا که هر متر مکعب هزار لیتر است، با جایگذاری مقادیر داده شده میتوان حجم ماده را به دست آورد.
تبدیل درصد غلظت به ppm
در قسمتهای قبل اشاره شد که ppm یک واحد اندازهگیری برای بیان غلظت ماده حلشونده در ۱ میلیون واحد حلال است. این واحد اندازهگیری برای محلولهای بسیار رقیق و محلولسازی بسیار کاربرد دارد. غلظت مواد همچنین گاهی با واحد درصد حجمی حجمی بیان میشود و ممکن است برای انجام محاسبات ریاضی نیاز به تبدیل این واحدها به بکدیگر داشته باشیم. در ادامه روش تبدیل واحد درصد حجمی-حجمی را به ppm به شکلی کاملتر توضیح خواهیم داد.
برای مثال تصور کنید یک محلول سدیم کلرید در آب داریم که غلظت آن ۹۰۰۰ ppm است . این بدان معنی است که در هر ۱ میلیون واحد آب ۹۰۰۰ واحد سدیم کلرید حل شده است.
حال محلول دیگری را در نظر بگیرید که از اتانول و آب تشکیل شده و غلظت آن ۱۲٪ حجمی بیان شده است. این بدان معنی است که در هر ۱۰۰ واحد از حجم آب (برای مثال میلیلیتر)، ۲۰ واحد حجم اتانول حل شده است.
حال باید بررسی کنیم روش تبدیل واحد درصد حجمی به ppm چیست. برای این کار میتوانیم عبارات ریاضی هریک از واحدها را نوشته و با قرار دادن متغیرهایی، این تبدیل واحد را محاسبه کنیم. به محاسبات زیر در این راستا دقت کنید.
برای تبدیل درصد x به ppm میتوانیم دوطرف معادله را در عدد یک میلیون ضرب کنیم. بدین ترتیب خواهیم داشت:
در نتیجه برای تبدیل واحد درصد حجمی به ppm باید آن را در عدد ۱۰۰۰۰ ضرب کنیم.
این تبدیل واحد برای تمامی واحدهایی که بر حسب درصد بیان میشوند نیز استفاده میشود. زیرا عبارت درصد همواره به عنوان واحد تقسیم بر ۱۰۰ بیان میشود.

مثال تبدیل درصد به ppm
در ادامه مطلب چند مثال برای انجام تبدیل واحد ذکر شده برای فهم بهتر این مفهوم که ppm چیست ارائه شده است.
مثال ۱
یک نمونه از آب دریا شامل ۱٫۹۴ درصد حجمی w/w کلرید است. مقدار غلظت کلرید در این محلول بر حسب ppm چیست؟
پاسخ
برای تبدیل این واحد کافی است درصد حجمی را در حدد ۱۰۰۰۰ ضرب کنیم.
جدول راهنما تبدیل درصد به ppm
| غلظت بر حسب درصد ٪ | غلظت بر حسب ppm |
| ۰٫۰۰۰۱ | ۱ |
| ۰٫۰۰۱ | ۱۰ |
| ۰٫۰۱ | ۱۰۰ |
| ۰٫۱ | ۱۰۰۰ |
| ۰٫۵ | ۵۰۰۰ |
تبدیل مولاریته به ppm
تا اینجا آموختیم ppm چیست و تبدیل واحدها برای این کمیت چگونه انجام میشوند. مولاریته و ppm از رایجترین واحدهای اندازهگیری غلظت در شیمی هستند. یک مول از یک ماده برابر با تعداد ۶٫۰۲۲ در ۱۰ به توان ۲۳ ذره از آن است. مقدار یک مول میتواند برای اتم، مولکول، یون و یا حتی ترکیب در نظر گرفته شود. یک ppm برابر با یک قسمت از حلشونده در یک میلیون قسمت حلال است. از آنجا که این واحدهای اندازهگیری از واحدهای مهم برای بیان غلظت محلولها هستند، آموختن تبدیل این واحدها به یکریگر بسیار حائز اهمیت است.
واحد ppm همانطور که در ابتدای متن توضیح داده شد، میتواند بر حسب گرم حلشونده به گرم حلال یا میلیگرم حلشونده بر لیتر حلال بیان شود. مولاریته نیز بر حسب مول حلشونده بر لیتر حلال بیان میشود. پس برای تبدیل واحد مولاریته به ppm کافی است مول حلشونده به میلیگرم حلشونده تبدیل شود. (این محاسبات در صورتی است که حلال آب بوده و هر گرم آن برابر با میلیلیتر آن باشد. در غیر این صورت چگالی حلال باید برای تبدیل واحد گرم به لیتر لحاظ شود.
مثال اول تبدیل مولاریته به ppm
یک محلول حاوی یونهای مس ۲ بار مثبت با غلظت است. میزان غلظت این یون بر حسب ppm چیست؟
پاسخ
گفتیم که مولاریته بر حسب مول بر لیتر بیان میشود پس میزان مول از یون مس در هر لیتر آب وجود دارد. با کمک جدول تناوبی میزان جرم اتمی مس را به دست اورده و از طریق آن مول آن را به گرم آن تبدیل میکنیم.
حال برای تبدیل گرم بر لیتر ماده به ppm کافی است آن را در ۱۰۰۰ ضرب کنیم. علت این تبدیل واحد در محاسبات زیر مشخص شده است. هر ppm برابر با یک گرم ماده حلشونده در یک میلیون گرم حلال است.
در نتیجه کافی است گرم یون مس بر لیتر آب به میلیگرم یون بر لیتر آب تقسیم شود تا غلظت آن بر حسب ppm به دست آید.

مثال دوم تبدیل مولاریته به ppm
میزان غلظت PPM یونهای کلرید را در محلول ۰٫۱ مولار سدیم کلرید به دست آورید.
پاسخ
با توجه به جرم اتمی سدیم و کلر، یک مول از محلول سدیم کلرید ۵۸٫۴۴ گرم جرم دارد و از این جرم مقدار ۳۵٫۴۵ گرم مربوط به کلر است. هر یک مول از این محلول حاوی یک مول یون کلر ایت. پس باید میزان جرم یون کلر را در محلول ۰٫۱ مولار سدیم کلرید حساب کنیم.
در نهایت باید میزان میلیگرم یون کلر را در یک لیتر آب حساب کنیم.
مثال سوم تبدیل مولاریته به ppm
میزان غلظت یون در یک نمونه آب برابر با ۳۳۵٫۰ ppm است. چه جرمی از یون در حجم ۳٫۴۵۰ میلی لیتر آب موجود است؟ (چگالی آب برابر با ۱ گرم بر میلی لیتر است.)
پاسخ
برای محاسبه غلظت یون آهن، ابتدا باید میزان جرم آب را با توجه به چگالی آن به دست آوریم. با توجه به این که چگالی آب برابر با ۱ است، جرم آب برابر با ۳۴۵۰ گرم میشود. سپس جرم یون آهن را با با توجه به فرمول محاسبه ppm (گرم حلشونده به گرم حلال در یک میلیون) به دست میآوریم.
و در نهایت میلیگرم یون آهن را به گرم آن تبدیل میکنیم.
مثال چهارم تبدیل مولاریته به ppm
اگر غلظت یون در محلول برابر با ۲٫۶۱ مولار باشد، غلظت را بر حسب ppm محاسبه کنید.
نکته
برای حل این گونه سوالات که شامل ترکیبات یونی هستند، باید تفاوت بین غلظت نمک و غلظت هریک از یونهای آنها را بشناسیم. برای مثال در محلول ۱ مولار سدیم کلرید میتوان محلول را ترکیبی از یون کلرید با غلظت یک مولار و یون سدیم با غلظت یک مولار در نظر گرفت.
این موارد به این دلیل است که در ترکیب ساختار سدیم کلرید تنها یک عدد از هرکدام از یونها وجود دارد. اگر ترکیبی مانند کلسیم کلرید با فرمول داشته باشیم، و غلظت محلول آن ۱ مولار باشد، غلظت یون کلسیم ۱ مولار و غلظت یون کلر ۲ مولار خواهد بود. در نهایت غلظت کلی برابر با جمع غلظتهای یونی و خود نمک است. برای مثال در مواردی که اشاره شد، غلظت کلی محلول سدیم کلرید برابر با ۲ مولار و غلظت کلی محلول کلسیم کلرید برابر با سه مولار خواهد بود.
پاسخ
با انحلال ترکیب کلرید آهن در آب این ترکیب به یونهای زیر شکسته میشود.
با توجه به این که به نسبت هر مول از ترکیب کلرید آهن، ۳ مول یون کلرید به دست میآید، و غلظت یون کلرید را داریم، با توجه به آن میتوانیم مولاریته ترکیب کلرید آهن را به دست آوریم.
حال با داشتن غلظت مولار کلرید آهن میتوانیم غلظت آن را بر حسب ppm محاسبه کنیم. برای این کار باید جرم مولی ترکیب کلرید آهن را به دست اوریم تا بتوانیم گرم آن را بر گرم آب به دست اورده و ppm آن را به دست اوریم.
جرم مولی کلرید آهن از روش زیر به دست میآید.
سپس با کمک غلظت به دست آمده، میزان گرم کلرید آهن در محلول آبی محاسبه میشود.
از آنجا که میزان چگالی آب برابر با ۱ گرم بر میلیلیتر است (۱۰۰۰ گرم بر لیتر) میتوان غلظت آن را بر حسب ppm به دست اورد.
در مطلب زیر از مجله فرادرس، واحد مولاریته را به طور مفصل توضیح داده و با مثالهای بسیاری تبدیل واحدهای مربوط به این واحد را بررسی کردهایم.
نکات مهم ppm
در قسمتهای قبلی اشاره کردیم که ppm یکی از مهمترین واحدهای اندازهگیری مقادیر غلظت محلولهای رقیق در شیمی است. در ادامه نکات مهم این مفهوم اشاره شده است.
- قسمت در میلیون یک واحد اندازهگیری برای غلظت محلولها است.
- ppm مخفف عبارت انگلیسی «parts per million» به معنی قسمت در میلیون است.
- یک ppm میتواند یک قسمت از جرم یا حجم یک حلشونده در ۱ میلیون قسمت حلال برحسب جرم یا حجم باشد.
- درصد نسبت اجزای سازنده میتواند با ضرب کردن در ۱۰۰۰۰ به واحد ppm تبدیل شود.
- برای هر محلول رقیق، نسبتهای حجمی-حجمی و جرمی-حجمی غلظت میتوانند بر حسب ppm نیز بیان شوند.
- در نسبت جرم حلشونده بر حجم حلال، ۱ قسمت در میلیون برابر با ۱ گرم بر مترمکعب، ۱ میلیگرم بر لیتر یا ۱ میکروگرم بر میلیلیتر است.
- در نسبت جرم حلشونده بر جرم حلال، یک قسمت در میلیون برابر با یک میلیگرم حلشونده بر کیلوگرم حلال یا یک میکروگرم حلشونده بر گرم حلال است.

اهمیت واحد ppm
اندازهگیریهای بر حسب ppm، برای اندازهگیری مواد موجود در یک ترکیب ، سیستم یا محیط زیست به کار میروند. این اندازهگیریها برای پایش کیفیت آب آشامیدنی، بررسی فرایندهای صنعتی، پایش وضعیت هوا و ... کاربرد دارد. این اندازهگیریها که معمولا شامل گزارش غلظتهای بسیار پایین آلایندهها در محیطهای مختلف است با واحدهای ppm و ppb و ppt بیان میشوند.
ppb و ppt چیست؟
ppb نیز یکی از روشهای بیان تعداد قسمتهای موجود حلشونده در یک حلال است. ppb برابر با یک قسمت در یک میلیارد قسمت حلال است. این واحد اندازهگیری قسمت حلال است. همچنین برای اندازهگیریهای این چنینی واحد دیگری نیز وجود دارد. این واحد ppt است که برابر با یک قسمت حلشونده در یک تریلیون قسمت حلال است. این واحد اندازهگیری برای بیان این است که هر واحد حلشونده قسمت حلال است.
مثال
بنابر اعلام سازمان حفاظت محیط زیست، غلظت سرب موجود در آبهای آشامیدنی اگر بیشتر از ۱۵ ppb شود، اقدامات اصلاحی باید سریعا انجام شوند. مقدار این غلظت بر حسب ppm چیست؟ در این غلظت میزان جرم سرب حل شده در یک لیوان ۳۰۰ میلیلیتری آب بر حسب میکروگرم چقدر است؟
پاسخ
از معانی و مقادیر ارائه شده برای تعریف ppm و ppb برای حل این مثال استفاده میکنیم. مقایسه این دو واحد نشان میدهد که واحد ppm هزار برابر بزرگتر از ppb است. بنابر این محاسبات انجام شده برای به دست آوردن مقدار ppm به شکل زیر است.
بنابر این یک میلیون گرم از آب، به میزان ۰٫۰۲۵ گرم سرب دارد. از عبارت ppb برای محاسبه جرم خواسته شده نیز میتوان استفاده کرد اما در صورتی که جرم محلول نیز داده شده باشد. در قسمت دوم سوال حجم حلال داده شده است و باید آن را به کمک چگالی آب به جرم تدیل کنیم. از آنجا که چگالی آب برابر با ۱ گرم بر میلیلیتر است، میتوان ۳۰۰ میلیلیتر آب برا برابر با ۳۰۰ گرم آب در نظر گرفت. در نتیجه میزان جرم سرب موجود در ۳۰۰ میلیلیتر آب به روش زیر به دست میآید.

روشهای اندازهگیری ppm
مقادیر ppm مقادیر بسیار کوچکی هستند و اندازهگیری مقادیر پایین ppm و ppt نیازمند روشهای دقیق و دستگاههای مختلف برای اندازهگیری است. روشهای متفاوتی برای اندازهگیری ppm وجود دارند. رایجترین این روشها رنگسنجی، تیتراسیون و روشهای الکتروشیمیایی هستند. در ادامه روش تعیین ppm با این روشها نام برده شده است.
- تیتراسیون
- رنگسنجی (کالرمتری)
- روشهای الکتروشیمیایی
- روشهای طیفسنجی
کاربرد اندازهگیری ppm
تا اینجا آموختیم ppm چیست و محاسبات مربوط به آن چگونه انجام میشوند. واحد ppm در بسیاری از صنایع و تحقیقات استفاده میشود. این واحد اندازهگیری که برای نشان دادن غلظتهای بسیار پایین مواد در یک محیط استفاده میشود بیشتر در صنایع آب و فاضلاب و محیط زیست کاربرد دارد. در ادامه این مطلب از مجله فرادرس برخی از این موارد را نام میبریم.
- در سم شناسی برای اندازهگیری غلظت جیوه در اندامهای آبزیان پرورشی
- اندازهگیری میزان آلایندههای اتمسفر
- اندارهگیری سختی آب
- اندازهگیری فلزات در نمونهها
- اندازهگیری غلظت ماده موثره داروها
- اندازهگیری غلظت مواد افزودنی و فلزات سنگین موجود در خوراکیها
- اندازهگیری آلودگی تولید شده توسط خودروها
همانطور که مشاهده میکنید واحد ppm با وجود کوچک بودن مقادیر آن، در بسیاری از صنایع برای اندازهگیری موارد مختلف کاربرد دارد.

آزمون ppm
۱. ppm چیست و چرا در اندازهگیری غلظت محلولهای رقیق اهمیت دارد؟
ppm واحدی برای بیان غلظت بسیار کم در محلولها است.
ppm برای سنجش حجم کل محلول بهکار میرود.
ppm فقط برای مواد جامد کاربرد دارد.
ppm واحدی مخصوص ترکیبات آلی در شیمی است.
ppm (قسمت در میلیون) اغلب برای سنجش غلظتهای بسیار پایین مواد حلشونده در محلولهای رقیق در شیمی و صنعت بهکار میرود و اهمیت آن در بیان نسبتهای کوچک به شکل ساده است.
۲. در بین واحدهای غلظت زیر، کدام بیشتر برای نمایش مقادیر بسیار کم ماده حلشونده در محلولهای رقیق کاربرد دارد؟
ppth (قسمت در هزار) برای غلظتهای متوسط بهکار میرود.
درصد بیشتر برای مقادیر نسبتا زیاد مناسب است.
ppt (قسمت در تریلیون) تنها برای غلظتهای فوقالعاده ناچیز است.
ppm (قسمت در میلیون) ترجیحی برای مقادیر بسیار کم است.
«ppm (قسمت در میلیون)» به دلیل دقت بالا و توانایی نمایش غلظتهای بسیار پایین، یکی از مناسبترین واحدها برای بیان مقادیر کم ماده حلشونده است. «درصد (Percent)» و «ppth (قسمت در هزار)» بیشتر برای مقادیر متوسط یا زیاد استفاده میشوند و قدرت تمایز مقادیر خیلی کوچک را ندارند. «ppt (قسمت در تریلیون)» بیشتر در مواردی کاربرد دارد که مقدار حلشونده خیلی ناچیز باشد و نیاز به نمایش غلظتهای فوقالعاده کم وجود دارد، اما برای بیشتر محلولهای رقیق، «ppm (قسمت در میلیون)» انتخاب مطلوبتر است.
۳. فرمول پایهای ppm برای سنجش غلظت یک ماده چگونه تعریف میشود و کدام عاملها در آن نقش اصلی دارند؟
سهم جرم حلال تقسیم بر جرم محلول ضربدر هزار
سهم جرم یا مقدار ماده حلشونده به کل محلول ضربدر یک میلیون
اختلاف وزن ماده و حلال ضربدر صد
مجموع جرم تمام مواد ضرب در یک میلیارد
در محاسبه ppm، نسبت جرم یا مقدار ماده حلشونده به کل محلول در یک میلیون ضرب میشود. این روش، مخصوص تعیین غلظتهای بسیار کم است.
۴. برای تبدیل مقدار ppm به واحدهای رایج غلظت مانند میلیگرم بر لیتر (mg/L) یا درصد، چه نکتهای مهم است؟
ضرب مقدار ppm در مقدار ppb را بدست میدهد.
تبدیل ppm به درصد با تقسیم ppm بر یک میلیون انجام میشود.
برای تبدیل ppm به گرم بر کیلوگرم باید در ۰.۰۰۱ ضرب کرد.
ppm برابر با میلیگرم بر لیتر زمانی است که چگالی محلول تقریبا یک باشد.
هنگام تبدیل ppm به میلیگرم بر لیتر (mg/L)، اگر چگالی محلول تقریبا یک باشد (مثل بیشتر محلولهای آبی)، مقدار ppm دقیقا با mg/L برابر است. زیرا هر کیلوگرم آب تقریبا معادل یک لیتر است.
۵. نقش اصلی ppm در کنترل کیفیت آب و هوا و صنایع چیست؟
ممکن ساختن سنجش آلایندهها در غلظتهای بسیار پایین
بیان غلظت مواد تنها در آزمایشگاههای تخصصی
کاهش هزینههای تولید با افزایش سرعت آزمایشها
استفاده صرفا در محاسبه مولاریته محلولها
واحد ppm به دلیل امکان سنجش بسیار دقیق مقادیر کم آلایندهها، ابزار کلیدی برای کنترل کیفیت آب، هوا و محصولات صنعتی محسوب میشود و فقط با این واحد میتوان وجود مواد سمی یا ناخالصیها را در غلظتهایی بسیار پایین آشکار کرد.
۶. کدام جمله درباره تفاوت ppb و ppt با ppm صحیح است؟
ppb بیانگر مقادیر کمتر از ppm است و ppt مقادیر کمتری نسبت به ppb دارد.
ppt برای بیان غلظتهای بالاتر از ppm استفاده میشود، ppb مشابه ppm است.
ppb و ppm هر دو یک مقدار را نشان میدهند ولی ppt متفاوت است.
هر سه واحد فقط برای مواد جامد به کار میروند و کاربرد مشابه دارند.
ppb (قسمت در میلیارد) برای غلظتهای بسیار پایینتر از ppm (قسمت در میلیون) و ppt (قسمت در تریلیون) نیز برای مقادیر حتی کمتر از ppb بهکار میرود.
۷. برای تبدیل درصد غلظت یک محلول به ppm کدام روش صحیح است؟
درصد را در عدد ۱۰۰۰ تقسیم میکنیم.
درصد را به صورت اعشاری نوشته و در ۱۰۰ ضرب میکنیم.
درصد را به میلیگرم بر لیتر تبدیل میکنیم.
درصد را در عدد ۱۰۰۰۰ ضرب میکنیم.
در تبدیل درصد غلظت به ppm، لازم است مقدار درصد را در عدد ۱۰۰۰۰ ضرب کنیم تا مقدار بر حسب قسمت در میلیون (ppm) به دست آید.
۸. در آزمایشگاه، اگر غلظت یک یون خاص به صورت مولاریته بیان شود، کدام مسیر، روند صحیح تبدیل مولاریته به ppm را نشان میدهد؟
ضرب مقدار مولاریته به حجم محلول و سپس تقسیم بر ۱۰۶
تقسیم مقدار مولاریته بر حجم محلول و ضرب در ۱۰۰۰
تقسیم مقدار مولاریته بر جرم مولی یون و ضرب در ۱۰۶
ضرب مقدار مولاریته در جرم مولی یون و سپس ضرب در ۱۰۰۰
تبدیل مولاریته به ppm باید با ضرب مقدار مولاریته (mol/L) در جرم مولی یون (g/mol) انجام شود تا جرم ماده حلشونده در یک لیتر به دست آید. سپس این مقدار برای بیان بر حسب میلیگرم بر لیتر یا ppm در ۱۰۰۰ ضرب میشود. عبارت «ضرب مقدار مولاریته در جرم مولی یون و سپس ضرب در ۱۰۰۰» دقیقا این مراحل را دنبال میکند. ppm=M×جرم مولی (g/mol)×1000
۹. در هنگام بیان غلظت محلول به کمک واحد ppm، چه نکتهای برای انتخاب درست نوع نسبت باید رعایت شود؟
همیشه باید نسبت حجمی استفاده شود.
انتخاب نسبت جرمی یا حجمی بر اساس نوع محلول مهم است.
تفاوت محلولهای رقیق و غلیظ اهمیت ندارد.
فقط محلولهای آبی قابل بیان با ppm هستند.
در استفاده از واحد ppm لازم است نسبت جرمی یا حجمی را براساس شرایط محلول و نوع ماده حلشونده مشخص کنیم. کاربرد نسبت جرمی برای محلولهای جامد یا غلیظ و استفاده از نسبت حجمی برای محلولهای رقیق یا گازی مهم است.
۱۰. استفاده از واحد ppm در صنایع و محیط زیست چه فایدهای برای کنترل آلایندهها یا کیفیت محصولات دارد؟
جایگزین مناسبی برای همه واحدهای استاندارد است.
به تعیین مقدار بسیار کم مواد آلاینده کمک میکند.
فقط برای محاسبه میزان آب به کار میرود.
باعث افزایش سرعت واکنشهای شیمیایی میشود.
مزیت واحد ppm این است که میتوان غلظتهای بسیار کم مواد آلاینده یا اجزای ناخواسته را به دقت اندازهگیری کرد. این ویژگی برای کنترل کیفیت محصولات و حفاظت محیط زیست اهمیت دارد، چون روش دیگری برای تشخیص این مقادیر پایین وجود ندارد.













باتشکر،عالی بود