فرآیند آیزنتروپیک (Isentropic Process) – از صفر تا صد
پیشتر در بلاگ فرادرس مفاهیم بنیادی ترمودینامیک همچون فرآیند آدیاباتیک، سیکلهای ترمودینامیکی و آنتروپی توضیح داده شدند. در این قسمت قصد داریم تا بخشی دیگر از دنیای ترمودینامیک که اتفاقا کاربرد بسیاری نیز در صنعت دارد را توضیح دهیم. این مفهوم، «فرآیند آیزنتروپیک» (Isentropic Process) نام دارد. از این رو در ابتدا مفاهیم پیشنیاز را به طور خلاصه توضیح داده، سپس فرآیند آیزنتروپیک را نیز شرح خواهیم داد.
فرآیند آدیاباتیک
در ترمودینامیک، آدیاباتیک یا بیدررو به فرآیندی اطلاق میشود که در آن انتقال حرارت و جرم بین سیستم ترمودینامیکی و محیط اطرافش وجود نداشته باشد. در حقیقت در چنین فرآیندی تنها کار عامل انتقال انرژی بین سیستم و محیط محسوب میشود.
برخی از فرآیندهای فیزیکی و شیمیایی در زمان بسیار کوتاهی انجام میشوند. با توجه به بالا بودن سرعت واکنش در این فرآیندها، سیستم فرصت انتقال حرارت با محیط اطرافش را نخواهد داشت. از این رو فرآیندهای مذکور عمدتا بهصورت آدیاباتیک رخ میدهند.
در طی رخ دادن یک فرآیند ترمودینامیکی، معمولا کار انجام شده را با نماد W و انتقال حرارت صورت گرفته را با Q نمایش میدهند. همچنین انرژی مولکولهای سیستم را انرژی درونی نامیده و آن را با U نمایش میدهند. با این فرضیات اگر سیستمی در طی فرآیندی ترمودینامیکی کار W را روی محیط اطرافش انجام داده و حرارت Q را مبادله کند، رابطه برقرار خواهد بود.
فرآیند برگشت پذیر و برگشت ناپذیر
مطابق با شکل زیر گازی ایدهآل را در یک محفظهی عایق در نظر بگیرید.
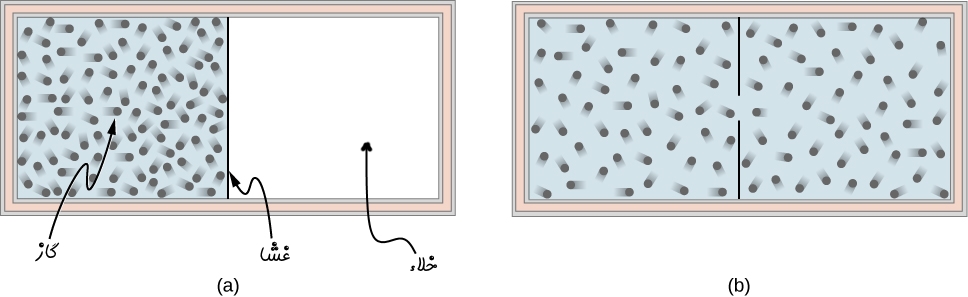
بخشی از حجم محفظه توسط یک غشا جدا شده است. همچنین بخش دیگر خالی بوده و به صورت خلاء است. در نتیجه اگر غشاء برداشته شود مطابق با تصویر b، گاز کل محفظه را اشغال میکند. با توجه به خلاء بودن یک سمت از محفظه، در این فرآیند مولکولها در هنگام انبساط نیرویی را در مقابل خود احساس نکرده و کاری انجام نمیدهند. بنابراین W=0 است. از طرفی محفظه عایق بوده و انتقال حرارتی نیز صورت نگرفته است (Q=0). در این شرایط قانون اول ترمودینامیک را میتوان به صورت زیر بیان کرد:
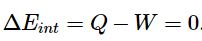
تغییر نکردن انرژی سیستم (E) به معنای آن است که دمای سیستم ثابت بوده. در نتیجه رابطه مربوط به گاز ایدهآل را میتوان به شکل زیر بیان کرد:
با دو برابر شدن حجم گاز، فشار آن نیز نصف میشود (). توجه داشته باشید که برابر با فشار اولیهی گاز است.
پخش شدن گاز فشرده شده در یک محفظه پدیدهای است که منطبق بر حس فیزیکی ما است. حال این سوال مطرح میشود که آیا مولکولهای گاز میتوانند فشرده شده و به حالت اولیهی خود بازگردند؟ با توجه به حس فیزیکی پاسخ این سوال منفی است. سوال دقیقتر این است چه موقع فرآیند انبساط در محفظه، برگشتپذیر است؟
به فرآیندی که در آن محیط و سیستم بتوانند در مسیری عکس، دقیقا به حالت اولیهی خود برگردند، «فرآیند برگشت پذیر» (Reversible Process) گفته میشود. بنابراین شرط لازم برای انجام فرآیندی برگشت پذیر، شبه پایا بودن فرآیند در هر لحظه است. واژه شبه پایا منتقل کننده این حس است که فرآیندِ عکس، در هر لحظه در حالت تعادل ترمودینامیکیش قرار دارد. بازگرداندن یک سیستم به حالت اولیهاش کار مشکلی نیست. اما بازگرداندن محیط اطراف به حالت اولیه، تقریبا غیرممکن است.
برای نمونه، مثال گازِ درون محفظه را در نظر بگیرید. در مثال مذکور گاز را میتوان دوباره فشرده کرده و به فشار اولیهاش رساند. اما مشکل این جا است که نمیتوان بدون انتقال حرارت این کار را کرد. چرا که در این صورت بایستی حرارت به گاز وارد شود. از طرفی وارد شدن حرارت به درون گاز به معنای استفاده از محیط و یا به عبارتی تغییر محیط است. بنابراین مسیر مذکور با تغییر محیط همراه است. از این رو فرآیند انبساط گاز، فرآیندی برگشت ناپذیر اطلاق میشود.
با توجه به توصیفات فوق، احتمالا متوجه شدهاید که یک فرآیند برگشت پذیر به سختی در طبیعت رخ میدهد. در حقیقت فرآیند برگشتپذیر مفهومی ایدهآل است و میزان انحراف از این حالت ایدهآل، معیاری است که در صنعت از آن استفاده میشود. «اگزرژی» (Exergy) و آنتروپی کمیتهایی هستند که میزان فاصله یک سیستم از حالت ایدهآل با استفاده از آنها سنجیده میشود.
از دیدگاه میکروسکوپی نیز میتوان فرآیند برگشت ناپذیر را توضیح داد. در حقیقت یک سیستم از میلیونها ذره تشکیل شده است. در طی یک فرآیند تمامی این ذرات برخوردهایی تصادفی را تجربه میکنند. فرآیند برگشتپذیر به معنای آن است که این برخوردها دقیقا به صورت عکس رخ دهند. همچون حالتی که یک فیلم را به عقب برمیگردانید! بدیهی است که این امر غیرممکن است.
معمولا جهت بررسی کمیِ میزان برگشت ناپذیری یک سیستم، از مفهوم آنتروپی استفاده میشود. افزایش آنتروپیِ یک سیستم، دو بخش را شامل میشود. بخشی از افزایشِ آنتروپیِ یک سیستم در نتیجه انتقال حرارت و بخش دیگر آن در نتیجه میزان برگشتناپذیری سیستم است. رابطه زیر افزایش کل آنتروپی یک سیستم را توصیف میکند.
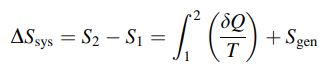
در رابطه فوق نشان دهنده آنتروپی تولید شده در نتیجه برگشتناپذیری است. توجه داشته باشید که برگشتناپذیری یک سیستم وابسته به اندازهی است. بنابراین صفر بودن به معنای برگشتپذیر بودن فرآیند است.
نکته مهم در مورد بدست آوردن ، این است که با جمع زدن تغییرات آنتروپی سیستم و آنتروپی محیط، آنتروپی خالص تولیدی () افزایش مییابد. شکل ریاضیاتی این جمله به صورت زیر قابل ارائه است:
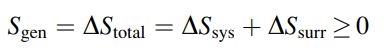
توجه داشته باشید که آنتروپی کل عالم همواره در حال افزایش است. در حقیقت با سرد شدن یک فنجان قهوه، آنتروپی محتوی آن کم شده و آنتروپی محیط اطرافش افزایش مییابد. ولی با جمع زدن این دو مقدار، آنتروپی کل، مقداری مثبت بدست خواهد آمد (). جالب است بدانید اگر این مقدار منفی بدست آید، به معنی آن است که قهوه خود به خود داغتر خواهد شد!
مثال ۱
فنجانی از قهوهی ۱۰۰ درجه سانتیگراد در اتاقی به دمای ۲۰ درجه قرار گرفته است. با فرض اینکه جرم قهوه برابر با بوده و حرارت ویژه آن برابر با باشد، آنتروپی تولیدی () در این فرآیند چقدر است؟
آنتروپی قهوه و اتاق همزمان در حال تغییر هستند. لذا هریک از آنها را بایستی به طور جداگانه محاسبه کنیم و با جمع زدن آنها افزایش خالص آنتروپی بدست میآید. گرمای از دست رفته توسط قهوه، در هر لحظه برابر است با:
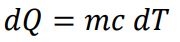
قهوه گرما از دست میدهد، بنابراین تغییرات آنتروپی آن برابر است با:
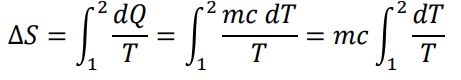
با محاسبه انتگرال فوق، کاهش آنتروپی قهوه برابر میشود با:
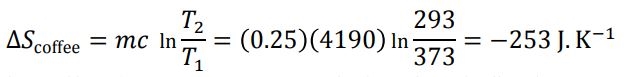
در این فرآیند، قهوه گرمایی به اندازهی زیر از دست میدهد.
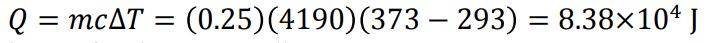
با توجه به ثابت فرض شدن دمای اتاق، افزایش آنتروپی محیط نیز به صورت زیر بدست میآید.
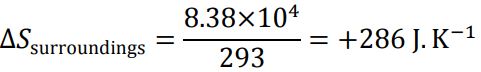
در نتیجه آنتروپی تولیدی در فرآیند سرد شدن قهوه در اتاق برابر است با:
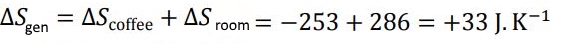
همانطور که میبینید عدد بدست آمده مثبت است. بنابراین آنتروپی دنیا به طور مداوم در حال افزایش است چرا که روزانه میلیونها فنجان قهوه نوشیده میشود!
فرآیند آیزنتروپیک
در بالا گفتیم که مجموع تغییرات آنتروپی یک سیستم و محیط اطرافش همواره مثبت است. اما در مواردی تنها تغییرات آنتروپی یک سیستم مورد بررسی قرار میگیرد. فرآیند آیزنتروپیک به فرآیندی اطلاق میشود که در آن تغییرات آنتروپیِ سیستم برابر با صفر باشد.
با این تعریف، هر فرآیند آدیاباتیکِ برگشت پذیر، فرآیندی آیزنتروپیک است. در واقع برای آیزنتروپیک بودن یک فرآیند، آن فرآیند هم باید برگشتپذیر باشد و هم در مجموع آدیاباتیک باشد. اگر یک فرایند ادیاباتیک باشد اما برگشتناپذیر باشد، ممکن است به دلایل مختلفی آنتروپی ایجاد شود و سیستم آیزنتروپیک نخواهد بود. برای مثال، ممکن است در دمای ثابت و بدون انتقال حرارت، فشار یا حجم گاز تغییر کند.
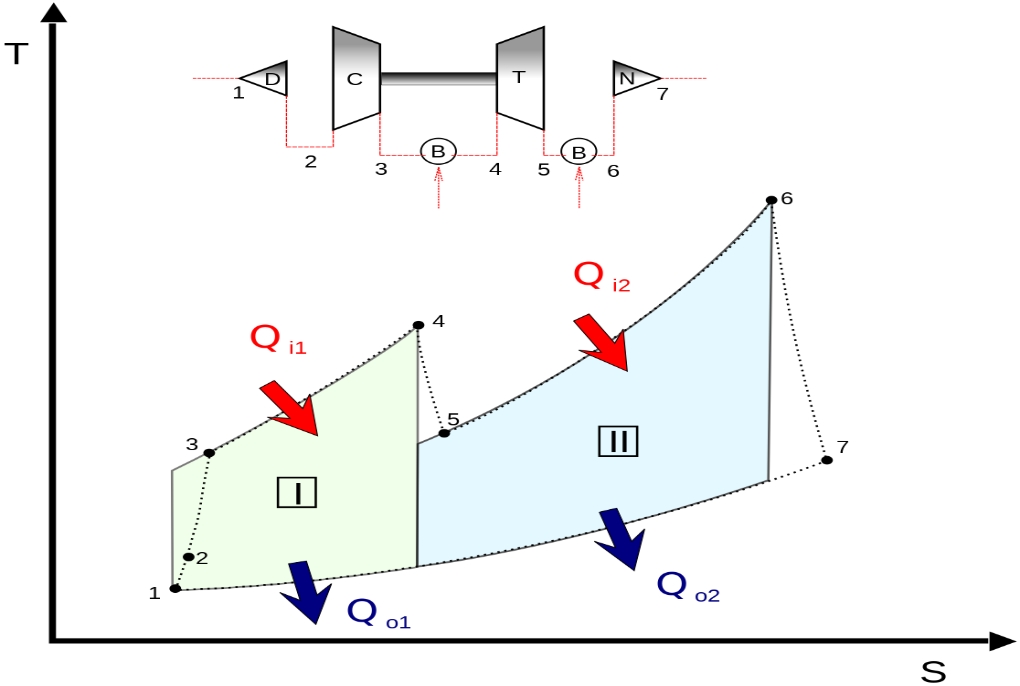
برای نمونه سیکل برایتون را در نظر بگیرید. «سیکل برایتون» (Brayton Cycle) عبارت است از سیکلی حرارتی که مبتنی بر دو فرآیند فشار ثابت کار میکند. اسم این سیکل برگرفته از نام مهندس آمریکایی، «جرج برایتون» (George Brayton) است. در حالت کلی سیکل برایتون شامل چهار فرآیند است. این فرآیندها به همراه اجزاء اصلی آنها در شکل زیر نشان داده شدهاند.
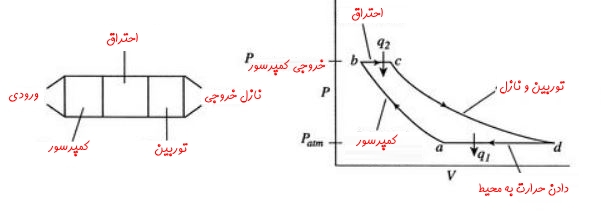
فرآیندهای تشکیلدهنده سیکل برایتون به ترتیب زیر هستند. این مراحل مطابق با شکل بالا بیان شدهاند.
- در ابتدا جریان طی فرآیند a-b به صورتی شبه پایا و برگشتپذیر فشرده میشود.
- در مرحله b-c، فرآیند احتراق و دریافت گرما در فشار ثابت اتفاق میافتد.
- در مرحله c-d انبساط شبهپایا، آدیاباتیک و برگشتپذیر رخ میدهد.
۱. مقداری کار از هوا گرفته میشود و بخشی از آن به کمپرسور داده میشود.
۲. مابقی کار تولید شده، در موتورهای جت صرف شتاب دادن به هوا و در نیروگاهها صرف تولید توان میشود. - در مرحله d-a سیال کاری (در اکثر کاربردها از هوا استفاده میشود) در فشار ثابت سرد شده و به حالت اولیه برمیگردد.
بنابراین همانطور که در بالا بیان شد، در مراحل a-b و c-d، فرآیند به صورت آدیاباتیک برگشت پذیر است لذا فرآیند در این دو قسمت آیزنتروپیک رخ میدهد. البته بدیهی است که در واقعیت کمپرسورها و توربینها، آیزنتروپیک نیستند لذا برای آنها عددی تحت عنوان راندمان آیزنتروپیک تعریف میشود.
راندمان آیزنتروپیک
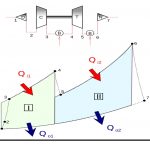
یکی از نمودارهای توصیف کننده سیکلهای ترمودینامیکی، نمودار آنتالپی-آنتروپی (h-s) است. در اکثر توربوماشینها فرآیند رخ داده به صورت آدیاباتیک برگشت پذیر نیست. اما به منظور بررسی کمیتر، حالتی ایدهآل به صورت آیزنتروپیک در نظر گرفته شده و میزان انحراف از این حالت ایدهآل را با مشخصهای تحت عنوان راندمان آیزنتروپیک میسنجند.
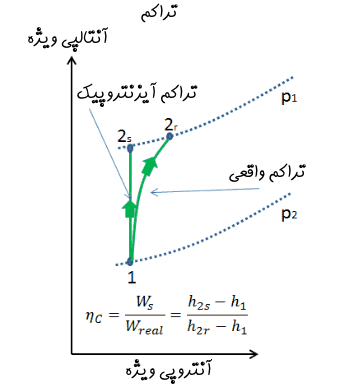
برای نمونه، در نمودار بالا دو حالت آیزنتروپیک و واقعی در فرآیند تراکم در کمپرسور نشان داده شده است. همانگونه که مشاهده میکنید در حالت آیزنتروپیک، (فرآیند ) برگشت ناپذیری وجود نداشته و آنتروپی جریان ورودی به کمپرسور پس از تراکم، افزایش نیافته است. این در حالی است که در فرآیند حقیقی رخ داده در کمپرسور ()، آنتروپیِ جریان پس از تراکم افزایش یافته است. توجه داشته باشید که معمولا در سیستمهای واقعی، میتوان کمپرسور یا توربین را به صورت آدیاباتیک ساخت؛ اما جلوگیری از برگشتناپذیریِ فرآیند، امری غیرقابل اجتناب است.
با توجه به نمودار شکل ۱، راندمان آیزنتروپیک کمپرسور، به شکل زیر تعریف میشود.

در این رابطه:
- h1 آنتالپی ویژه گاز در ورودی است.
- h2r آنتالپی ویژه خروجی در فرآیند واقعی است.
- h2s آنتالپی ویژه خروجی در حالت آیزنتروپیک است.
توجه داشته داشته که در فرآیند انبساط رخ داده در توربین نیز همین امر وجود دارد. در حقیقت فرآیند انبساطِ سیال در توربین مطابق با نمودار ارائه شده در زیر است.
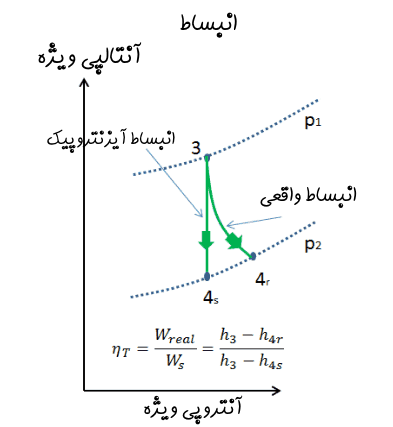
در این صورت راندمان آیزنتروپیک توربین مطابق با رابطه زیر تعریف میشود.
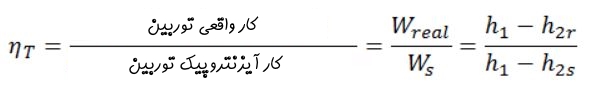
مثال ۲
انبساط آیزنتروپیک هلیوم () را در یک توربین در نظر بگیرید. در این توربین، گاز هلیوم در فشار و دمای و دریافت شده (نقطه ۳ در شکل ۲) و در فشار از آن خارج میشود. اگر دمای خروجی از توربین در حالت ایدهآل برابر با T4s=839 K بوده و همچنین راندمان آیزنتروپیک توربین نیز برابر با ۹۱ درصد باشد، کار انجام شده توسط توربین و دمای خروجیِ واقعی از آن را بیابید.
با توجه به قانون اول ترمودینامیک، کار انجام شده توسط توربین در یک فرآیند آیزنتروپیک را میتوان با استفاده از رابطه زیر بدست آورد.
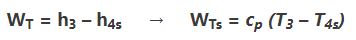
با استفاده از قانون گاز ایدهآل، ظرفیت ویژه در حجم و فشار ثابت برابرند با:
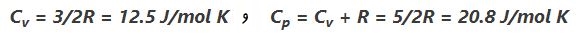
البته با استفاده از تبدیل زیر، واحدها به J/kg K تبدیل میشوند.

حال کار در حالت آیزنتروپیک به صورت زیر بدست میآید.
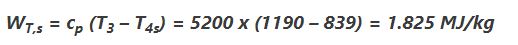
در مرحلهی آخر با فرض آدیاباتیک بودن توربین و برگشت ناپذیر بودن آن، کار واقعی انجام شده توسط توربین برابر است با:
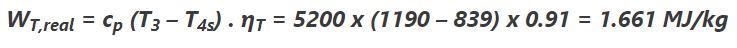
برای محاسبه دمای خروجی واقعی، از رابطه زیر استفاده میکنیم که دمای خروجی واقعی را با استفاده از راندمان آیزنتروپیک و دمای خروجی آیزنتروپیک تخمین میزند:
مقدارهای داده شده را در رابطه فوق قرار میدهیم:
مطابق با مثال ارائه شده در بالا اکثر اجزاء یک سیکل ترمودینامیکی نسبت به یک حالت ایدهآل سنجیده شده و بدین صورت کل سیکل ترمودینامیکی تحلیل میشود.
در صورت علاقهمندی به مباحث مرتبط در زمینه مهندسی مکانیک، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- فرآیند آدیاباتیک -- به زبان ساده
- سیکل ترمودینامیکی چیست؟ — به زبان ساده
- موتور جت چگونه کار میکند؟ — از صفر تا صد
- معادلات ناویر استوکس -- از صفر تا صد
^^













قسمت اول که میگید هر فرآیند آیزنتروپیکی بازگشت پذیر و آدیاباتیک نیست رو اثبات نکردید بلکه با مثال سیکل برایتون برعکسش که واضحه رو گفتین، دلیل اینکه میگین دومی غلطه چیه؟
با سلام.
قسمت ذکر شده اصلاح و بازنویسی شد.
با تشکر از همراهی شما با مجله فرادس.
درود
درمثال حل شده دما محاسبه نکردید
T4r
با سلام،
محاسبه دما اضافه شد،
با تشکر از همراهی شما با مجله فرادرس
با سلام
بنظر می آید مشکل تایپی در متن بالا موجود است ممنون میشوم رسیدگی کنید تا باعث ایجاد سر در گمی برای خوانندگان مطلب نشود.
در قسمت (راندمان آیزونتروپیک) ، سطر اول بالای شکل۱ ، خط اول می گوید :((یکی از نمودارهای توصیف کننده سیکلهای ترمودینامیکی، نمودار آنتالپی-دما (h-s) است.))
که فکر میکنم با توجه شکل 1 منظور جمله (. . . ، نمودار آنتالپی-آنتروپی (h-s) است.) میباشد.
ممنون
عالی بودش. ممنون
سلام و روز شما به خیر؛
این موضوع در متن ویرایش و اصلاح شد.
از اینکه با فرادرس همراه هستید خرسندیم.
با سلام
بنظر می آید مشکل تایپی در متن بالا موجود است ممنون میشوم رسیدگی کنید تا باعث ایجاد سر در گمی برای خوانندگان مطلب نشود.
در قسمت (راندمان آیزونتروپیک) ، سطر دوم زیر شکل1 ، خط دوم می گوید :((. . . ناپذیری وجود نداشته و آنتروپی جریان ورودی به کمپرسور پس از تراکم، افزایش [[ یافته ]] است.))
که فکر میکنم منظور جمله (. . . افزایش [[ نیافته ]] است.) میباشد.
ممنون
سلام و روز شما به خیر؛
موضوعی که در مورد اشتباه تایپی مطرح کردهاید صحیح است و در شکل (1) و تحت فرآیند (1-2s) آنتروپی افزایش نیافته و ثابت مانده است. این موضوع در متن ویرایش و تصحیح شد.
از حسن توجه شما سپاسگزاریم.