اوزون – از صفر تا صد
اوزون یا «تری اکسیژن» (Trioxygen) مولکولی غیرآلی (معدنی) با فرمول شیمیایی و آلوتروپی از اکسیژن است. اوزون معمولا با رنگ آبی کمرنگ و بویی تند شناخته میشود. این آلوتروپ، پایداری کمتری از گاز اکسیژن دارد و به کمک نور ماورا بنفش و تخلیه الکتریکی در اتمسفر زمین بوجود میآید. بیشترین غلظت این مولکول در لایه اوزون استراتوسفر دیده میشود و به میزان بسیار کمی در جو زمین قرار دارد. بوی اوزون بسیار به بوی کلر شبیه است و بسیاری از افراد این بو را حتی با غلظت تشخیص میدهند. ساختار اوزون در سال 1865 تعیین شد و بعد از آن مشخص شد که مولکول آن ساختاری خمیده دارد و «دیامغناطیس» (Diamagnetic) است.

در شرایط استاندارد، این گاز به رنگ آبی کمرنگ حضور دارد اما در شرایط بسیار سرد به مایعی تیره به رنگ آبی یا جامدی بنفش تبدیل میشود. ناپایدرای اوزون در مقایسه با گاز اکسیژن به گونهای است که گاز یا مایع غلیظ ازون با گرم کردن یا افزایش سریع دما تا نقطه جوش، رفتاری انفجاری از خود نشان میدهد. بنابراین، باید در غلظتهای بسیار کم مورد استفاده قرار بگیرد.
ازون یک اکسنده قوی است و کاربردهای بسیاری در صنعت دارد. همچنین پتاسیل بالای اکسایش در اوزون میتواند به مخاط و بافتهای تنفسی حیوانات و گیاهان آسیب برساند. با وجود اینکه غلظتهای کم و در حدود نزدیک سطح زمین موجب آلودگیهای زیست محیطی و تخریب بافتها میشود، غلظت بالای آن برای جلوگیری از تابش نور ماورا بنفش به سطح زمین بسیار سودمند است.
تاریخچه
در سال 1785 شیمیدانی هلندی به نام «مارتینوس فن ماروم» (Martinus van Marum) مشغول انجام آزمایشی بود که در حین آزمایش متوجه بویی نامشخص شد. این بو به دلیل جرقههای ایجاد شده در واکنش بود. او البته در آن زمان متوجه نشد که موجب تشکیل اوزون شده است.
نیمقرن بعد، دانشمندی آلمانی به نام «کریستین فردریک شونباین» (Christian Friedrich Schönbein) همین بو را بعد از وقوع رعد و برق متوجه شد. سرانجام او در سال 1839 موفق به جداسازی این گاز شد و نام آن را اوزون نهاد. این نام از ریشه یونانی (Ozein) به معنای «بو» گرفته شده است. به همین دلیل او را به عنوان کاشف اوزون میشناسند. فرمول مولکولی اوزون در سال 1865 بوسیله «ژاک-لویی سوقه» (Jacques-Louis Soret) مشخص شد که در 1867 به تایید شونباین رسید.

خواص فیزیکی
این گاز آبیرنگ حلالپذیری کمی در آب دارد و در حلالهای ناقطبی همچون کربن تترا کلرید به خوبی حل و موجب تشکیل محلولی آبیرنگ میشود. این گاز در دمای مایعی به رنگ آبی تیره است و در دمای جامدی به رنگ بنفش تیره خواهد بود. غلظت از این ماده موجب سردرد، سوزش چشمها و التهاب مجاری تنفسی میشود. حتی غلظتهای پایین اوزون هم خواصی به شدت تخریبی بر مواد آلی همچون لاتکس، پلاستیکها و بافتهای ریوی حیوانات خواهد داشت. همچنین، اوزون مولکولی دیامغناطیس است که تمامی الکترونهای آن به صورت جفتشده قرار دارند اما اکسیژن پارامغناطیس و به همراه دو جفت الکترون جفتنشده است.
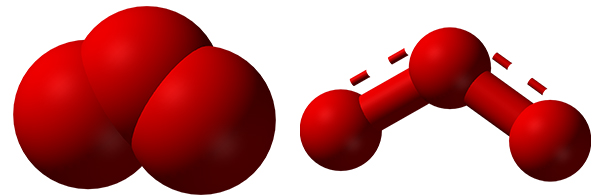
ساختار اوزون
بر اساس نتایج «طیفسنجی مایکروویو» (Microwave Spectroscopy)، اوزون ساختاری خمیده همچون مولکول آب دارد. طول پیوند برابر با و زاویه بین پیوندی برابر با درجه است.
واکنشها
اوزون به عنوان یکی از قدرتمندترین عوامل اکسنده و بسیار قوی تر از شناخته میشود. نیمه عمر آن با شرایط جوی همچون دما، رطوبت و تحرک هوا متغیر است. اگر یک فن در محیطی عایق سبب حرکت ازن شود، نیم عمر آن در دمای اتاق در حدود یک روز خواهد بود. برخی منابع علمی، نیمه عمر اوزون را تحت شرایط اتمسفر در حدود نیم ساعت تخمین زدهاند.
واکنش سوختن اوزون که به کمک انتقال حرارت انجام و توسط جرقه تحریک میشود. این واکنش با غلظتهای 10 درصد وزنی یا بیشتر انجام میگیرد. همچنین، تولید این مولکول از طریق یک سلول الکتروشیمیایی نیز قابل انجام است. البته ازن تولیدی در این واکنش بسیار کم و برای مطالعات آزمایشگاهی مورد استفاده قرار میگیرد.
در صورتیکه به هنگام الکترولیز آب به کمک دستگاه هافمن، ولتاژ دستگاه بیش از حد مورد نیاز باشد، واکنش بالا قابل مشاهده خواهد بود.
اوزون و فلزات
اوزون، بیشتر فلزات را به بالاترین عدد اکسایش خود، اکسید میکند. البته طلا، پلاتین و ایریدیوم از این قانون تبعیت نمیکنند. به طور مثال، واکنش اکسید شدن مس در زیر آورده شده است:
واکنش با نیتروژن و ترکیبات کربن
اوزون موجب اکسید شدن مونو اکسید نیتروژن و تبدیل آن به دیاکسید نیتروژن میشود:
دیاکسید نیتروژن نیز مجددا طی واکنش اکسید شدن شرکت میکند و موجب تشکیل خواهد بود که این فرآورده نیز در واکنش با دی اکسید نیتروژن به تبدیل میشود. واکنشهای مختلف ازن با نیتروژن و ترکیبات کربن در زیر آورده شده است:
واکنش با ترکیبات گوکرد
- اوزون موجب اکسیدشدن سولفیدها و تبدیل آنها به سولفاتها میشود.
- به کمک آب، گوگرد یا دیاکسید گوگرد و اوزون میتوان به سولفوریک اسید دست پیدا کرد:
- در فاز گاز، اوزون با هیدروژن سولفید برای تولید دیاکسید گوگرد وارد واکنش میشود:
- در یک محلول آبی، دو واکنش به طور همزمان اتفاق میافتد، یکی از واکنشها به تولید گوگرد منجر و دیگری موجب تولید سولفوریک اسید میشود:
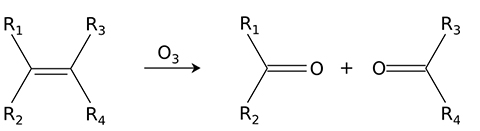
واکنش با آلکنها و آلکینها
آلکنها در فرآیندی با نام «ازنکافت» (Ozonolysis) به الکلها، آلدهیدها، کتونها و کربوکسیلیک اسیدها قابل تبدیل هستند:
همچنین به کمک اوزونکافت، آلکینها به اسید آنیدرید یا دیکتونها تبدیل میشوند. در صورتیکه این واکنشها در حضور آب اتفاق بیافتند، آنیدرید هیدرولیز و به دو کربوکسیلیک اسید تبدیل میشود:
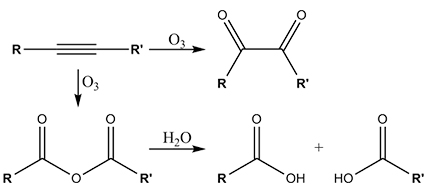
به طور معمول، اوزونکافت در محلول «دی کلرومتان» و در دمای انجام میشود. بعد از مجموعهای از واکنشها، «اوزونویید» به تولید میرسد. تحت واکنشهای کاهشی، آلدهیدها و کتونها تشکیل میشوند و تحت واکنش های اکسایشی، کربوکسیلیک اسیدها شکل میگیرند.
احتراق
از اوزون میتوان در واکنشهای احتراق (سوختن) استفاده کرد چراکه موجب تولید دمای بیشتری نسبت به سوختن با اکسیژن میشود. در معادله زیر، واکنش «سابنیترید کربن» (Carbon Subnitride) نشان داده شده است که در حضور ازن، دمای واکنش بیشتر خواهد بود:
تحت دماهای بسیار پایین نیز این ماده وارد واکنش میشود. به طور مثال در دمای ، اتم هیدروژن با ازن مایع واکنش و رادیکال هیدروژن سوپراکسید را شکل میدهد که در فرآیندهای دیمر شدن شرکت میکند:
واکنشهای کاربردی
از این ماده به منظور حذف آهن و منگنز از آب بهره میگیرند. در این واکنشها، فرآورده به صورت رسوب است و به سادگی با عمل فیلتراسیون از آب خارج میشود. علاوهبر این، ازن در اکسید کردن هیدروژن سولفید موجود در آب و تبدیل آن به «سولفورو اسید» (Sulfurous Acid) نیز کاربرد دارد. سه واکنشی که در پایین آورده شده است، هسته اصلی سیستمهای تصفیه آب مبتنی بر اوزون را تشکیل میدهند:
از ازن همچنین برای سمزدایی سیانور و تجزیه کامل اوره استفاده میشود:
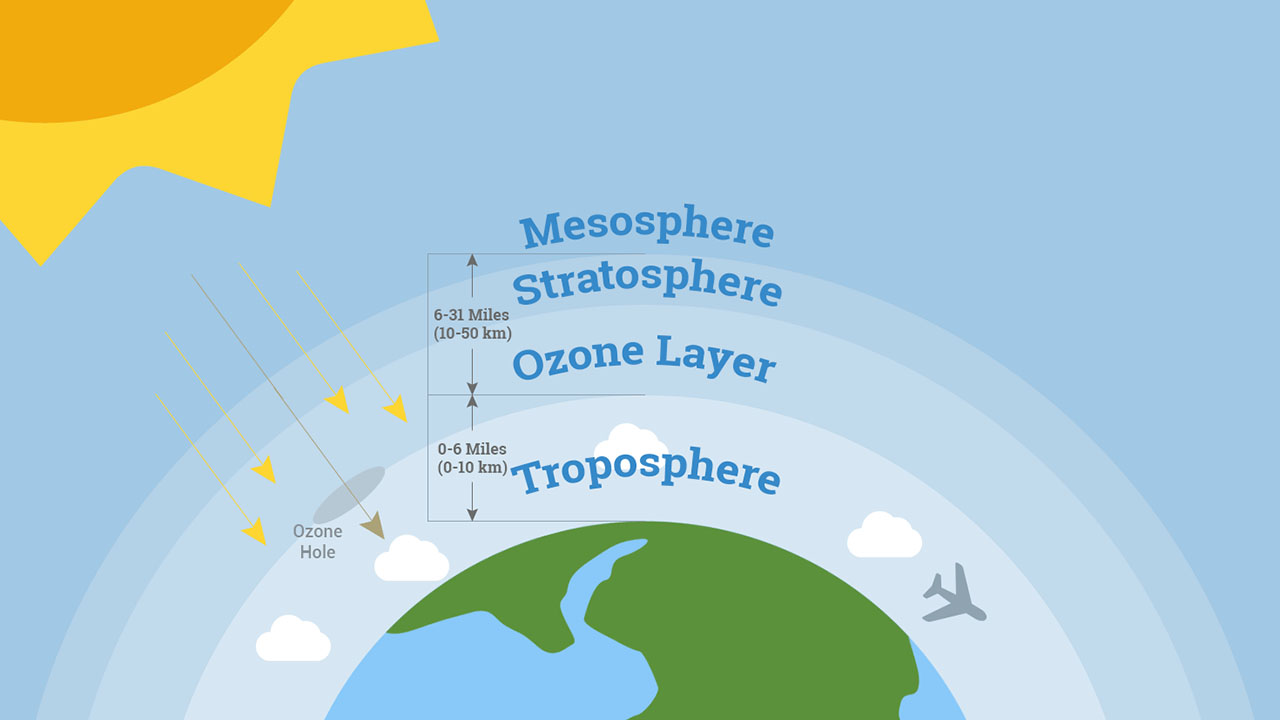
لایه اوزون
در فاصله ۱۰ تا ۵۰ کیلومتری از سطح زمین، جایی که آن را با نام استراتوسفر میشناسیم، بیشترین میزان از اوزون را خواهیم داشت که به لایه اوزون موسوم است.
حتی در لایه اوزون هم غلظت این ماده را بین ذکر کردهاند و بیشتر اکسیژن موجود در این لایه به شکل دیده میشود.
اوزونی که در استراتوسفر به تولید میرسد بیشتر از طریق موجهای کوتاه ماورابنفش بوجود میآید. فرآیند تولید و از بین رفتن ازون به نام «چرخه چاپمن» (Chapman Cycle) شناخته میشود. آغاز این چرخه با فوتولیز مولکول اکسیژن همراه است:
اکسیژن تولیدی با مولکول اکسیژن واکنش میدهد و اوزون تولید میکند.
مولکول ازن در نهایت با جذب فوتون، تجزیه و موجب تولید انرژی جنبشی (سینتیک) میشود:
این نوع تبدیل نور ماورا بنفش به انرژی جنبشی موجب گرم شدن استراتوسفر خواهد بود. اتمهای اکسیژن تولیدی در فرآیند فوتولیز با دیگر اتمها واکنش میدهند و به طور مجدد اوزون تولید میکنند. در جو و در زمانی که تنها نیتروژن و اکسیژن داشته باشیم، مولکول ازن در واکنش با اتم اکسیژن، موجب تولید دو موکلول میشود:
واکنش بالا دلیلی برای از بین رفتن ازن خواهد بود. این واکنش در حضور برخی رادیکالهای آزاد، کاتالیز میشود. این رادیکالها عبارتند از: «هیدروکسیل» ، مونواکسید نیتروژن، کلر و برم. در نیمه دوم قرن بیستم مقدار اوزون در استراتوسفر، رو به کاهش بود. دلیل این امر افزایش غلظت «کلرو فلوئورو کربن» (CFC) و همچنین مولکولهای آلی «کلرزده» (Chlorinated) و «برم زده» (Brominated) ذکر شد. در نتیجه این امر، تولید مواد از بین برنده اوزون بر اساس پروتوکل 1987 مونترال متوقف شد که موجب افزایش غلظت ازون استراتوسفر در دو دهه اول قرن 21 شد.

اهمیت اوزون در زمین
اوزون موجود در لایه اوزون موجب جذب نور خورشید با طول موج بین 200-315 نانومتر میشود. نور ماورا بنفش توسط اکسیژن و نیتروژن موجود در هوا نیز قابل جذب است اما لایه اوزون به این امر کمک میکند. نتیجه این امر، جذب طول موجهای موسوم به UV-C و UV-B خواهد بود. بخش کوچکی از نور ماورا بنفش مربوط به طول موجهای UV-B که توسط لایه اوزون جذب نشدهاست موجب آفتابسوختگی پوست انسان و تخریب DNA بافت موجودات زنده اعم از گیاهان و حیوانات خواهد شد. با وجود این، طول موجی که سبب آفتابسوختگی میشود، همان طول موجی است که برای تولید ویتامین D در بدن نیاز داریم.
لایه ازن تاثیر کمی در جذب طول موجهای بلندتر اشعه ماورا بنفش موسوم به UV-A دارد. البته این اشعه موجب تخریب DNA یا آفتابسوختگی نمیشود. برای بعضی از افراد این نور تخریب طولانی مدت پوست را به همراه دارد اما برای گیاهان و سلامت جانداران روی زمین خطرساز نیست.
اوزون تروپوسفری
ازن تروپوسفری یا «اوزون سطح پایین» (Low Level Ozone)، به عنوان آلاینده جو شناخته میشود. این گاز به طور مستقیم از موتور خودروها و کارخانههای صنعتی به تولید نمیرسد بلکه از طریق واکنش نور خورشید با هوای شامل هیدروکربن و اکسیدهای نیتروژن بوجود میآید. این واکنش موجب تولید ازن در محل واکنش و همچنین حمل آن توسط باد خواهد بود.
این گاز به طور مستقیم با برخی از هیدروکربنها مانند آلدهیدها وارد واکنش و موجب حذف خود از هوا میشوند اما فرآورده تولیدی عموما به صورت گرد و غبار و دوده شکل میگیرد. همچنین گرد و غبار تولیدی حاصل از فوتولیز ازون علت اصلی التهاب و قرمزی چشمها است. این گاز در حدود ۲۲ روز طول میکشد تا به صورت رسوباتی در سطح زمین تشکیل و از تروپوسفر حذف شود. علاوه بر این، شواهد نشان دادهاست که افزایش اوزون تروپوسفری موجب کاهش در تولید محصولات زراعی خواهد بود.
شهرهایی همچون دنور، کلرادو، هوستون، تگزاس و مکزیک از جمله آلودهترین شهرهایی هستند که غلظت اوزون در آنها بالاست و در میان آنها مکزیک جایگاه نخست را دارد.
اثرات تخریبی
گاز اوزون هر نوع پلیمری که شامل پیوندهای دوگانه در زنجیر کربنی خود باشد را مورد حمله قرار میدهد. محصولات لاستیکی همچون لاتکس، نیتریل رابر (NBR) و استایرن بوتادین (SBR) در معرض حملات اوزون قرار میگیرند. در نتیجه این حملات، شکافهایی در سطح این پلیمرها بوجود میآیند که در طول زمان بر عمق و وسعت آنها افزوده میشود. میزان این تخریب به غلظت ازن در جو و بار (وزن) متحمل شده توسط لاستیک وابسته است. این نوع از لاستیکها به کمک مواد «آنتی ازونانت» (Antiozonant)، همچون «وکس» (Wax)، در برابر تخریب اوزون محافظت میشوند.
آنتی اوزونانتها با تشکیل یک فیلم محافظ بر سطح لاستیکها یا ترکیب شدن با آنها، از حملات تخریبی ازن جلوگیری میکنند. این فرآیند تخریبی که با نام «کراکینگ اوزون» (Ozone Cracking) نیز شناخته میشود، از مشکلات جدی در تایر خودروها بوده که امروزه برطرف شده است. واشرها و اورینگهای لاستیکی که در سیستمهای هوای فشرده نقش حیاتی ایفا میکنند نیز در معرض حملات ازن قرار میگیرند. شلنگهای بنزین در خودروها که از موادی مقاوم تهیه شدهاند نیز در معرض این حملات قرار دارند مخصوصا در قسمتهای الکتریکی موتور چراکه که به هنگام کار کردن موجب تولید این گاز میشوند. انبار کردن مواد لاستیکی در کنار الکتروموتورهای برق مستقیم موجب افزایش کراکینگ اوزون میشود چراکه کموتاتور این موتورها به هنگام کارکرد، جرقههایی ایجاد میکنند که در تولید گاز اوزون موثر هستند.

اوزون به عنوان گاز گلخانهای
با وجود اینکه میزان اُزن در سطح زمین حتی قبل از انقلاب صنعتی وجود داشته است، اما امروزه پیک غلظت در برخی موارد بسیار بیشتر از گذشته است و در مواردی حتی میزان این غلظتها از منشا اصلی تولیدی خود هم فراتر رفتهاند. ازون با جذب برخی انرژیهای فروسرخ متساعد شده از زمین، به عنوان گاز گلخانهای عمل میکند. البته اندازهگیری قابلیت ازن به عنوان گاز گلخانهای کاری دشوار است زیرا با غلظتهای یکسان و ثابت در زمین وجود ندارد اما به هر صورت، منابع علمی زیست محیطی، اثرات تابشی اوزون تروپوسفری را در حدود 25 درصد دیاکسید کربن ذکر کردهاند.
«پتانسیل گرمایش جهانی» (Global Warming Potential)، برای هر مولکول اُزن در تروپوسفر، در حدود 1000 برابر قویتر از مولکول دیاکسید کربن است اما اُزن تروپوسفری، عمر کمی دارد و بسیار سریعتر از دیاکسید کربن تجزیه میشود. این بدان معنی است که پتانسیل گرمایش جهانی (GWP) برای اوزون تروپوسفری بسیار پایینتر از مقدار ذکر شده در بالا است. به همین خاطر، اُزن تروپوسفری، تاثیر شدیدی بر گرمایش زمین ندارد اما اثرات تابشی شدیدی در مقیاسهای منطقهای دارد. در مناطقی از دنیا، این اثرات تا 150 درصد بیشتر از اثرات گاز کربن دیاکسید ذکر شده است.
اثرات بر سلامتی انسان
در دهههای اخیر، دانشمندان مطالعاتی در خصوص اثرات بلندمدت و کوتاهمدت گاز اوزون بر سلامتی انسان انجام دادهاند. بسیاری از مطالعات بر این مطلب تاکید دارند که میزان این گاز در مناطق شهری به گونهای است که برای سلامتی افراد ساکن در آن خطرآفرین و اثرات مخرب ازون بر قلب و سیستمهای تنفسی و عصبی اثبات شده است. مرگ زودرس و مشکلات باروری از جمله مسائلی است که رد پای این گاز در آن دیده میشود.
جمعیت در معرض خطر
انجمن ریه آمریکا، پنج گروه جمعیتی را که در معرض خطر تنفس اُزن قرار دارند مشخص کرده است:
- کودکان و نوجوانان
- افراد بالای 65 سال
- افرادی که در محیطهای بیرون کار میکنند
- افرادی که دارای بیماریهای ریوی همچون برونشیت مزمن هستند
- بیماران قلبی
مطالعات بیشتر حاکی از آن است که زنان بویژه آنهایی که با اضافه وزن روبرو هستند، از جمله گروههای در معرض خطر شمرده میشوند.
آلودگی هوا با اوزون
«پریکرسرهای اوزون» (Ozone Precursors) موجب تولید گروهی از آلودگیها هستند که به طور ویژه از احتراق سوختهای فسیلی بوجود میآیند. همانطور که توضیح داده شد، اوزون تروپوسفری حاصل فعالیت اشعه ماورا بنفش و همچنین پریکرسر (مواد کیمیاوی) اوزون در سطح زمین بیشتر حاصل واکنش سوختهای فسیلی است. متان را میتوان به عنوان یک پریکرسر طبیعی در نظر گرفت. شواهد مختلفی حاکی از این امر هستند که اوزون تروپوسفری اثرات مخربی بر عملکرد ریهها و همچنین التهاب سیستم تنفسی دارد.
افرادی که به مدت طولانی در معرض این گاز قرار گرفتهاند، با خطر مرگ بر اثر بیماریهای ریوی مواجه خواهند بود. بررسیها روی 450 هزار بیمار در طول یک دوره ۱۸ ساله، وجود ارتباط بین سطح ازن و بیماریهای تنفسی را اثبات کرده است به گونهای که در برخی افراد، خطر مرگ بر اثر بیماریهای ریوی تا 30 درصد افزایش مییابد.

تولید آزمایشگاهی اوزون
در آزمایشگاه میتوان ازن را به کمک یک باتری کتابی ۹ ولت، نوک مداد به عنوان کاتد، سیم پلاتینی به عنوان آند و سولفوریک اسید ۳ مولار به عنوان الکترولیت تولید کرد. نیمواکنشها در سلول به صورت زیر خواهند بود:
کاربردهای اوزون
بیشترین استفادههای ازن در داروسازی، روانکارهای مصنوعی، میکروبکشها و سفیدکنندهها است. همچنین از این گاز برای کشتن میکروبها در هوا و آب نیز استفاده میشود. در موارد معدودی از این گاز بمنظور درمان برخی بیماریها و سرطان نیز بهره میگیرند. ازن کاربردهای دیگری نیاز دارد که در زیر آمدهاند:
- ضدعفونی کردن البسه بیمارستانی، کارخانجات صنایع غذایی و ...
- ضدعفونی آب به جای استفاده از کلر
- از بین بردن باکتریهای غذا یا باکتریهای موجود در سطوح
- از بین بردن لارو حشرات در انبارهای غلات و حبوبات
- شستشوی سبزیجات و میوههای تازه برای از بین بردن قارچ، کپک و باکتری
- ضدعفونی کردن آب استخر
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- آبکاری — به زبان ساده
- خوردگی فلزات در شیمی — به زبان ساده
^^













سلام و درود
گاز اوزون بیرنگ هستش و اوزون مایع هستش که ابیرنگه
اون گاز اکسژنه که بیرنگه و گرنه اوزن در حالت گازی ابی کم رنگه و در حالت مایع ابی پر رنگه
درود
ای کاش عدداکسایش و بار قراردادی اکسیژن های اوزون را نیز بررسی نموده بودید. بدرود
با سلام؛
برای آشنایی با این موضوعات میتوانید مطالب زیر را مطالعه کنید.
بار قراردادی چیست؟ — به زبان ساده
عدد اکسایش و تعیین آن — به زبان ساده (+ دانلود فیلم آموزش گام به گام)
با تشکر