کلسترول چیست؟ – هر آنچه باید بدانید
کلسترول یک مولکول آلی است و ساختمانی مشابه چربیها دارد که در تمام سلولهای بدن یافت میشود. این مولکول از جنس استرول است که گونهای از لیپیدها هستند. کلسترول توسط سلولهای جانوری ساخته میشود و یکی از اجزای ضروری ساختمان غشای سلولی در این جانداران به شمار میآید.


کلسترول چیست؟
«کلسترول» (Cholesterol) یک استرول مهم (ترکیبی از استروئید و الکل) و یک چربی خنثی است که به عنوان ماده اصلی تشکیل دهنده غشای سلولی حیوانات به شمار میآید و به عنوان پیشساز هورمونهای مهم و سایر مواد عمل میکند. کلسترول، به عنوان استرول اصلی در کلیه سلولهای مهرهداران وجود دارد. کلسترول در مقادیر کمی نیز در غشاهای گیاهی یافت میشود.
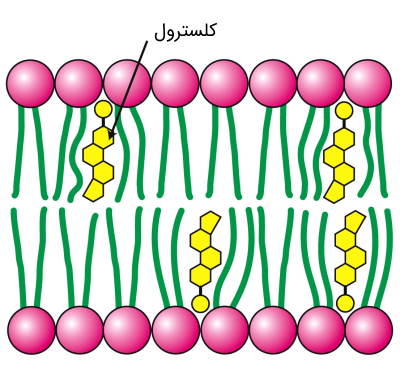
نام کلسترول از ترکیب کلمات یونانی «Chole» (به معنای صفرا) و «Stereos» (به معنای جامد) و پسوند شیمیایی «ول» (به دلیل الکلی بودن ساختار آن)، خلق شده است. دلیل این نامگذاری این بود که محققان برای اولین بار کلسترول را به صورت جامد در سنگهای صفراوی در سال 1784 شناسایی کردند.
اگرچه کلسترول به دلیل نقش خود در تأثیرگذاری بر بیماریهای قلبی و عروقی در انسان، به عنوان یک مولکول مضر شناخته میشود، اما وجود کلسترول برای عملکرد صحیح سلولها لازم است و این مولکول وظایف مهمی را در سلولها به عهده دارد.
کلسترول در ترمیم بافتها، تقویت غشاهای سلولی و تأثیر بر سیالیت آنها و تولید نمکهای صفراوی نقش دارد و از طرفی به عنوان پیشساز هورمونهای استروئیدی (شامل استروژن، تستوسترون، کورتیزون) و ماده اولیه تولید ویتامین D در بدن مورد استفاده قرار میگیرد.
در حالی که کلسترول در بسیاری از فرآیندهای بیوشیمیایی نقش اصلی را ایفا میکند، اما این مولکول بیشتر به دلیل ارتباط بیماریهای قلبی و عروقی با الگوهای مختلف انتقال کلسترول (به وسیله لیپوپروتئینها) و سطح بالای کلسترول در خون شناخته میشود.
کلسترول در خون نامحلول است، اما در سیستم گردش خون به یکی از انواع لیپوپروتئین متصل شده و به قسمتهای مختلف بدن منتقل میشود. لیپوپروتئینها ذرات کروی هستند که در قسمت بیرونی ساختمان خود از پروتئینهای محلول در آب تشکیل شدهاند و بخش درونی آنها را ترکیبات لیپیدی و کلسترولها تشکیل میدهند.
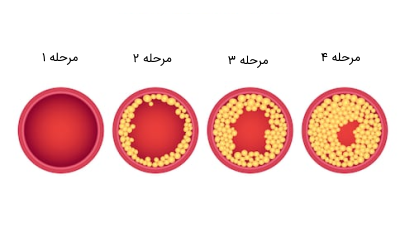
میزان کلسترول در خون میتواند بر رشد پلاکها در رگها و ابتلا به بیماری تصلب شرایین یا «آترواسکلروتیک» (Atherosclerosis) تاثیرگذار باشد. رسوب این پلاکها بر روی دیواره رگهای خونی باعث باریک شدن رگها، به خصوص رگهای کرونری شده که در نهایت باعث کاهش سرعت جریان خون، انسداد رگها و سکته میشود.
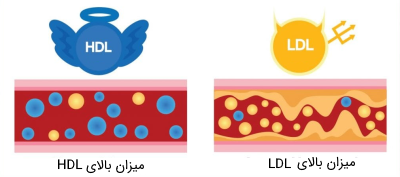
در سالهای اخیر، اصطلاح «کلسترول بد» برای کلسترولهای حاوی LDL به کار میرود. LDL لیپوپروتئینهایی با چگالی کم هستند. بر طبق فرضیه لیپید، تصور میشود که این لیپوپروتئین عملکردهای مضری در بدن دارد، در حالی که لیپوپروتئین با چگالی بالا یا HDL که به عنوان «کلسترول خوب» شناخته میشود، اقدامات مفیدی را در بدن انجام میدهد.
کلسترول میتواند مستقیماً از رژیم غذایی یا از طریق بیوسنتز در بدن حاصل شود. مصرف مواد غذایی دارای کلسترول به دلیل مکانیسمهای تنظیم کننده، عامل اصلی مؤثر بر افزایش کلسترول خون نیست، بلکه مصرف چربیهای اشباع در رژیم غذایی موجب افزایش کلسترول در خون میشوند.
ساختمان کلسترول
کلسترول یک ترکیب ۴ حلقهای با ۲۷ اتم کربن است. این ترکیب یک لیپید است که از چهار حلقه هیدروکربنی برای تشکیل یک ساختار استروئیدی استفاده میکند. در یک انتهای ساختمان کلسترول دم هیدروکربنی وجود دارد و در انتهای دیگر آن یک استروئید و یک گروه هیدروکسیل قرار گرفتهاند. گروه هیدروکسیلی میتواند برای اتصال به اکسیژنِ کربونیل فسفولیپیدها و اسفنگولیپیدها، پیوند هیدروژنی تشکیل دهد. کلسترول به دلیل این که از دو بخش استروئید و الکل ساخته شده است، در گروه استرولها جای میگیرد.

انواع کلسترول
همان طور که در بالا اشاره شد، کلسترولها به صورت آزاد در جریان خون حرکت نمیکنند. کلسترولها به همراه لیپوپروتئینها در خون حمل میشوند. سه نوع لیپوپروتئین وجود دارد که براساس میزان پروتئینهای سطحی در گروههای متفاوتی، دستهبندی میشوند:
- لیپوپروتئين با چگالی کم (LDL): این نوع لیپوپروتئین دارای میزان بالایی از کلسترول است. میزان بالای LDL در خون به دلیل ایجاد پلاکهای کلسترولی در رگهای خونی، موجب افزایش خطر ابتلا به بیماریهای قلبی و عروقی و سکته میشود. LDL، کلسترولها را از کبد و سایر بافتهای بدن به رگهای خونی میآورد.
- لیپوپروتئین با چگالی زیاد (HDL): این لیپوپروتئین از مقادیر بالایی از پروتئین در سطح خود تشکیل شده و کلسترولهای کمی را با خود حمل میکند. نسبت بالای HDL به LDL در خون در حفظ سلامت قلب و عروق و جلوگیری از سکته بسیار موثر است. HDL وظیفه جمعآوری کلسترولها از رگها و بخشها مختلف بدن را بر عهده دارد و آنها را به کبد منتقل میکند.
- لیپوپروتئین با چگالی بسیار کم (VLDL): این نوع از لیپوپروتئینها نسبت به سایر لیپوپروتئینها، دارای میزان بسیار کمی از پروتئینهای سطحی هستند. VLDLها به عنوان پیشساز LDLها شناخته میشوند و مانند LDLها در ایجاد رسوب و تشکیل پلاک در رگها دخیل هستند.
کلسترول کل
کلسترول کل یا «کلسترول تام» (Total Cholesterol) خون از اندازهگیری HDL ،LDL و VLDL در گردش خون محاسبه میشود. VLDL پیشساز LDL یا کلسترول بد خون به شمار میآید. محاسبه کلسترول کل خون در کنار سایر فاکتورهای خونی در تشخیص حملات قلبی موثر است.
منابع کلسترول
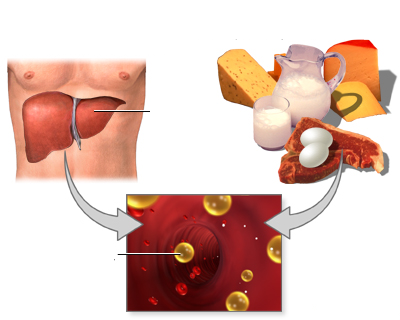
دو منبع اصلی کلسترول در انسان، شامل کلسترول موجود در رژیم غذایی و سنتز کلسترول از چربیها، کربوهیدراتها و پروتئینها در کبد است. علاوه بر این، برخی از انواع کلسترولها نیز در بخشهای دیگری از بدن به ویژه در غدد آدرنال و غدد موجود در اندامهای تولید مثلی، ساخته میشوند.
کلسترول میتواند به صورت آزاد در بدن وجود داشته باشد یا به شکل یک ترکیب استری که از یک اسید چرب متصل به گروه هیدروکسیل (با یک پیوند استری) تشکیل شده است، در بدن یافت شود.
کلسترول در بافتهایی از بدن که میتوانند بیشتر کلسترول را بسازند و آن دسته از بافتهایی که دارای غشاهای متراکمی هستند، وجود دارد. از این دسته بافتها میتوان به بافتهای کبد، نخاع، مغز و پلاکهای رگها اشاره کرد.
تمام مواد غذایی حاوی چربیهای حیوانی دارای کلسترول هستند. مواد غذایی که چربیهای حیوانی ندارند، به طور کلی دارای کلسترولهای بسیار ناچیزی هستند. منابع اصلی رژیم غذایی کلسترول شامل تخم مرغ، گوشت و لبنیات است.
گیاهان مقدار کمی کلسترول دارند، بنابراین حتی یک رژیم غذایی وگان (گیاهخواری) که شامل غذاهایی با منشا حیوانی نیست، مقادیر ناچیزی کلسترول دارد. برای مثال، برای مصرف مقدار کلسترول موجود در یک تخم مرغ از طریق منابع گیاهی، باید 9/6 لیتر روغن بادام زمینی خالص استفاده کرد. برخی از ترکیبات گیاهی مانند بذر کتان و بادام زمینی دارای ترکیبات کلسترولی به نام «فیتواسترولها» (Phytosterol) هستند که در کاهش کلسترول سرمی تاثیر مثبت میگذارند.
سنتز و مصرف کلسترول
وجود کلسترول برای عملکرد طبیعی سلولی در غشای سلولهای پستانداران ضروری است. کلسترول، استرول اصلی در بافتهای حیوانات و رایجترین استرول در سلولهای یوکاریوتی به شمار میآید.
کلسترول در شبکه آندوپلاسمی سلولهای یوکاریوتی سنتز میشود. علاوه بر این، جانوران اغلب ترکیبات کلسترولی را میتوانند از رژیم غذایی خود دریافت کنند که در این حالت توسط لیپوپروتئینهای با چگالی کم یا LDL در جریان خون به گردش در میآیند. این لیپوپروتئینهای کلسترولی توسط گیرندههای اندوسیتوزی که در چالههای پوشیده شده با کلاترین قرار دارند، وارد سلولها میشوند و در لیزوزومهای سلولی مورد هیدرولیز قرار میگیرند.
کلسترول از ترکیب استیل کوآنزیم A (استیل CoA) از طریق مسیر HMG-CoA ردوکتاز در بسیاری از سلولها و بافتها سنتز میشود. حدود 20-25 درصد از کل تولید روزانه کلسترول (1 گرم در روز) در کبد رخ میدهد. بافتهای دیگری که معمولا میزان بیشتری کلسترول در آنها سنتز میشود، شامل رودهها، غدد فوق کلیوی و اندام تولید مثلی هستند. برای یک فرد با وزنی در حدود 68 کیلوگرم، مقدار کل محتوی کلسترول بدن در حدود 35 گرم، تولید داخلی روزانه حدود 1 گرم و میزان کلسترولی که اغلب از رژیم غذایی روزانه دریافت میشود، 200 تا 300 میلیگرم تخمین زده شده است. کلسترولهای دریافتی از رژیم غذایی درون روده به شکل اسیدهای صفراوی تبدیل شده و به این ترتیب 92-97 درصد کلسترول مجدداً در روده جذب میشود و از طریق گردش خون رودهای دوباره به گردش خون برمیگردد.
مراحل سنتز کلسترول
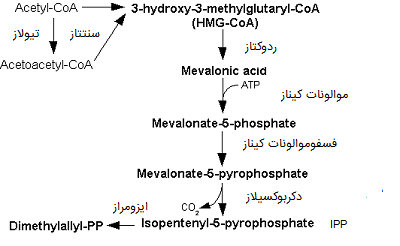
آنزیمها و ترکیبات متعددی در مراحل سنتز کلسترول در سلولهای بدن دخیل هستند که در بررسی مراحل سنتز کلسترول به آنها میپردازیم. فرایند سنتز کلسترول را میتوان شامل ۵ مرحله اصلی در نظر گرفت:
- استیل-CoA طی واکنشی که با آنزیم HMG-CoA سنتتاز کاتالیز میشود، به 3-هیدروکسی-3-متیل گلوتاریل کوآنزیم آ (HMG-CoA) تبدیل میشوند.
- HMG-CoA میتواند «موالونات» (Mevalonate) را با کمک آنزیم ردوکتازی تولید کند.
- در این مرحله موالونات به مولکول مبتنی بر ایزوپرن، به نام ایزوپنتنیل پیروفسفات (IPP) تبدیل میشود.
- مولکولهای IPP طی چندین واکنش آنزیمی «اسکوالن» (Squalene) را میسازند.
- اسکوالن سرانجام با کاتالیز آنزیم ۷- هیدروکسی کلسترول ردوکتاز کلسترول را سنتز میکند.
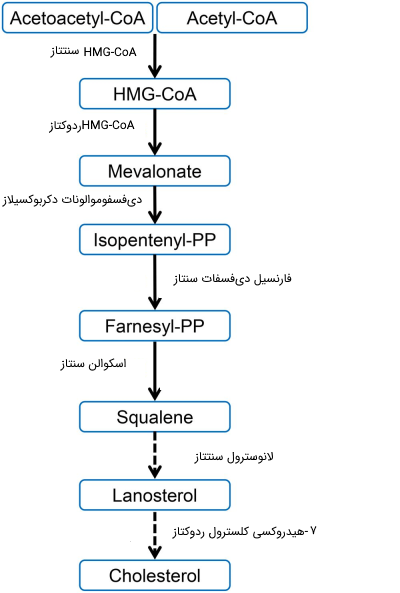
سنتز HMG-CoA
واحدهای «استیل-CoA» توسط یک سری واکنشهایی که با تشکیل «هیدروکسی متیل گلوتاریل کوآنزیم آ» (HMG-CoA) آغاز میشوند، موالونات را میسازد. بر خلاف HMG-CoA که در طول سنتز اجسام کتونی (کتون بادی) در میتوکندری تشکیل میشود، این فرم از HMG-CoA در سیتوپلاسم سنتز میشود. با این حال، مسیر و آنزیمهای لازم در هر دو فرایند (در میتوکندری و سیتوپلاسم) مشابه هم هستند.
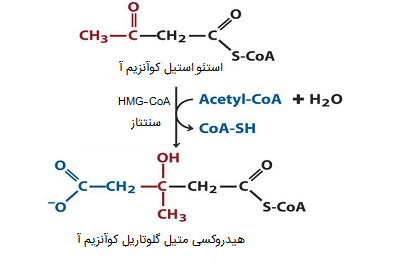
دو مولکول استیل CoA در طول واکنش «تیولاز» متراکم میشود و «استئواستیل CoA» را تشکیل میدهد. آنزیم سیتوپلاسمی تیولاز که در بیوسنتز کلسترول دخیل است، «استواستیل- CoA تیولاز» (استیل- CoA استیل ترانسفراز 2) نام دارد که توسط ژن «ACAT2» رمزگذاری شده است. اگرچه بخش عمدهای از استئواستیل CoA از طریق این فرآیند بدست میآید، اما ممکن است برخی از استئواستیل CoAها در طول فرایند کتوژنز نیز تولید شوند. استئواستیل CoA و مولکول سوم استیل CoA در کنار یکدیگر به HMG-CoA تبدیل میشوند. آنزیم HMG-COA سنتتاز از ژنی با همین نام در کروموزوم (5q12) ساخته میشود و شامل دو ایزوفرم با تعداد اسیدآمینههای ۵۲۰ و ۴۷۸ است.
سنتز موالونات
HMG-CoA تولید شده در مرحله قبل سپس توسط آنزیم «هیدروکسی متیلگلوتاریل کوآنزیم آ ردوکتاز» (HMGR) به «موالونات» تبدیل میشود (این آنزیم به غشای شبکه آندوپلاسمی متصل است). HMGR برای فعالیت خود کاملاً به NADPH وابسته است و به عنوان یک کوفاکتور از دو مولکول NADPH در تولید موالونات استفاده میکند.
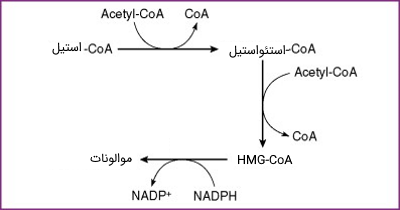
واكنش كاتاليز شده توسط HMGR، مرحله محدود كننده سرعت در بيوسنتز كلسترول است و اين آنزيم در معرض كنترلهای تنظيمی بسیاری قرار دارد كه در ادامه در مورد آنها بحث میکنیم.
آنزیم رودکتاز از چند طریق مورد تنظیم قرار میگیرد:
- سرعت سنتز mRNA آنزیم به وسیله عناصر کنترلی استرولی تنظیم میشود
- فعالیت این آنزیم تحت تاثیر دو هورمون انسولین و گلوکاگون قرار دارد.
- مصرف داروهایی مانند «استاتین» (Statin) به عنوان سوبسترا و مهارکننده رقابتی در فعالیت آنزیم HMGR و سنتز کلسترول موثر هستند.
آنزیم HMGR از ژنی با همین نام که بر روی کروموزوم (5q13.3) قرار دارد، کد میشود و دارای دو ایزوفرم است که به ترتیب ۸۸۸ و ۸۳۵ اسید آمینه را کد میکنند.
موالونات پس از سنتز، با دو واکنش فسفوریلاسیون متوالی (که توسط موالونات کیناز، و فسفوموالونات کیناز کاتالیز میشوند) به شکل فعال در میآید. ترکیبات حاصل از فعالیت این آنزیمها، به این ترتیب شامل «۵ - فسفات موالونات» و «5 - دیفسفات موالونات» (این ترکیب 5 -پیروفسفوموالونات یا موالونات - ۵ - پروفسفات نامیده میشود) هستند. در انسان، موالونات کیناز آنزیمی است که در پراکسیزوم جای دارد و توسط ژن MVK رمزگذاری میشود. ژن MVK بر روی کروموزوم (12q24) قرار دارد. فسفوموالونات کیناز نیز یک آنزیم پراکسیزومی است و از ژن PMVK بدست میآید. ژن PMVK بر روی کروموزوم (1q22) قرار دارد و یک پروتئین ۱۹۲ اسید آمینهای را رمز گذار میکند.
سنتز ایزوپنتنیل پیروفسفات
به دنبال شکلگیری «5 - دی فسفات موالونات»، در طی دکربوکسیلاسیون وابسته به ATP، «ایزوپنتنیل پیروفسفات» (IPP) که یک مولکول ایزوپرونوئید فعال است، تولید میشود. سنتز IPP توسط «دیفسفوموالونات دکربوکسیلاز » (که به آن موالونات - 5 - پیروفسفات دکربوکسیلاز نیز گفته میشود) کاتالیز میشود. ژن دیفسفوموالونات دکربوکسیلاز روی کروموزوم (16q24.3) قرار دارد و از 13 اگزون تشکیل شده است که یک پروتئین 400 اسید آمینه را رمزگذاری میکند. ایزوپنتنیل پیرو فسفات از طریق عمل آنزیم ایزومراز با «ایزوپنتنیل-دیفسفات دلتا ایزومراز» (همچنین به آن ایزومراز ایزوپنتنیل پیرو فسفات میگویند) در تعادل است.
سنتز اسکوالن
یک مولکول IPP با یک مولکول «دیمتیل پیروفسفات» برای تولید «گرانیل پروفسفات» (GPP) ترکیب شده و سپس GPP تولیدی با یک مولکول IPP دیگر برای تولید «فارنسیل پیروفسفات» (FPP) متراکم میشود. سنتز هر دو مولکول گرانیل پروفسفات و فارنسیل پیروفسفات توسط آنزیم «فارنسیل دیفسفات سنتاز» کاتالیز میشود. فارنسیل دیفسفات سنتاز از ژن (FDPS) گرفته شده است که بر روی کروموزوم (1q22) قرار دارد و از 11 اگزون تشکیل شده است و پنج mRNA مختلف با قطعات متناوب ایجاد میکند که در کنار هم، سه ایزوفرم مختلف آنزیم را رمزگذاری میکنند.
سنتز اسکوالن، از فارنسیل پیروفسفات اولین مرحله اختصاصی کلسترول در مسیر سنتز آن است. سنتز اسکوالن توسط آنزیم وابسته به NADPH، یعنی آنزیم «فارنسیل دی فسفات فارنسیل ترانسفراز 1» (که معمولاً آن را اسکوالن سنتاز مینامند) کاتالیز میشود. اسکوالن یک ترکیب ۳۰ کربنی است.
این آنزیم توسط ژن (FDFT 1) که بر روی کروموزوم (8p23.1) قرار دارد کد میشود. ژن FDFT 1 از ۱۴ اگزون تشکیل شده است که 11 mRNA با قطعات متناوب تولید میکنند. این 11 mRNA مختلف رمزگذاری شده توسط ژن FDFT 1، به طور جمعی پنج ایزوفرم مختلف فارنسیل دیفسفات فارنسیل ترانسفراز 1 را سنتز میکنند.
سنتز کلسترول از اسکوالن
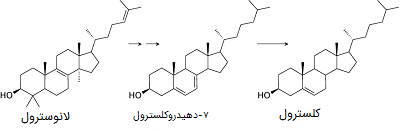
اسکوالن دو مرحله حلقوی شدن را طی میکند تا به «لانوسترول» تبدیل میشود. اولین واکنش زمانی اتفاق میافتد که اسکوالن توسط آنزیم «اسکوالن اپوکسیداز» (SQLE) (به این آنزیم اسکوالن مونو اکسیژناز نیز میگویند) کاتالیز میشود. این آنزیم از NADPH به عنوان کوفاکتور استفاده میکند. در مرحله دوم «حد واسطهای اپوکساید» تولید شده در مرحله قبل، توسط آنزیم «لانوسترول سنتتاز» (LSS) لانوسترول را تولید میکنند. آنزیم اسکوالن اپوکسیداز از ژن (SQLE) ساخته میشود که در کروموزوم (8q24.13) قرار دارد. پروتئین این آنزیم دارای ۵۷۴ اسید آمینه است. لانوسترول سنتتاز در ژن (LSS) بر روی کروموزوم (21q22.3) قرار دارد.
در طول ۱۹ واکنش دیگر، لانوسترول به کلسترول تبدیل میشود. این ۱۹ واکنش توسط ۹ آنزیم متفاوت که در شبکه آندوپلاسمی و پراکسیزوم قرار گرفتهاند، کاتالیز میشوند. آخرین مرحله از بیوسنتز کلسترول به وسیله آنزیم «۷- دهیدروکلسترول ردوکتاز » انجام میشود.
تنظیمات بیوسنتز کلسترول
بیوسنتز کلسترول مستقیماً توسط کلسترول موجود در خون تنظیم میشود، علاوه بر این، مکانیسمهای هموستاز نیز در این تنظیمات دخیل هستند.
مصرف بیشتر مواد غذایی حاوی کلسترول، منجر به کاهش بیوسنتز کلسترول در بدن میشود، در حالی که تامین کمتر کلسترول از مواد غذایی، اثر متضاد دارد. اما کلسترول موجود در رژیم غذایی که از مصرف چربیهای اشباع در غذاها تامین میشود، عامل کلیدی در سطح سرمی کلسترول نیست.
مکانیسم اصلی نظارتی برای بیوسنتز کلسترول، سنجش کلسترول داخل سلولی در شبکه آندوپلاسمی است که توسط پروتئین (SREBP) انجام میشود. این پروتئین در واقع عنصر استرولی تنظیمی متصل شونده به پروتئین یک و دو (Sterol Regulatory Element Binding Protein 1 and 2) است. در حضور کلسترول، SREBP به دو پروتئین دیگر متصل میشود که این پروتئینها شامل SCAP (پروتئین فعال کننده شکاف SREBP) و پروتئین Insig-۱ هستند.
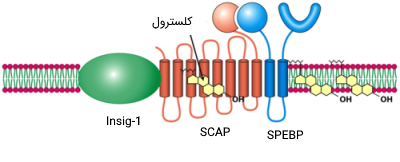
هنگامی که سطح کلسترول کاهش مییابد، پروتئین Insig-1 از مجموعه SREBP-SCAP جدا میشود و به این کمپلکس پروتئینی اجازه میدهد تا به دستگاه گلژی برود، جایی که SREBP توسط S1P و S2P (جایگاه 1/2 پروتئاز) شکافته میشود. پروتئینهای S1P و S2P دو آنزیمی هستند که در هنگام کاهش سطح کلسترول بدن توسط پروتئین SCAP فعال میشوند.
SREBP شکاف یافته سپس به هسته مهاجرت میکند و به عنوان یک فاکتور رونویسی وارد عمل میشود تا به عنصر تنظیم کننده استرولی (SRE) تعدادی از ژنها بپیوندد و بتواند رونویسی را در آنها تحریک کند. در بین این ژنهای رونویسی، گیرنده LDL و آنزیم هیدروکسی متیلگلوتاریل کوآنزیم آ ردوکتاز (HMG-CoA Reductase) وجود دارند. آنزیم HMG-CoA ردوکتاز منجر به افزایش تولید دورنی کلسترول در بدن میشود.
متوسط میزان کلسترول خون با افزایش سن تغییر میکند. به طور معمول میزان کلسترول بدن به تدریج با افزایش سن تا حدود ۶۰ سالگی در حال افزایش است. علاوه بر این به نظر میرسد، تغییرات فصلی بر میزان کلسترول در بدن انسان تاثیر گذار است، به طوری که این میزان در زمستان بیشتر میشود. در جدول زیر میزان انواع کلسترول طبیعی در افراد با توجه به سن و جنسیت آورده شده است.
| سن | کلسترول کل | کلسترولهای غیر HDL | LDL | HDL |
| کمتر از ۲۰ سال | کمتر از ۱۷۰ میلیگرم در دسیلیتر | کمتر از ۱۲۰ میلیگرم در دسیلیتر | کمتر از ۱۰۰ میلیگرم در دسیلیتر | بیش از ۴۵ میلیگرم در دسیلیتر |
| مردان بالاتر از ۲۰ سال | از ۱۲۵ تا ۲۰۰ میلیگرم در دسیلیتر | کمتر از ۱۳۰ میلیگرم در دسیلیتر | کمتر از ۱۰۰ میلیگرم در دسیلیتر | ۴۰ میلیگرم در دسیلیتر |
| زنان بالاتر از ۲۰ سال | از ۱۲۵ تا ۲۰۰ میلیگرم در دسیلیتر | کمتر از ۱۳۰ میلیگرم در دسیلیتر | کمتر از ۱۰۰ میلیگرم در دسیلیتر | ۵۰ میلیگرم در دسیلیتر |
دفع کلسترول
کلسترول از کبد به صفرا دفع شده و مجدداً از روده جذب میشود. در شرایط خاص، هنگامی که اسیدهای صفراوی در کیسه صفرا غلیظتر باشند، کلسترولها در کیسه صفرا کریستالیزه میشوند و ماده اصلی تشکیل دهنده اکثر سنگهای کیسه صفراوی را تشکیل میدهند. تعداد کمی از سنگهای صفراوی نیز منشا لسیتین و بیلی روبین دارند.
مایعات بدن، LDL و HDL
کلسترول در آب به میزان کمی حل میشود، به همین دلیل این مولکول نمیتواند در جریان خون که محیطی آبی است به راحتی به گردش در آید. در عوض، کلسترولها توسط لیپوپروتئینها (به چمدانهای مولکولی نیز معروف هستند) که محلول در آب هستند، در گردش خون بدن جریان پیدا میکنند. در لیپوپروتئینها، کلسترولها و تری گلیسیریدها قرار میگیرند.
آپولیپوپروتئین که بخش سطحی لیپوپروتئینها را تشکیل میدهند، تعیین میکنند که از کدام سلولها باید کلسترول خارج شود و کلسترول در کدام سلولها باید به صورت ذخیره باقی بماند.
بزرگترین لیپوپروتئینها، که در درجه اول چربیها را از مخاط روده به کبد منتقل میکنند، «شیلومیکرونها» (Chylomicrons) نامیده میشوند. آنها اکثراً چربیهایی به شکل تریگلیسیرید و کلسترول را با خود حمل میکنند.
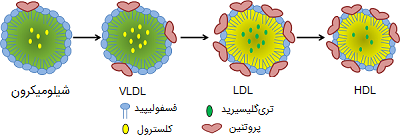
در کبد، ذرات شیلومایکرون تریگلیسیریدها و مقداری از کلسترولها را آزاد میکنند. کبد متابولیتهای غذایی سوزانده نشده را به لیپوپروتئینهای با چگالی بسیار کم (VLDL) تبدیل کرده و آنها را در پلاسمای خون ترشح میکند که در آنجا به ذرات لیپوپروتئین با چگالی کم (LDL) و اسیدهای چرب غیر استری تبدیل میشوند و میتوانند بر سایر سلولهای بدن تأثیر بگذارد. در افراد سالم، ذرات نسبتاً کمی LDL بزرگ وجود دارد. در حالی در افرادی با کلسترول خون بالا که تعداد زیادی ذرات LDL کوچک متراکم در گردش خون خود دارند، احتمال ابتلا به بیماریهای قلبی و عروقی در آنها به شدت افزایش مییابد، به همین دلیل، به LDL، کلسترول بد گفته میشود.
ذرات لیپوپروتئین با چگالی بالا (HDL) کلسترول را برای دفع به کبد منتقل میکنند، اما نحوه عملکرد آنها برای انجام این کار بسیار متفاوت است. وجود تعداد زیادی از ذرات بزرگ HDL در خون با حفظ سلامت قلب و عروق ارتباط دارد و از این رو معمولاً HDL، کلسترول خوب نامیده میشود. در مقابل، وجود مقادیر کمی از ذرات HDL بزرگ با پیشرفت بیماری گرفتگی در عروق همراه است.
میزان طبیعی کلسترول خون
در آزمایشهای خونی روتین، میزان چربیها و کلسترولهای خون برای بررسی سلامت قلب و متابولیسم فرد مورد بررسی قرار میگیرد. در جدول زیر میزان سالم و ناسالم انواع کلسترولها در خون آورده شده است.
| نوع کلسترول | محدوده مجاز | مرز خطر | بالا |
| کلسترول کل | > 200 میلیگرم در دسیلیتر | 200 - 239 میلیگرم در دسیلیتر | < 240 میلیگرم در دسیلیتر |
| HDL | > 40 یا ۵۰ میلیگرم در دسیلیتر | -- | < 60 میلیگرم در دسیلیتر |
| LDL | 100 - 129 میلیگرم در دسیلیتر | 130 - 159 و 160 - 189 میلیگرم در دسیلیتر | < 190 میلیگرم در دسیلیتر |
وظایف و عملکردهای کلسترول در بدن
کلسترول برای ساخت و نگهداری غشای سلولی ضروری است. کلسترول میتواند سیالیت غشایی را در طیف وسیعی از دما تنظیم کند. گروه هیدروکسیل موجود در کلسترول با بخشی از غشا که دارای فسفات است، تعامل دارد و بخشی از زنجیره استروئیدی و زنجیره هیدروکربنی کلسترول نیز در غشا تعبیه شدهاند. در مهرهداران، بالاترین غلظت کلسترول در غلاف میلین سلولهای عصبی و غشای پلاسمایی همه سلولها بدن وجود دارد.
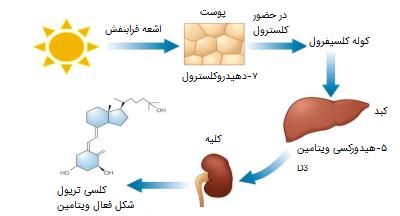
کلسترول در تولید و متابولیسم سایر مواد حیاتی نیز در بدن اهمیت دارد. این ماده در ساختن صفرا (که در کیسه صفرا ذخیره میشود و به هضم چربیها کمک میکند) دخالت دارد و همچنین در متابولیسم ویتامینهای محلول در چربی از جمله ویتامینهای A ،D ،E و K نقش دارد. کلسترول از مهمترین پیشسازهای سنتز ویتامین D محسوب میشود. زمانی که کلسترول موجود در پوست موجب افزایش 7-دهیدرو کلسترول میشود، این ترکیب در طی فرایندی به ویتامین D تبدیل میشود.
کلسترول همچنین یک ماده اصلی در ساخت هورمونهای استروئیدی مختلف مانند کورتیزول و آلدوسترون در غدههای آدرنال و هورمونهای جنسی پروژسترون، استروژنهای مختلف، تستوسترون و مشتقات آن به شمار میآید.
برخی تحقیقات نشان میدهد که کلسترول ممکن است به عنوان یک آنتی اکسیدان نیز عمل کند. با توجه به تحقیقات اخیر مشخص شده است که کلسترول در غشای پلاسمایی با تشکیل قایقهای لیپیدی یا «لیپید رفتها» در فرآیندهای سیگنالینگ سلولی نقش دارد. همچنین کلسترول باعث کاهش نفوذپذیری غشای پلاسمایی در برابر یونهای هیدروژن (پروتون) و یونهای سدیم میشود.
کلسترول برای ساختار و عملکرد حفرههای غشایی و چالههای پوشیده شده با کلاترین از جمله حفرههای وابسته به آندوسیتوز و اندوسیتوز وابسته به کلاترین ضروری است. نقش کلسترول در اندوسیتوز وابسته به حفرههای غشایی و کلاترین را میتوان با استفاده از «متیل بتا سیکلو دکسترین» (MβCD) برای از بین بردن کلسترول از غشای پلاسمایی بررسی کرد.
در حالت کلی، وظایفی که کلسترول در بدن بر عهده دارد را میتوان به طور خلاصه در موارد زیر مطرح کرد:
- شرکت در ساختمان غشای سلولی
- پیشساز هورمونهای جنسی
- آزادسازی هورمونها از غدد آدرنال
- تولید اسیدهای صفراوی
- تولید ویتامین D
- سیگنالینگ سلولی
اهمیت بالینی کلسترول
کلسترول به دلیل عملکردهای مهمی که در بدن دارد، در حفظ سلامت و بروز برخی از بیماریها اهمیت ویژهای دارد. در اینجا دو اختلالی که در اثر بینظمی در میزان کلسترول در خون ایجاد میشود، مورد بررسی قرار میگیرند.
هایپرکلسترولمی
«هایپر کلسترولمی» (Hypercholesterolemia) شرایطی است که با غلظت زیاد ذرات LDL اکسید شده، به خصوص ذرات کوچک LDL که موجب تشکیل «آتروما» (Atheroma) (آتروما شامل تجمع لیپیدها و کلسترولهای رسوبی در دیواره داخلی رگها است) در دیواره شریانها میشود، همراه است. این شرایط به عنوان «آترواسکلروز» (Atherosclerosis) نیز شناخته میشود. آترواسکلروز عامل اصلی بیماری عروق کرونر قلب و سایر اشکال بیماریهای قلبی عروقی است. در مقابل، ذرات HDL (بخصوص HDL بزرگ) به عنوان مکانیزمی شناخته شدهاند که با استفاده از آنها میتوان کلسترول و واسطههای التهابی را از آتروما خارج کرد. افزایش غلظت HDL با کاهش پیشرفت آتروما ارتباط دارد.

سطح بالایی از لیپوپروتئینهای شامل LDL و VLDL به عنوان عوامل آتروژنیک (مستعد ایجاد آترواسکلروز) در نظر گرفته میشوند. میزان این لیپوپروتئینها نسبت به میزان کل کلسترول خون، با ایجاد و پیشرفت آترواسکلروز ارتباط دارند. گاهی میزان کلسترول کل خون به حالت طبیعی است اما ممکن است، از این مقدار کل، تعداد زیادی LDL و تعداد کمتری HDL باشد که در این حالت نیز احتمال خطر ابتلا به آتروما بالا است. چنانچه از میزان کلسترول کلی خون، نسبت HDL بسیار بیشتر از LDL باشد، احتمال ابتلا به آتروما بسیار کاهش مییابد.
هیپوکلسترولمی
کاهش غیرطبیعی سطح کلسترول خون را «هیپوکلسترولمی» (Hypocholesterolemia) میگویند. اطلاعات زیادی در مورد دلایل این اختلال کلسترولی در دسترس نیست اما برخی شواهد از ارتباط هیپوکلسترولمی با افسردگی، سرطان و خونریزی مغزی خبر میدهند. برخی از یافتههای ژنتیکی نیز نشان دهنده ارتباط بین اختلال ژنتیکی سندرم «اسمیت لملی اوپیتز» و اختلال کلسترول پایین هستند.
اگر این مطلب برای شما مفید بود، آموزشها و مطالب زیر نیز به شما پیشنهاد میشود:













کلسترول در ساختار کورتیزول هست یا کورتیزون؟
سلام و وقت بخیر؛
کورتیزول و کورتیزون دو هورمونی استروئیدی هستند که ساختمان اصلی آنها از کلسترول تشکیل شده است. اما در گروه عاملی متصل به کربن ۱۱ تفاوت دارند. کربن ۱۱ در کورتیزول به گروه هیدروکسیل (OH) متصل است و در کورتیزون کتون (کربن متصل به اکسیژن با پیوند دوگانه) تشکیل میدهد.
با تشکر از همراهی شما با مجله فرادرس
بسیار عالی و کامل برای همه رده های سنی و گروه های متخصص و غیر متخصص
سلامت و پایدار باشید
مرسی ، خوب بود