ویژگی های ترکیب یونی – به زبان ساده
در مطالب پیشین مجله فرادرس، ترکیبات یونی را تعریف و نحوه تشکیل آنها را بیان کردیم. در این مطلب قصد داریم به طور دقیقتری به بررسی ویژگی های ترکیب یونی بپردازیم و این ویژگیها را با جزئیات بیشتری بیان کنیم. میدانیم که ترکیب یونی زمانی شکل میگیرد که اختلاف الکترونگاتیوی بالایی بین اتمهای شرکتکننده در واکنش وجود داشته باشد. هرقدر این اختلاف بیشتر باشد، جاذبه بین یونهای مثبت (کاتیون) و یونهای منفی (آنیون) بیشتر خواهد بود.


تصویر زیر، مثالهایی از ترکیبات یونی و بلورهای درخشنده آنها را نشان میدهد. آرایش منظم یونها در شبکه بلور سبب ایجاد شکلهای مختلف در این بلورها شده و رنگ آنها نیز به واسطه وجود فلزات واسطه ایجاد شده است.

ویژگی های ترکیب یونی
بعد از آشنایی مختصر با ترکیبات یونی و نحوه تشکیل آنها، ویژگی های ترکیب یونی و به طور خاص، خواص فیزیکی و شیمیایی ترکیبات یونی را بررسی میکنیم.
تشکیل بلور
ترکیبات یونی به جای تشکیل جامدهای بیشکل (آمورف)، شبکههای بلوری تشکیل میدهند. در سطوح اتمی، یک بلور یونی، ساختار منظمی دارد که در آن، کاتیونها و آنیونها به صورت متناوب در کنار یکدیگر قرار گرفتهاند و شبکهای سهبعدی را میسازند که به طور معمول، یونهای کوچکتر به طور مساوی، فاصله بین یونهای بزرگتر را پر کردهاند.
نقطه ذوب
به دلیل وجود جاذبه بین کاتیونها و آنیونها، شبکه بلورهای یونی بسیار قدرتمند هستند. فرآیند ذوب یک ترکیب یونی نیازمند انرژی زیادی برای شکستن تمامی پیوندهای یونی در بلور است. به طور مثال، سدیم کلرید، نقطه ذوبی در حدود ۸۰۰ درجه سانتیگراد دارد که این میزان برای ترکیب مولکولی همچون آب، صفر درجه ذکر میشود.
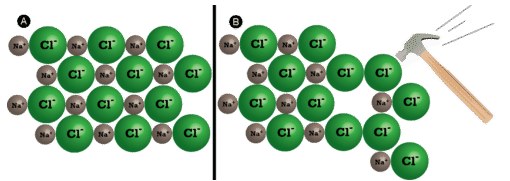
خرد شدن
از جمله ویژگی های ترکیب یونی میتوان به شکننده بودن آن اشاره کرد. در حقیقت، ترکیبات یونی به طور کلی سخت و شکننده هستند زیرا نیروی مکانیکی بسیار زیادی - مانند کوبیدن چکش بر روی بلور - نیاز داریم تا لایهای از یونها را جابجا کنیم. زمانی که این اتفاق رخ بدهد، یونهای با بار همنام در کنار یکدیگر قرار میگیرند. نیروی دافعه بین یونهای یکسان، سبب خرد شدن بلور میشود.
هدایت الکتریکی
هدایت الکتریکی نیز از جمله سایر ویژگی های ترکیب یونی به شمار میآید. تصویر زیر سه آزمایش را نشان میدهد که در هر یک، دو الکترود درون یک بِشر قرار دارند و متصل به یک لامپ هستند. این الکترودها در سه ماده مختلف قرار داده شدهاند.
در بشر اول، آب مقطر، سبب هدایت جریان الکتریکی نمیشود زیرا آب، ترکیبی مولکولی است. در بِشر دوم شامل سدیم کلرید هم هدایت الکتریکی نخواهیم داشت. با وجود اینکه سدیم کلرید، ترکیبی یونی است اما شبکه بلور جامد آن مانع از حرکت یونها در بین بلورها میشود. به عبارت دیگر، برای تکمیل مدار به ذرات باردار متحرک نیاز داریم.
در بشر سوم، سدیم کلرید در آب حل شده و در این حالت، شبکه بلوری از بین رفته است و یونهای مجزای مثبت و منفی، قابلیت حرکت خواهند داشت. کاتیونها جذب یک الکترود و آنیونها جذب الکترود دیگر میشوند و در اثر این اتفاق، جریان الکتریکی برقرار خواهد شد. همچنین، با ذوب یک ترکیب یونی و آزاد شدن یونهای آن نیز جریان الکتریکی برقرار میشود. بنابراین، ترکیبات یونی به هنگام ذوب یا حل شدن در آب، جریان الکتریکی را از خود عبور میدهند.

خاصیت اسیدی و بازی
ترکیبات یونی که شامل یون هیدروژن باشند اسیدی و ترکیبات شامل کایتونهای الکتروپوزیتیو و آنیونهای بازی هیدروکسید یا اکسید در دسته بازها قرار میگیرند. سایر ترکیبات یونی که به عنوان نمک شناخته میشوند، در اثر واکنش اسید-باز به تولید میرسند.
نتیجه واکنش بین یک اسید قوی و باز ضعیف، ترکیبی موسوم به نمک اسیدی است و به ترکیب حاصل از واکنش بین اسید ضعیف و باز قوی، نمک بازی میگویند. در اثر واکنش اسیدها و بازهای قوی نیز، نمک خنثی خواهیم داشت. واکنش اسیدهای ضعیف با بازهای ضعیف میتواند منجر به تولید یون باز مزدوج و یون اسید مزدوج شود که از نمونههای آن میتوان به آمونیوم استات اشاره کرد. برخی از یونها خاصیتی آمفوتری دارند و با اسید و باز واکنش میدهند.
انحلال پذیری
به هنگام انحلال یک ترکیب یونی، این یونها توسط حلال، درون محلول حاصل، تفکیک و حل میشوند. به علت آزاد شدن یونها در محلول و قابلیت هدایت الکتریکی، ترکیبات یونی انحلالپذیر، معمولترین نوع از الکترولیتهای قوی را شامل میشوند و محلولهای حاصل از آنها، هدایت الکتریکی بالایی دارند.
در حلالهای قطبی همچون آب یا مایعات یونی، میزان انحلالپذیری بسیار بالا است و این مقدار در حلالهای ناقطبی، کاهش پیدا میکند که دلیل آن قویتر بودن برهمکنشهای یون-دوقطبی نسبت به برهمکنشهای یون-دوقطبی القایی است و بنابراین، آنتالپی انحلال نیز در این ترکیبات، بالاتر است.
هنگامی که یونهای ناهمنام در شبکه بلور جامد با قطب مخالف مولکولهای قطبی احاطه شده باشند، یونهای جامد از شبکه بلوری به طرف مایع کشیده میشوند. زمانیکه انرژی «حلالپوشی» (Solvation) از انرژی شبکه بیشتر شود، تغییر آنتالپی خالص محلول، نیرویی ترمودینامیکی ایجاد میکند تا یونها از محل خود در شبکه بلوری جدا و در مایع حل شوند.
علاوه بر این، برای ترکیبات یونی، تغییرات آنتروپی محلول نیز به طور معمول مثبت است به این معنی که انحلالپذیری آنها با افزایش دما، افزایش پیدا میکند. برخی از ترکیبات همجون سریوم (III) سولفات وجود دارند که به دلیل تغییر آنتروپی منفی، به هنگام انحلال و کاهش بینظمی، انحلالپذیری آنها با افزایش دما، کاهش پیدا میکند.

رنگ
از جمله ویژگی های ترکیب یونی میتوان به رنگ آنها اشاره کرد. به طور معمول، رنگ یک ترکیب یونی با رنگ محلول آبی آن متفات است. آنیونهای یک ترکیب شامل پیوند یونی، بیرنگ هستند. در ترکیباتی که خاصیت یونی کمتری دارند، این رنگ به زرد، نارنجی، قرمز و مشکی تبدیل میشود. به طور مثال، کبالت (II) کلرید بیآب، به رنگ آبی فیروزهای دیده میشود اما ترکیب آبدار آن (کبالت (II) کلرید شش آبه)، قرمزرنگ است.

تراکم پذیری
تراکمپذیری ترکیبات یونی به طور عمده توسط ساختار آنها بویژه عدد کوئوردیناسیون تعیین میشود. به طور مثال، هالیدهایی با ساختار سزیم کلرید (عدد کوئوردیناسی برابر با ۸)، تراکمپذیری کمتری نسبت به این ترکیبات با ساختار سدیم کلرید (عدد کوئوردیناسی برابر با ۶) دارند.
جمع بندی ویژگی های ترکیب یونی
در انتها، به طور خلاصه، موارد گفته شده در خصوص ویژگی های ترکیب یونی آورده شدهاند.
- ترکیبات یونی، نقطه ذوب بالایی دارند.
- شکننده هستند.
- به هنگام انحلال در آب، به یونهای سازنده خود تفکیک میشوند.
- محلولهای حاصل از ترکیب یونی و همچنین، ترکیبات یونی مذاب، هادی جریان الکتریسیته هستند.
- نسبت به ترکیبات مولکولی، آنتالپی ذوب و تبخیر بالایی دارند.
- تراکمپذیری آنها توسط عدد کوئوردیناسی تعیین میشود.
- به طور معمول، رنگ ترکیبات بیآب و آبدار، متفاوت است.












