منیزیم و کاربردهای آن – از صفر تا صد
منیزیم، عنصری با نماد Mg و عدد اتمی ۱۲ در جدول تناوبی عناصر است. این عنصر براق، خواصی مشابه با سایر پنج عنصر گروه دوم، یعنی فلزات قلیایی خاکی دارد. منیزیم به عنوان نهمین عنصر در بین فراوانترین عناصر کیهان به شمار میآید. این عنصر در ستارگان بزرگ با اضافه کردن سه هسته هلیوم اضافی به کربن، بوجود میآید. همچنین، منیزیم، هشتمین عنصر فراوان در پوسته زمین است که 13 درصد جرم کره زمین و بخش عظیمی از گوشته را تشکیل میدهد.


منیزیم چیست ؟
منیزیم را به طور طبیعی میتوان در ترکیب با سایر فلزات مشاهده کرد و عدد اکسایشی برابر با دارد. این عنصرِ به شدت واکنشپذیر را میتوان به صورت مصنوعی هم تولید کرد. سوختن این فلز با نور شدیدی همراه است. امروزه این عنصر از طریق الکترولیز نمکهای منیزیم آب شور بدست میآید.
استفاده گسترده از این عنصر را میتوان در آلیاژهای آلومینیوم-منیزیم موسوم به مگنالیوم مشاهده کرد. آلیاژ مگنالیوم، چگالی کمتری نسبت به آلومینیوم دارد و به دلیل استحکام بیشتر و وزن کمتر از آلومینیوم، کاربردهای بسیاری دارد.
منیزیم، یازدهمین عنصر فراوان در بدن انسان به شمار میآید که وجود آن برای تمامی سلولها و حدود 300 آنزیم، ضروری است. یونهای این فلز با بسیاری از ترکیبات پلیفسفات همچوپن ATP، DNA و RNA واکنش میدهند.
خواص فیزیکی و شیمیایی منیزیم
در این بخش، خواص مختلف فیزیکی و شیمیایی این فلز را مورد بررسی قرار میدهیم.
خواص فیزیکی
عنصر منیزیم، فلزی به رنگ سفید-خاکستری با وزن کم و چگالی حدود دوسوم آلومینیوم است. در بین فلزات قلیایی خاکی، این عنصر، کمترین نقطه ذوب و جوش را دارد که به ترتیب برابر با 649 و 1089 درجه سانتیگراد ذکر میشود.
خواص شیمیایی
این عنصر، زمانی که در معرض هوا قرار بگیرد، کمی تیرهرنگ خواهد شد اما برخلاف سایر فلزات قلیایی خاکی، نیازی به نگهداری آن در محیط بدون اکسیژن (داخل نفت) نیست زیرا در اثر واکنش با هوا، لایهای اکسید بر روی آن تشکیل میشود که از پیشرفت واکنش جلوگیری میکند.
این عنصر در دمای اتاق با آب واکنش میدهد. البته سرعت این واکنش، نسبت به واکنش کلسیم، بسیار آهستهتر انجام میشود به گونهای که اگر آن را در آب غوطهور کنیم، حبابهای هیدروژن، به آرامی بر روی سطح فلز تشکیل میشوند. با پودر کردن این فلز، سرعت این واکنش سریعتر خواهد بود. از واکنش برگشتپذیر منیزیم بمنظور ذخیره انرژی در موتورهای منیزیمی استفاده میکنند. همچنین، این عنصر در واکنشی گرماده، با اسیدهایی همچون هیدروکلریک اسید واکنش میدهد و کلرید فلزی و گاز هیدروژن تولید میکند.

اشتعالپذیری
این فلز به شدت اشتعالپذیر است، به خصوص زمانی که به صورت پودر یا نوار وجود داشته باشد. دمای شعله منیزیم و آلیاژهای آن به 3100 درجه سلسیوس میرسد، البته ارتفاع شعله آن کمتر از 30 سانتیمتر ذکر میشود. خاموش کردن شعله منیزیم کار دشورای است زیرا واکنش سوختن آن در حضور اکسیژن، با عوامل مختلف دیگری همچون نیتروژن، دیاکسید کربن و آب ادامه مییابد. از این خاصیت، برای بمباران شهرها در جنگ جهانی دوم استفاده میشد زیرا در آن زمان، تنها را خاموش کردن آتش، استفاده از خاک و ماسه بود.
خواص نوری
زمانی که این فلز را در حضور هوا بسوزانیم، نور شدید سفیدی تولید میکند که شامل طول موجهای قوی از پرتو ماورا بنفش است. در گذشتهها از پودر این فلز برای نوردهی به سوژه در عکاسی با فلاش استفاده میشد که در ادامه، فیلامنتهای منیزیمی در فلاشهای عکاسی رواج پیدا کرد. همچنین، در آتشبازی، نورپردازی صحنه تئاتر و شبیهسازی شلیک گلوله از این عنصر بهره میگرفتند.
منیزیم در طبیعت
همانطور که در ابتدای بحث به آن اشاره شد، منیزیم، هشتمین عنصر فراوان (از نظر جرمی) در پوسته زمین است. در منابع عظیم «دولومیت» (Dolomite)، «منیزیت» (Magnesite) و سایر مواد معدنی و همچنین در آب (به صورت یون منیزیم)، میتوان به این فلز دست پیدا کرد. با توجه به اینکه این عنصر را در بیش از ۶۰ ماده معدنی میتوان پیدا کرد، تنها برخی از آنها همچون دولومیت، منیزیت، بروسیت، کارنالیت، «تالک» (Talc) و «اولیوین» (Olivin) به لحاظ اقتصادی ارزشمند هستند.
کاتیون دومین کاتیون فراوان در آب دریاست و منبع عظیمی از منیزیم به شمار میآید. برای استخراج منیزیم از آب، کلسیم هیدروکسید را به آب دریا اضافه میکنند تا رسوب منیزیم هیدروکسید تولید شود:
منیزیم هیدورکسید (بروسیت) در آب، نامحلول است و به کمک فیلتراسیون از آب خارج میشود. در نهایت با واکنش با هیدروکلریک اسید، منیزیم کلرید تغلیض شده به تولید میرسد و با الکترولیز آن، میتوان به این فلز دست پیدا کرد.
ایزوتوپهای منیزیم
منیزیم دارای سه ایزوتوپ پایدار ، و است. تمامی این ایزوتوپها با مقادیر قابل توجهی در طبیعت وجود دارند. 79 درصد از این فراوانی، متعلق به است. ایزوتوپ خاصیت رادیواکتیو دارد و در خلال سالهای 1950 تا 1970، در بسیاری از راکتورهای هستهای بمنظور مطالعات علمی تولید شد. این ایزوتوپ، نیمه عمری کوتاه و در حدود 21 ساعت داشت.
تولید سالانه منیزیم
در جدول زیر، تولید اولیه این فلز از معادن آورده شده است.
| کل دنیا | 910 هزار تن |
| چین | 800 هزار تن |
| آمریکا | 70000 هزار تن |
| روسیه | 30000 هزار تن |
| قزاقستان | 20000 هزار تن |
در سال 1993، میزان منیزیم تولیدی توسط چین، مقداری ناچیز بود که در حدود ۲۰ سال بعد، حدود ۹۰ درصد منیزیم تولیدی جهان را از آن خود کرد. تولید منیزیم، به مقادیر زیادی از انرژی نیاز دارد که به همین دلیل، تولید آن در بسیاری از کشورها متوقف شده است به گونهای که دیگر در غرب اروپا، این عنصر به تولید نمیرسد.

تولید منیزیم
منیزیم را میتوان به صورت محلول، در آب دریا و آبهای شور پیدا کرد. همچنین، سنگهای منیزیت و دولومیت ، از دیگر منابع این فلز به شمار میآیند. به طور کلی، منیزیم از دو روش زیر به تولید میرسد:
- فرآیند کاهشی منیزیم اکسید
- الکترولیز منیزیم کلرید
پیش از افزایش تولید توسط چین، با توجه به ارزان بودن تولید برق، اصلیترین روش تولید منیزیم، به کمک الکترولیز بود. امروزه بیشتر کارخانجات تولید منیزیم، از روش بهبودیافتهای استفاده میکنند که در دهه 1940، کانادا بمنظور افزایش تولید، آن را ارائه داد.
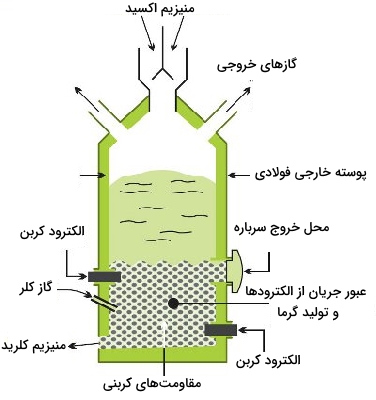
فرآیند کاهش حرارتی
در این فرآیند، دولومیت را خرد میکنند و در کوره حرارت میدهند تا مخلوطی از اکسیدهای منیزیم و کلسیم تولید شود. به این فرآیند «تکلیس» (Calcining) یا کلسینهکردن میگویند.
در مرحله بعد، منیزیماکسید کاهش پیدا میکند. عامل اکسندهای که در این فرآیند مورد استفاده قرار میگیرد، آلیاژی از آهن و سیلیکون، موسوم به فرو سیلیکون است. برای تولید آن، ماسه را با کُک و ضایعات آهن حرارت میدهند که در نهایت به آلیاژی با ۸۰ درصد سیلیکون میرسند.
اکسیدها با فروسیلیکون خرد شده مخلوط و به خشتهایی تبدیل و وارد راکتور میشوند. بمنظور کاهش نقطه ذوب سرباره، آلومینا نیز به مخلوط اضافه خواهد شد. واکنش در دمای 1226 تا 1526 درجه سانتیگراد و فشاری بسیار کم (نزدیک خلأ) انجام میشود. تحت چنین شرایطی، منیزیم به شکل بخار تولید خواهد شد که تا 826 درجه سانتیگراد و در کندانسورهای فولادی سرد میشود و پس از آن به صورت شمشهایی قالبزنی خواهند شد.
واکنش بالا، گرماگیر است و جهت تعادل، به طرف تولید منیزیماکسید پیش میرود. با توجه به اصل لوشاتلیه، و حذف بخار منیزیم به هنگام تولید، جهت پیشرفت واکنش به طرف راست خواهد بود. سیلیس (سیلیکا) نیز با کلسیماکسید ترکیب میشود تا سرباره کلسیم سیلیکات را تولید کند:
این فرآیند در نهایت، منیزیم را با خلوص 99/99 درصد بدست میدهد.
فرآیند الکترولیتی تولید منیزیم
همانطور که توضیح داده شد، اصلیترین روش تولید این فلز، قبل از روش معمول در چین، الکترولیز بود. این فرآیند در دو مرحله به انجام میرسد:
- تولید منیزیمکلرید خالص از آب دریا
- الکترولیز منیزیمکلرید
دولومیت را با حرارت دادن به مخلوطِ اکسیدهایی تبدیل و از آن برای فرآوری آب دریا استفاده میکنند. با رسوب منیزیم هیدروکسید، کلسیم هیدروکسید به صورت محلول در آب باقی خواهد ماند. منیزیم هیدروکسید را به کمک فیلتراسیون، از محلول جدا میکنند و با حرارت دادن به اکسید خالص تبدیل میشود. طی فرآیندهایی، اکسید را به منیزیمکلرید تبدیل میکنند که این فرآیندها شامل حرارت دادن و مخلوط کردن اکسید با کربن در جریانی از کلر با دما بالا است. تمامی این فرآیندها در کوره الکتریکی انجام خواهد شد.
منبع این فلز در واکنشهای بالا، آب شور است. عملیات مختلفی برای حذف ناخالصیها و تغلیظ محلول منیزیم کلرید انجام میشود. از جمله این مراحل میتواند به چندین مرحله فرآیند آبگیری اشاره کرد که در مرحله آخر، برای جلوگیری از هیدرولیز منیزیم کلرید، این واکنش در حضور هیدروژن کلرید انجام خواهد شد:
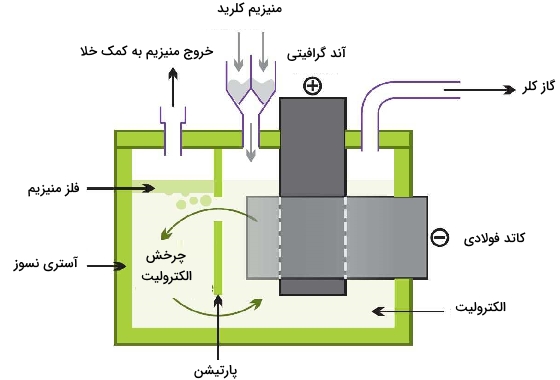
الکترولیز منیزیم کلرید مذاب
منیزیمکلرید بیآب (انیدروز) به طور پیوسته به سلول الکترولیتی وارد میشود. تحت الکترولیز، منیزیم و کلر به تولید میرسند.
آند:
کاتد:
در نهایت، فلز مذاب به صورت شمشهایی به تولید میرسد. گاز کلر نیز برای استفاده مجدد در فرآیندهای «کلرزنی» (Chlorination) بازیافت خواهد شد.
آلیاژهای منیزیم
مصرف آلیاژهای این فلز در سال 2013، کمتر از ۱ میلیون تن ذکر شده است. این مقدار مصرف را با مصرف سالانه ۵۰ میلیون تن از آلیاژهای آلومینیوم مقایسه کنید. به مرور زمان، استفاده از آلیاژهای این فلز به دلیل ایجاد خوردگی، شرکت در واکنشهای سوختن و «خزش» (Creep) در دماهای بالا، محدود شد.
خوردگی منیزیم
حضور عناصری همچون آهن، نیکل، کبالت و مس، به شدت موجب افزایش خوردگی میشوند. این فلزات به صورت «ترکیبات بین فلزی» (Intermetallic Compounds) رسوب و محلهای رسوب، به عنوان یک مرکز کاتدی عمل میکنند که آب را کاهش میدهند. این عمل، موجب از دست رفتن این فلز میشود. کنترل مقادیر این فلزات، موجب بهبود مقاومت در برابر خوردگی خواهد شد. وجود مقدار کافی از منگنز، بر خوردگی آهن غلبه میکند اما رصد دقیق مقادیر آن، صرف هزینههای زیادی را به دنبال دارد.
کاربردهای منیزیم
بعد از آهن و آلومینیوم، منیزیم بیشترین استفاده را در میان فلزات دارد. اصلیترین کاربردهای این عنصر به ترتیب عبارتست از:
- آلیاژهای آلومینیوم
- ریختهگری (دایکاست)
- حذف گوگرد در تولید آهن و فولاد
- تولید تیتانیوم در فرآیند کرال
منیزیم، در تولید آلیاژها و مواد بسیار سبک و مستحکم مورد استفاده قرار میگیرد. این فلز در گذشته، فلز اصلی در ساخت هواپیماهای جنگی آلمان در جنگ جهانی اول را تشکیل میداد که تا جنگ جهانی دوم هم استفاده از آن رواج داشت. در صنعت هوافضا، با توجه به خطرات خوردگی و آتشسوزی منیزیم، استفاده از آن به قطعات موتور محدود شد. امروزه به دلیل اهمیت صرفهجویی در مصرف سوخت، استفاده از آلیاژهای این فلز در صنعت هوافضا رو به افزایش است.
استفاده در موتور خودروها
منیزیم، در ساخت موتور خودروهای سواری نیز کاربرد دارد. شرکتهایی همچون مرسدس بنز، پورشه، فولکسواگن، میتسوبیشی، ب ام و و شورلت در موتور خودروهای خود از این فلز بهره بردهاند.
صنایع الکترونیک
به دلیل وزن کم و خواص مکانیکی و الکتریکی مناسب این فلز، از آن در تولید تلفنهای همراه، لپتاب و تبلتها، استفادههای فراوانی میشود.
سایر موارد استفاده
به دلیل سهولت دسترسی و سمی نبودن، کاربردهای فراوانی را برای این فلز در نظر گرفتهاند. منیزیم، بسیار اشتعالپذیر است و در دمای حدود 3100 درجه سانتیگراد شروع به سوختن میکند. لازم به ذکر است، نوار منیزیمی، در دمای 473 درجه سانتیگراد، به طور خودکار آتش میگیرد و نور سفید شدیدی تولید میکند. از این خاصیت برای تولید آتش در مواقع ضروری بهره میگیرند. کاربردهای دیگر آن شامل استفاده در عکاسی، فلرها، لوزام آتشبازی و ... است. از دیگر کاربردهای منیزیم، میتوان به موارد زیر اشاره کرد:
- برای تهیه واکنشگر (ریجنت) گرینیارد
- به عنوان آند گالوانی جهت جلوگیری از خوردگی کشتیها، تانکرهای زیرزمینی، خطوط لوله، تاسیسات زیرزمینی، و آبگرمکنها
- در ترکیب با روی، برای ساخت آلیاژی بمنظور استفاده در صنعت چاپ، ساخت دیواره باتریهای خشک و ضد آب کردن سقف منازل
- ساخت آلیاژ آلومینیوم-منیزیم در تولید قوطیهای نوشابه، چوب گلف، قرقره ماهیگیری و تیر و کمان
- تولید رینگهای منیزیمی در خودرو
- تولید باتریهای منیزیمی

موارد ایمنی در خصوص استفاده از منیزیم
این فلز و آلیاژهای آن همگی خطر منفجر شدن دارند و در حالتهای پودری، نواری یا مذاب، به شدت قابل اشتعال هستند. منیزیم مذاب یا در حال سوختن، به شدت با آب واکنش میدهد. به هنگام کار با پودر منیزیم، استفاده از عینک ایمنی با فیلتر UV ضروری است زیرا سوزاندن منیزیم، اشعه ماورا بنفش تولید میکند که میتواند به طور کامل، شبکیه چشم انسان را تخریب کند.
واکنش منیزیم با آب
منیزیم این قابلیت را دارد که در واکنشهای ردوکس، آب را کاهش دهد و طبق واکنش زیر، گازِ به شدت قابل اشتعالِ هیدروژن آزاد کند.
بنابراین، آب توانایی خاموش کردن شعلههای حاصل از سوختن منیزیم را ندارد زیرا گاز هیدروژن تولیدی، شدت شعله را بیشتر میکند. استفاده از ماسه خشک روش بهتری است که تنها در سطوح صاف و بدون شیب کاربرد دارد. همچنین، این فلز با دیاکسید کربن، طی واکنشی گرماده، منیزیم اکسید و کربن تولید میکند.
بنابراین، با استفاده از دیاکسید کربن هم نمیتوان شعله حاصل را خاموش کرد بلکه این کار نیز، موجب ادامه سوختن فلز میشود و معمولا با استفاده از کپسولهای آتشنشانی پودری یا ماسه و حذف اکسیژن، میتوان شعله حاصل را خاموش کرد.

ترکیبات مفید
از ترکیبات این فلز به ویژه منیزیم اکسید ، به عنوان ماده نسوز در کورهها استفاده میکنند. از این کورهها بیشتر در تولید آهن، فولاد، شیشه و سیمان بهره میگیرند. علاوه بر این، منیزیم اکسید و سایر ترکیبات این فلز در کشاورزی، صنایع شیمیایی و ساختوساز کاربرد دارند. منیزیم اکسید حاصل از «تکلیس» (کلسینه کردن) بمنظور تولید عایق الکتریسته در کابلهای برق نسوز استفاده میشود.
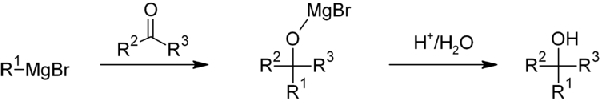
در واکنش این فلز با یک آلکیل هالید، واکنشگر گرینیارد به تولید میرسد که در تهیه الکلها کاربرد دارد.
نمکهای این فلز در بسیاری از غذاها، کودها و محیطهای کشت میکروبی یافت میشوند. علاوه بر این، در تولید کاغذ، از منیزیم سولفیت با فرمول بهره میگیرند. از منیزیم فسفات هم برای نسوزکردن مصالح ساختمانی چوبی مورد استفاده میکنند.
نقش بیولوژیکی منیزیم
برهمکنشهای اصلی بین فسفاتها و یونهای منیزیم سبب شده است تا این عنصر بین سلولهای زنده، اهمیت خاصی پیدا کند. بیش از ۳۰۰ آنزیم برای فعالیتهای کاتالیستی خود به یونهای منیزیم احتیاج دارند.
منیزیم در رژیم غذایی
این عنصر برای فعالیتهای بیولوژیکی در بدن مورد استفاده قرار میگیرد و به عملکرد صحیح اعصاب و عضلات کمک میکند. علاوه بر این، در استحکام استخوانها، سیستم ایمنی بدن و تنظیم ضربان قلب تاثیرگذار است. همچنین، در تنظیم سطح گلوکز و تولید انرژی و پروتئین نقش اساسی دارد.
مطالعات مختلفی در خصوص نقش منیزیم در جلوگیری از برخی بیماریها همچون فشار خون، بیماریهای قلبی و دیابتی در حال انجام است. با این وجود، استفاده از مکملهای منیزیم توصیه نمیشود. رژیمهای حاوی مقادیر زیادی از پروتئین، کلسیم یا ویتامین D، نیاز بدن به منیزیم را افزایش میدهند.

منابع غذایی منیزیم
این عنصر در بیشتر سبزیجات سبزرنگ و برگها وجود دارد. سایر منابع غذایی در زیر آورده شدهاند:
- میوههایی همچون موز، برگه زردآلو و آووکادو
- آجیل مثل بادام
- لوبیا و نخودفرنگی
- سویا
- شیر و غلات کامل

منیزیم بالا در بدن
منیزیم زیاد در بدن، معمول نیست چراکه به طور کلی، بدن انسان، مقادیر اضافه آن را دفع میکند. در صورت استفاده زیاد از مکملهای منیزیم، مشکلاتی در عملکرد بدن بوجود خواهد آمد که در زیر آورده شدهاند:
- تهوع
- سستی
- ضعف عضلانی
- هدایت الکتریکی نامناسب در قلب
- کاهش فشار خون
- مشکلات تنفسی
- مشکلات قلبی
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:













سلام ممنون از مطلب مفيدتون يك سوال دارم چرا وقتي نوار منيزيم در حال سوختن را كه همراه با توليد نور هست به ظرف حاوي كربن دي اكسيد اضافه ميكنيم شدت واكنش بيشتر ميگردد آيا به خاطر اين است كه بخشي از منيزيم با كربن دي اكسيد واكنش ميكند و گرماي حاصل باعث شديد شدن واكنش ميشود و يا علت هاي ديگري دارد ممنونم از راهنمائي كه ميفرمائيد.