روش تشخیص اسید و باز چیست؟ – از صفر تا صد
از بدن انسان گرفته تا اقیانوسهای زمین، اسیدها و بازها نقشی بسیار مهم در زندگی و محیط زندگی ما ایفا میکنند. دانشمندان مواد را به سه دسته اسیدی، بازی (قلیایی) و خنثی تقسیم میکنند. مهمترین روش تشخیص اسید و باز استفاده از فرمول شیمیایی آنها و یا استفاده از شناساگرها مانند کاغذ لیتموس و یا استفاده از pHمتر است. احتمالا تا حدودی با ویژگیهای اسید و باز آشنا هستید. برای مثال در مرکبات میدانیم که مزه ترش به دلیل وجود اسید (ویتامین ث) در آن است. همچنین میدانیم که مواد قلیایی از زمانهای گذشته به دلیل خاصیت صابونی مانند و تمیزکنندگی آنها مورد استفاده قرار میگرفتند. در این مطلب از مجله فرادرس به بررسی این ویژگیها و روشهای تشخیص اسید و باز از یکدیگر میپردازیم.
- روشهای مختلف تشخیص اسید و باز را میآموزید.
- مهارت تشخیص نشانههای ساختاری اسید و باز در فرمولهای شیمیایی را کسب میکنید.
- خواهید توانست با شناساگرهای شیمیایی و طبیعی، نوع ماده را مشخص کنید.
- کار با pH متر و تفسیر دادههای اندازهگیری شده را یاد میگیرید.
- واکنش خنثیسازی اسید و باز را درک خواهید کرد.
- با کاربردهای عملی اسید و باز در زندگی، صنعت و آزمایشگاهها آشنا میشوید.


در ابتدای این مطلب روش تشخیص اسید و باز را به راههای مختلف مانند شناساگر، مزه، پی اچ سنج و فرمول شیمیایی میآموزیم. سپس توضیح میدهیم اسید و باز چیست و ویژگیهای هر کدام چه مواردی هستند. سپس تفاوت اسید و باز ضعیف و قوی را توضیح میدهیم و سپس با تعارف مختلفی که برای اسید و باز وجود دارد آشنا میشویم. این تعاریف اسید و باز لوری برونستد، آرنیوس و لویس هستند. با شناسایی این تعاریف میتوانیم بفهمیم آمفوتر چیست و چه موادی آمفوتر هستند. در آخر اهمیت تشخیص اسید و باز و کاربردهای اسید و باز را فرا میگیریم. با مطالعه این مطلب تا انتها با این مواد مهم و کاربردی آشنا شویم و مفاهیم مربوط به آنها و روش تشخیص آنها را به صورت جامع و کامل فرابگیرید.
روش تشخیص اسید و باز
اسیدها و بازها را میتوان به چندین روش تشخیص داد که در لیست زیر معرفی شده است.
- استفاده از شناساگر
- شناسایی از روی مزه
- شناسایی از روی ظاهر
- استفاده از pH سنج
- شناسایی به وسیله فرمول شیمیایی
اصلیترین روش شناسایی و تشخیص اسید و باز اندازهگیری مقدار خاصیت اسیدی یا بازی آنها یا همان پی اچ «pH» است. اسیدها pH کمتری از عدد ۷ دارند. درحالی که برای بازها این مقدار بین ۷ تا ۱۴ است. هرچه میزان پی اچ اسید کمتر باشد، آن اسید قویتر و هرچه میزان پی اچ باز بیشتر باشد آن باز قویتر است. درواقع موادی که نه اسید هستند و نه باز (مواد خنثی) پی اچی برابر ۷ دارند و هرچه میزان پی اچ اسیدها و بازها به عدد ۷ نزدیکتر باشد، آن اسید و باز ضعیفتر هستند.
بررسی و تشخیص اسید و باز از روی اندازه پی اچ میتواند به وسیله شناساگرها (معرفها) مانند کاغذ لیتموس یا به وسیله دستگاه سنجش پی اچ مشخص شود. این موارد در ادامه این مطلب از مجله فرادرس توضیح داده میشوند.

شناساگر تشخیص اسید و باز
شناساگرها مواد شیمیایی هستند که به مقدار کمی به محلولهای حاوی اسید یا باز اضافه میشوند و باعث تغییر رنگ محلول و شناسایی خاصیت اسیدی یا بازی میشوند. از این مواد در فرایندهای تیتراسیون برای تشخیص انجام واکنش یا اندازهگیری غلظت برخی از مواد استفاده میشود. شناساگرها در واقع موادی هستند که به میزان یون موجود در محلولها حساس هستند و به نسبت آن و pH محلول، تغییر رنگ میدهند.
رایجترین روش تشخیص اسید و باز استفاده از کاغذ شناسایی pH لیتموس است. یک کاغذ لیتموس آبی در صورت قرار گرفتن در معرض مواد اسیدی به قرمز تغییر رنگ میدهد. در مقابل، کاغذ لیتموس قرمز در صورت قرار گرفتن در برابر مواد بازی به آبی تغییر رنگ میدهد. هرچند کاغذ لیتموس تنها به محدوده پی اچ بین ۴٫۵ تا ۸٫۳ پاسخ میدهد.

در ادامه برخی از شناساگرهای رایج مورد استفاده برای تشخیص پی اچ محلولها تشخیص اسید و یا باز بودن مواد آورده شده است. در این تصویر میزان pH مربوط به تغییر رنگ این مواد به همراه نوع تغییر رنگ نشان داده شده است. برای مثال کروزول رد در محلولهای اسیدی با پی اچ حدود ۰٫۵ تا ۱٫۵ از قرمز به زرد تغییر رنگ میدهد و در محلولهای بازی با pH ۷٫۵ تا ۸٫۵ از زرد به نارنجی تغییر میکند.
در آخرین سطر از تصویر بالا، شناساگری به نام معرف یونیورسال مشخص شده است. این معرف ترکیبی از چند معرف مختلف است که تقریبا در تمامی محدودههای pH تغییر رنگی آشکار دارد. مثالهای دیگری از شناساگرهایی که برای تشخیص اسید و باز به کار میروند موادی مانند تیمول بلو، متیل اورانژ، برموکروزول گرین و.. هستند. در جدول برخی از مهم ترین این شناساگرها به همراه رنگ و محدوده پی اچ آنها آورده شدهاند.
| شناساگر | رنگ در محلول اسیدی | رنگ در محلول بازی | محدوده pH تغییر رنگ |
| تیمول بلو (اولین تغییر رنگ) | قرمز | زرد | ۱٫۲ تا ۲٫۸ |
| متیل اورانژ | قرمز | زرد | ۳٫۲ تا ۴٫۴ |
| برموکروزول گرین | زرد | آبی | ۳٫۸ تا ۵٫۴ |
| متیل رد | زرد | قرمز | ۴٫۸ تا ۶٫۰ |
| برموتیمول بلو | زرد | آبی | ۶ تا ۷٫۶ |
| فنل رد | زرد | قرمز | ۶٫۸ تا ۸٫۴ |
| تیمول بلو (دومین تغییر رنگ) | زرد | آبی | ۸ تا ۹٫۶ |
| فنل فتالئین | بدون رنگ | ارغوانی | ۸٫۲ تا ۱۰ |
علاوه بر موارد شیمیایی ذکر شده، برخی از مواد طبیعی نیز میتوانند به عنوان شناساگر تشخیص اسید و باز استفاده شوند. برای مثال برگ کلم قرمز یکی از این موارد است.

شناسایی از روی مزه
قبلا اشاره شد که به طور کلی اسیدها ترش مزه و بازها تلخ هستند. تشخیص مزه نیز یکی دیگر از روشهای تشخیص اسیدها و بازها است. هرچند به دلیل خطرناک و خورنده بودن بسیاری از اسیدها و بازها این روش به هیچ وجه پیشنهاد نمیشود. این روش تنها برای برخی اسیدهای بسیار ضعیف آلی خوراکی قابل انجام است.
برای مثال مزه کردن استیک اسید (سرکه) و باز سدیم بی کربنات (جوش شیرین) ممکن است و میتواند در شناسایی آنها موثر باشد.
شناخت اسید و باز به وسیله پی اچ سنج
از آنجا که اسیدها میزان یون محلولها را افزایش میدهند، و بازها نیز میزان یون هیدروکسید موجود را افزایش میدهند، میزان قدرت اسید و باز با شمارش میزان یونهای هیدروژن مشخص میشود.
این میزان با مقیاس pH اندازه گیری میشود که فرمول آن به شکل زیر است.
مقادیر پی اچ معمولا بین ۱ تا ۱۴ اندازه گیری میشوند. پی اچ آب برابر ۷ است و پی اچ ۷ خنثی در نظر گرفته میشود. موادی که پی اچ بالای ۷ دارند خاصیت بازی دارند و موادی که پی اچ کمتر از ۷ دارند اسیدی در نظر گرفته میشوند. معادله ریاضی بالا مشخص میکند که هرچه میزان یون هیدروژن مثبت موجود در محلول بیشتر باشد، مقادیر پی اچ کمتر میشود. در تصویر زیر محدوده pH و میزان pH برخی از اسیدها و بازها مشخص شده است.

مقادیر پیاچ یک محلول را میتوان به وسیله دستگاههایی به نام پی اچ متر (pH meter) یا پی اچ سنج اندازه گرفت. این دستگاهها دستگاههای دیجیتالی هستند که با برق یا باتری کار میکنند و باید با محلولهای بافر کالیبره شوند تا نتایج درستی به دست آورند. اساس کار این دستگاهها اندازه گیری فعالیت الکتریکی محلولهای اسیدی و بازی به دلیل تفکیک یون آنهاست.

بافرها محلولهایی هستند که اگر مقادیر کمی از اسید یا باز به آنها اضافه شود، میزان pH آنها تغییر نمیکند.
شناسایی اسید و باز از روی فرمول
در تشخیص اسید و باز از روی فرمول شیمیایی، وجود گروه هیدروکسید یا هیدروژن تنها مورد بررسی قرار میگیرد. اسیدها یک یون هیدروژن دارند که در صورت حل شدن در آب، به صورت یون هیدروژن مثبت جدا میشود. بازها نیز با متصل بودن یک گروه هیدروکسیل (OH-) به ساختار گروه آنها مشخص میشوند.
بای مثال به فرمول شیمیایی اسیدها و بازهای زیر توجه کنید.
| نام اسید | فرمول شیمیایی | نام باز | فرمول شیمیایی |
| نیتریک اسید | کلسیم هیدروکسید | ||
| سولفوریک اسید | منیزیم هیدروکسید | ||
| کلریدریک اسید | سدیم هیدروکسید |
اسید چیست؟
حال که روش تشخیص اسید و باز را شناختیم، به معرفی عمیقتر مفاهیم اسید و باز میپردازیم. اسید از کلمه لاتین «acidus» به معنای ترش گرفته شده است. این مواد ترش مزه و خورنده هستند و باعث ایجاد سوزش روی سطح پوست میشوند. این مواد در آب یونهای هیدروژن آزاد تولید کرده و از این روش شناسایی میشوند. اسیدها خاصیت حل کردن برخی از فلزات را دارند و به همین دلیل در لایه برداری از سطوح فلزی کاربرد دارند.
وجود اسیدها در زندگی و در سیستم غذایی انسانها و سیستم گوارش انسان (اسید معده کلریدریک اسید است.) آن را به یک ماده بسیار با اهمیت تبدیل میکند. اسیدها در آب حل شده و به یونهای سازنده شان تفکیک میشوند. این فرایند باعث میشود محلولهای آبی حاوی اسیدها از نظر الکتریکی رسانا باشد. میزان این تفکیک با پارامتری به نام ثابت یونش اندازهگیری میشود.

برخی از اسیدها مانند مرکبات، سرکه و گوجه مثالهایی طبیعی از وجود اسیدها هستند. این مواد مزهای ترش دارند و میتوانند در موارد غلیظتر باعث آسیب به پوست و سلولها شوند. pH اسیدها کمتر از عدد ۷ است. روش تشخیص اسید معمولا بررسی وجود یا ایجاد شدن یونهای هیدروژن مثبت است. به یون هیدروژن مثبت پروتون نیز گفته میشود زیرا هیدروژن تنها از یک الکترون و یک پروتون تشکیل شده است و با از دست دادن الکترون تنها یک پروتون باقی میماند. اسیدها خاصیت خنثی سازی بازها را دارند.
اسیدها به راحتی میتوانند الکترونهای والانس فلزات و دیگر ترکیبات را جدا کند. این ویژگی باعث میشود اسیدها بسیار خورنده باشند. به خصوص اسیدهای قوی و غلیظ خاصیت خورندگی زیادی دارند. این مواد با بسیاری از فلزات واکنش داده و فرایندشان از نوع جابه جایی و گرماده است و در فراوردههای آن هیدروژن آزاد میشود.
باز چیست؟
بازها موادی خورنده هستند موادی هستند که در صورت واکنش شیمیایی با دسته یا از مواد آنها را از بین میبرند. این مواد خاصیت صابونی دارند و این خاصیت به این علت است که این مواد میتوانند ساختار پروتئینها را تغییر دهند. مواد بازی در ساختار بسیاری از شویندهها استفاده میشوند.
پی اچ این مواد بالای عدد ۷ است. این مواد خاصیت خنثی سازی اسیدها را دارند. واکنش بازها با فلزات مانند واکنش اسیدها با فلزات نیست. این ترکیبات اگر با نافلزها واکنش دهند، آب و نمک باز را تولید میکنند. این مواد معمولا یک گروه هیدروسیل (OH-) دارند و یون آزاد میکنند.

یادگیری شیمی عمومی با فرادرس
تا اینجا با مفهوم اسید و باز و ویژگیهای آنها آشنا شدیم و آموختیم روشهای مختلفی برای شناخت اسید و باز وجود دارد. برای تشخیص بهتر اسید و بازهای پیچیده از یکدیگر باید مفاهیم مختلفی مانند اندازه گیری قدرت اسیدها و بازها و اسیدها و بازهای سخت و نرم آشنا شویم. همچنین شناخت مفاهیمی مانند ثابت یونش و ثابت تفکیک اسید و باز به درک بیشتر این مفاهیم کمک میکنند و مقدمه ای در آموزش مفهوم pH و تشخیص قدرت اسید و باز به شمار میآیند.
اگر به یادگیری این مفاهیم علاقه دارید پیشنهاد میکنیم با مراجعه به مجموعه فیلمهای آموزشی دروس شیمی از دروس دانشگاهی تا کاربردی فرادرس، به ویژه فیلم آموزش اسیدها و بازها در شیمی عمومی این مفاهیم را فرابگیرید. این مجموعه آموزشها با زبانی ساده ولی کاربردی به توضیح مفاهیم مختلف مربوط به اسید و باز میپردازند و میتوانند منابع خوبی برای شما باشند.
با بهرهگیری از این مجموعه، میتوانید بهراحتی مفاهیم پیچیده را درک کنید و در کاربردهای علمی و عملی بهکار ببرید.
همچنین با مراجعه به فیلمهای آموزشی فرادرس که لینک آن در زیر آورده شده میتوانید به آموزشهای بیشتری در زمینه اسید و باز، دسترسی داشته باشید.
- فیلم آموزش شیمی تجزیه پیشرفته به همراه نکات کاربردی
- فیلم آموزش آشنایی با اسیدها و بازها در شیمی معدنی ۱
- فیلم آموزش اسیدها و بازها در شیمی عمومی
تشخیص اسید و باز ضعیف و قوی
یکی از تغییراتی که برای اسیدها و بازها اتفاق میافتد تفکیک آنها در آب است. هرچه یک اسید یا باز قویتر باشد به میزان بیشتری در اب تفکیک میشود. میزان تفکیک اسید یا باز در آب با عبارتی به نام ثابت یونش اسیدی و بازی مشخص میشود که در واقع اندازهگیری میزان تفکیک این مواد در آب را مشخص میکند. این اندازهگیری بر اساس غلظت یونهای آزاد شده از اسید و باز در آب هستند. مقادیر pH نیز از روی میزان تفکیک اسید و باز و میزان یونهای هیدروژن مثبت و هیدروکسید منفی آزاد شده در آب حاصل از تفکیک اندازهگیری میشود.
پس میتوان با اندازهگیری پی اچ یا بررسی واکنش تفکیک اسید یا باز در آب میزان قدرت اسید و باز را تشخیص داد. یک نگته مهم این است که میزان خورندگی اسیدها و بازها ربطی به میزان قوی یا ضعیف بودن آنها ندارد و در واقع از ویژگیهای ذاتی اسیدها و بازها است. برای مثال اسید هیدروژن فلوئورید، یک اسید ضعیف است اما بسیار خطرناک است و باید با دقت زیادی حمل و استفاده شود.
از اسیدهای قوی میتوان به اسید کلریدریک، اسید نیتریک، اسید پرکلریک، اسید سولفوریک و از اسیدهای ضعیف به استیک اسید و فسفریک اسید اشاره کرد. بازهای قوی نیز مواردی مانند سدیم هیدروکسید، کلسیم هیدروکسید و بازهای ضعیف مواردی مانند آمونیاک و سدیم استات هستند.
تفاوتهای اسید و باز
مهمترین تفاوت اسیدها و بازها در رفتار آنها با یون مشخص میشود. این مواد یا جذب کننده یون هیدروژن و یا از دست دهنده آن هستند.
| اسیدها | بازها |
| اسیدها باعث سوزش میشوند. | بازها خاصیت صابونی دارند. |
| اسیدها ترش مزه هستند. | بازها تلخ هستند. |
| اسیدها pH کمتر از ۷ دارند. | بازها pH بالاتر از ۷ دارند. |
| اسیدها در واکنش با فلزات گاز هیدروژن آزاد میکنند. | -- |
| اسیدها در واکنش با کربناتها کربن دی اکسید آزاد میکنند. | -- |
| اسیدها در معرض کاغذ لیتموس آبی میشوند. | بازها در معرض کاغذ لیتموس قرمز میشوند. |
| اسیدها در حضور فنل فتالئین بی رنگهستند. | بازها در حضور فنل فتالئین، محلول ارغوانی میشود. |
تعاریف مختلف اسید و باز
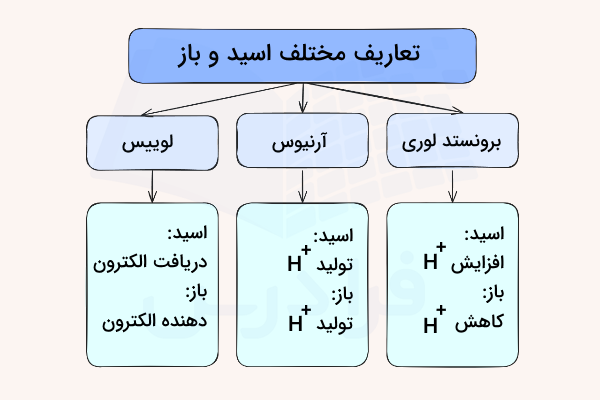
در سال ۱۹۲۳ شیمیدانها یوهان برونستد و مارتین لوری به شکل جداگانهای معنیای برای تعریف اسید ارائه کردند که بر مبنی توانایی این ترکیبات در به دست آوردن یا از دست دادن یونهای هیدروژن مثبت است. اسیدها میتوانند این یونها را دریافت کرده و بازها میتوانند آن را از دست بدهند. این تعاریف مقدمهای شد که در آینده آرنیوس تعریفی از اسید و باز ارائه دهد که دیگر در آن به وجود آب در واکنش اسید یا باز نیازی نبود. در ادامه هریک از این تعاریف را به شکلی مختصر توضیح میدهیم.
اسید و باز لوری برونستد
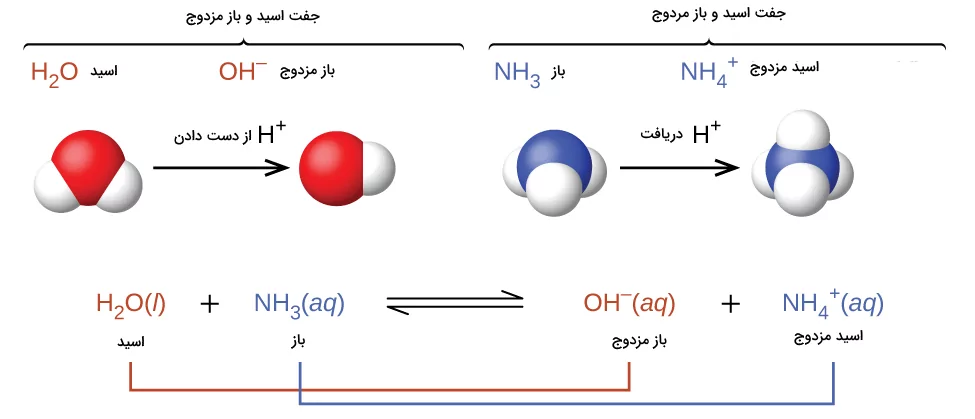
این داشنمندان تعریف اسید و باز را بر منبای توانایی در به دست آوردن یا از دست دادن یون هیدروژن مثبت ارائه داد. در نظریع آرنیوس که اسیدها و بازها بر مبنای اینکه مولکولها شامل یون هیدروژن هستند یا خیر تعریف میشود و دارای محدودیتهایی است. اصلی ترین کاربرد تعریف لوری برونستد در توضیح انتقال یون هیدروژن در واکنشهای اسید و باز است. برای تشخیص اسید و باز بنا بر این تعریف باید هیدروژنهای موجود قبل و بعد انجام واکنش شمارش شوند.
اگر تعداد هیدروژن افزایش پیدا کرده باشد، ماده موجود در واکنش باز بوده است و اگر کاهش پیدا کرده باشد، ماده مورد نظر اسید است. همچنین به فراوردهای که پس از اینکه اسید یون هیدروژن از دست میدهد باقی میماند، باز مزدوج اسید گفته میشود. یه این محصول باز گفته میشود زیرا از اسید پروتون دریافت میکند. به شکل معکوسی هنگامی که یک باز پروتون دریافت میکند، به فراورده باقی مانده از آن اسید مزدوج گفته میشود. در تصویر زیر مثالهایی برای درک بهتر این موارد ارائه شده است.
تعریف آرنیوس
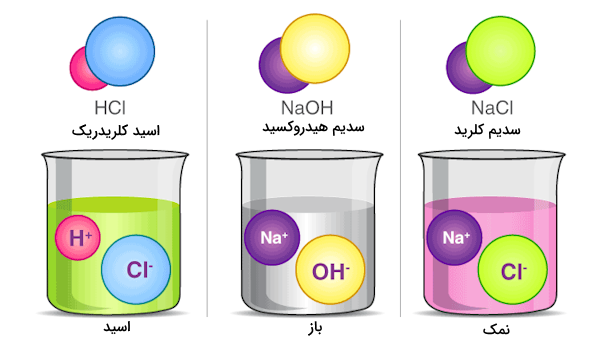
طبق این تعریف اسید مادهای است که در محلولهای آبی یون تولید و آزاد کند و باز آرنیوس مادهای است که در محلولهای آبی یون هیدروکسید آزاد کند. یونهای آزاد شده از اسید آرنیوس در آب تولید یون هیدرونیوم میکنند. این تعریف برای اسیدها و بازها درست است اما تعریف کاملی نیست زیرا تعاریف اسید و باز را تنها به محلولهای آبی محدود میکند. طبق این تعریف اسید سولفوریک و اسید کلریدریک در صورت حل شدن در حلالی مانند تولوئن اسید نیستند در صورتی که اسیدیته این مواد همواره وجود دارد. در معادله زیر این تعریف برای اسید کلریدریک مشخص شده است.
$${HCl(g) \rightarrow H^{+}(aq) + Cl^{-}(aq)} \label{eq1}$$
تعریف لوییس
تعریف لوری برونستد از اسید و باز تعریف خوب و جامعی است. با این حال تعریف لوییس از اسید و باز پس از تعریف لوری برونستد ارائه شد و تعریف را کاملتر و جامعتر کرد. طبق این تعریف اسید مادهای است که یک جفت الکترون دریافت میکند و باز مادهای است که یک جفت الکترون از دست میدهد. در شیمی مدرن به موادی که الکترون از دست میدهند نوکلئوفیل و به موادی که الکترون دریافت میکنند الکتروفیل گفته میشود. این تعریف دیگر مانند تعریف آرنیوس محدود به محلولهای آبی نیست و نیازی نیست برای تعیین اسید یا باز بودن وجود یون هیدروژن مثبت و انتقال آن را بررسی کرد. به تصویر زیر برای درک بهتر تعریف لوییس از اسید و باز دقت کنید. در این واکنش ارائه شده آب که باز است جفت الکترون خود را در اختیار آلومینیوم قرار میدهد.
آمفوتر چیست؟
آمفوترها موادی هستند که میتوانند همزمان هم به صورت اسید هم به صورت باز رفتار کنند. با اینکه تا به اینجا آموختیم اسیدها و بازها به عنوان دو ماده جداگانه با ویژگیهای متفاوت شناخته میشوند، برخی از مواد وجود دارند که میتوانند هم یون هیدروژن و هم هیدروکسید را تولید کنند. برای مثال در واکنش آب با سایر مواد مشاهده میکنیم که این ماده میتواند هم یون هیدروکسید و هم یون هیدروژن مثبت تولید کند. واکنشهای زیر مثالی از آمفوتر بودن اب است.
اهمیت تشخیص اسید و باز
اسیدها و بازها یکی از مهمترین مباحث در شیمی هستند. با شناسایی و تشخیص اسید و باز میتوان از کاربردهای بیشمار این مواد در صنایع مختلف استفاده کرد. اسیدها و بازها علاوه بر حضور در بسیاری از مواد در طبیعت، در صنعت نیز به شکلها ی مختلفی استفاده میشوند. این مواد در سنتز مواد جدید خصوصا مواد آلی کاربردهای فراوانی دارند. با شناسایی و تشخیص اسید و باز و آموختن ویژگی اسید و باز میتوانیم درباره ساختار و نوع واکنشهای آنها اطلاعاتی کسب کنیم که ما در استفاده از آنها در فرایندهای شیمیایی مختلف یاری کند.
کاربردهای اسید و باز
اسیدها و بازها در بسیاری از مواد مصرفی و آزمایشهای شیمیایی استفاده میشوند. در ادامه برخی از این کاربردها را توضیح داده ایم.
کاربرد اسیدها
- اسیدها در شویندههای خانگی استفاده میشوند.
- این مواد در مصارف صنعتی برای تولید رنگها، کودها و مواد منفجره استفاده میشود.
- یکی از مهمترین کاربردهای اسیدها شست و شوی سطوح فلزی است. از اسید کلریدیک برای تولید تیزاب سلطانی برای حل کردن فلزات نجیب مانند طلا و پلاتین استفاده میشود و در جواهرسازی کاربرد دارد.
- از برخی از اسیدها برای تولید باتری ماشینها استفاده میشود. یکی از اسیدهایی که در این فرایند استفاده میشود سولفوریک اسید است.
- یکی دیگر از مهمترین کاربرد اسیدها، از بین بردن سطوح اکسید شده فلزات در فرایند خوردگی آنها است.
- در فرایندهای صنعتی از اسیدها برای استفاده در واکنشهای خنثی شدن برای تولید برخی از نمکها استفاده میشود. برای مثال نیتریک اسید و آمونیاک در واکنش با یکدیگر آمونیوم نیترات تولید میکنند که یک کود بسیار مهم است.

کاربرد بازها
بازها در بسیاری از صنایع کاربرد دارند و در بسیاری از مواد مصرفی مانند شویندهها استفاده میشوند. همچنین بازها نقشی مهم در بسیاری از واکنشها و فرایندهای شیمیایی ایفا میکنند. در ادامه چند مورد از این کاربردها را توضیح میدهیم.
- سدیم هیدروکسید برای تولید صابونها، سنتز پارچه ریون و کاغذ استفاده میشود. همچنین از این ماده در تولید برخی از داروها و همچنین خالص سازی فراوردههای نفتی استفاده میشود.
- سدیم بیکربنات یا همان جوش شیرین برای تولید خمیر دندان و کپسولهای آتشنشانی کاربرد دارد.
- کلسیم هیدروکسید برای تولید پودرهای سفید کننده استفاده میشود. این ماده در ترکیب با خاک و آب، ملاتهای ساختمانی را تولید میکند. از این ماده همچنین در برخی از موارد برای خنثی کردن آثار تخریب بارانهای اسیدی استفاده میشود. همچنین برای پادزهر مسمومیتهای غذایی و تولید قارچکشها، و کاربردهای دندان پزشکی استفاده میشود.
- بازها در باتریها نیز استفاده میشوند. برای مثال پتاسیم هیدروکسید یکی از رایجترین مواد برای استفاده در باتریها است. از این مواد همچنینی در آفت کشها، دئودورانتها و خنثی ساختن اسیدیته خاک نیز کاربرد دارند.
- آمونیوم هیدروکسید برای پاک کردن آثار گریس و روغن از سطح لباسها استفاده میشود.

واکنش اسید و باز
یکی از ویژگیهای مهم اسیدها و بازها این است که میتوانند خواص یکدیگر را خنثی کنند. یونهای هیدروژن مثبت موجود در اسید و یونهای هیدروکسید منفی موجود در بازها با یکدیگر ترکیب میشوند و مولکولهای آب را تشکیل میدهند. فراورده دیگر واکنش اسید و باز، نمک یونی اسید و باز است. با حل شدن اسیدها و بازها در آب، یونهای تولید شده آنها تمایل بسیاری برای ترکیب با یکدیگر و تولید ترکیبات نمکی پایدار را دارند. برای مثال، واکنش زیر واکنش اسید سولفوریک و سدیم هیدروکسید است که فراوردههای آن آب و سدیم سولفات هستند.
جدول جمع بندی تشخیص اسید و باز
| روش تشخیص | اسید | باز |
| مقایسه تفکیک ماده در آب طبق تعریف آرنیوس | یون آزاد میکنند. | یون هیدروکسید آزاد میکنند. |
| مقایسه و تشخیص طبق تعریف لوری برونتسد | یون هیدروژن مثبت میدهد. | یون هیدروژن مثبت میگیرد. |
| مقایسه مقادیر pH | pH کمتر از ۷ | pH بیشتر از ۷ |
| استفاده از معرفهایی مانند فنل فتالئین | بیرنگ | ارغوانی رنگ . |
| تشخیص از فرمول شیمیایی | یک هیدروژن قابل جداسازی . | یک گروه هیدروکسیل قابل جداسازی |
| استفاده از کاغذ لیتموس | اسیدها کاغذ لیتموس را به رنگ آبی تغییر میدهند. | بازها رنگ کاغذ لیتموس را به آبی تبدیل میکنند. |
| ویژگیهای ظاهری | اسیدها بسته به دما و شرایط محیط میتوانند به فرم مایع، جامد یا گاز باشند. این مواد مزه ای ترش دارند و خورنده هستند. | بازها نیز میتوانند جامد، مایع یا گاز باشند. این مواد مزهای تلخ دارند و حالت صابونی و لغزنده دارند. |