عدد اتمی چیست؟ – از صفر تا صد
عدد اتمی یا عدد پروتون با نماد Z برای یک عنصر شیمیایی، به تعداد پروتونهای هسته هر اتمِ یک عنصر میگویند. در حقیقت، عدد اتمی در جدول تناوبی نشاندهنده نوع اتم است. در یک اتم خنثی، این عدد برابر با تعداد الکترونهای اتم نیز خواهد بود. مجموع عدد اتمی و تعداد نوترونها، عدد جرمی اتم را نشان میدهد. اتمهایی که عدد اتمی یکسان اما عدد جرمی متفاوتی داشته باشند را با نام ایزوتوپ میشناسند. در این مطلب از مجله فرادرس با عدد اتمی و روند معرفی و نکات مهم آن آشنا میشویم.
- میآموزید عدد اتمی چیست.
- با نحوه تعیین و نمایش عدد اتمی آشنا میشوید.
- مدلهای اتمی و آزمایشهای مهم این مدلها را میشناسید.
- با جدول تناوبی و ترتیب عدد اتمی در آن آشنا میشوید.
- میآموزید کشف نوترون چه نقشی در کشف عدد اتمی داشته است.
- میتوانید با حل نمونه سوالاتی، مفهوم عدد اتمی را بهتر بیاموزید.


عدد اتمی چیست؟
عدد اتمی یک عنصر که آن را با Z نشان میدهند به تعداد پروتون موجود در هر یک از اتمهای آن عنصر میگویند. هر اتم را میتوان به طور ویژه و بر اساس عدد اتمی آن طبقهبندی کرد. به طور مثال، اتمی با عدد اتمی ۸ که هسته آن شامل ۸ پروتون باشد را به عنوان اتم اکسیژن میشناسند. به طور مشابه نیز اتمها با عدد اتمی متفاوت نیز عناصر متفاوتی را تشکیل میدهند.
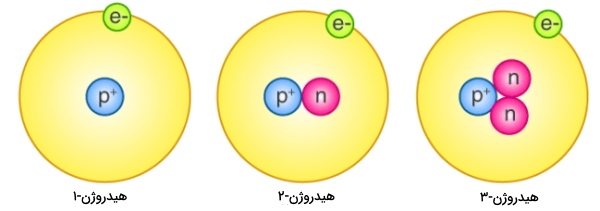
جدول تناوبی عناصر، تمامی عنصرهای شناخته شده را بر اساس افزایش عدد اتمی نشان میدهد و راههای مختلفی نیز برای حفظ کردن این جدول وجود دارند که در مطلب «روشهای کاربردی حفظ کردن جدول تناوبی — به زبان ساده» به خوبی به این روشها پرداخته شده است. اگر با دقت به جدول تناوبی تصویر زیر نگاه کنید، در مییابید که عدد اتمی هر عنصر در بالای آن نوشته شده است. به طور مثال، در هیدروژن این عدد برابر با ۱ است. یعنی هر اتم هیدروژن در هسته خود دارای یک پروتون است.

عنصر بعدی در این جدول، هلیوم با عدد اتمی ۲ خواهد بود و به همین ترتیب، سایر عناصر در گروههای مختلف جدول تناوبی، به ترتیب افزایش عدد اتمی در کنار یکدیگر چیده شدهاند. با توجه به اینکه اتمها خنثی هستند، تعداد الکترونها با تعداد پروتونها در هر اتم برابر است. اتمهای هیدروژن، همگی یک الکترون در اطراف هسته خود دارند و این تعداد الکترون برای اتم هلیوم، به عدد ۲ میرسد. در دروس شیمی، تعداد پروتون یک اتم همواره با عدد اتمی آن برابر است و تا زمانی که این اتم دچار شکافت هستهای نشود، این مقدار ثابت میماند.

عدد اتمی و سطوح انرژی اوربیتال
معمولترین راه نمایش الکترونها در یک اتم، رسم دیاگرامی مانند تصویر زیر است.
همانطور که پیشتر گفته شد، عدد اتمی، تعداد الکترونها در یک اتم خنثی را نیز بدست میدهد. به طور مثال، عدد اتمی کربن، برابر با ۶ و شامل ۶ الکترون است. اگر با اوربیتال اتمی و آرایش الکترونی آشنا باشید، میدانید که این ۶ الکترون در دو سطح انرژی با ۴ و ۲ الکترون قرار گرفتهاند. به همین ترتیب، عدد اتمی ۱۲، ساختاری الکترونی به ترتیب به صورت ۲ و ۸ و ۲ الکترون خواهد داشت یعنی ۲ الکترون در سطح انرژی داخلی، ۸ الکترون در سطح انرژی بعد و ۲ الکترون در بالاترین سطح انرژی دارد.
روند معرفی عدد اتمی
نماد معمول برای این عدد، است که ریشهای آلمانی به معنای «عدد» دارد. ساختار جدول تناوبی نیز بر مبنای ترتیب این عدد بنا شده است. «دمیتری مندلیف» (Dmitri Mendeleev) بیان کرد که اولین جدول تناوبی خود را (در سال ۱۸۶۹)، بر مبنای جرمهای اتمی مرتب کرده است. با این وجود، برای اینکه خواص شیمیایی عناصر را مد نظر قرار دهد، این ترتیب را قدری تغییر داد و تلوریم را پیش از ید قرار دارد که با چینش جدید عنصرها بر مبنای عدد پروتون (Z)، مطابقت دارد. البته در آن زمان، این عدد، شناخته شده نبود.
شمارهگذاری کلی در جدول تناوبی و بر اساس محل عناصر، هیچگاه دانشمندان را راضی نکرد و به غیر از ید و تلوریم، جفتعنصرهای دیگری مثل آرگون و پتاسیم و همچنین کبالت و نیکل یافت شدند که ترتیب آنها برعکس وزن اتمی بود. به همین دلیل، چیدمان آنها در جدول نیازمند بررسی خواص شیمیایی آنها بود. علاوه بر این، کشف عناصر دیگری همچون لانتانیدها سبب شد تا به چینش بهتری برای اتمها نیاز باشد.
مدل های اتمی
در سال ۱۹۱۱، «ارنست رادرفورد» (Ernest Rutherford) مدلی از اتم ارائه داد که در آن، یک هسته مرکزی، بیشترِ بار مثبت و جرم اتم را تشکیل میدهد. این بار مرکزی، به طور تقریبی نیمی از وزن اتمی است. با این وجود، فارغ از تخمین رادرفورد که بار مرکزی آن را در حدود ۱۰۰ تخمین زده بود، یک ماه بعد، «آنتونیوس وان دن بروک» (Antonius van den Broek) پیشنهاد داد که بار مرکزی و تعداد الکترونها در یک اتم دقیقا با محل آنها در جدول تناوبی برابر است.

آزمایش موزلی
مکان عناصر در جدول تناوبی بعد از تحقیقات «هنری موزلی» (Henry Mosley) در سال ۱۹۱۳ بهبود پیدا کرد. موزلی بعد از صحبتهایی که با «نیلز بور» (Niels Bohr) داشت تصمیم گرفت تا مدلهای وان دن بروک و رادرفورد را آزمایش کند. او قصد داشت ببیند که آیا خطوط طیفی گسیلی از اتمهای برانگیخته با تئوری بور مطابقت دارند یا خیر. در حقیقت قصد داشت مشخص کند که آیا فرکانس خطوط طیفی با مجذور Z متناسب هستند.
برای این کار، موزلی طول موج داخلیترین گذار فوتون تولیدی از عناصر آلومینیوم تا طلا را اندازهگیری کرد. ریشه دوم فرکانس این فوتونها، یک به یک به صورت تصاعد حسابی، افزایش پیدا کرد. این آزمایش سبب بوجود آمدن قانون موزلی شد که بیان میکرد عدد اتمی بسیار به بار الکتریکی محاسبه شده هسته، یعنی همان Z نزدیک است. علاوه بر این، او بیان کرد که لانتانیدها شامل ۱۵ عنصر هستند و بیشتر یا کمتر از این عدد برای لانتانیدها ممکن نیست که با دانش آن زمان، اظهار نظر بسیار مهمی به شمار میآمد.

سایر عناصر
بعد از فوت موزلی در سال ۱۹۱۵، عدد اتمی تمامی عناصر از هیدروژن تا اورانیوم () با روش او اندازهگیری شد. هفت اتم با عدد اتمی کمتر از ۹۲ وجود داشتند که هنوز کشف نشده بودند. در بین سالهای ۱۹۱۸ تا ۱۹۴۷، تمامی هفت عنصر مورد نظر نیز کشف شدند.
پروتون و ایده الکترون های هسته ای
در سال ۱۹۱۵ هنوز دلیل کوانتیده (بستهای) بودن بار هسته در واحد Z، به درستی درک نشده بود. ایدهای قدیمی موسوم به «فرضیه پرووت» (Prout's Hypothesis) بیان میکرد که عنصرها همگی از بقایای سبکترین هیدروژن بوجود آمدهاند که شامل یک الکترون و بار هسته برابر با ۱ بود. با این وجود، رادرفورد و همکارش در سال ۱۹۰۷ نشان دادند که هسته هلیوم دارای بار است و جرمی چهار برابر (و نه دو برابر) نسبت به هیدروژن دارد. اگر فرضیه پرووت درست بود، چیزی باید برخی از بار هسته هیدروژن در اتمهای سنگینتر را خنثی میکرد.
در سال ۱۹۱۷، رادرفورد موفق شد هسته هیدروژن را از واکنش هستهای بین ذرات آلفا و گاز نیتروژن تولید کند به این باور برسد که نظریه پرووت صحیح است. او در سال ۱۹۱۷، این ذرات هستهای جدید را پروتون نامید. با آزمایشات موزلی میشد دریافت که هسته اتمهای سنگین، جرمی بیش از دو برابر جرم مورد انتظار از هسته هلیوم دارند. بنابراین، به نظریه جدیدی نیاز بود تا پرتونهای خنثی شده در هسته اتمهای سنگین را توضیح دهد.
به همین دلیل، فرض شد که هسته هلیوم از چهار پروتون بعلاوه دو «الکترون هستهای» (Nuclear Electrons) برای خنثی کردن دو بار، تشکیل شده است. همچنین، در بخش دیگر جدول تناوبی، اتم طلا با هستهای ۱۹۷ برابر سنگینتر از هیدروژن وجود داشت و فرض میشد که این اتم، دارای ۱۱۸ الکترون هستهای است تا بار را فراهم کند.
معرفی فیلم آموزش علوم تجربی پایه هشتم - بخش شیمی
مفهوم عدد اتمی و ساختار اتم، از جمله دروسی است که دانشآموزان در مقاطع مخلف از جمله در درس علوم تجربی هشتم آنرا فرا میگیرند. به دلیل اهمیت این موضوع، «فرادرس» مجموعه آموزشی ۵ ساعته را در قالب ۶ درس آماده کرده است که در ادامه به توضیح این دروس خواهیم پرداخت.
در درس اول، مخلوطها آموزش داده میشود که از جمله مهمترین مباحث این بخش میتوان به کلوئید، سوسپانسیون، شناساگرهای اسید و باز، انحلالپذیری و انواع روشهای جداسازی اشاره کرد. در درس دوم، تغییرات شیمیایی و تغییرات فیزیکی را یاد میگیریم و مثالهای آنرا بررسی میکنیم. از جمله مباحث مهم درس سوم، واکنشهای گرماگیر و گرماده و اجزای تشکیل دهنده هوا هستند.
در درس چهارم، با ساختار اتم، نظریه اتمی و تعاریف اتم و مولکول آشنا خواهیم شد. درس پنجم به تعریف عنصر و نماد شیمیایی آنها، مدلهای اتمی همچون مدل اتمی بور و ایزوتوپها اختصاص دارد. در نهایت، در درس ششم، یونها به همراه کاتیون و آنیون آموزش داده میشود و نحوه تشکیل نمک طعام نیز مرور خواهد شد.
کشف نوترون و معرفی عدد اتمی
تمامی فرضیات در خصوص الکترون ذرهای با کشف نوترون توسط «جیمز چادویک» (James Chadwick) در سال 1932 پایان یافت. بعد از این کشف، اتم طلا دارای ۱۱۸ نوترون به جای ۱۱۸ الکترون هستهای بود و مشخص شد که بار مثبت نیز حاصل ۷۹ پروتون است. در نتیجه، بعد از سال ۱۹۳۲ بود که «Z» را معادل عدد پروتون هسته شناختند.
نمونه سوال عدد اتمی
اتمی با عدد اتمی ۹ و عدد جرمی ۱۹ را در نظر بگیرید. با توجه به این اتم، تعداد پروتون، نوترون و الکترون را در این اتم مشخص کنید.
پاسخ
با توجه به اینکه عدد اتمی همواره با تعداد پروتون برابر است، ۹ پروتون در این اتم داریم. برای اینکه تعداد نوترون را محاسبه کنیم باید عدد اتمی را از عدد جرمی آن کم کنیم و با این کار، به عدد ۱۰ یعنی ۱۰ نوترون در اتم میرسیم. در خصوص تعداد الکترون نیز باید گفت تعداد الکترون و پروتون در یک اتم خنثی با یکدیگر برابرند و بنابراین، در این اتم، ۹ الکترون خواهیم داشت.













خیلی مفید بود سپاسگزارم
سلام ،،، عالی بود ،،،، سپاس
عالیــــــی بود ممنون از سایـــــت خوبتون
واقعا ممنون مرسی