عدد آووگادرو – به زبان ساده
عدد آووگادرو که آن را با نام ثابت آووگادرو نیز میشناسند، تعداد ذرات تشکیل دهنده (مولکول، اتم یا یون) در یک نمونه را به مقدار ماده در نمونه مرتبط میکند. به بیان سادهتر، عدد آووگادرو، تعداد ذرات را در ۱ مول از ماده برای ما مشخص میکند و همانطور که گفته شد، این ذرات شامل اتم، مولکول یا یون هستند. عدد آووگادرو یا ثابت آووگادرو برابر با ذره از هر چیزی است که با توجه به مفهوم مول، به صورت تعریف میشود و نماد آن است.
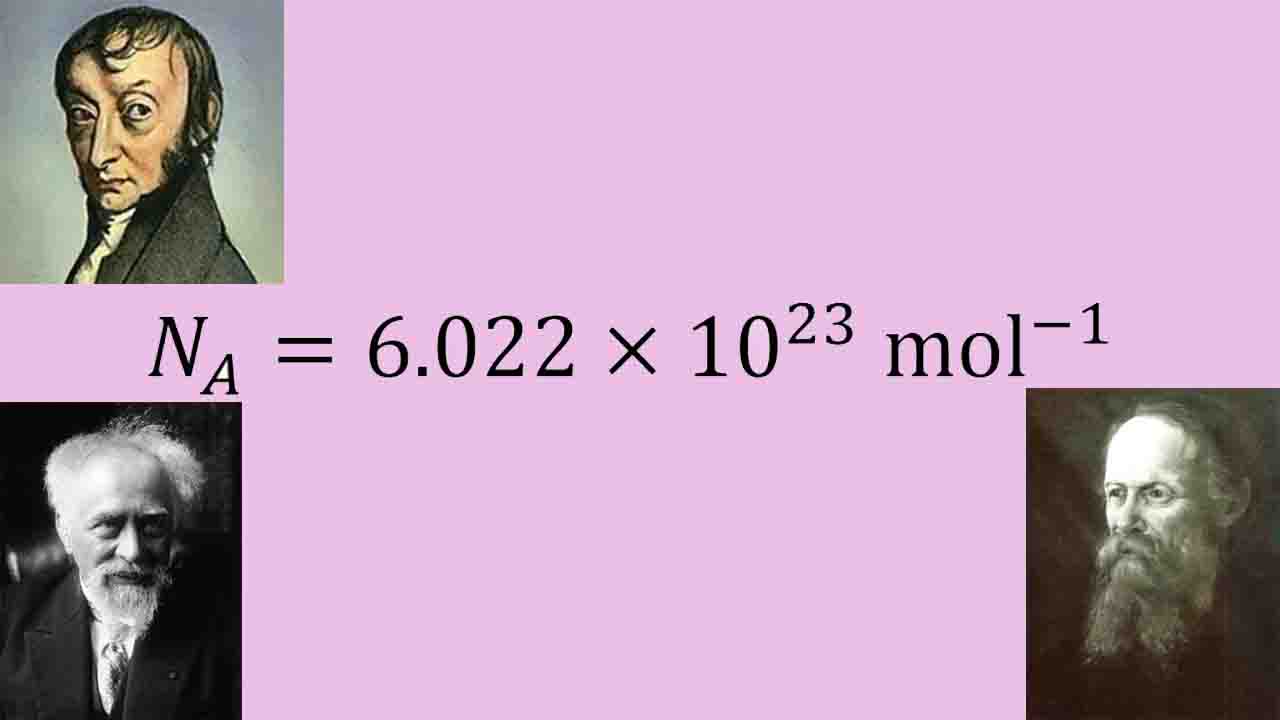
عدد آووگادرو چیست؟
همانطور که پیشتر اشاره شد، تعداد ذرات در ۱ مول از هر مادهای، به عدد آووگادرو یا ثابت آووگادرو معروف است که مقداری برابر با دارد. این ذرات میتوانند یونها، الکترونها، اتمها یا مولکولها باشند که بستگی به طبیعت مواد و ماده مورد نظر شیمیایی دارد.
به طور مثال، اگر بخواهید تعداد ذرات در ۳ مول از یک ماده را پیدا کنید کافی است عدد ۳ را در عدد آووگادرو به صورت زیر ضرب کنید:

اهمیت ثابت آووگادرو
اگر بخواهیم اهمیت این عدد را به طور ساده بیان کنیم باید بگوییم که این عدد، مانند پلی بین جهان ماکروسکوپی و جهان میکروسکوپی است چراکه مقادیر مواد را به تعداد ذرات آن نسبت میدهد. همچنین، این عدد، سایر ثابتهای فیزیکی را نیز به یکدیگر مرتبط میکند که برخی از آنها در زیر آورده شدهاند:
- رابطه بین ثابت جهانی گازها (R) با ثابت بولتزمن:
- رابطه بین ثابت فارادی (F) و بار الکترون:
- رابطه بین یکای جرم اتمی (u) با ثابت جرم مولی:
در علم شیمی، همواره تلاش میکنیم تا برای اندازهگیری و سنجش مواد، از مقادیر ماکروسکوپی استفاده کنیم یعنی برای اندازهگیری حجم مواد، دما و جرم مواد، سعی بر این است که از مقادیر ماکروسکوپی بهره بگیریم. اما اگر از نگاه اتمی به این موارد بنگریم، دانش سرعت و تکانه ذرات اهمیت پیدا میکنند و عدد آووگادرو این مقادیر را به یکدیگر مرتبط میکند.

عدد آووگادرو چگونه بدست آمد؟
باید بگوییم که آووگادرو در دورهای متولد شد که علم شیمی در حال گسترش بود. شیمیدانهایی همچون «جان دالتون» (John Dalton) و «جوزف لوییس گیلوساک» (Joseph Louis Gay-Lussac) در این زمان، شروع به درک خواص اتمها و مولکولها کرده بودند و بحثهایی نیز در خصوص رفتار این ذرات بسیار کوچک داشتند. قانون حجمهای ترکیبی گیلوساک به طور ویژهای حس کنجکاوی آووگادرو را برانگیخت.
با بررسی شاخههای مختلف این قانون، آووگادرو انتظار داشت که برای درستی این قانون، تعداد ذرات هر دو گاز در دما و وزن یکسان، با یکدیگر برابر باشند. تنها راهی که میشد درستی این قانون را تایید کرد این بود که بین اتمها و مولکولهای برخی عناصر همانند نیتروژن، تفاوتی وجود داشته باشد چراکه نیتروژن به صورت مولکولی، به شکل وجود دارد. در آن زمان، آووگادرو عبارتی همچون «مولکول» را برای توصیف نظریه خود در دست نداشت و نظرات او بر خلاف جان دالتون بود. شیمیدان دیگری به نام «استانیسلاو کانیزارو» (Stanislao Cannizzaro) سبب شد تا به نظرات آووگادرو توجه شود. البته زمانیکه این نظرات مورد توجه قرار گرفت، آووگادرو از دنیا رفته بود.
از آنجایی که قانون آووگادرو در توسعه علم شیمی اهمیت بسیاری داشت، شیمیدان فرانسوی «ژان باتیست پرن» (Jean Baptiste Perrin)، این عدد را به افتخار آووگادرو، به او اختصاص داد.
برخلاف باور عموم، عدد آووگادرو توسط آمادئو آووگادرو کشف نشد. آووگادرو یک وکیل بود که بعدها به علم ریاضی و فیزیک علاقهمند و در سال 1820، اولین پروفسور فیزیک در ایتالیا شد. شهرت او بیشتر به دلیل نظریهای است که بیان میکرد حجمهای مختلف از گازهای مختلف، در دما و فشار یکسان، حاوی تعداد ذرات برابری هستند.
اولین کسی که تعداد ذرات را در نمونهای مشخص، تخمین زد، معلمی اتریشی به نام «یوهان یوزف لوشمیت» (Johann Josef Loschmidt) بود که بعدها استاد دانشگاه وین شد. در سال 1865، لوشمیت از نظریه جنبشی گازها برای تخمین تعداد ذرات در یک سانتیمتر مکعب از گاز در شرایط استاندارد استفاده کرد. این مقدار را امروزه با نام ثابت لوشمیت میشناسند و مقداری برابر با دارد.
رابطهای که لوشمیت برای «چگالی تعداد» (Number Density) ذرات در یک گاز ایدهآل معرفی کرد را در زیر مشاهده میکنید که در آن، عدد آووگادرو را به احترام این دانشمند لحاظ کرده است:
در این رابطه، فشار، ثابت جهانی گازها و دمای مطلق است.

همانطور که گفته شد، واژه «عدد آووگادرو» در ابتدا توسط شیمیدان فرانسوی، ژان باتیست پرن استفاده شد. در سال 1909 پرن بر اساس کار خود بر روی «حرکت براونی» (Browninan Motion)، تخمینی از عدد آووگادرو را ارائه کرد. از آن زمان به بعد، روشهای مختلفی برای تخمین مقدار این ثابت اساسی بکار گرفته شدند. برای تعیین دقیق عدد آووگادرو نیاز به سنجش دقیق یک کمیت منفرد در دو مقیاس اتمی و ماکروسکوپیک داریم. این امکان زمانی میسر شد که فیزیکدان آمریکایی «رابرت میلیکان» (Robert Millikan)، بار یک الکترون را اندازهگیری کرد.
روش های تعیین عدد آووگادرو
بار یک مول الکترون از قبل به کمک ثابت فارادی، شناخته شده بود. بهترین تخمین ثابت فارادی، کولن به ازای هر مول الکترون است. نزدیکترین عدد برای بار یک الکترون بر اساس آزمایشات جدید نیز برابر با کولن به ازای هر الکترون است. اگر بار هر مول الکترون را بر بار هر الکترون تقسیم کنید، به عدد آووگادرو به ازای هر مول میرسید.
از جمله راههای دیگری که برای تعیین عدد آووگادرو مورد استفاده قرار میگیرد، اندازهگیری دقیق چگالی یک نمونه بسیار خالص در مقیاسی ماکروسکوپی است. در ادامه نیز چگالی این ماده را در مقیاس اتمی به کمک پراش اشعه ایکس اندازهگیری میکنند تا تعداد اتمها به ازای هر واحد سلول در بلور و فاصله بین نقاط تعریف کننده واحد سلولی تعیین شود تا به کمک آن بتوان مقدار عدد آووگادرو را بدست آورد.
آزمایش تعیین عدد آووگادرو
عدد آووگادرو را نمیتوان از طریق ریاضی اثبات کرد. تعداد ذرات در یک مول از ماده را به صورت آزمایشگاهی و به کمک علم الکتروشیمی تعیین میکنند. برای این کار باید با سلولهای الکتروشیمیایی آشنایی داشته باشیم. در ادامه قصد داریم روش آزمایشگاهی تعیین ثابت آووگادرو را بررسی کنیم. در این آزمایش، جریان الکترونها و زمان اندازهگیری میشود تا تعداد الکترونهای گذرنده از یک سلول الکتروشیمیایی مشخص شود. تعداد اتمها در یک نمونه (با وزن مشخص) با جریان الکترونها مرتبط هستند و به کمک آن میتوان عدد آووگادرو را محاسبه کرد.
در سلول الکتروشیمیایی این آزمایش، هر دو الکترود از جنس مس هستند و الکترولیت ما محلول 0/5 مولار است. در طول الکترولیز، الکترود مس (آند) به سر مثبت منبع تغذیه (باتری) متصل میشود و با تبدیل اتمهای مس به یون، از وزن آن کاسته خواهد شد. این کاهش وزن را میتوان از روی ظاهر الکترود نیز تشخیص داد. همچنین، یونهای مس به داخل محلول آبی وارد میشوند و رنگ آنها را به آبی تغییر میدهند. در الکترود دیگر (کاتد)، گاز هیدروژن در سطح آزاد میشود چراکه یونهای هیدروژن در محلول آبی سولفوریک اسید، واکنشی کاهشی را تجربه میکنند که این واکنش در زیر آورده شده است.
این آزمایش بر اساس جرمِ از دست رفته آند مس بنا شده است اما میتوان از گاز هیدروژن آزاد شده نیز برای این منظور استفاده کرد.
مواد مورد نیاز آزمایش
لوازم آزمایشگاهی مورد نیاز به شرح زیر است:
- منبع جریان مستقیم (باتری یا منبع تغذیه)
- سیمهای عایق به همراه گیره سوسماری جهت اتصال به سلولها
- ۲ الکترود (نواری از مس، نیکل، روی یا آهن)
- بِشری با حجم ۲۵۰ میلیلیتر حاوی سولفوریک اسید 0/5 مولار
- آب
- الکل (متانول یا ایزوپروپیل الکل)
- مولتیمتر
- زمانسنج
- ترازو با قدرت اندازهگیری 0/0001 گرم
- محلول ۶ مولار
روش انجام آزمایش
۲ الکترود مسی را بردارید و سطوح آنها را پاک کنید. برای شستشوی آند، در زیر هود آزمایشگاهی، الکترود آند را به مدت ۲ تا۳ ثانیه در محلول ۶ مولار قرار دهید و سپس، پیش از آنکه اسید، سبب خوردگی آن شود، آن را از محلول خارج کنید. توجه داشته باشید که این الکترود را با انگشتان خود لمس نکنید. در ادامه، الکترود را با آب بشویید و آن را در داخل بشر حاوی الکل قرار دهید. با قرار دادن الکترود بر روی یک حوله، به آن فرصت دهید تا خشک شود و سپس، وزن آن را با ترازو اندازهگیری کنید.
بشر حاوی سولفوریک اسید را بردارید و هر الکترود را داخل آن قرار دهید. قبل از برقراری هرگونه اتصال، اطمینان حاصل کنید که منبع تغذیه وصل نباشد چراکه این کار را در مرحله آخر انجام میدهیم. اگر آمپرمتر داشته باشید، آن را به صورت سری در مسیر قرار دهید. سر مثبت منبع تغذیه را به آند و سر منفی آمپرمتر را نیز به آند متصل کنید. اگر فکر میکنید که با وصل کردن گیره سوسماری به الکترود و ایجاد خراش روی آن، تغییر وزن خواهید داشت، میتوانید آن را در داخل محلول قرار دهید. کاتد را به سر مثبت آمپرمتر متصل کنید. در نهایت، کاتد سلول الکترولیتی به سر منفی منبع تغذیه متصل خواهد شد.
به یاد داشته باشید که به محض وصل شدن مدار، جرم آند تغییر میکند، در نتیجه، زمانسنج خود را آماده نگهدارید. برای این آزمایش، اندازهگیری دقیق زمان و وزن را نیاز دارید. جریان باید در بازههای زمانی ۶۰ ثانیهای اندازهگیری شود. توجه داشته باشید که به دلیل تغییر محلول الکترولیت، دما و محل الکترودها، تغییراتی در میزان جریان اندازهگیری شده خواهید داشت. به همین دلیل، باید مقدار متوسط این خوانشها در محاسبات مورد استفاده قرار بگیرد. آزمایش را به مدت ۱۷ دقیقه (شامل ۱۷ بار خوانش جریان) انجام دهید. بعد از این مدت زمان، منبع تغذیه را قطع کنید و مقادیر زمان و جریان را یادداشت کنید.
حال، آند را از سلول خارج کنید و در محلول الکلی و سپس بر روی حوله قرار دهید تا خشک شود. بعد از خشک شدن، آن را وزن کنید. به هیچ عنوان هیچ پارچهای را برای خشک کردن، روی آن نکشید چراکه جرم الکترود مس را تغییر میدهد. همچنین برای انجام بهتر آزمایش، میتوانید آن را چندین مرتبه تکرار کنید.

نمونهای از محاسبات
در یک آزمایش، اعداد زیر بدست آمدهاند:
- جرم از دست رفته آند: 0/3554 گرم
- مقدار متوسط جریان: 0/601 آمپر
- مدت زمان الکترولیز: 1802 ثانیه
به یاد داشته باشید که آمپر برابر با ۱ کولن بر ثانیه است و بار یک الکترون نیز مقداری برابر با دارد.
- بار کلی گذرنده از مدار:
- تعداد الکترونها در فرآیند الکترولیز:
برای تعیین تعداد اتمهای از دست رفته در آند به این شکل عمل میکنیم که با توجه به اینکه در فرآیند التکرولیز، به ازای هر یون تشکیل شده، ۲ الکترون مصرف میشود، بنابراین، تعداد یونهای مس (II) تشکیل شده، نصف تعداد الکترونها خواهد بود.
= تعداد یونهای مس (II)
با استفاده از عدد بالا، تعداد یونهای مس به ازای هر گرم مس و جرم یونهای تولیدی را محاسبه کنید. جرم یونهای مس تولیدی برابر با جرم از دست رفته در آند است چراکه جرم الکترونها بسیار کم و قابل صرفنظر خواهد بود. بنابراین، جرم از دست رفته در الکترود به کمک محاسبات زیر بدست میآید.
در نهایت، تعداد اتمهای مس در یک مول از آن را حساب کنید. تعداد اتمهای مس را به کمک رابطه زیر بدست میآوریم.
میبینید که عدد بدست آمده همان عدد آووگادرو با مقداری خطا است.
نکات مهم در خصوص ثابت آووگادرو
برخی از نکات مهم در خصوص عدد آووگادرو در ادامه ذکر میشود:
در سطوح اتمی، مواد به ازای یکای جرم اتمی سنجش میشوند. یکای جرم اتمی به صورت ۱/۱۲ وزن یک اتم کربن ۱۲ تعریف میشود. به طور مثال، یکای جرم اتمی هیدروژن، برابر با است. بهرهگیری از این عدد برای محاسبات شیمی، خاصه محاسبات استوکیومتری، بسیار دشوار است. از اینرو، شیمیدانها از تبدیل آن به گرم استفاده میکنند که ضریب تبدیل آن به صورت زیر است:
در واقع، با توجه به آنچه که در ابتدای متن گفته شد، از این نکته میتوان برای تبدیل amu به گرم استفاده کرد و این تبدیل، به کمک عدد آووگادرو میسر میشود.
مفهوم مول
مول، یکای SI برای اندازهگیری ذرات شیمیایی همچون اتمها، الکترونها، پروتونها یا یونها است. در گذشته، تعریف مول در شیمی بر اساس تعداد اتمهای ۱۲ گرم از کربن ۱۲ انجام میشد اما در سال ۲۰۱۸، یک مول از ماده را به صورت تعداد از همان ماده تعریف میکنند.

مثال برای کاربرد عدد آووگادرو
چه تعداد مولکول آب در دانهای از برف به وزن ۱ میلیگرم وجود دارد؟
در مرحله اول، جرم یک مول مولکول آب را محاسبه میکنیم. برای بدست آوردن جرم یک مول آب، در جدول تناوبی، جرمهای اتمی هیدروژن و اکسیژن را محاسبه کنید. ۲ اتم هیدروژن و یک اتم اکسیژن در هر مولکول آب داریم. بنابراین جرم مولکول آب برابر خواهد بود با:
جرم اکسیژن + جرم هیدروژن × ۲ = جرم
در ادامه، تعداد مولکولهای آب در یک گرم را محاسبه میکنیم. همانطور که یاد گرفتیم، ۱ مول آب شامل تعداد مولکول آب است. از این اطلاعات برای تبدیل تعداد مولکولهای آب به گرم بهره میگیریم.
مولکول / جرم یک مول مولکول آب = تعداد X مولکول / جرم X مولکول آب
با حل این رابطه برای X، به عدد زیر میرسیم که بیانگر تعداد مولکولهای در ۱ گرم آب است.
= تعداد مولکول در ۱ گرم آب
وزن دانه برفی که داشتیم برابر با ۱ میلیگرم بود. میدانیم که هر گرم برابر با ۱۰۰۰ میلیگرم است. بنابراین، با استفاده از تبدیل واحد مناسب، به عدد زیر میرسیم که همان جواب سوال است.













تحولی که فرادرس در آموزش ایجاد کرد به اندازه دبیرستان و دانشگاه درکشور است.