اکسیژن فعال چیست؟ – به زبان ساده + تست ros
در شیمی رادیکال آزاد مولکولهای ناپایداری هستند که یک یا چند الکترون جفت نشده دارند و میتوانند با اهدای الکترون یا دریافت آن، با مولکولهای دیگر واکنش دهند. به این ترتیب مولکولی که با آنها واکنش میدهد به رادیکال آزاد دیگری تبدیل میشود. به همین دلیل زنجیرهای از واکنشها ایجاد میشود. این فرآیند زنجیرهای تنها زمانی متوقف میشود که دو رادیکال آزاد با یکدیگر واکنش دهند. اکسیژن فعال به مولکولهای فعال و رادیکالهای آزاد مشتق شده از اکسیژن مولکولی گفته میشود که به طور پیوسته در موجودات هوازی تولید میشوند. این مولکولها که به عنوان محصولات جانبی در طی زنجیره انتقال الکترون میتوکندری یا توسط آنزیمهای اکسیدوردوکتاز و اکسیداسیون تولید میشوند، میتوانند باعث بروز اختلالاتی در موجود زنده شوند. در این مطلب انواع گونههای اکسیژن فعال و نقش آنها در بدن توضیح داده میشود.
- گونههای اکسیژن فعال و نحوه تولید آنها در سلول را میآموزید.
- یاد میگیرید چگونه «ROS» تعادل سلول را برهم میزند و باعث آسیب زیستی میشود.
- آسیبهای سلولی و بیماریهای مرتبط با افزایش اکسیژن فعال را خواهید شناخت.
- نقش آنتیاکسیدانها و مکانیسمهای دفاعی سلول در حذف «ROS» را یاد میگیرید.
- خواهید آموخت «ROS» چگونه بهعنوان پیامرسان یا عامل دفاع ایمنی عمل میکند.
- با روشهای آزمایشگاهی تشخیص و ارزیابی گونههای اکسیژن فعال آشنا میشوید.
اکسیژن فعال چیست ؟
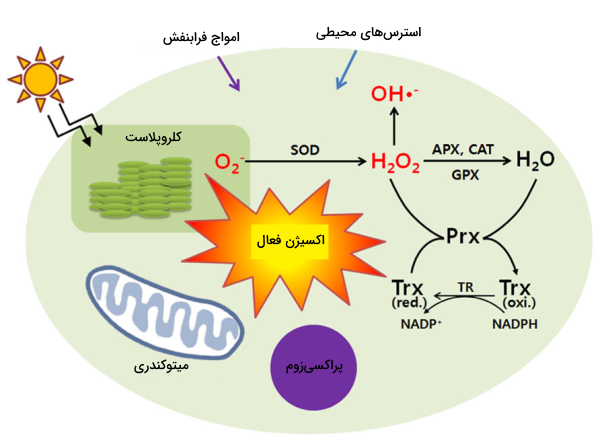
گونههای اکسیژن فعال (Reactive Oxygen Species) یا به اختصار ROS مولکولهای بسیار واکنشپذیر و رادیکالهای آزادی هستند که از مولکول اکسیژن مشتق شدهاند. اکسیژنهای فعال هم در سلولهای سالم و هم در سلولهای تحت استرس تولید میشود. تنفس میتوکندریایی یکی از دلایل اصلی تولید رادیکال آزاد است. علاوه بر میتوکندری، اکسیژن فعال در اثر فعالیت آنزیمهایی مثل NADPH اکسیداز، «گزانتین اکسیداز» (Xanthine Oxidase)، نیتریکاکسید سنتاز و آنزیمهای پراکسیزوم ساخته میشود. تجمع گونههای فعال اکسیژن در سلولها ممکن است باعث آسیب به DNA، RNA و پروتئینها شود و در نتیجه آن مرگ سلولی را ایجاد کند.
انواع اکسیژن فعال
اکسیژن اتمی دارای دو الکترون جفت نشده در مدارهای جداگانه در لایه الکترونی بیرونی خود است. این ساختار الکترونی اکسیژن را مستعد تشکیل رادیکال میکند. اضافه شدن الکترون به اتم اکسیژن باعث احیای آن و تولید گونههای مختلف اکسیژن فعال میشود. که شامل موارد زیر هستند.
- اکسیژن منفرد یا
- رادیکال سوپراکسید
- رادیکال هیدروکسیل
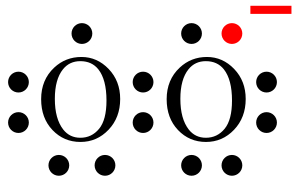
رادیکال سوپراکسید
رادیکال سوپراکسید به صورت طبیعی در اثر احیا یک الکترون مولکول اکسیژن () ایجاد میشود. مولکول اکسیژن دیرادیکالی است که دو الکترون جفت نشده دارد و اضافه شدن یک الکترون به آن باعث تولید رادیکال سوپراکسید میشود. بیشتر رادیکالهای سوپراکسید در اثر نشت الکترون به اکسیژن در زنجیره انتقال الکترون میتوکندری صورت میگیرد. بعضی از آنزیمهای سلولهای فاگوسیت نیز میتوانند رادیکال سوپراکسید ایجاد کنند. این اکسیژن فعال نمیتواند از غشای لیپیدی عبور کند به همین خاطر بیشتر اوقات درون میتوکندری باقی میماند.
بعضی از سلولهای سیستم ایمنی برای از بین بردن میکروارگانیسمها، رادیکال سوپراکسید تولید میکنند. برای مثال در سلولهای بیگانهخوار (فاگوسیت) رادیکال سوپراکسید در مقادیر بالایی توسط آنزیم NADPH اکسیداز تولید میشود که به فرایند تولید آن «انفجار تنفسی» (The Respiratory Burst) میگویند. ایجاد جهش در ژن تولید کننده این آنزیم باعث بروز سندرم نقص ایمنی به نام «گرانولوماتوز مزمن» (Chronic Granulomatous Disease) که سلولهای فاگوسیت فرد توانایی تولید رادیکال سوپراکسید ندارند و در دفع میکروارگانیسمها ناتوان هستند.
آنزیم «منگنز سوپراکسید دیسموتاز» (Superoxide Dismutase) مسئول حذف رادیکال سوپراکسید در سلولهای پستانداران است. این آنزیم دو رادیکال سوپراکسید و دو پروتون را به هیدروژن پراکسید و مولکول اکسیژن تبدیل میکند.
رادیکال سوپراکسید نسبتا واکنشپذیر است و نیمهعمری در حدود 2 تا 4 میکروثانیه دارد. به همین دلیل به طور مستقیم آسیب زیادی به سلولهای بدن نمیزند اما تغییر آن به اکسیژنهای فعال دیگر مانند رادیکال هیدروکسیل و اکسیژن منفرد باعث پراکسیداسیون لیپیدهای غشا میشود.
در سلولهای گیاهی نیز اکسیژن فعال به طور مداوم در اثر احیای نسبی یا در اثر انتقال انرژی به در کلروپلاست ساخته میشود. رادیکال سوپراکسید بیشتر در PSI قرار گرفته در «تیلاکوئید» (Thylakoid) و هنگام «زنجیره انتقال الکترون غیرچرخهای» (Non-cyclic Electron Transport Chain) ساخته میشود.
به طور طبیعی وقتی سیتوکروم C اکسیداز با واکنش میدهد تولید میشود. گاهی اوقات با اجزای دیگری از زنجیره انتقال الکترون واکنش میدهد و رادیکال سوپراکسید را ایجاد میکند. رادیکال سوپراکسید اولین اکسیژن فعالی است که در سلول گیاهی شکل میگیرد و میتواند در اثر واکنشهای دیگر به سایر اعضای خانواده اکسیژن فعال تبدیل شود.
اکسیژن منفرد
اکسیژن منفرد از طریق فعال سازی فتوشیمیایی، حرارتی، شیمیایی یا آنزیمی مولکول تولید میشود. اکسیژن منفرد رادیکال آزاد نیست، اما میتواند در طی برخی واکنشهای رادیکال آزاد تشکیل شود یا باعث تشکیل رادیکالهای آزاد شود.
این مولکول حالتی برانگیخته از مولکول را نشان میدهد که در آن اسپین یکی از الکترونهای جفت نشده، تغییر میکند تا دو الکترون با اسپینهای مخالف ایجاد کند. اکسیژن منفرد نیمه عمری در حدود 5 تا 10 ثانیه دارد. این مولکول اکسید کنندهای بسیار قوی است که به آسانی اجزای سلولی مانند لیپیدها، پروتئینها و اسیدهای نوکلئیک را اکسید میکند.
اکسیژن منفرد می تواند توسط ماکروفاژها در طول فاگوسیتوز یا توسط نور (در کلروفیل) تشکیل شود. در سلولهای گیاهی اکسیژن منفرد به عنوان محصول جانبی فتوسنتز در ساخته میشود. در حضور نور و اکسیژن، کلروفیل II ممکن است اکسیژن سه تایی () را به منفرد تبدیل کند.
استرسهای محیطی مثل شوری، خشکی و فلزات سنگین باعث بسته شدن روزنه سلول گیاهی میشوند که در نتیجه آن میزان غلظت داخلسلولی کاهش مییابد. این مسئله احتمال تولید اکسیژن منفرد را افزایش میدهد.
اکسیژن منفرد می تواند به هر دو سیستم فتوسنتزی، PSI و PSII آسیب جدی وارد کند و کل دستگاه فتوسنتزی را در معرض خطر قرار دهد. این ماده میتواند تا 100 نانومتر در سلول منتشر شود و به پروتئینها، رنگدانهها، نوکلئیکاسیدها و لیپیدهای سلول گیاهی آسیب وارد کند. گیاهان با استفاده از بتاکاروتن، «توکوفرول» (Tocopherol) و «پلاستوکینون» (Plastoquinone)، اکسیژن منفرد را از بین میبرند.
برهمکنش اکسیژن منفرد با مولکولها
اکسیژن منفرد به دو طریق با مولکول های دیگر برهمکنش می کند.
- از نظر شیمیایی با آنها ترکیب می شود.
- انرژی تحریک خود را به آنها منتقل میکند. سپس اکسیژن منفرد به حالت پایه باز میگردد در حالی که مولکول دیگر (مولکولی که اکسیژن منفرد با آن برهمکنش داشته است) برانگیخته میشود.
هیدروژن پراکسید
«هیدروژن پراکسید» (Hydrogen Peroxide) مایعی آبی خیلی کمرنگ با گرانروی بیشتر از آب است که فرمول شیمیایی دارد. از این ماده به عنوان اکسید کننده، سفید کننده و ضدعفونی کننده استفاده میکنند.
هیدروژن پراکسید نسبتا واکنشپذیر است و در اثر کاهش یکظرفیتی یا پروتوناسیون رادیکال سوپراکسید ایجاد میشود. ایجاد هیدروژن پراکسید هم میتواند به طور خودبخودی در pH پایین و هم در اثر آنزیم سوپراکسید دیسموتاز صورت بگیرد.
پراکسیزوم اندامکی است که بیشتر هیدروژن پراکسید در آن تولید میشود. این اندامک مسئول کاتابولیسم اسیدهای چرب خیلی بلند و انشعابدار، D-آمینواسیدها، پلیآمین و بیوسنتز پلاسمالوژن هستند. در حین اکسید کردن این مواد، هیدروژن پراکسید تولید میشود.
یکی دیگر از منابع تولید هیدروژن پراکسید تجزیه «آدنوزین مونوفسفات» (Adenosine Monophosphate) است. در اثر تجزیه آدنوزین مونوفسفات، هیپوگزانتین تولید میشود. هیپوگزانتین به گزانتین و سپس به اوریکاسید تجزیه میشود و در حین انجام این واکنشها هیدروژن پراکسید نیز تولید میشود.
ایجاد هیدروژن پراکسید در سلولهای گیاهی هم در شرایط نرمال و هم تحت استرسهای خشکی، سرما، نور زیاد، تابش UV و عفونت ایجاد شود. در اثر این استرسها و کاهش میزان داخل سلولی، اکسیژنزایی با استفاده از آنزیم ریبولوز 1 و 5- بیفسفات ترجیح داده میشود و میزان تنفس نوری افزایش مییابد. این مسئله باعث تولید 70٪ از هیدروژن پراکسید تولیدی سلول است.
هیدروژن پراکسید در گیاهان مانند شمشیر دولبه عمل میکند. در مقادیر کم برای سلول مناسب است و در مقادیر بالا باعث آسیب میشود. در غلظتهای کم داخل سلولی به عنوان سیگنالی برای فرایندهای فیزیولوژیکی ضروری مثل پیری، تنفس نوری و فتوسنتز، باز و بسته شدن روزنه، رشد و تکامل عمل میکند.
هیدروژن پراکسید نسبت به سایر اعضای اکسیژن فعال نیمهعمر بالاتری در حدود 1 میلیثانیه دارد که میتواند مسیرهای بیشتری را در سلول طی کند حتی می تواند از طریق آکواپورینها از غشای پلاسمایی نیز عبور کند. هیدروژن پراکسید در غلظتهای بالا ریشههای سیستئین و متیونین را اکسید میکند و آنزیمهای چرخه کالوین را با اکسید کردن گروههای تیولی از کار می اندازد.
هیدروژن پراکسید در غلظت 10 میکرومولار آنزیمهایی مثل «فروکتوز 1، 6 بیس فسفاتاز» (Fructose 1, 6 Bisphosphatase)، «سدوهپتولوز 1، 7 بیس فسفاتاز» (Sedoheptulose 1, 7 Bisphosphatase) و «فسفریبولوکیناز» (Phosphoribulokinase) را از کار میاندازد. حتی میتواند باعث مرگ برنامهریزی شده سلول شود.
رادیکال هیدروکسیل
رادیکال هیدروکسیل واکنشپذیرترین و سمیترین اکسیژن فعال شناخته شده است و در pH خنثی توسط واکنش فنتون بین هیدروژن پراکسید و رادیکال سوپراکسید ساخته میشود.
این اکسیژن فعال با پراکسیداسیون لیپید، تخریب پروتئینی و تخریب غشای سلول باعث تخریب ساختارهای سلولی میشود. از آنجایی که آنزیمی برای حذف این اکسیژن فعال در سلول وجود ندارد، افزایش آن باعث مرگ سلول میشود.
اثرات منفی اکسیژن فعال در بدن
اکسیژنهای فعال به عنوان محصولات جانبی متابولیک توسط سیستمهای بیولوژیکی تولید می شوند. فرآیندهایی مانند فسفوریلاسیون پروتئین، فعال شدن چندین فاکتور رونویسی، آپوپتوز، ایمنی و تمایز، همگی به تولید اکسیژن فعال در میزان مناسب و حضور در داخل سلولها وابسته هستند. هنگامی که تولید اکسیژن فعال افزایش مییابد پدیده استرس اکسیداتیو اتفاق میافتد که باعث اثرات مضر روی ساختارهای مهم سلولی مانند پروتئینها، لیپیدها و اسیدهای نوکلئیک میشود.
استرس اکسیداتیو وقتی اتفاق میافتد که تعادل میان تولید رادیکالهای آزاد و توانایی بدن برای حذف آنها بهم میریزد. این پدیده باعث بروز بیماریهایی در بدن سلولهای گیاهی و جانوری میشود. در ادامه اثرات منفی اکسیژن فعال در سلول توضیح داده میشود.
تخریب DNA
تخریب DNA به تغییرات فیزیکی و شیمیایی گفته میشود که تفسیر و انتقال اطلاعات ژنتیکی را با مشکل روبرو میسازد. این آسیبها در اثر استرسهای درونی و بیرونی ایجاد میشوند که میتواند تغییرات متفاوت مولکولی را باعث شود.
از آن جایی که DNA اصلی سلولها با استفاده از هیستون و پروتئینهای دیگر به خوبی محافظت میشوند، DNA میتوکندری و کلروپلاست بیشتر تحت تاثیر آسیب اکسیژنهای فعال قرار میگیرند. آسیب اکسیداتیو DNA در سطوح مختلف رخ میدهد که شامل اکسیداسیون ریشههای قند دئوکسیریبوز، تغییر باز نوکلئوتیدی شکستگی در هر یک از رشتههای DNA و اتصال DNA و پروتئین است. رادیکال هیدروکسیل با جداکردن اتم H به قند دئوکسی ریبوز آسیب میرساند. همچنین با پیوندهای دوگانه بازهای پورین و پیریمیدین نیز واکنش میدهد.
اکسیژن فعال اتم هیدروژن کربن چهارم قند دئوکسیریبوز را خارج میکند و یک رادیکال دئوکسیریبوز تشکیل میدهد که باعث شکست تکرشتهای در DNA میشود. این واکنشها باعث ایجاد جهش، سرطان، آپوپتوز، نکروز و بیماریهای ارثی میشود.
تخریب پروتئین
پروتئینها و آنزیمها مولکولهای بزرگ و پیچیدهای هستند که عملکردهای حیاتی را در بدن انجام میدهند. آنها توسط DNA هستهای و میتوکندریایی کدگذاری میشوند و بیشتر کار را در سلولها انجام میدهند. آنها برای ساختار، عملکرد و تنظیم بافت ها و اندام های بدن ضروری هستند. اکسیژنهای فعال با تخریب و ایجاد اختلال در ساختار این پروتئینها، باعث از بین رفتن فعالیت کاتالیزوری و اختلال در تنظیم مسیرهای متابولیک میشوند.
حمله اکسیژنهای فعال به پروتئینها باعث تغییر آنها به شیوههای مختلف میشود. بعضی از این تغییرات به طور مستقیم و بعضی دیگر به طور غیرمستقیم ایجاد میشوند. این تغییرات شامل موارد زیر هستند.
- اکسیداسیون ریشههای اسیدآمینه
- برش پیوندهای پپتیدی
- تجمع بین پروتئینها
نوع آسیب پروتئین به وسیله اکسیژنهای فعال به ترکیب اسیدآمینه پروتئین بستگی دارد. گروههای تیول و گوگرد آمینواسیدها قسمتهایی هستند که بیشتر تحت تاثیر اکسیژنهای فعال قرار میگیرند. اکسیژن فعال میتواند یک اتم هیدروژن از ریشههای سیستین جدا و «رادیکال تیل» (Thiyl Radicals) را ایجاد کند. رادیکالهای تیل با یکدیگر متصل میشوند و پیوند دیسولفیدی ایجاد میکنند.
تخریب لیپید
غشاهای سلولی به دلیل وجود اسیدهای چرب غیراشباع چندگانه به آسیب رادیکال های آزاد حساس هستند. هنگامی که فسفولیپیدهای غشایی با یک عامل اکسید کننده اکسیژن فعال در تماس باشند، پراکسیداسیون لیپیدی اتفاق میافتد.
در این واکنش، رادیکال آزاد یک زنجیره لیپیدی غیراشباع را اکسید میکند که منجر به تشکیل یک لیپید هیدروپراکسیده و یک رادیکال آلکیل میشود. پراکسیداسیون لیپیدها منجر به تغییراتی در ساختار غشا میشود که به سیالیت و یکپارچگی آن آسیب می رساند.
پراکسیداسیون لیپیدها استرس اکسیداتیو را از طریق تولید رادیکالهای مشتق شده از لیپید تشدید میکند که خود میتواند با پروتئینها و DNA واکنش نشان دهند و به آنها آسیب برسانند. سطح پراکسیداسیون لیپیدی به عنوان شاخص آسیب ناشی از اکسیژن فعال به غشای سلولی در شرایط استرسزا استفاده میشود.
«مالون دیآلدهید» (MDA) یکی از محصولات نهایی پراکسیداسیون اسیدهای چرب غیراشباع در فسفولیپیدها است و مسئول آسیب غشای سلولی است. دو محل رایج حمله اکسیژن فعال به مولکولهای فسفولیپید، پیوند غیراشباع (دوگانه) بین دو اتم کربن و پیوند استری بین گلیسرول و اسیدچرب است.
اگر رادیکال آزاد به کربن زنجیره آلیفاتیک یک اسید چرب حمله کند، باعث خروج هیدروژن از گروه متیلن () میشود که در نتیجه آن رادیکال آزاد دیگری تشکیل میشود. رادیکال تشکیل شده با رزونانس پیوند دوگانه تثبیت می شود. این رادیکال با اکسیژن واکنش داده و یک رادیکال پراکسیل (LOO) تشکیل میدهد که میتواند با سایر اسیدهای چرب غیراشباع مجاور واکنش داده و هیدروپراکسید و رادیکال آلکیل تشکیل دهد. در نتیجه باعث واکنش زنجیرهای و آسیب به تعداد فزایندهای از اسیدهای چرب غشا میشود.
در پراکسیداسیون لیپیدی، آلدهیدهای سمی مانند «مالونآلدهید» (Malonaldehyde) و «هیدروکسی نوننال» (Hydroxynonenal) تشکیل میشوند که با پروتئینها و بازهای DNA واکنش میدهند. این واکنشها باعث ترکیباتی میشود که میتوانند باعث بروز جهش شوند.
مالون دیآلدهید می تواند به صورت کووالانسی به گروههای آمین دو پروتئین مختلف (به ویژه بر روی ریشههای لیزین) یا با دو گروه آمین روی یک پروتئین متصل شود و پس از حذف آب، مشتقات «ایمین» (Imine) یا بازهای «شیف» (Schiff) تشکیل دهد. مالون دیآلدهید همچنین می تواند با بازهای DNA واکنش داده و آسیبهای جهشزا ایجاد کند.
القای اتوفاژی
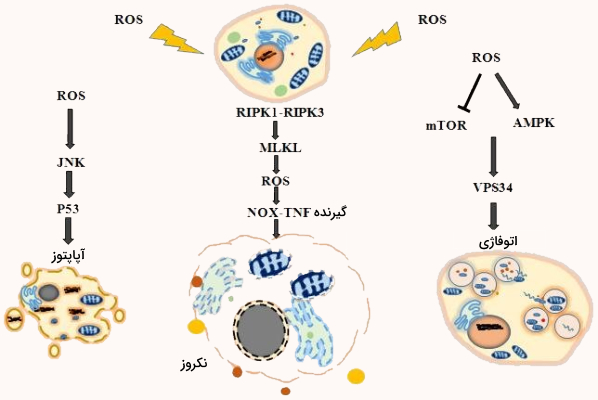
اتوفاژی مکانیسم تجزیه سلولی تنظیم شده است که در آن به وسیله لیزوزوم اندامکهای خراب، تجمعات پروتئینی و میکروارگانسیمها از بین میروند. اختلال در اتوفاژی برخی مشکلات نظیر سرطان، عفونت، مشکلات متابولیکی در ارتباط است. این سیستم تحت تاثیر شرایط استرسزا مانند «گرسنگی» (Starvation)، استرس شبکه اندوپلاسمی، تخریب اندامکها و عفونت به راه میافتد.
اکسیژنهای فعال نقش مهمی در شروع اتوفاژی دارند. تجمع هیدروژن پراکسید به منبع استرس اکسیداتیو تبدیل میشود. ATG4 یک ژن اتوفاژی ضروری است که در مسیر اتوفاژی نقش دارد. ATG4 توسط هیدروژن پراکسید به عنوان هدفی مستقیم برای اکسیداسیون در هنگام گرسنگی شناسایی شده است. افزایش سطح هیدروژن پراکسید میتواند ATG4 را اکسید کند که باعث افزایش لیپیداسیون LC3/ATG8 برای شروع اتوفاژی می شود.
همچنین اکسیژن فعال میتواند اتوفاژی را به طور غیرمستقیم از طریق فعال کردن پروتئینهای خانواده MAPK مثل JNK، p38 و ERK به راه بیاندازد. اعضای خانواده MAPK در یک آبشار کیناز 3 لایه تشکیل شده از MAPK کیناز کیناز (MAPKKK)، MAPK کیناز (MAPKK) و MAPK فعال می شوند. فعالسازی مداوم JNK میتواند باعث افزایش شدید تولید اکسیژن فعال سلولی شود که در نتیجه آن DNA آسیب میبیند.
در نهایت مسیر p53 با احساس استرس ردوکس سلولی فعال میشود و به عنوان فاکتور رونویسی، چندین القا کننده اتوفاژی را فعال میکند که ممکن است JNK و Sestrin2 را فعال کنند. فعال شدن JNK و Sestrin2 باعث اتصال آنها به TSC1/TSC2، فعال شدن TSC2 و در نهایت ایجاد اتوفاژی میشود. مسیر دیگری که در اتوفاژی به واسطه اکسیژنهای فعال ایجاد میشود، مسیر پیامرسانی Akt/mTOR و AMPK است.
القای آپوپتوز
آپوپتوز یا مرگ برنامهریزی شده سلول توسط پیامهای ایجاد شده داخل یا خارج سلولی حاصل از «گیرنده مرگ» (Death Receptors) یا مسیرهای القای پیام میتوکندریایی شکل میگیرد. وقتی آپاپتوز در سلول شروع میشود میزان اکسیژنم فعال سلولی به دلیل اختلال در هموستاز ردوکس داخل سلولی افزایش مییابد. در نتیجه افزایش اکسیژن فعال در سلول لیپیدها، پروتئینها و DNA تخریب میشود که خود باعث ایجاد پیامهای آپوپتوزی ناشی از استرس اکسیداتیو میشود.
نکروز
نکروز روشی از مرگ سلول است که با مرگ برنامهریزی شده یعنی آپوپتوز متفاوت است. کلسیم و اکسیژنهای فعال نقش مهمی در ایجاد نکروز دارند. نکروز با عمل دو سرین/ترئونین کیناز RIP1 و RIP3 کنترل میشود. فسفوریلاسیون RIP1 و RIP3 برای سرهم بندی کردن نکروزوم ضروری است. نکروزوم کمپلکسی است که پیام پرونکروز را القا میکند. کاهش میزان RIP3 غلظت اکسیژنهای فعال ناشی از نکروز را کاهش میدهد و در مقابل، افزایش سطح آن باعث افزایش تولید اکسیژن فعال میشود. در نتیجه افزایش اکسیژن فعال در سلول DNA، پروتئین و لیپیدها تخریب میشوند و نکروز اتفالق میافتد.
القای فروپتوز
فروپتوز نوعی مرگ سلولی اکسیداتیو وابسته به آهن است که توسط مولکولهای کوچک ساختاری متفاوت مانند «اراستین» (Erastin)، «سولفاسالازین» (Sulfasalazine) و RSL3 ایجاد میشود. فروپتوز ناشی از اختلال در عملکرد سیستم آنتی اکسیدانی است که منجر به از بین رفتن هموستاز ردوکس سلولی می شود.
فروپتوز از آپوپتوز متمایز است. در آپاپتوز در نتیجه آزاد شدن سیتوکروم C از میتوکندری، کاسپازها فعال میشوند و قطعه قطعه شدن کروماتین اتفاق میافتد ولی در فروپتوز مرگ سلول در نتیجه افزایش اکسیژن فعال شروع میشود.
SLC7A11 یکی از ترنسپورترهای غشای پلاسمایی است که سیستین خارج سلولی را به داخل سلول و گلوتامات داخل سلولی را به خارج سلول منتقل میکند. مهار رونویسی از ژن این ترنسپورتر باعث عدم ورود سیستین به سلول، تولید اکسیژن فعال و در نتیجه آن فروپتوز میشود.
اکسیژن فعال در کجا تولید میشود ؟
اکسیژن فعال در قسمتهای مختلف سلول مانند کلروپلاست، میتوکندری، غشای سلولی، پراکسیزوم، آپوپلاست، شبکه اندوپلاسمی و دیواره سلولی ساخته میشود. در ادامه نحوه تولید اکسیژنهای فعال در هر یک از این اندامکها بررسی خواهد شد.
پراکسیزوم
«پراکسیزوم» (Peroxisome) ساختاری کروی با غشای تک لایه است که بیشتر هیدروژن پراکسید در آن ساخته میشود. وظیفه اصلی اندامک پراکسیزوم تجزیه اسیدهای چرب بسیار بلندزنجیر از طریق بتااکسیداسیون است. در سلولهای حیوانی، اسیدهای چرب بلند زنجیر به اسیدهای چرب با زنجیره متوسط تجزیه میشوند. این اسیدهای چرب به میتوکندری منتقل میشوند و در آنجا به کربندراکسید و آب تجزیه میشوند. این فرایند در سلولهای گیاهی و قارچ به طور کامل در پراکسیزوم انجام میشود.
پراکسیزوم انزیمهایی مانند آمینواسید اکسیداز و اوریکاسید اکسیداز در خود دارد که فعالیت آنها باعث تولید اکسیژن فعال هیدروژن پراکسید میشود.
آنزیم دیگر پراکسیزوم به نام کاتالاز از هیدروژن پراکسید برای اکسید کردن سوبستراهای خود (مانند فنولها، فرمالدهید و الکل) استفاده میکند. با اکسید کردن این سوبستراها، هیدروژن پراکسید سمی از بین میرود و دیگر خطری برای سلول ایجاد نمیکند. انجام این واکنش در سلولهای کلیه و کبد اهمیت ویژهای دارد چون این سلولها محل از بین بردن سمیت سوبستراهای سمی هستند.

در سلولهای گیاهی این اندامک همچنین مانند کلروپلاست و میتوکندری، در حین انجام فعالیتهای متابولیکی خود رادیکال سوپراکسید تولید میکند. رادیکال سوپراکسید در دو محل مختلف پراکسیزوم تولید میشود.
- گزانتین اکسیداز واقع در ماتریکس پراکسیزوم گزانتین و هیپوگزانتین را به اوریکاسید و رادیکال سوپراکسید تبدیل میکند.
- زنجیره انتقال الکترون وابسته به NADPH از NADH و سیتوکروم b تشکیل شده است که در غشای پراکسیزوم قرار گرفتهاند. این ترکیبات از مولکول اکسیژن به عنوان گیرنده الکترون استفاده میکنند و رادیکال سوپراکسید را تولید میکنند.
علاوه بر این پلیپپتیدهای غشایی پراکسیزوم با وزن مولکولی 18، 29 و 132 کیلودالتون نیز رادیکال سوپراکسید تولید میکنند. NADH به عنوان دهنده الکترون به پلیپپتیدهای 18 و 32 عمل میکند در صورتی که پلیپپتید 29 کیلودالتونی از NADPH به عنوان دهنده الکترون برای کاهش سیتوکروم c استفاده میکند.
کلروپلاست
«کلروپلاست» (Chloroplast) از غشاهای تیلاکوئید تشکیل شده است که محل قرار گرفتن ماشینهای فتوسنتزی هستند. فتوسیستمهای PSI و PSII در تیلاکوئید مسئول اصلی تولید اکسیژنهای فعال سلول هستند. عوامل استرسزایی مثل خشکی، شوری، تغییرات شدید دمایی و کمبود آب باعث کاهش میزان در درون سلول میشوند. این عوامل همراه با نور زیاد باعث تولید رادیکال سوپراکسید در PS از طریق واکنش «ملر» (Mehler) میشوند.
متعاقب این واکنش، آنزیم متصل به غشای Cu/Zn SOD در PSI، رادیکال سوپراکسید را به هیدروژن پراکسید تبدیل میکند. 2Fe-2S و 4Fe-4S موجود در PSI نیز باعث نشت الکترون از زنجیره انتقال الکترون میشوند.
در PSII نشت الکترون ها از طریق گیرنده های الکترون و رخ می دهد و رادیکال سوپراکسید تولید میشود. پس از تولید رادیکال سوپراکسید از طریق واکنش «فنتون» (Fenton) در Fe-S، رادیکال سوپراکسید به اکسیژن فعال سمیتری مثل رادیکال هیدروکسیل تبدیل میشود. تولید رادیکال هیدروکسیل و اکسیژن منفرد از دو طریق صورت میگیرد.
- وقتی استرس محیطی تعادل بین جذب نور و استفاده از انرژی را بر هم میزند، منجر به تشکیل Chl (3Chl*) میشود که در واکنش با «دیاکسیژن» () اکسیژن منفرد آزاد میکند.
- وقتی زنجیره انتقال الکترون بیش از حد احیا شود «کمپلکس گیرنده نور» (Light Harvesting Complex | LHC) در PSII اکسیژن منفرد تولید میکند.
تجمع اکسیژن منفرد در کلروپلاست باعث پراکسیداسیون لیپیدهای غشایی و تخریب پروتئینهای غشایی میشود که مرکز واکنش P680 در PSII را در خطر قرار میدهد و میتواند مستقیما باعث مرگ سلول شود. افزایش اکسیژن منفرد همچنین باعث فعال شدن مسیرهای EXECUTOR1 و EXECUTOR2 میشود که مهار رشد سلول گیاهی را به دنبال دارد.
آلوپلاست
«آلوپلاست» (Apoplast) یک فضای قابل انتشار دور تا دور دیواره سلولی گیاه است که کربن دیاکسید را به فرم محلول تبدیل میکند تا بتواند به سیتوزول نفوذ کند و تحت فتوسنتز قرار بگیرد. در شرایط سخت محیطی، سیگنالهای استرس همراه با «اسیدآبسسیک» (Abscisic Acid | ABA)، آپوپلاست را به محلی برای تولید هیدروژن پراکسید تبدیل میکند. بیان اکسیدازهای NADPH به وسیله AtRbohD و AtRbohF در سلولهای نگهبان و سلولهای مزوفیل گیاه «آرابیدوپسیس» (Arabidopsis) باعث تولید اکسیژنهای فعال «آپوپلاستیک» (Apoplastic) میشوند که برای القای بسته شدن روزنهها لازم هستند.
علاوه بر این آنزیمها آنزیمهایی مثل پراکسیدازهای وابسته به pH، اکسیدازهای مرتبط با دیواره سلولی، اکسیدازهای اگزالات ژرمینمانند و اکسیدازهای پلیآمین نیز هستند که همگی عمدتاً هیدروژن پراکسید تولید میکنند.
دیواره سلولی
در هنگام وجود استرس، «لیپوکسیژناز» (lipoxygenase | LOX) موجود در «دیواره سلولی» (Cell Wall) باعث هیدروپراکسیداسیون »اسیدهای چرب غیراشباع چندگانه» (Polyunsaturated Fatty Acids | PUFA) میشود از این رو منبع فعال اکسیژن فعال است. دیآمین اکسیدازهای موجود در دیواره سلولی از دی آمینها یا پلیآمینها برای تولید اکسیژنهای فعال استفاده میکنند. در زمان حمله پاتوژن برای تقویت دیواره سلولی، پیشسازهای «لیگنین» (Lignin) از طریق مسیرهای واسطه هیدروژن پراکسید به یکدیگر متصل میشوند.
میتوکندری
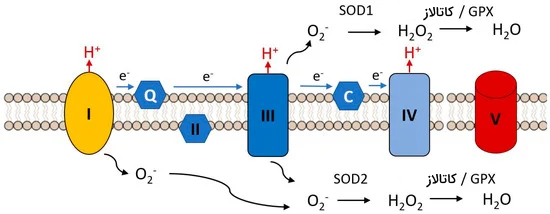
«میتوکندری» (Mitochondria) میتواند اکسیژن فعال را در چندین محل از زنجیره انتقال الکترون تولید کند. در میتوکندری کاهش مستقیم اکسیژن به رادیکال سوپراکسید در ناحیه فلاووپروتئین بخش NADH دهیدروژناز (کمپلکس I) زنجیره تنفسی رخ میدهد.
هنگامی که سوبستراهای مرتبط با NAD+ برای کمپلکس I محدود میشوند، الکترون میتواند از کمپلکس II به کمپلکس I (جریان الکترون معکوس) منتقل شود. این فرآیند تولید اکسیژن فعال را در کمپلکس I افزایش میدهد و توسط هیدرولیز ATP تنظیم میشود. ناحیه یوبیکینون-سیتوکروم (کمپلکس III) زنجیره انتقال الکترون نیز از اکسیژن، رادیکال سوپراکسید تولید میکند.
در این حالت یوبیکینون کاملا احیا شده یک الکترون به سیتوکروم C1 اهدا میکند و یک رادیکال یوبیسیمی کینون بسیار احیاکننده ناپایدار باقی میگذارد. تولید این رادیکال برای نشت الکترون به مولکول اکسیژن و در نتیجه آن تشکیل رادیکال سوپراکسید استفاده میشود.
در گیاهان، تحت شرایط هوازی معمولی، زنجیره انتقال الکترون و تولید ATP با هم در ارتباط هستند. با این حال، عوامل تنش مختلف منجر به مهار و تغییر اجزای آن میشود که در نتیجه آن کاهش بیش از حد حاملهای الکترون و تشکیل اکسیژن فعال اتفاق میافتد.
آنزیمهای زیادی در ماتریکس میتوکندری سلولهای گیاهی میتوانند اکسیژن فعال تولید کنند. بعضی از آنها به طور مستقیم اکسیژن فعال تولید میکنند (برای مثال آکونیتاز) و بعضی دیگر مانند آنزیم «1-گالاکتونو-γ لاکتون دهیدروژناز» (GAL)، الکترون را به زنجیره انتقال الکترون انتقال میدهند.
رادیکال سوپراکسید اولین اکسیژن فعالی است که در اثر کاهش تک ظرفیتی در زنجیره انتقال الکترون تولید میشود. این رادیکال به سرعت پس از تولید شدن توسط آنزیم MnSOD (شکل میتوکندری SOD) یا APX به هیدروژن پراکسید نسبتاً پایدار و نفوذپذیر از غشا تبدیل میشود. پس از آن، هیدروژن پراکسید میتواند در واکنش فنتون به رادیکال هیدروکسیل بسیار فعال تبدیل شود که بسیار سمی است.
شبکه اندوپلاسمی
«شبکه آندوپلاسمی» (Endoplasmic Reticulum) سلولهای گیاهی، انتقال الکترون وابسته به NAD(P)H (شامل Cyt P450) میتواند رادیکال سوپراکسید تولید کند. سوبسترای ارگانیک، ابتدا با Cyt P450 واکنش میدهد و سپس توسط یک فلاوپروتئین کاهش مییابد تا یک رادیکال واسطه تشکیل شود. اکسیژن سهگانه میتواند به راحتی با این رادیکال واسطه واکنش دهد زیرا دارای یک الکترون جفت نشده است. سپس این کمپلکس اکسیژندار توسط سیتوکروم b کاهش مییابد یا با آزاد کردن رادیکال سوپراکسید تجزیه شود.
غشای پلاسمایی
«غشای پلاسمایی» (Plasma Membranes) سلولهای گیاهی نقش مهمی در تعامل با تغییرات محیطی و انتقال پیام آن به سلول دارد. اکسیدازهای وابسته به NADPH که در غشای سلولهای گیاهی قرار گرفتهاند با انتقال الکترون از NADPH سیتوپلاسمی به مولکول اکسیژن رادیکال سوپراکسید تولید میکنند.
مکانیسم های مقاومت در برابر اکسیژن فعال
بقای سلولهای هوازی وابسته به از بین بردن اثرات مضر اکسیژنهای فعال است. میزان کم اکسیژن فعال در بدن در شکلگیری برخی از مسیرهای پیامرسانی و از بین بردن میکروارگانیسمها نقش دارد. اما اگر میزان تولید اکسیژن فعال و میزان از بین بردن آن در سلول متعادل نباشد، استرس اکسیداتیو رخ میدهد که به موجب آن آسیب به لیپید، پروتئین و DNA اتفاق میافتد. آسیب به این مواد سیالیت غشا، انتقال یون، اتصال متقابل بین پروتئینها، سنتز و فعالیت پروتئین و عملکرد DNA را تحت تاثیر قرار میدهد و مرگ سلولی اتفاق میافتد.
استرس اکسیداتیو بیماریهای زیادی ایجاد میکند. بدن برای از بین بردن اکسیژن فعال از آنتیاکسیدانهای انزیمی و غیرآنزیمی استفاده میکند که در ادامه توضیح داده میشوند.
آنتیاکسیدان های آنزیمی
آنتیاکسیدانهای آنزیمی در نقاط مختلفی از سلول قرار میگیرند و اکسیژنهای فعال را خنثی میکنند. این آنزیمها و محل قرارگیری آنها در سلول در جدول زیر مشخص شدهاند و در ادامه توضیح داده میشوند.
| آنتیاکسیدانهای آنزیمی | محل قرارگیری |
| سوپراکسید دیسموتاز | پراکسیزوم، میتوکندری، سیتوزول و کلروپلاست |
| کاتالاز | پراکسیزوم، میتوکندری |
| آسکوربات پراکسیداز | پراکسیزوم، میتوکندری، سیتوزول و کلروپلاست |
| منودیهیدروآسکوربات ردوکتاز | میتوکندری، سیتوزول و کلروپلاست |
| دیهیدروآسکوربات ردوکتاز | میتوکندری، سیتوزول و کلروپلاست |
| گلوتاتیون ردوکتاز | میتوکندری، سیتوزول و کلروپلاست |
| گایکول پراکسیداز | میتوکندری، سیتوزول، کلروپلاست و شبکه اندوپلاسمی |
سوپراکسید دیسموتاز
آنزیمهای سوپراکسید دیسموتاز به خانواده آنزیمهای فلزی تعلق دارند و در همه سلولهای هوازی دیده میشوند. تحت شرایط استرسزا این آنزیمها اولین سد دفاعی در برابر اکسیژنهای فعال را ایفا میکنند و سوپراکسید دیسموتاز را به مولکول اکسیژن و تبدیل میکند. این کار احتمال ایجاد رادیکال هیدروکسیل که در اثر واکنش «هابر-ویز» (Haber-Weiss) را کم میکند.
سوپراکسید دیسموتاز براساس یون فلزی که به آن متصل میشود در سلولهای گیاهی به سه ایزوآنزیم مختلف طبقهبندی می کنند.
- «منیزیم سوپراکسید دیسموتاز» (Mn-SOD): در میتوکندری
- «آهن سوپراکسید دیسموتاز» (Fe-SOD): در کلروپلاست
- «مس٫ روی سوپراکسید دیسموتاز» (Cu/Zn-SOD): در سیتوزول، پراکسیزوم و کلروپلاست
در سلولهای انسانی این آنزیم به صورت سه ایزوفرم SOD1 (در سیتوپلاسم)، SOD2 (در میتوکندری) و SOD3 (خارج سلولی) وجود دارد. SOD1 به صورت دیمر است ولی سایر آنها یه صورت تترامر هستند. SOD1 و SOD3 دارای عناصر روی و مس در ساختار خود هستند در صورتی که نوع SOD2 در ساختار خود منگنز دارد.
گلبولهای سفید انسان انزیم NADPH اکسیداز در ساختار خود دارند که سوپراکسید و سایر اکسیژنهای فعال را تولید میکند تا میکروارگانسیمها را از بین ببرد با این حال برخی از باکتریها با داشتن آنزیم سوپراکسید دیسموتاز از این مسیر فرار میکنند و میزبان را آلوده میکنند.
کاتالاز
«کاتالاز» (Catalase) یک آنزیم تترامر حاوی «هم» (Heme) است و را به آب و مولکول اکسیژن تبدیل میکند. این آنزیم تمایل زیادی به دارد اما اختصاصیت کمتری نسبت به پراکسیدهای آلی (R-O-O-R) دارد. بازدهی خیلی بالایی دارد ( مولکول را در هر دقیقه به آب و اکسیژن تبدیل میکند) و برخلاف سایر آنزیمهای آنتیاکسیدانی به معادل کاهنده نیاز ندارد. مکانیسم دقیق این آنزیم کاملا شناسایی نشده است ولی فرمول زیر را برای فعالیت آن پیشنهاد میکنند.
پراکسیزومها محل اصلی تولید به دلیل انجام فعالیتهایی مانند بتااکسیداسیون اسیدهای چرب، تنفس نوری، کاتابولیسم پورین و استرس اکسیداتیو هستند به همین خاطر آنزیم کاتالاز بیشتر در این اندامک قرار دارد.
بعضی از باکتریها مانند «مایکوباکتریوم توبرکلوسیس» (Mycobacterium tuberculosis)، «لژیونلا پنوموفیلا» (Legionella pneumophila) و «کامپیلوباکتر ژژونی» (Campylobacter jejuni) این آنزیم را درون سلولهای خود دارند و در صورت آلوده کردن سلول میزبان میتوانند رادیکالهای پراکسیزوم را خنثی کنند و میزبان را دچار عفونت کنند.
کمبود این آنزیم باعث سفید شدن موی انسان میشود. هیدروژن پراکساید که به طور طبیعی توسط سلولهای بدن تولید میشوند در صورت کمبود کاتالاز تجزیه نمیشوند و در فولیکولهای مو تجمع میکنند. تجمع هیدروژن پراکساید در فولیکولهای مو با تولید ملانین (رنگدانه مو) تداخل دارد و مو به سمت سفیدی میرود.
گوایاکول پراکسیداز
«گوایاکول پراکسیداز» (Guaiacol Peroxidase) پروتئینی حاوی «هم» (Heme) یا سلنیوم است که با مصرف ساختارهای آروماتیک دهنده الکترون مانند «گوایاکول» (Guaiacol) و «پیراگالول» (Pyragallol) را اکسید میکند. این آنزیم به طور گسترده در گیاهان، جانوران و میکروبها دیده میشود. آنزیم گوایاکول پراکسیداز دارای چهار پل دیسولفیدی حفاظت شده و دو یون کلسیم ساختاری است. این آنزیم در واکوئل، دیواره سلولی و سیتوپلاسم سلول های گیاهی یافت میشود. در انسان ۸ ایزوفرم مختلف از این آنزیم وجود دارد که نوع 1 آن فراوانترین است. واکنش اصلی که این آنزیم انجام میدهد به شرح زیر است.
میزان کم این آنزیم در سرم افراد با بروز بیماری پیسی یا «ویتیلیگو» (Vitiligo) در ارتباط است. همچنین فعالیت این آنزیم در بیماران مبتلا به MS عود کننده به شدت پایین است.
آنزیمهای چرخه آسکوربات گلوتاتیون
«چرخه آسکوربات گلوتاتیون» (Glutathione-ascorbate Cycle) یا مسیر «فویر-هالیول-آسادا» (Foyer-Halliwell-Asada)، مسیری متابولیکی است که در آن هیدروژن پراکسید تجزیه میشود. در این چرخه از متابولیتهای آنتیاکسیدانی نظیر «آسکوربات» (Ascorbate)، «گلوتاتیون» (Glutathione) و NADPH استفاده میشود تا آنزیمها بتوانند را تجزیه کنند.
این چرخه در نقاط مختلفی از سلول شامل سیتوزول، کلروپلاست، میتوکندری و پراکسیزوم وجود دارد تا با استرس اکسیداتیو مقابله کند. آنزیمهای زیر در این چرخه نقش دارند که به تفصیل در بخش بعد توضیح داده میشوند.
- «آسکوربات پراکسیداز» (Ascorbate Peroxidase | APX)
- «مونودهیدروآسکوربات ردوکتاز» (Monodehydroascorbate Reductase | MDHA)
- «دیهیدروآسکوربات ردوکتاز» (Dehydroascorbate Reductase | DHAR)
- «گلوتاتیون ردوکتاز» (Glutathione Reductase | GR)
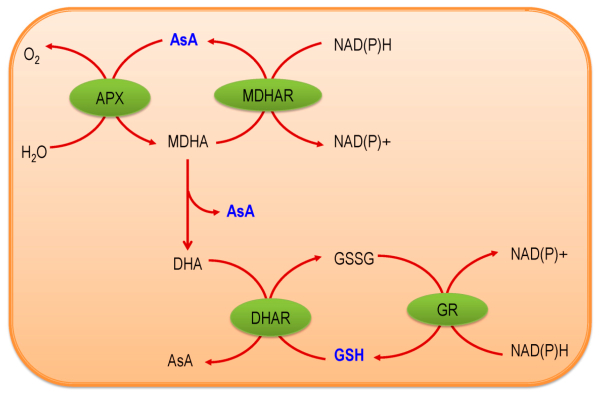
آسکوربات پراکسیداز
آسکوربات پراکسیداز یکی از اجزای اصلی سیکل آسکوربات-گلوتاتیون است. وقتی آنزیم کاتالاز در پراکسیزوم را حذف میکند این آنزیم مشابه همین کار را در سیتوزول و کلروپلاست انجام میدهد. آسکوربات پراکسیداز را به آب و «دیهیدروآسکوربات» (DHA) تبدیل میکند و برای انجام این واکنش از آسکوربیکاسید (AA) به عنوان عامل کاهنده استفاده میکند. این آنزیم تمایل بیشتری نسبت به انزیم کاتالاز برای دارد.
مونودهیدروآسکوربات ردوکتاز
آنزیم مونودهیدروآسکوربات ردوکتاز رادیکال مونودهیدروآسکوربات را با استفاده از NADPH به آسکوربات تبدیل میکند و مخزن آسکوربیکاسید سلول را دوباره پر میکند. از آنجایی که این آنزیم آسکوربیک اسید تولید میکند به همراه آسکوربات پراکسیداز در پراکسیزوم و میتوکندری قرار دارد. آسکوربات پراکسیداز برای حذف ، آسکوربیک اسید را مصرف میکند و این آنزیم دوباره آن را تولید میکند. این انزیم ایزوآنزیمهای مختلفی دارد که در کلروپلاست، میتوکندری، پراکسیزوم، سیتوزول و «گلیاکسیزوم» (Glyoxysomes) قرار دارند. واکنش زیر برای عملکرد آنزیم مونودهیدروآسکوربات ردوکتاز پیشنهاد میشود.
دیهیدروآسکوربات ردوکتاز
آنزیم دیهیدروآسکوربات ردوکتاز، دیهیدروآسکوربات را به آسکوربیکاسید کاهش میدهد و برای انجام این کار از گلوتاتیون احیاشده به عنوان دهنده الکترون استفاده میکند. این آنزیم اندازه استخر اسکوربیکاسید در «سیمپلاست» (Symplast) و آپوپلاست افزایش می دهد.
گلوتاتیون ردوکتاز
آنزیم گلوتاتیون ردوکتاز به عنوان یک آنتی اکسیدان در چرخههای کاهش اکسیداسیون آنزیمی و غیرآنزیمی عمل میکند و گلوتاتیون دیسولفید (GSSG) را به «گلوتاتیون» (GSH) احیا میکند. گلوتاتیون ردوکتاز، یک آنزیم وابسته به NADPH است و به گروه فلاوآنزیمها تعلق دارد. این آنزیم دارای یک گروه دی سولفید ضروری است.
این آنزیم در انسان نقش مهمی در حفاظت از عدسی چشم در برابر هیدروژن پراکسید دارد. کمبود این آنزیم در انسان با بروز آب مروارید در ارتباط است چون در سلولهای عدسی چشم آنزیم کاتالاز وجود ندارد و نبود این آنزیم باعث آسیب هیدروژن پراکسید به عدسی چشم میشود.
آنتی اکسیدان های غیر آنزیمی
علاوه بر آنزیمها بعضی از مواد معدنی نیز میتوانند نقش انتیاکسیدانی داشته باشند. برای مثال روی و سلنیوم باعث عملکرد صحیح آنزیمهای آنتیاکسیدانی میشوند. روی مهار کننده آنزیم NADPH اکسیداز است که باعث تولید اکسیژن منفرد میشود. همچنین روی یکی از اجزای آنزیم سوپراکسید دیسموتاز است که اکسیژن منفرد را به هیدروژن پراکسید تبدیل میکند.
در کنار ویتامینها و مواد معدنی برخی از متابولیتها نظیر بیلیروبین، اوریکاسید و ملاتونین نیز نقش آنتیاکسیدانی دارند. مطالعات نشان می دهد که اسیداوریک میتواند از «نیتروزیلاسیون» (Nitrosylation) پروتئین ناشی از پراکسینیتریت، پراکسیداسیون لیپیدی و پروتئین و غیرفعال شدن «تتراهیدروبیوپترین» (Tetrahydrobiopterin) جلوگیری کند.
توکوفرول
توکوفرولها (α ،β ،γو δ) از جمله آنتیاکسیدانهای چربیدوست هستند که رادیکالهای آزاد اکسیژن، رادیکالهای پراکسی لیپید و اکسیژن منفرد را غیرفعال میکنند. توکوفرولها جزء آنتیاکسیدانهای رایج و مهم بدن انسان حساب میشوند.
مکانیسم های آنتی اکسیدانی توکوفرولها شامل انتقال یک اتم هیدروژن در گروه 6- هیدروکسیل روی حلقه کرومان، و حذف اکسیژن منفرد و سایر گونههای اکسیژن فعال است. توکوفرولها در حضور اسیدهای آسکوربیک بازسازی می شوند. CoQ10 نیز میتواند خاصیت اکسیداتیو رادیکالهای پراکسیل را خنثی کند و دوباره ویتامین E بسازد.
ویتامین E هشت ایزوفرم دارد که 4 مورد آن توکوفرولی و 4 ایزوفرم دیگر آن توکوترینولی هستند. ویتامین E پراکسیداسیون لیپیدها را با دادن هیدروژن فنولی به رادیکال پراکسیل متوقف میکند. در این حالت رادیکال توکوفروکسیل ایجاد میشود که واکنش نمیدهد و زنجیره واکنشهای اکسیداتیو را متوقف میکند.
آسکوربیک اسید
ویتامین C (آسکوربیک اسید یا آسکوربات) ویتامینی محلول در آب است که در مرکبات و سایر سبزیجات و میوهها وجود دارد. این ویتامین به عنوان آنتیاکسیدانی قوی شناخته میشود چون میتواند در بسیاری از واکنشهای آنزیمی و غیرآنزیمی الکترون اهدا کند.
مکانیسمهای آنتی اکسیدانی اسیدآسکوربیک بر اساس اهدای اتم هیدروژن به رادیکالهای لیپیدی، غیر فعال کردن اکسیژن منفرد و حذف اکسیژن مولکولی است. از بین بردن رادیکالهای آبی و بازسازی توکوفرول از گونههای رادیکال توکوفروکسیل نیز از مکانیسمهای آنتی اکسیدانی شناخته شده ویتامین C هستند.
کاروتنوئید
کاروتنوئیدها یا تتراترپنوئیدها رنگدانههای زرد، نارنجی و قرمزی هستند که توسط گیاهان، جلبکها، بعضی باکتریها و قارچها ساخته میشوند. کاروتنوئیدها جزء آنتیاکسیدانهای چربیدوست هستند که بسیاری از اکسیژنهای فعال را از بین میبرند.
دو کلاس عمده از آنها وجود دارد که شامل «گزانتروفیل» (Xanthophylls) و و «کاروتن» (Carotenes) میشود. لکوپن و بتاکاروتن از جمله کاروتنهای رایج و لوتئین و زآگزانتین گزانتروفیلهای رایج هستند. کاروتنوئیدها نقش مهمی در حذف اکسیژن منفرد دارند. یک مول از بتاکاروتن 250 تا 1000 مولکول اکسیژن منفرد را از بین میبرد.
همچنین ویتامین A یا رتینول کاراتنوئیدی است که در اثر شکستن بتاکاروتن در کبد ساخته میشوند ویتامین A میتواند مستقیما به رادیکالهای پراکسیل متصل شود و مانع پراکسیداسیون لیپیدها شود.
پلیفنولها
ترکیبات فنولی با انواع رادیکالهای آزاد واکنش میدهند و به عنوان یک آنتیاکسیدان عمل می کند. مکانیسم آنتیاکسیدانی آنها شامل انتقال اتم هیدروژن، انتقال تک الکترون، انتقال متوالی الکترون، از دست دادن پروتون و کلاته کردن فلزات واسطه است.
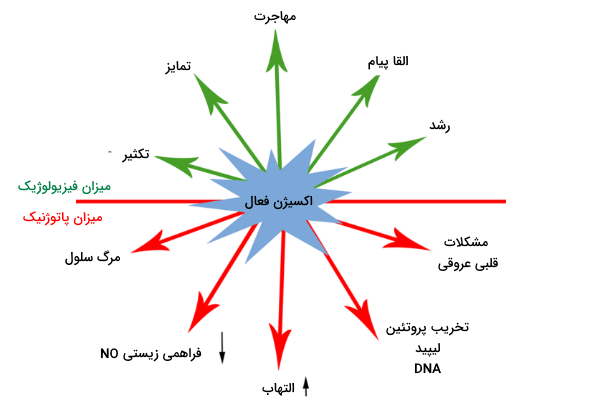
مزایای اکسیژن فعال در سلول
میزان فیزیولوژیک و طبیعی اکسیژن فعال در مسیرهای پیامرسانی و حذف پاتوژن ها اهمیت دارد. این موارد در ادامه توضیح داده میشوند.
نقش اکسیژن فعال در از بین بردن پاتوژن ها
سلولهای بیگانهخوار (فاگوسیت) برای از بین بردن سلولهای بیگانه و میکروبها از اکسیژن فعال استفاده میکنند. برای تولید اکسیژن فعال مصرف مولکول اکسیزن توسط این سلولها بالا میرود که به آن انفجار تنفسی میگویند. برای تولید اکسیژن فعال در سلولهای فاگوسیت از آنزیمهای متعددی استفاده میشود که یکی از مهمترین آنها NADPH اکسیداز نام دارد. فعال شدن و تولید اکسیژن فعال توسط آنزیم NADPH اکسیداز به وسیله G پروتئینی به نام Rac کنترل میشود.
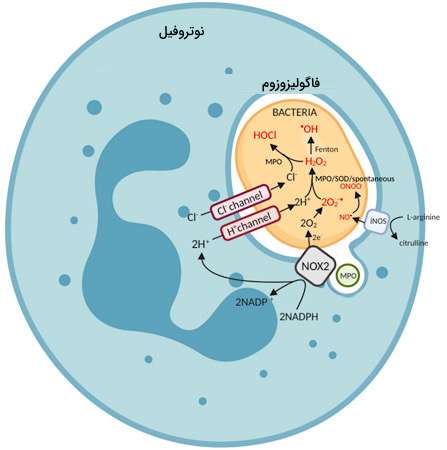
نقش اکسیژن فعال به عنوان پیام رسان
در غلظت های کم/متوسط، اکسیژن فعال به عنوان پیام رسان دوم در آبشارهای سیگنال دهی درون سلولی نقش دارند که واکنشهای متعددی را در سلولهای گیاهی نظیر بسته شدن روزنه ، مرگ برنامه ریزی شده سلولی ، گراویتروپیسم، و کسب تحمل به تنش های زنده و غیر زنده انجام میدهند.
گیاهان می توانند سیگنال اکسیژن فعال را با کمک برخی پروتئین های حساس به اکسیداسیون و کاهش، حرکت کلسیم، فسفوریلاسیون پروتئین و بیان ژن حس کنند، انتقال دهند و به پاسخ های سلولی مناسب تبدیل کنند.
اکسیژنهای فعال را میتوان مستقیماً توسط پروتئینهای سیگنالدهنده کلیدی مانند تیروزین فسفاتاز از طریق اکسیداسیون باقیماندههای سیستئین حفظ شده نیز حس کرد.
اکسیژنهای فعال همچنین میتوانند فعالیتهای بسیاری از مواد مانند پروتئین فسفاتازها، پروتئین کینازها و فاکتورهای رونویسی را در سیگنالدهی سلول تعدیل کنند. قدرت، طول عمر و میزان پیام حاصل از اکسیژن فعال به تعادل بین تولید اکسیدان و حذف توسط آنتی اکسیدان بستگی دارد.
اکسیزن فعال به عنوان پیامرسان دوم در مسیر انتقال «اسید آبسیزیک» (ABA) در سلولهای نگهبان در نظر گرفته میشود. هیدروژن پراکسید ناشی از ABA یک سیگنال ضروری در واسطه بستن روزنه برای کاهش اتلاف آب از طریق فعال شدن کانالهای کلسیمی در غشای پلاسمایی است.
به نظر می رسد که اکسیژنهای فعال در کاهش خواب سلولهای گیاهی نیز تاثیر داشته باشند. در دانههای جو، سیگنالدهی «اسید جیبرلیک »(GA) و اکسیژن فعال کم است، در حالی که سیگنالدهی اسید آبسیزیک زیاد است که منجر به خواب میشود.
گیاهان کمپلکسهای پیچیدهای برای مقابله با استرسهای زیستی و غیرزیستی دارند. در مواجهه اولیه گیاه با پاتوژن تولید کوتاهمدت اکسیژن فعال دیده میشود که نقش مهمی در انتقال سیگنال پاتوژنز ایفا میکند. برای مثال در سلولهای گوجهفرنگی اکسیزن فعال به عنوان سیگنال ثانویه عمل میکند و باعث القای رونویسی از ژنهای مقاومت در برابر زخمی شدن گیاه میشود.
بیماری های مرتبط با اکسیژن فعال در انسان
میزان بیش از اندازه اکسیژن فعال در سلولهای انسانی نیز میتواند باعث از بین رفتن لیپیدها، پروتئینها و تخریب DNA شود که در نهایت روند پیری را افزایش میدهد و باعث بروز برخی بیماریها میشود. در ادامه نقش اکسیژن فعال در برخی بیماریهای انسان بررسی میشود.
اکسیژن فعال چگونه باعث سرطان می شود ؟
تولید زیاد اکسیژن فعال و تداوم استرس اکسیداتیو یکی از ویژگیهای سلولهای سرطانی است. نفوذ ماکروفاژها به تومور و به دنبال انفجار اکسیداتیو، افزایش تولید اکسیژن فعال در سیستم عروقی معیوب تومورها (در رگزایی مجدد به دنبال هیپوکسی) و همچنین افزایش متابولیسم گلیکولیک دلایلی از وجود سطوح بالای اکسیژن فعال در سلولهای توموری نسبت به سلولهای سالم در نظر گرفته میشود.
تجمع آسیبهایی که اکسیژن فعال به DNA سلول وارد میکند، سلول را به سمت سرطانی شدن پیش میبرد. رادیکال هیدروکسیل با غیرفعال کردن ژنهای سرکوبکننده تومور و فعال کردن انکوژنها به وسیله ایجاد جهشهای نقطهای، فعالسازی کارسینوژنهای شیمیایی و جلوگیری از ترمیم آسیبهای DNA باعث ایجاد سرطان میشود.
علاوه بر این، اکسیژنهای فعال میزان یون کلسیم داخل سلولی را نیز افزایش میدهند که در نتیجه آن پروتوانکوژنهایی مثل c-fos، c-jun و c-myc فعال میشوند. افزایش یون کلسیم داخل سلولی باعث فعال شدن پروتئین کیناز C نیز میشود که تکثیر سلولهای توموری را بیشتر میکند.
اکسیژن فعال و بیماریهای قلبی عروقی
اکسیژنهای فعال در تعداد زیادی از بیماریهای قلبی عروقی نقش دارند. سلولهای عروقی به طور همزمان آنزیمهای NADPH اکسیداز بیان میکنند که میتوانند باعث تولید اکسیژن فعال شوند. بیشتر بیماریهای عروقی با تغییر بیان آنزیمهای NADPH اکسیداز 1، 2، 4 و 5 ایجاد میشوند.
برای مثال در بیماری فشار خون افزایش رادیکال سوپراکسید دیده میشود که میزان نیتریکاکسید (باز کننده عروق) را کاهش میدهد. علاوه بر این اکسیژن فعال باعث القای تکثیر و هیپرتروفی سلولهای عضلات صاف عروق میشود که در نتیجه آن مقاومت عروق بالا میرود و فشار خون بالا میرود.
اکسیژن فعال و بیماریهای عصبی
بیان آنزیم NADPH اکسیداز در سلولهای میکروگلیا باعث تولید اکسیژن فعال میشود. همچنین اکسیژن فعال از طریق مکانیسمهای دیگری در سلولها آستروسیت و نورونها نیز ایجاد میشود. میزان کم اکسیژن فعال در سلولهای عصبی برای عملکرد صحیح دستگاه عصبی ضروری است. اما میزان بالای آن باعث بیماریهایی مانند آلزایمر میشود.
آمیلوئید بهویژه اشکال محلول آن، میتواند منجر به فعالسازی میکروگلیا و تولید طولانیمدت اکسیژن فعال شود که به آسیب عصبی و در نهایت زوال عقل کمک میکند.
اکسیژن فعال و بیماریهای تنفسی
چندین تحقیق اشاره کردند که بیماری های ریوی مانند آسم و بیماری «انسداد مزمن ریه» (COPD) که توسط التهاب مزمن سیستمیک و موضعی تعیین می شود، با استرس اکسیداتیو مرتبط هستند. اکسیژنهای فعال از طریق فعال سازی کینازهای مختلف مسیرهای پیامرسانی التهابی و فاکتورهای رونویسی مانند NF-kappa B و AP-1 التهاب در بافت ریه را تقویت می کنند.
اکسیژن فعال و اختلالات حسی
بسیاری از بیماریهای چشم مرتبط با سن، مانند آب مروارید و دژنراسیون شبکیه همچنین کمشنوایی مرتبط با سن در اثر تولید اکسیژن فعال و استرس اکسیداتیو ایجاد میشوند. همچنین به نظر میرسد که کم شنوایی مرتبط با سن به دلیل میزان بالای اکسیژن فعال ایجاد شود.
اکسیژن فعال و ناباروری
براساس مقالات موجود اکسیژن فعال نقش ویژهای در ایجاد ناباروری مردان دارند. وجود اکسیژن فعال در مایع منی میتواند به علت عوامل درونی یا بیرونی باشد. لوکوسیتها شامل نوتروفیل و ماکروفاژ و همچنین اسپرماتوزاهای نابالغ منبع اصلی تولید کننده اکسیژن فعال داخلی هستند.
در مقابل، مصرف بالای الکل و دخانیات از جمله عوامل بیرونی وجود اکسیژن فعال در منی هستند. وجود عفونت و التهاب لکوسیتهای دارای آنزیم پراکسیداز را تحریک میکند و آنها نیز میزان اکسیژن فعال منی را تا 100 برابر افزایش میدهند. این میزان از اکسیژن فعال میتواند باعث تحرک و شکل غیرطبیعی و همچنین کشته شدن اسپرمها و ناباروری شود.
تست ROS ناباروری چیست ؟
تست ROS میزان استرس اکسیداتیو که اسپرمها با آن مواجه میشوند را اندازهگیری میکند. میزان کم اکسیژنهای فعال در منی برای انجام عملکرد طبیعی اسپرم همچون اتصال و نفوذ به اووسیت ضروری است. اما میزان بالای اکسیژن فعال میتواند باعث کشته شدن اسپرمها و ناباروری شود.
اندازه گیری اکسیژن فعال
به دلیل طول عمر پایین اکسیژن فعال در بدن اندازهگیری میزان آن مشکل است. با این وجود چندین روش برای اندازهگیری آنها توسعه یافته است. بسیاری از این روشها بر مولکولهایی متکی هستند که پس از اکسید شدن توسط اکسیژنهای فعال، فلورسانس منتشر میکنند.
از جمله پرکاربردترین این مولکولها «دیکلرودیهیدروفلورسین دیاستات» (Dichlorodihydrofluorescein diacetate | DCF)، «دی هیدرواتیدیوم» (Dihydroethidium | DHE) و MitoSOX هستند که میتوانند به ترتیب سطح کلی اکسیژن فعال، سطح رادیکال سوپراکسید سلولی و میتوکندریایی را اندازهگیری کنند.
جمعبندی
اکسیژن فعال ساختارهایی از مولکول اکسیژن را تشکیل میدهد که به دلیل واکنشپذیر بالا تاثیر زیادی بر سلولهای گیاهی و جانوری میگذارند. این مولکولها در میزان کم و فیزیولوژیک برای سلول مفید هستند و اعمالی مانند از بین بردن پاتوژنها و به راه انداختن مسیرهای پیامرسانی را انجام میدهند. با این وجود اگر تعادل میان میزان تولید و از بین رفتن اکسیژن فعال بهم بریزد، به دلیل واکنشپذیری بالای این مولکولها استرس اکسیداتیو رخ میدهد. در نتیجه استرس اکسیداتیو لیپیدها، پروتئینها و DNA آسیب میبینند و مشکلاتی برای سلول ایجاد میشود.













خیلی مطلب عالی بود برای من خیلی مفید واقع شد