فرآیند آدیاباتیک – به زبان ساده
پیشتر در مطلبی تحت عنوان گاز ایدهآل به تعریف اینگونه از گازها پرداختیم. در این مطلب قصد داریم تا فرآیند آدیاباتیک رخ داده روی گازهای ایدهآل را بررسی کرده و روابط حاکم بر آن را نیز توضیح دهیم. در ابتدا اجازه دهید تا بهطور خلاصه فرآیند آدیاباتیک را توضیح دهیم.
فرآیند آدیاباتیک
در ترمودینامیک، آدیاباتیک یا بیدررو به فرآیندی اطلاق میشود که در آن انتقال حرارت و جرم بین سیستم ترمودینامیکی و محیط اطراف وجود نداشته باشد. در حقیقت در چنین فرآیندی تنها کار عامل انتقال انرژی بین سیستم و محیط محسوب میشود.
برخی از فرآیندهای فیزیکی و شیمیایی در زمان بسیار کوتاهی انجام میشوند. با توجه به بالا بودن سرعت واکنش در این فرآیندها، سیستم فرصت انتقال حرارت با محیط اطراف را نخواهد داشت. از این رو فرآیندهای مذکور عمدتا بهصورت آدیاباتیک رخ میدهند.
در طی رخ دادن یک فرآیند ترمودینامیکی، معمولا کار انجام شده را با نماد W و انتقال حرارت صورت گرفته را با Q نمایش میدهند. همچنین انرژی مولکولهای سیستم را انرژی درونی نامیده و آن را با U نمایش میدهند. با این فرضیات اگر سیستمی در طی فرآیندی ترمودینامیکی کار W را روی محیط اطرافش انجام داده و حرارت Q را مبادله کند، قانون پایستگی انرژی، (یا همان قانون اول ترمودینامیک) رابطه زیر را بیان میکند:
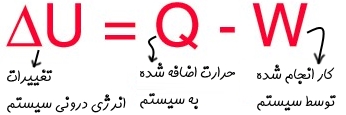
رابطه فوق میگوید افزایش انرژی درونی سیستم برابر با برآیند انتقال حرارت و کار انجام شده توسط سیستم است. در حالتی که با فرآیندی آدیاباتیک روبهرو باشیم، Q در رابطه فوق برابر با صفر بوده و رابطه بهصورت زیر در میآید.

رابطه بالا نشان میدهد که در یک فرآیند ترمودینامیکی تنها کار مبادله شده با محیط، عامل تغییرات انرژی درونی سیستم محسوب میشود.
در اکثر کاربردهای صنعتی و در بیشتر سوالات دروس مرتبط با ترمودینامیک، گازهای ایدهآل هستند که فرآیند آدیاباتیک را تجربه میکنند. در ادامه نحوه رخ دادن فرآیند آدیاباتیک روی یک سیستم حاوی گاز ایدهآل و روابط حاکم بر آن را توضیح میدهیم.

فرآیند آدیاباتیک در گاز ایدهآل
زمانی که یک گاز ایدهآل بهصورت آدیاباتیک متراکم شود، فقط کار روی آن انجام شده و دمای آن نیز افزایش مییابد. از طرفی در فرآیند انبساط آدیاباتیک دمای گاز کاهش یافته و کار انجام میشود. انبساط و تراکم، فرآیندهایی هستند که بهطور تقریبی در موتور خودرو رخ میدهند.
فرآیند انبساط آزاد
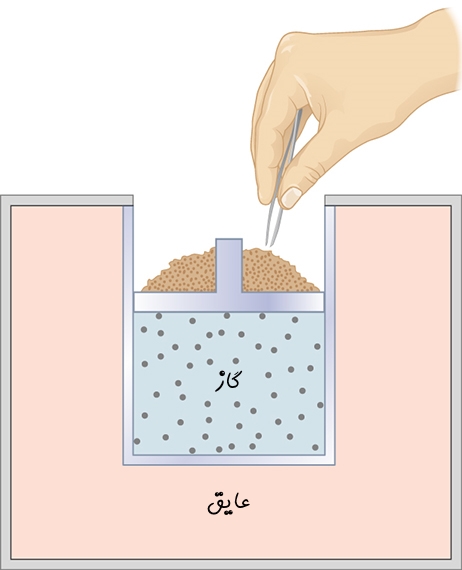
یکی دیگر از فرآیندهای آدیاباتیک معروف، فرآیند «انبساط آزاد» (Free Expansion) است. در شکل زیر محفظهای را میبینید که در یک سمت آن گاز ایدهآل توسط یک غشاء جدا شده است. توجه داشته باشید که در سمت دیگر، خلا بوده و محفظه نیز عایق فرض شده. با توجه به این دو فرض، در صورت پاره شدن غشا، گاز در محفظه پخش میشود.
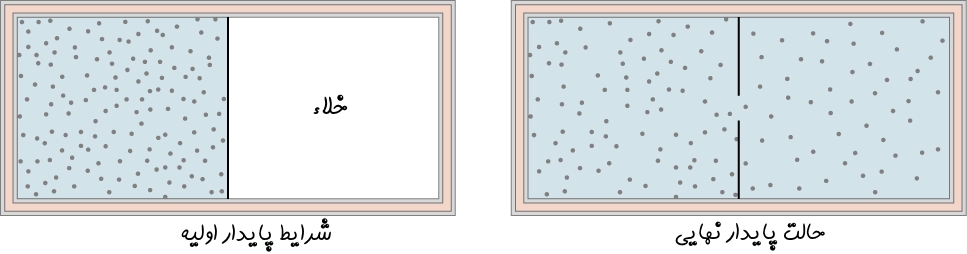
توجه داشته باشید که گاز در خلا پخش میشود، بنابراین در هنگام منتشر شدنش کاری انجام نمیدهد. از طرفی محفظه عایق است؛ بنابراین فرآیند بهصورت آدیاباتیک انجام میشود. با صفر بودن W و Q در رابطه ۱، انرژی درونی سیستم نیز تغییری نخواهد کرد (ΔU=0).
نکته بسیار مهم در تحلیل فرآیند صورت گرفته روی گاز ایدهآل این است که انرژی درونی در این گازها تنها وابسته به دمای گاز است. از این رو در فرآیند انبساط آزاد انرژی درونی گاز ثابت مانده، در نتیجه دمای گاز نیز ثابت خواهد ماند. به چنین انبساطی، «انبساط ژول» (Joule Expansion) گفته میشود.
فرآیند شبه پایا
در شکل زیر سیلندری عایق نشان داده شده که ۱ مول گاز ایدهآل در آن موجود است. فرض کنید روی سیلندر تعدادی سنگ ریزه قرار داده شده. اگر یکی از سنگها برداشته شود، گاز در طی فرآیندی شبه پایا منبسط شده و حجم سیلندر به اندازهی dv افزایش مییابد.
این افزایش حجم منجر به تغییر دمای dT در گاز میشود. کار انجام شده در این فرآیند برابر با dW=pdV بوده و Q=0 است. از طرفی همانطور که عنوان شد، تغییرات انرژی درونی گاز ایدهآل تنها وابسته به دمای گاز است. در حقیقت تغییرات انرژی درونی گاز برابر است با:
با جایگذاری کار انجام شده و تغییرات انرژی درونی در رابطه ۱ داریم:
از رابطه بالا دیفرانسیل dT برابر است با:
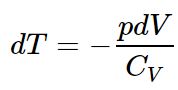
همچنین قانون گاز ایدهآل برای ۱ مول از آن را میتوان بهصورت زیر بیان کرد:
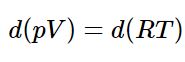
با محاسبه دیفرانسیل بالا داریم (توجه داشته باشید که R مقداری ثابت است):
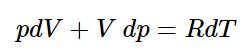
رابطه فوق را میتوان بهصورت زیر بازنویسی کرد:
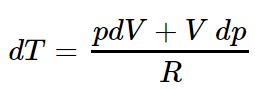
با برابر قرار دادن رابطه فوق و رابطه ۱ داریم:
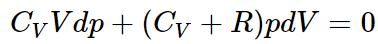
حال رابطه فوق را در ابتدا به pV تقسیم کرده و با استفاده از رابطه ، عبارت زیر حاصل میشود.
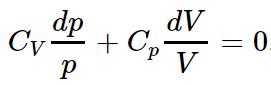
توجه داشته باشید که در رابطه فوق به صورت زیر محاسبه میشود (در برخی از متون این ضریب را با k نمایش میدهند). حال با انتگرالگیری از رابطه فوق عبارت زیر بدست میآید.
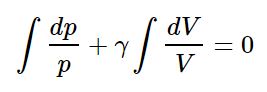
حاصل انتگرال فوق برابر است با:
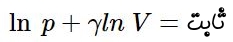
با توجه به قوانین لگاریتم، روابط و برقرارند. بنابراین، رابطه فوق را میتوان بهصورت زیر نوشت:
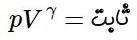
رابطه فوق، گاز ایدهآل تحت یک فرآیند شبهپایا را توصیف میکند. برای نمونه فرض کنید گازی ایدهآل، تحت فرآیندی شبهپایا از حجم و فشار اولیهی P1 و V1 به حجم و فشار نهایی P2 و V2 تغییر حالت بدهد. در این صورت رابطه بین حالت اولیه و نهایی وجود خواهد داشت.
در ترمودینامیک فرآیندهایی وجود دارند که از رابطهی ثابت= PVn پیروی میکنند. به این فرآیندها پلیتروپیک گفته میشود. در حالتی که باشد، فرآیند همان آدیاباتیک خواهد بود. در نتیجه فرآیند آدیاباتیک نوعی فرآیند پلیتروپیک محسوب میشود.
رابطه ۳ نشان دهنده فرآیندی آدیاباتیک در گاز ایدهآل است که میتوان آن را بهشکلهای دیگری نیز نشان داد. رابطه ۳ بهصورت فشار-دما و دما-حجم نشان داده شده است.
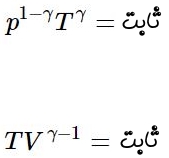
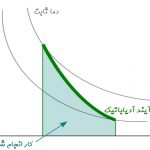
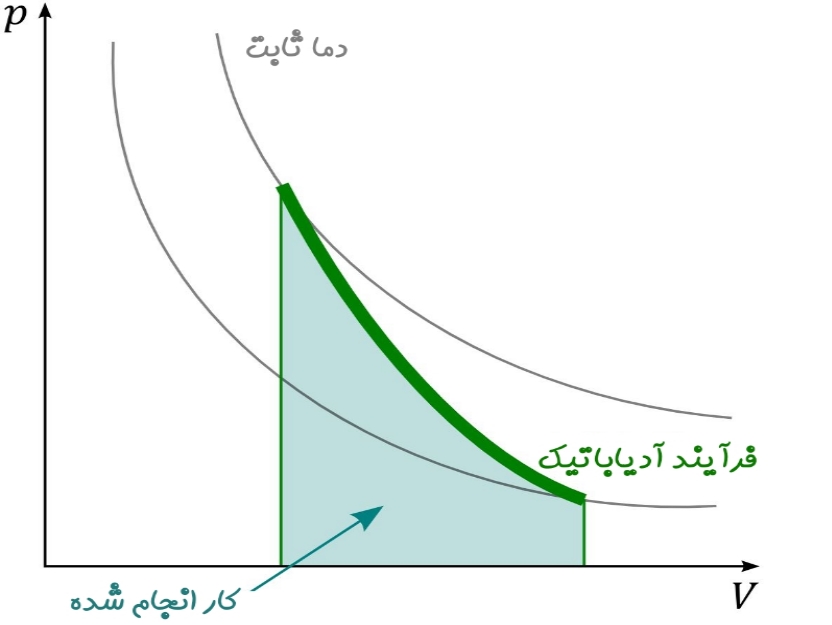
نمودار زیر تغییرات فشار بر حسب حجم را برای گازی ایدهآل، در دو فرآیند دما ثابت و آدیاباتیک نشان میدهد.
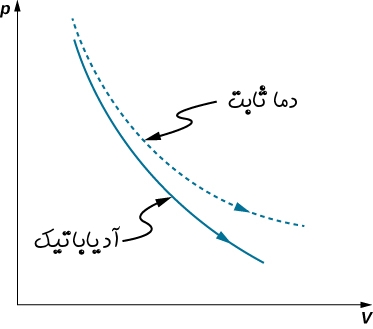
شیب تغییرات فشار نسبت به حجم در فرآیند آدیاباتیک، برابر است با:
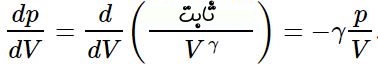
تغییرات مذکور برای فرآیند دما ثابت نیز مطابق با رابطه زیر بدست میآید.
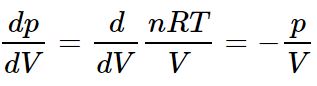
در ادامه مثالی از کاربرد این روابط در تحلیل موتور خودرو ارائه شده که مطالعه آن پیشنهاد میشود. همانطور که پیشتر نیز بیان شده، موتور خودرو مبتنی بر سیکل اتو کار میکند.
مثال: تراکم گاز ایدهآل در موتور خودرو
فرض کنید سوخت خودرو با حالت بخار در موتور خودرویی تزریق شده. در لحظهای که سوخت به طور کامل در موتور تزریق شده، دما، فشار و حجم گاز بهترتیب برابرند با:
فرض کنید مخلوط موجود در سیلندر، طی فرآیندی شبه پایا تا حجم متراکم شود. توجه داشته باشید که در واقعیت، فرآیند تراکم دقیقا شبه پایا نیست. با فرض آدیاباتیک و شبه پایا بودن فرآیند:
- دما و فشار مخلوط پس از تراکم چقدر است؟
- کار انجام شده توسط مخلوطِ گاز، طی فرآیند تراکم چقدر است؟
فرآیند آدیاباتیک فرض شده، بنابراین رابطهی برقرار است. از طرفی مخلوط سوخت گاز ایدهآل در نظر گرفته شده؛ در نتیجه رابطهی PV=NRT نیز صادق است.
(۱): فرآیند تراکم، آدیاباتیک فرض شده بنابراین رابطه زیر بین فشار اولیه و فشار نهایی برقرار است.
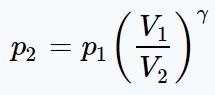
با استفاده از رابطهی بالا فشارِ مخلوط گازی پس از متراکم شدن برابر است با:
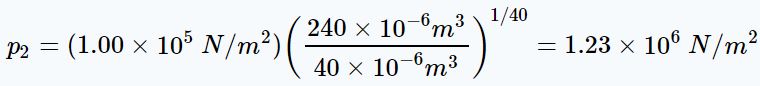
از طرفی دمای مخلوط، پس از تراکم را میتوان با استفاده از قانون گاز ایدهآل، بهصورت زیر بدست آورد.
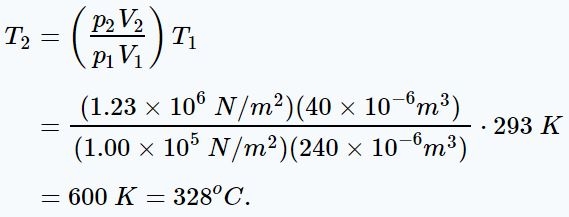
(۲): کار انجام شده توسط گازی ایدهآل که حجم و فشارش تغییر میکند، برابر است با:
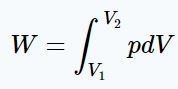
در انتگرال بالا هم فشار و هم حجم وجود دارد. از طرفی این دو کمیت در طول فرآیند به هم وابسته هستند. بنابراین بهمنظور انتگرالگیری نیاز است تا وابستگی آنها به یکدیگر بیان شوند. فرآیند آدیاباتیک است بنابراین رابطه برقرار خواهد بود. با توجه به این رابطه، انتگرال فوق بهصورت زیر بدست میآید.
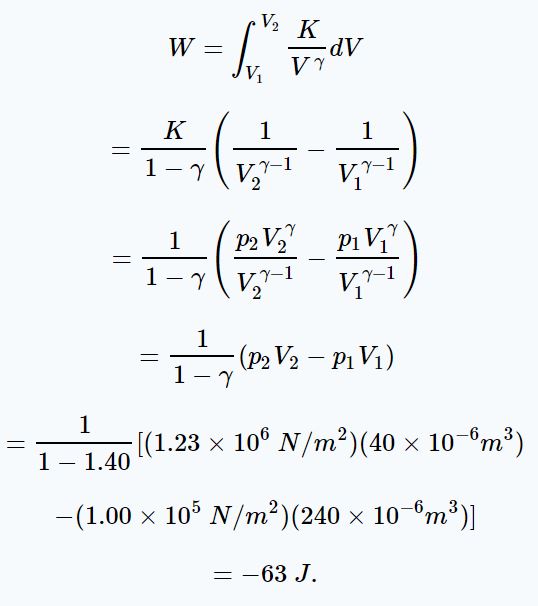
نکته: همانطور که میبینید در بالا کار انجام شده توسط گاز، منفی بدست آمده است. این علامت نشان میدهد که در طی فرآیندِ تراکم، محیط اطراف روی گاز کار انجام داده است.
در صورت علاقهمندی به مباحث مرتبط در زمینه مهندسی مکانیک، آموزشهای زیر نیز به شما پیشنهاد میشوند:
^^













سلام،
در مثال موتور خودرو چرا برای دمای نهایی گاز از رابطه گاز ایده آل استفاده شد و به جای توان گاما، توان یک برای حجم درنظر گرفته شد؟
ممنون
سلام وقت همگی بخیر آیا برای گاز های حقیقی معادلهای در فرایند آدیاباتیک وجود دارد
با سلام،
به پرسش شما، داخل مطلب پاسخ داده شده است،
با تشکر از همراهی شما با مجله فرادرس
با سلام
در مثال موتور خودرو ضریب k یا همان لاندا،چطور ۱/۴۰ در نظر گرفته شد در صورتی که در صورت سوال هیچ اشاره ای به اون نشده بود ولی در حل مساله از اون استفاده شد!
با سلام؛
مقدار γ برای گاز تکاتمی ایدهآل برابر 35 یا ۱/۶۷ و برای گاز دواتمی (مانند اکسیژن و نیتروژن، عناصر تشکیلدهنده هوا) برابر 57 یا ۱/۴۰ است. تراکم در یک موتور بنزینی میتواند به عنوان مثالی از تراکم آدیابتیک در نظر گرفته شود. گاز استفاده شده در موتور خودرو همان هما و متشکل از اتمهای اکسیژن و نیتروژن است، بنابراین γ آن را ۱/۴۰ در نظر میگیریم.
با تشکر از همراهی شما با مجله فرادرس
کاش ویدیو اش رو هم بزارید.
سلام وقتتون بخیر
نماد y که در رابطه است چه نام دارد؟؟
با سلام،
در رابطه به دست آمده، گاما برابر نسبت ظرفیت گرمایی ویژه در فشار ثابت به ظرفیت گرمایی ویژه در حجم ثابت است:
Cp/Cv = y
با تشکر از همراهی شما با مجله فرادرس
فیلم این میتونید بزارید. ممنون