سلول گالوانی (ولتایی) چیست – نحوه ساخت و کاربرد به زبان ساده

یک سلول گالوانی یا ولتایی (ولتاییک)، نوعی از سلولهای الکتروشیمیایی به شمار میآید که به منظور تامین جریان الکتریکی از آن استفاده میشود. این تامین جریان از طریق انتقال الکترونها به کمک واکنشهای اکسایش و کاهش (ردوکس) روی میدهد. یک سلول گالوانی نمونهای از ایده کنترل و بکارگیری انرژی به کمک واکنشهایی ساده بین عناصر مشخص است. در این مطلب با مفهوم سلول گالوانی آشنا میشویم و نحوه راهاندازی آن برای تولید انرژی را مرور میکنیم.
سلول گالوانی چیست؟
به بیان ساده، یک سلول گالوانی همچون دستگاهی عمل میکند که به طور همزمان، واکنشهای اکسایش و کاهش در آن روی میدهند. از این واکنشها برای تبدیل انرژی شیمیایی به انرژی الکتریکی استفاده میشود. انرژی آزاد شده نیز برای انجام کار مورد استفاده قرار میگیرد. برای دستیابی به این انرژی، باید واکنشهای اکسایش و کاهش، هردو به نیمواکنشهای جداگانهای تقسیم شوند. این کار به کمک دو محفظه مختلف و یک سیم انجام میگیرد و هر نیمواکنش در محفظهای جدا رخ میدهند تا الکترونها از یک بخش به دیگری حرکت کنند. به این ترتیب، یک سلول ولتایی ایجاد میشود.
پیشنهاد میکنیم برای آشنایی با این سلول گالوانی و یادگیری آن، فیلم آموزش رایگان سلول گالوانی و ولتایی در فرادرس را تماشا کنید که آن را در همین کادر زیر قرار دادهایم.
اساس سلول گالوانی
کار انجام شده توسط این سلول به طور عمده به دلیل انرژی آزاد گیبس واکنشهای خودبهخودی ردوکس در یک سلول ولتایی است. این سلول به طور کلی شامل دو نیمسلول و یک پل نمکی است. هر نیمسلول نیز شامل یک الکترود فلزی خواهد بود که در داخل محلول الکترولیت قرار داده شده است.
این دو نیمسلول توسط یک سیم و کلید به یکدیگر متصل شدهاند به یک ولتسنج نیز به صورت موازی در مسیر جریان قرار گرفته است. در برخی موارد، زمانیکه هر دو الکترود در یک الکترولیت قرار داده شوند، نیازی به پل نمکی نیست.
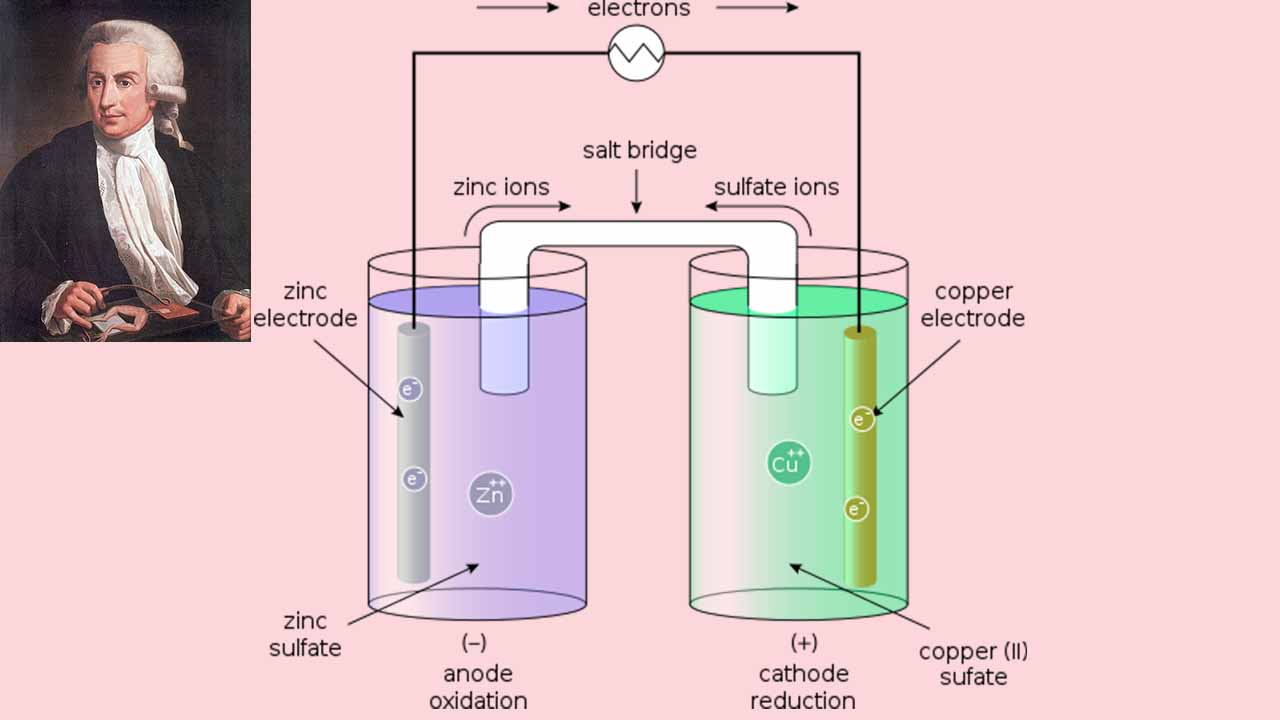
اجزای سلول ولتایی
در ادامه، اجزای سلول گالوانی (ولتایی) آورده شده است.
- آند: اکسایش در این الکترود انجام میگیرد.
- کاتد: کاهش در این الکترود رخ میدهد.
- پل نمکی: شامل الکترولیت و برای تکمیل مدار در یک سلول گالوانی مورد نیاز است.
- نیمسلولها: به کمک نیمسلولها، واکنشهای اکسایش و کاهش به دو بخش مختلف تقسیم و از یکدیگر جدا میشوند.
- مدار خارجی: سبب جریان الکترونها بین الکترودها میشود.
نحوه عملکرد سلول گالوانی
در یک سلول گالوانی، زمانیکه یک الکترود را درون الکترولیت قرار دهیم، اتمهای الکترود فلزی تمایل دارند تا یونهایی را در محلول الکترولیت ایجاد کنند و در الکترود، الکترونها باقی بمانند. در اثر این اتفاق، الکترود فلزی دارای بار منفی خواهد بود. در برخی موارد نیز، یونهای موجود در محلول الکترولیت تمایل دارند تا بر روی الکترود فلزی رسوب تشکیل دهند که در نتیجه این کار، الکترود دارای بار مثبت خواهد شد.
تحت شرایط تعادل، جدایش بار خواهیم داشت و بسته به تمایل دو واکنش متقابل، الکترودها ممکن است دارای بار مثبت یا منفی شوند. در اثر این اتقاق، اختلاف پتانسیلی بین الکترود و الکترولیت ایجاد میشود. این اختلاف پتانسیل را با نام «پتانسیل الکترود» (Electrode Potenrial) میشناسند. همانطور که در آموزشهای مربوط به کاتد و آند مطرح کردیم، به الکترودی که در آن اکسایش رخ دهد، آند و به الکترودی که در آن کاهش رخ میدهد، کاتد میگویند. با توجه به نوع الکترولیت، آند دارای قطب منفی و کاتد دارای قطب مثبت خواهد بود.
با توجه به قطبهای مخالف ایجاد شده، اختلاف پتانسیلی بین دو الکترود سلول بوجود میآید که به «پتانسیل سلول» (Cell Potential) معروف است. زمانیکه هیچ جریانی از یک سلول گالوانی عبور نکند، به پتانسیل سلول، نیروی الکتروموتوری سلول (نیروی محرکه سلول) میگویند. هنگامی که به کمک یک کلید، مدار متصل شود، به دلیل اختلاف پتانسیل، الکترونها از الکترود منفی به الکترود مثبت حرکت خواهند کرد.
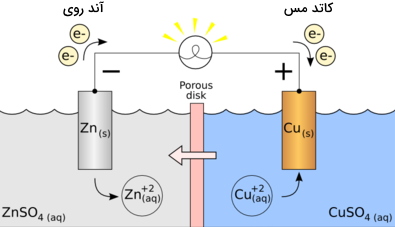
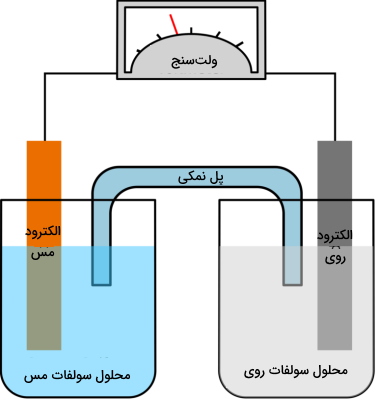
نحوه عملکرد سلول گالوانی روی مس
در ادامه برای اینکه توصیف بهتری از سلول ولتایی داشته باشیم، به کمک بیان یک مثال، نحوه عملکرد سلول گالوانی روی مس را بررسی میکنیم. در این مثال، الکترودها، فلزات روی و مس هستند. با انجام واکنش، روی، دو الکترون از دست میدهد که این دو الکترون توسط مس دریافت خواهند شد. از آنجایی که این دو فلز در دو محفظه جداگانه نگهداری میشوند، به هنگام اتصال این دو ظرف (محفظه) به یکدیگر توسط یک سیم، جریان الکتریکی بوجود خواهد آمد. این جریان به دلیل انتقال الکترونها از یک فلز به دیگری ایجاد میشود.
هر دو الکترود باید به طور همزمان در محلول نمکی قرار داده شوند که در این مثال، مس را در داخل محلول سولفات مس و روی را در داخل محلول سولفات روی قرار دادهایم. این محلولها با یکدیگر مخلوط نمیشوند چراکه هرکدام در یک بِشر جداگانه قرار دارند اما به کمک یک پل نمکی، تبادل و انتقال یونها بین این دو ظرف انجام میگیرد.
در حقیقت، پل نمکی کمک میکند تا مدار الکتریکی را کامل کنیم و در عین حال، هر دو محلول، با یکدیگر مخلوط نشوند. تا زمانی که پل نمکی دچار واکنشهای اکسایش و کاهش نشود، تفاوتی ندارد که از چه نوع پل نمکی استفاده میکنیم. واکنشهای نیمسلولهای سلول گالوانی روی مس در زیر آورده شده است:
کاتد:
آند:
اصطلاحات مهم در خصوص سلول گالوانی
در ادامه، به برخی از اصطلاحات مهم در خصوص سلولهای ولتایی اشاره میکنیم:
- «مرز فازی» (Phase Boundaries): به مرز فازهای محلول و الکترود اشاره دارد.
- پل نمکی: پل یا محیطی که سبب تبادل یونها بین دو نیمسلول میشود.
تفاوت سلول گالوانی و الکترولیتی
یک سلول گالوانی، سلولی الکتروشیمیایی است که در آن، واکنشهای اکسایش و کاهش به طور خودبهخودی انجام میگیرند و جریانی پیوسته از الکترونها خواهیم داشت.
این درحالیست که واکنشهای اکسایش کاهش در سلول الکترولیتی، نه به شکل خودبهخودی بلکه از طریق منبع تغذیهای جداگانه انجام میگیرند و این منبع تغذیه، عامل جریان در سلول است. در جدول زیر، تفاوت سلول گالوانی و الکترولیتی آورده شده است.
| سلول گالوانی | سلول الکترولیتی |
| واکنشهای خودبهخودی ردوکس انرژی شیمیایی را به الکتریکی تبدیل میکند. | واکنشهای ردوکس غیرخودبهخودی، انرژی شیمیایی را به انرژی الکتریکی تبدیل میکنند. |
| انرژی الکتریکی به کمک واکنشهای ردوکس تولید میشود. | تامین انرژی الکتریکی از طریق یک منبع تغذیه جداگانه صورت میگیرد. |
| کاتد، الکترود مثبت و آند، الکترود منفی است. | آند الکترود مثبت و کاتد، الکترود منفی است. |
| نیمواکنشها در محفظههای جداگانهای انجام میگیرند که از طریق پل نمکی به یکدیگر متصل شدهاند. | الکترودها هر دو در یک محفظه و در داخل محلول یا الکترولیت مذاب قرار دارند. |
| بیشتر در باتریها مورد استفاده قرار میگیرد. | از این سلول برای خالصسازی مس و آبکاری استفاده میشود. |
سوالات متداول سلول گالوانی
در ادامه، به برخی از سوالات متداول پیرامون سلول ولتایی پاسخ میدهیم.

کاربرد سلول گالوانی چیست؟
از سلول گالوانی (ولتایی) بمنظور ایجاد انرژی الکتریکی از طریق واکنشهای اکسایش و کاهش استفاده میشود. سلول گالوانی، نمونهای از نحوه استفاده از واکنشهای ساده بین برخی از عناصر بمنظور بکارگیری انرژی است.
یک سلول گالوانی چطور ساخته میشود؟
این سلول از دو الکترود (به طور معمول مس و روی) ساخته میشود که هرکدام درون محلولی از سولفوریک اسید رقیق قرار دارند. جریان در خارج سلول، از مس به روی و در داخل، از روی به مس برقرار است. البته برای برقراری این جریان، به یک سیم الکتریکی هم نیاز خواهیم داشت.
چرا کاتد در سلول گالوانی مثبت است؟
آند جایی است که در آن الکترون از دست میدهیم و اکسایش رخ میدهد. دلیل منفی بودن این الکترود در سلول گالوانی این است که الکترونها به هنگام وقوع واکنش اکسایش، بر روی الکترود باقی میمانند. بنابراین، کاتد در اینجا شامل یونهای فلزی کاهش یافته است.
اگر در سلول گالوانی، پل نمکی نداشته باشیم چه اتفاقی میافتد؟
در غیاب پل نمکی، واکنشهای ردوکس مانند قبل انجام میشوند اما این اتفاق به سرعت روی میدهد و محلولها قادر نخواهند بود تا خاصیت خنثی بودن خود را حفظ کنند.













مطالب خیلی خوب بودش،ممنونم از شما ❤
سلام شما گفتید جریان در خارج سلول، از مس به روی و در داخل، از روی به مس برقرار است.
آیا درسته؟
ممنون ازتون آقای بحرکاظمی
یه سوال داشتم، الکترونها در سلول گالوانی فقط از مدار و سیم بیرونی عبور میکنند نه؟ دلیلش چیه؟ چرا فقط از مدار عبور میکنند؟
با سلام؛
عبور الکترونها در داخل الکترولیت از طریق یونها صورت میگیرد. برای درک بهتر این موضوع، مطالعه مطالب زیر را توصیه میکنیم:
پیوند فلزی — به زبان ساده
پل نمکی چیست و چطور ساخته می شود؟ — به زبان ساده
با تشکر از همراهی شما با مجله فرادرس
اگر سلول گالوانی از نظر بار الکتریکی خنثی نباشه چه اتفاقی رخ میده و دلیلش چیه؟
مس مثبت واحیا میشه وروی منفی واکسایش می یابد
سلام مهندس. من تست جدایش کاتدی پوشش سرجوش خط لوله میخوام انجام بدم. چندتا سوال دارم. میتونید راهنمایی کنید؟
تست براساس پیوت G استاندارد ISO21809-3(2016) انجام باید بشه. تست در طول 28 روز و در دمای 80 درجه انجام میگیره.
سوال اول:از کجا پایداری الکترود اشباع کالومل یا الکترود استاندارد هیدروژن رو بفهمم؟
سوال دوم:منظور از پتانسیل منفی بین الکترود مرجع و الکترود کار چیست؟
با تشکر
با سلام؛
استانداردهای ایزو در دستورالعملهای مرتبط با آن به طور جداگانه به چاپ میرسند و توسط شرکتها خریداری میشوند. از اینرو جهت نحوه اجرا باید به منابع مرجع مراجعه کنید. اما برای اینکه با الکترودهای استاندارد و اشباع و همچنین مفاهیم پتانسیل آشنا شوید، مطالعه مطالب زیر را پیشنهاد میکنیم.
«پتانسیل استاندارد در الکتروشیمی — از صفر تا صد»
«پتانسیل سلول — به زبان ساده»
«الکتروشیمی – به زبان ساده»
با تشکر از همراهی شما با مجله فرادرس
سلام
در سلول گالوانی فلز مس بارش مثبته یا منفی؟
با سلام؛
پیشنهاد میکنیم که متن و تصاویر آن را با دقت بیشتری مطالعه کنید. نوع الکترودها و یونها هریک به طور کامل توضیح داده شده است.
با تشکر از همراهی شما با مجله فرادرس