تیتراسیون اسید باز – از صفر تا صد
تا پیش از قرن نوزدهم، بیشتر فعالیتهای مربوط به تیتراسیون اسید باز از ، هیدروکلرید اسید یا به عنوان تیترانت اسیدی و یا به عنوان تیترانت بازی استفاده میکردند. نقطه پایانی تیتراسیون نیز به کمک معرفی (شناساگری) همچون لیتموس تعیین میشد که در محلولهای اسیدی، به رنگ قرمز و در محلولهای بازی آبیرنگ بود یا اینکه با توقف فعالیت دیاکسید کربن در خنثیسازی ، نقطه پایانی را تعیین میکردند. نمونههای اولیه تیترسنجی اسید باز تنها شامل مشخص کردن خاصیت اسیدی یا بازی محلولها و تعیین خلوص کربناتها و اکسیدهای قلیایی خاکی میشد.


مقدمه
سه عامل موجب توسعه محدود تیتراسیون اسید باز بود:
- فقدان باز قوی به عنوان تیترانت برای آنالیز اسیدهای ضعیف
- عدم وجود معرفهای مناسب
- فقدان نظریه مناسب در خصوص واکنشپذیری اسید و باز
با معرفی سدیم هیدروکسید به عنوان تیترانت بازی قوی در سال 1846، دامنه فعالیت تیتراسیون اسید باز به تعیین اسیدهای ضعیف رسید. سنتز رنگهای آلی هم معرفهای بسیاری را فراهم کرد. به طور مثال، فنولفتالئین در سال 1871 سنتز شد که به عنوان معرف تیتراسیون اسید باز مورد استفاده قرار گرفت.
با وجود افزایش معرفها، نبودِ یک نظریه در خصوص واکنشپذیری اسید و باز، انتخاب معرف را دچار مشکل میکرد. توسعه نظریه تعادل در اواخر قرن نوزدهم، پیشرفتهای قابل توجهی را در درک نظری اسید و باز سبب شد که با پیشرفت تیتراسیون اسید باز همراه بود. تعاریف ارائه شده برای pH توسط سورن سورنسن، امکان مقایسه معرفها را فراهم کرد. علاوه بر این، تعیین ثابت تفکیک اسید، امکان محاسبه نظری نمودارهای تیتراسیون اسید باز را در سال 1914 فراهم کرد. در این زمان بود که برای اولین بار، شیمیدانهای تحلیلی، روشی منطقی برای انتخاب یک معرف داشتند و تیتراسیون اسید و باز را به عنوان روشی جایگزین برای گراویمتری ارائه کردند.
نمودارهای تیتراسیون اسید باز
در ابتدای بحث اشاره شد که نقطه پایانی تیتراسیون با نقطه تعادلی آن همراه است. برای فهم ارتباط نقطه تعادل و نقطه پایانی باید نوع تغییرات pH در تیتراسیون اسید باز را بشناسیم. در این بخش، با استفاده از محاسبات تعادلی، میآموزیم که چطور محاسبات را برای رسم یک نمودار تیتراسیون اسید باز انجام دهیم.
تیتراسیون اسید و باز قوی
تیتراسیون 50 میلیلیتر محلول 0/1 مولار هیدروکلریک اسید با استفاده از تیترانت 0/2 مولار سدیم هیدروکسید را در نظر میگیریم. واکنش آن به صورت زیر است:
اگر به معادله بالا توجه کنیم، متوجه خواهیم شد که واکنش بالا به صورت تعادلی نوشته نشده است. اما با توجه به اینکه ثابت تعادل این واکنش، عدد بزرگی است، فرض میکنیم که این واکنش به صورت کامل انجام میشود.
برای رسم نمودارهای تیتراسیون، به صورت زیر عمل میکنیم:
در مرحله اول، میزان حجم تیترانت مورد نیاز برای رسیدن به نقطه تعادل (نقطه همارزی یا اکیوالان) را محاسبه کنید. در حقیقت، اولین مرحله برای تشکیل نمودار تیتراسیون، محاسبه حجم سدیم هیدروکسید مورد نیاز برای رسیدن به نقطه تعادل است. در نقطه تعادل، با توجه به واکنش خواهیم داشت:
در واکنش بالا، زیروندهای a و b به ترتیب بیانگر اسید و باز هستند. حجم سدیم هیدروکسید مورد نیاز برای رسیدن به نقطه تعادل، از رابطه زیر بدست میآید:
در مرحله دوم، مقدار pH را قبل از نقطه تعادل با استفاده از تعیین غلظت آنالیت محاسبه میکنیم. قبل از نقطه تعادل، با مقدار اضافی وجود دارد و میزان pH را به کمک هیدروکلریک اسیدِ واکنشنداده، محاسبه میکنیم. در نقطه شروع تیتراسیون، محلول ۱ مولار هیدروکلریک اسید داریم. با توجه به اینکه یک اسید قوی است، برای محاسبه pH از رابطه زیر استفاده میکنیم:
بعد از اضافه کردن ۱۰ میلیلیتر سدیم هیدروکسید، غلظت اضافی برابر است با:
حجم کل/ (تعداد مول سدیم هیدروکسید اضافه شده - تعداد مول اولیه Hcl) =
$$\begin{align} [\textrm{HCl}]&\;=\dfrac{\textrm{initial moles HCl} - \textrm{moles NaOH added}}{\textrm{total volume}}=\dfrac{M_textrm aV_textrm a - M_textrm bV_textrm b}{V_textrm a + V_textrm b}\ &\;=\dfrac{(0.100\;textrm M)(50.0textrm{ mL}) - (0.200\;textrm M)(10.0textrm{ mL})}{50.0textrm{ mL} + 10.0textrm{ mL}} = 0.0500\;textrm Mend{align}$$
در این حالت pH به 1/30 میرسد.
در مرحله سوم: مقدار pH را برای بعد از نقطه تعادل حساب میکنیم. برای حجمهای سدیم هیدروکسید بعد از نقطه تعادل، pH را به کمک غلظت اضافی حساب میکنیم. به طور مثال، بعد از اضافه کردن ۳۰ میلیلیتر تیترانت، غلظت یون هیدروکسید برابر خواهد بود با:
حجم کل / (تعداد مول اولیه HCl - تعداد مول سدیم هیدروکسید اضافه شده) =
برای پیدا کردن غلظت ، از عبارت استفاده میکنیم:
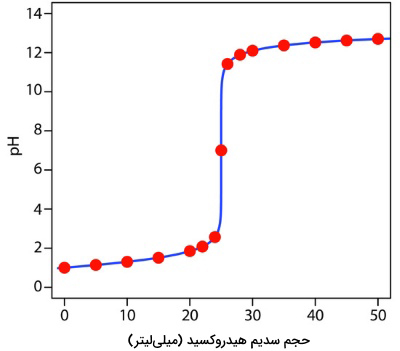
به همین صورت، برای حجمهای مختلف میتوان مقدار pH را محاسبه کرد که مقادیر آن در جدول زیر آورده شدهاند. از همین روش میتوانید برای تیتراسیون باز قوی با اسید قوی هم استفاده کنید، فقط باید توجه داشته باشید که در این حالت، قبل از نقطه تعادل، مقداری اضافی باز و بعد از نقطه تعادل، مقدار اضافی اسید خواهیم داشت.
| pH | حجم سدیم هیدروکسید (میلیلیتر) | pH | حجم سدیم هیدروکسید (میلیلیتر) |
| 11/42 | 26 | 1 | 0/00 |
| 11/89 | 28 | 1/14 | 5/00 |
| 12/10 | 30 | 1/30 | 10/0 |
| 12/37 | 35 | 1/51 | 15/00 |
| 12/52 | 40 | 1/85 | 20/00 |
| 12/62 | 45 | 2/08 | 22/00 |
| 12/70 | 50 | 2/57 | 24/00 |
| 7/00 | 25/00 |
تیتراسیون اسید ضعیف با باز قوی
برای تیتر کردن اسید ضعیف با باز قوی، به صورت مرحله به مرحله طبق مراحل زیر پیش میرویم. برای این کار، تیتراسیون ۵۰ میلیلیتر از محلول ۱ مولار استیک اسید با محلول 0/2 مولار سدیم هیدورکسید را در نظر میگیریم.
مانند قبل، میزان حجم سدیم هیدروکسید مورد نیاز برای رسیدن به نقطه تعادل را حساب میکنیم. در اینصورت خواهیم داشت:
مرحله دوم: قبل از اضافه کردن تیترانت، pH را از آنالیت محاسبه میکنیم. قبل از اضافه کردن سدیم هیدروکسید، مقدار pH با محلول ۱ مولار استیک اسید مرتبط است. از آنجایی که استیک اسید، نوعی اسید ضعیف به شمار میآید، مقدار pH را از طریق زیر محاسبه میکنیم:
در ابتدای تیتراسیون، مقدار pH برابر با 2/88 است. اضافه کردن سدیم هیدروکسید، بخشی از استیک اسید را به باز مزدوج خود، تبدیل میکند.
به طور مشابه، به دلیل اینکه ثابت تعادل برای این واکنش نیز عدد بزرگی است، میتوان فرض کرد که واکنش به طور کامل انجام میشود:
هر محلولی که مقادیر قابل توجهی اسید ضعیف HA و باز مزدوج داشته باشد، یک محلول بافر است. برای محاسبه pH محلولهای بافر میتوانیم از رابطه زیر استفاده کنیم:
در مرحله سوم، قبل از نقطه تعادل، میزان pH به کمک بافر شامل آنالیت و حالت مزدوج آن اندازهگیری میشود.
غلظت استات نیز به شکل زیر محاسبه میشود:
حجم کل / تعداد مول سدیم هیدروکسید اضافه شده = غلظت استات
به طور مثال، بعد از اضافه کردن 10 میلیلیتر سدیم هیدروکسید، غلظتهای استیک اسید و استات به صورت زیر محاسبه خواهند شد:
در نتیجه برای محاسبه pH به صورت زیر عمل میکنیم:
در مرحله چهارم، مقدار pH در نقطه تعادل را با استفاده از نوع مزدوج آنالیت حساب میکنیم که در اینجا یک باز ضعیف خواهد بود. در نقطه تعادل، تعداد مول سدیم هیدروکسید اضافه شده و تعداد مول استیک اسید با یکدیگر برابرند. با توجه به اینکه واکنش در جهت تکمیل (راست) پیشروی میکند، در محلول، یون خواهیم داشت که یک باز ضعیف است. برای محاسبه مقدار pH، در ابتدا مقدار غلظت را محاسبه میکنیم.
لازم به ذکر است که در روشی دیگر، میتوانیم غلظت استات را به کمک تعداد مول اولیه استیک اسید حساب کنیم، در اینصورت خواهیم داشت:
در ادامه، مقدار pH باز ضعیف را به صورت زیر محاسبه میکنیم:
میزان pH در نقطه تعادل برابر با 8/79 خواهد بود.
در مرحله پنجم مقدار pH را بعد از نقطه تعادل حساب میکنیم. بعد از نقطه تعادل، مقدار اضافی از تیترانت را داریم و مخلوط تیتراسیون، نوع رقیقی از محلول سدیم هیدروکسید است. مقدار pH را به همان شکلی محاسبه میکنیم که در تیتراسیون اسید باز قوی انجام دادیم. به طور مثال، بعد از اضافه کردن ۳۰ میلیلیتر سدیم هیدروکسید، غلظت یون هیدروکسید عبارتست از:
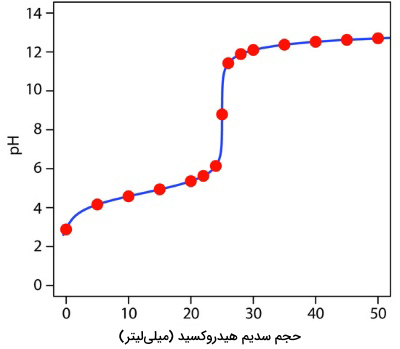
مشابه قبل، جدول زیر، مقادیر محاسبه شده pH را برای حجمهای سدیم هیدروکسید نشان میدهد که به کمک آنها نمودار تیتراسیون مربوطه را رسم خواهد شد. از این روش به طور مشابه میتوان برای محاسبه نمودار تیتراسیون برای باز ضعیف و اسید قوی استفاده کرد با این تفاوت که مقدار اولیه pH از طریق باز ضعیف بدست میآید. pH در نقطه تعادل توسط اسید مزدوج و pH بعد از نقطه تعادل از طریق مقدار اضافی اسید قوی محاسبه میشود.
| pH | حجم سدیم هیدروکسید (میلیلیتر) | pH | حجم سدیم هیدروکسید (میلیلیتر) |
| 11/42 | 26 | 2/88 | 0/00 |
| 11/89 | 28 | 4/16 | 5 |
| 12/10 | 30 | 4/58 | 10 |
| 12/37 | 35 | 4/94 | 15 |
| 12/52 | 40 | 5/36 | 20 |
| 12/62 | 45 | 5/63 | 22 |
| 12/70 | 50 | 6/14 | 24 |
| 8/79 | 25 |
این روش را میتوان برای محاسبه نمودار تیتراسیون اسید ضعیف و باز قوی برای واکنشهای شامل اسیدها و بازهای چند ظرفیتی استفاده کرد. هرقدر، پیچیدگی تیتراسیون بیشتر شود، زمان محاسبات مربوطه نیز بیشتر خواهد شد.
رسم نمودار تیتراسیون اسید باز
برای بررسی ارتباط بین نقطه تعادل و نقطه پایانی، باید تقریب مناسبی از نمودار دقیق تیتراسیون را رسم کنیم. در این بخش، روشی ساده برای رسم یک نمودار تیتراسیون اسید باز را ارائه میکنیم. هدف این بخش، رسم سریع نمودار تیتراسیون با حداقل محاسبات است.
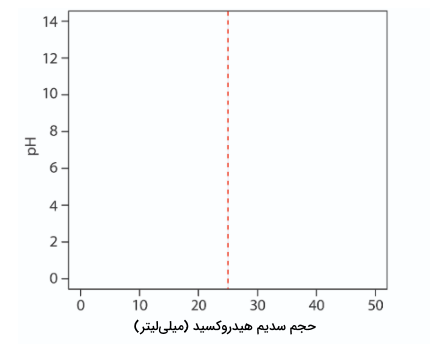
تیتراسیون 50 میلیلیتر محلول ۱ مولار استیک اسید با محلول 0/2 مولار سدیم هیدروکسید را در نظر میگیریم. کار خود را با محاسبه حجم نقطه تعادل شروع میکنیم که پیشتر توضیح داده شد و مقدار آن 25 میلیلیتر بود. در مرحله بعد، محورهای نمودار را رسم میکنیم که pH را در محور y و حجم تیترانت را در محور x قرار میدهیم. برای مشخص کردن حجم نقطه تعادل، خطی عمودی متناظر با حجم ۲۵ میلیلیتر میکشیم. تصویر آن در نمودار زیر آمده است:
قبل از نقطه تعادل، pH مخلوط تیتراسیون را به کمک بافر استیک اسید و استات تعیین میکنیم. با وجود اینکه به راحتی میتوان مقدار pH بافر را از معادله «هندرسون-هاسلبالخ» (Henderson–Hasselbalch) محاسبه کرد، با فرضی ساده هم میتوانیم از این محاسبه چشمپوشی کنیم. ذکر این نکته لازم است که یک بافر، در محدوده واحد pH در دو طرف ثابت تفکیک یک اسید ضعیف عمل میکند. زمانی که غلظت اسید ضعیف، ۱۰ برابر بزرگتر از باز مزدوج خود باشد، رابطه برقرار است و زمانی که غلظت اسید ضعیف، ده برابر کمتر از باز مزدوج خود باشد، از رابطه استفاده میکنیم. به هنگام تیتر کردن یک اسید یا باز ضعیف، محلول بافر، دامنهای از حجم را از 10 درصد حجم نقطه تعادل تا ۹۰ درصد آن پوشش میدهد.
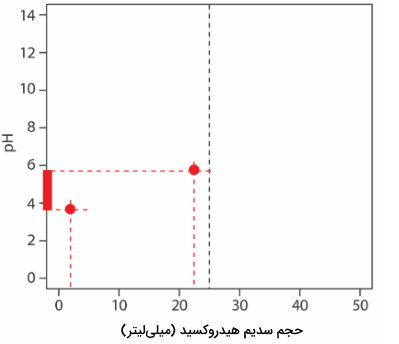
تصویر زیر، مرحله دوم این رسم را نشان میدهد. در ابتدا، نموداری نردبانی روی محور y شامل دامنه بافر رسم میکنیم. با توجه به اینکه مقدار برابر با ۴/76 است، میزان ۱۰ و ۹۰ درصد آن را به عنوان دامنه بالا و پایین نمودار نردبانی در نظر میگیریم که به ترتیب برای pH برابر با 3/76 و 5/76، 2/5 و 22/5 میلیلیتر است.
مرحله سوم در رسم نمودار تیتراسیون اسید باز شامل اضافه کردن دو نقطه، بعد از نقطه تعادل است. مقدار pH بعد از نقطه تعادل، توسط غلظت تیترانت اضافی، یعنی سدیم هیدروکسید بدست میآید. محاسبه pH بازهای قوی به صورت مستقیم است که در بالا با آن آشنا شدیم. نمودار زیر، میزان pH بعد از اضافه کردن ۳۰ و ۴۰ میلیلیتر از سدیم هیدروکسید را نشان میدهد.
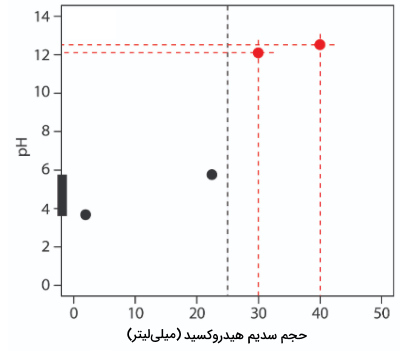
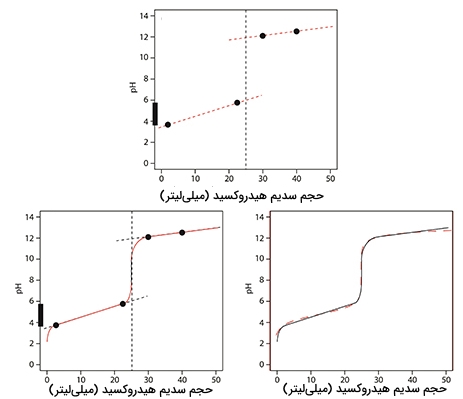
در مرحله بعد، خطی مستقیم از هر دو نقطه رد میکنیم و آن را با خط عمودی رسم شده قطع میدهیم. در این مرحله، با توجه به خطوط و نقاط رسم شده میتوانیم نمودار مورد نظر را رسم کنیم. تصویر زیر، مقایسه بین این نمودار با نمودار دقیق را نشان میدهد. با نگاه به نمودار رسم شده درمییابیم که این نمودار با تقریب مناسبی رسم شده است.
انتخاب و بررسی نقطه پایانی در تیتراسیون اسید باز
در ابتدای این آموزش، مشاهده کردیم که بین نقطه تعادل و پایانی، تفاوتهایی وجود دارد. با توجه به اهمیت این دو عبارت، بهتر است آنها را دوباره مرور کنیم. نقطه تعادل، نقطهای نظری است که مقادیر مساوی استوکیومتری از آنالیت و تیترانت را وارد واکنش میکنیم. در مقابل، نقطه پایانی، نقطهای است که از طریق آزمایش بدست میآید و بیانگر تلاش ما برای تخمین نقطه تعادل است. اختلاف بین نقطه تعادل و نقطه پایانی، «خطای معین» (Determinate Error) نام دارد.
محل نقطه تعادل تیتراسیون اسید باز
در این آموزش یاد گرفتیم که چطور میزان pH در نقطه تعادل را برای تیتراسیونهای اسید قوی با باز قوی و اسید ضعیف با باز قوی محاسبه کنیم. همچنین آموختیم که چطور با حداقل محاسبات، نمودار تیتراسیون را رسم کنیم. این سوال مطرح میشود که آیا میتوانیم بدون هیچ محاسبهای، نقطه تعادل را پیدا کنیم؟ پاسخ این سوال، مثبت است.
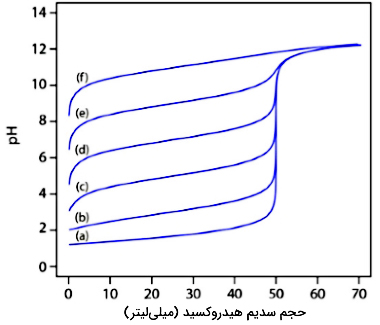
برای بیشتر فرآیندهای تیتراسیونهای اسید باز باید به این نکته اشاره کرد که نقطه عطف، یعنی محلی که نمودار ما بیشترین شیب را دارد، به نقطه تعادل بسیار نزدیک است. به طور مثال، فلشهای قرمزرنگ تصویر زیر، نمایانگر نقاط تعادل هستند. از جمله محدودیتهای این روش باید خاطرنشان کرد که در بعضی از تیتراسیونها، نقطه عطفی نداریم. تصویر زیر، اثر ثابت تفکیک یک اسید ضعیف را بر شکل نمودار تیتراسیون نشان میدهد. همانطور که مشاهده میکنید، نقطه عطف در تمامی مقادیر به جز حالت f، وجود دارد که در این حالت، برابر با است.
در تیتراسیونهایی که آنالیت، اسید یا باز ضعیف چند پروتونه با ثابتهای تفکیکِ نزدیک به هم باشند، نقطه عطف نخواهیم داشت. برای بررسی علت این اتفاق، تیتراسیون یک اسید دو پروتونه با را در نظر بگیرید. در طول تیتراسیون، دو واکنش زیر رخ میدهند:
برای اینکه دو نقطه عطف مجزا داشته باشیم، واکنش اول باید به طور کامل، قبل از واکنش دوم تکمیل شود. تصویر زیر، نمودار تیتراسیون برای ۳ اسید ضعیف چند پروتونه را نشان میدهد. نمودار تیتراسیون مالئیک اسید که آن در حدود 20000 برابر بزرگتر از است، دو نقطه عطف مجزا دارد. اما در خصوص مالونیک اسید، این اختلافِ ثابتهای تفکیک، کمتر و در حدود 690 است.
باوجود اینکه نمودار این اسید هم دو نقطه عطف مجزا دارد، اما نسبت به نمودار قبلی، وضوح کمتری را شاهد هستیم. در نهایت، نمودار مربوط به سوکسینیک اسید که اختلاف ثابتهای تفکیکی در حدود 72 دارد، تنها دارای یک نقطه عطف مجزا است که به خثیسازی به ربط دارد. در حالت کلی، زمانی نقاط عطف مجزا داریم که ثابتهای تفکیک اسید، اختلافی در حدود 500 واحد داشته باشند یا اختلاف حداقل 2/7 باشد.

یافتن نقطه پایانی تیتراسیون اسید باز به کمک معرف
از جمله اسیدها و بازهای ضعیف اما جالب میتوان به رنگهای آلی اشاره کرد. از آنجایی که یک رنگ آلی، حداقل دارای یک اسید یا باز مزدوج رنگی است، در اثر تیتراسیون، تغییر رنگ و pH خواهیم داشت. اگر این تغییر رنگ در نقطه تعادل یا نزدیک آن رخ دهد، میتوان از آن برای تعیین نقطه پایانی تیتراسیون اسید باز استفاده کرد.
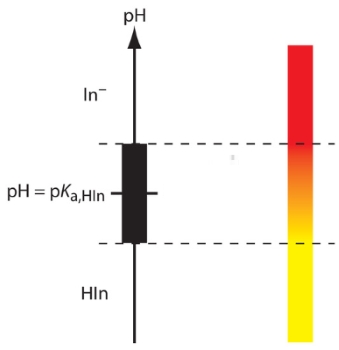
برای نمایش نحوه کار معرف اسید و باز، معرفی با فرمول شیمیایی HIn را در نظر بگیرید. حالتهای اسیدی و بازی معرف، رنگهای متفاوتی دارند. اسید ضعیف HIn به رنگ زرد و باز ضعیف قرمزرنگ است. با توجه به این تغییر رنگ، رنگ محلول حاوی معرف، به غلظتهای نسبی اسید یا باز ضعیف بستگی دارد. واکنش تفکیک این معرف به صورت زیر خواهد بود:
در نتیجه، ثابت تعادل واکنش را میتوان از رابطه زیر حساب کرد:
اگر از طرفین رابطه، لگاریتم منفی بگیریم و آن را برای محاسبه pH، بازآرایی کنیم، خواهیم داشت:
این رابطه، نقطه pH محلول را به غلظتهای نسبی و مرتبط میکند. درصورتیکه غلظتهای برابری از و را شناسایی کنیم، رنگ محلول به نقطه میانی خود یعنی رنگ نارنجی میرسد. در حقیقت، زمانی که و pH در نقطه تعادل با یکدیگر برابر باشند، تیتر کردن آنالیت تا رسیدن به رنگ نارنجی، ما را به نقطه پایانی مناسبی میرساند. متاسفانه به طور معمول، اطلاع دقیقی از pH در نقطه تعادل نداریم، علاوه بر این، اگر تغییر رنگ معرف، محسوس نباشد، تعیین این نقطه با دشواری همراه است.
میتوانیم دامنهای را برای مشاهدات pH بر اساس تغییرات رنگ معرف در نظر بگیریم که این کار به کمک فرضهای زیر امکانپذیر است:
- اگر غلظت ده برابر بیشتر از غلظت باشد، رنگ معرف زرد است.
- اگر غلظت ده برابر کمتر از غلظت باشد، رنگ معرف قرمز است.
با در نظر گرفتن فرضها و جایگزینی آنها در رابطه بالا، به روابط زیر میرسیم:
روابط بالا نشان میدهند که رنگ معرف در محدوده از pH، تغییر میکند. همانطور که در تصویر زیر مشاهده میشود، زمانی که میزان pH، کمتر از باشد، رنگ معرف زرد خواهد بود و اگر مقدار pH، بیش از باشد، معرف، قرمزرنگ است. در شرایطی که pH، بین این دو بازه باشد، رنگ معرف، درجات مختلفی از رنگ نارنجی را شامل میشود. در جدول زیر، خواص معرفهای معمول در تیتراسیون اسید باز آورده شده است:
| دامنه pH | رنگ باز | رنگ اسید | معرف | |
| - | 1/8-0/2 | زرد | قرمز | کرسول قرمز |
| 1/7 | 2/8-1/2 | زرد | قرمز | تیمول آبی |
| 4/1 | 4/6-3 | آبی | زرد | برموفنول آبی |
| 3/7 | 4/4-3/1 | زرد | قرمز | متیل اورنج |
| - | 5-3 | قرمز | آبی | سرخ کنگو |
| 4/7 | 5/4-3/8 | آبی | زرد | بروموکرسول سبز |
| 5 | 6/3-4/2 | زرد | قرمز | متیل قرمز |
| 6/1 | 6/8-5/2 | بنفش | زرد | برومو کرسول بنفش |
| - | 8/5 | آبی | قرمز | لیتموس |
| 7/1 | 7/6-6 | آبی | زرد | برومومتیل آبی |
| 7/8 | 8/4-6/8 | آبی | زرد | فنول قرمز |
| 8/2 | 8/8-7/2 | قرمز | زرد | کرسول قرمز |
| 8/9 | 9/6-8 | قرمز | زرد | تیمول آبی |
| 9/6 | 10-8/3 | قرمز | بیرنگ | فنول فتالئین |
| - | 12/10/1 | نارنجی-قرمز | زرد | آلیزارین زرد |
تغییرات pH در محدوده رنگی معرفها، محدودیتهایی در تعیین نقطه پایانی ایجاد میکند. برای کاهش خطای معین تیتراسیون اسید باز باید دامنه pH یک معرف، در محدوده تغییر سریع pH نقطه تعادل قرار داشته باشد. به طور مثال، در تصویر زیر مشاهده میکنیم که فنولفتالئین، معرف مناسبی برای تیتراسیون 50 میلیلیتر از محلول 0/05 مولار استیک اسید با محلول 0/1 مولار سدیم هیدروکسید است.
در مقابل، «برموتیمول آبی» (Bromothymol Blue)، معرف مناسبی نیست چراکه تغییر رنگ آن قبل از تغییر شدید نمودار اتفاق میافتد و حجم وسیعی را پوشش میدهد. به همین دلیل احتمال خطا در محاسبات وجود دارد.
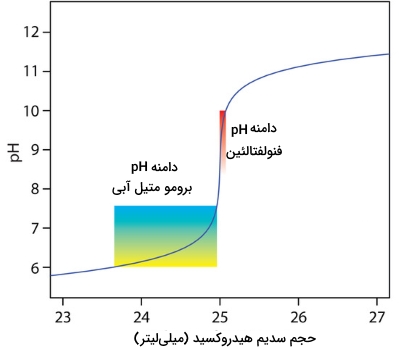
پیدا کردن نقطه تعادل تیتراسیون اسید باز با رصد pH
روشی جایگزین برای پیدا کردن نقطه پایانی، رصد مداوم پیشرفت تیتراسیون اسید باز به کمک سنسور حساس به غلظت آنالیت است. نتیجه حاصل، نمودار کاملی از تیتراسیون است که میتوان بمنظور مشخص کردن محل نقطه پایانی با حداقل خطا از آن استفاده کرد. سنسور مورد نظر، یک الکترود pH است و نتیجه حاصل، «نمودار پتانسیلسنجی تیتراسیون» (Potentiometric Titration Curve) خواهد بود. به طور مثال در تصویر زیر، بخش کوچکی از این نمودار برای تیتراسیون 50 میلیلیتر از محلول 0/05 مولار استیک اسید با محلول 0/1 مولار سدیم هیدروکسید نشان داده شده است.
سادهترین راه برای پیدا کردن نقطه پایانی، پیدا کردن نقطه عطف در نمودار است و فلش قرمز، آنرا نشان میدهد. البته این روش، مخصوصا در نمودارهای با شیب کم، دقت بسیار کمی دارد.
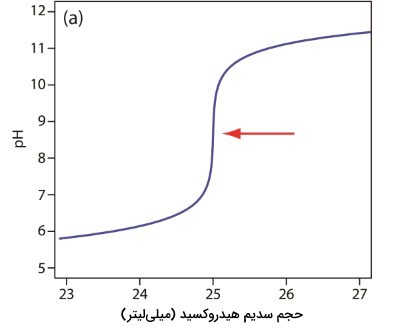
روش دیگر برای مشخص کردن نقطه پایانی، رسم مشتق اول نمودار است که شیب تیتراسیون را در هر نقطه در محور از نمودار نشان میدهد. به نمودار زیر نگاه کنید و تغییرات شیب را در زمان رسیدن و گذر از نقطه تعادل، در نظر بگیرید. از آنجایی که شیب خط به بیشترین مقدار خود در نقطه عطف میرسد، نمودار مشتق، یک پیک را در نقطه تعادل نشان میدهد. مشتق دوم نمودار تیتراسیون، کاربرد بیشتری از مشتق اول دارد زیرا نقطه تعادل، محور حجم را قطع میکند.
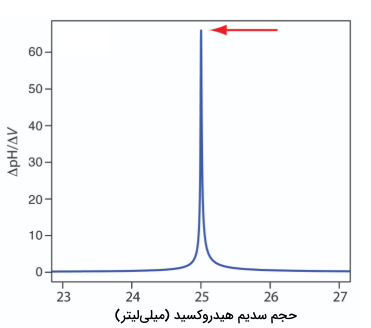
استفاده از مشتق در نمودارهای تیتراسیون اسید باز در حقیقت، بیشتر برای نمونههایی کاربرد دارد که بیش از یک آنالیت داشته باشند. اگر بخواهیم از معرفها برای نقطه پایانی استفاده کنیم، باید برای هر آنالیت، یک تیتراسیون کامل انجام دهیم. در نمودارهای تیتراسیونی که شکل مناسبی برای پیدا کردن نقطه پایانی ندارند، میتوان از نمودارهای مشتق استفاده کرد.
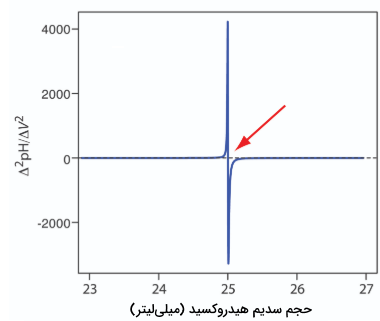
البته نمودارهای مشتق، تنها زمانی مفید هستند که دادههای مناسبی را به هنگام افزایش ناگهانی pH نزدیک نقطه تعادل ثبت کرده باشیم. به دلیل اینکه مقدار pH در نزدیکی نقطه تعادل، به سرعت تغییر پیدا میکند، تغییر چندواحدی pH با اضافه کردن چند قطره از تیترانت نامعمول نیست. لازم به ذکر است که تیتراسیونی که در آزمایشگاه و توسط انسان انجام شود، دقت کافی برای رسم نمودار مشتق را ندارد.
مثال جهت محاسبه مشتق نمودار
فرض کنید که سه نقطه زیر را از یک نمودار تیتراسیون داشته باشیم:
| حجم (میلیلیتر) | pH |
| 23/65 | 6 |
| 23/91 | 6/1 |
| 24/13 | 6/2 |
از طریق ریاضی و به کمک محاسبه رابطه زیر، مشتق اول را حساب میکنیم:
عدد بدست آمده را به حجم متوسط این دو مقدار نسبت میدهیم که برابر با 23/78 میلیلیتر است. برای نقاط دوم و سوم، مشتق دوم برابر با 0/455 و حجم متوسط 24/02 میلیلیتر محاسبه میشود.
| حجم (میلیلیتر) | |
| 23/78 | 0/385 |
| 24/02 | 0/455 |
به کمک دو نقطهای که از مشتق اول حساب کردیم، مشتق دوم را محاسبه میکنیم:
نمودار گِرَن
یکبار دیگر، تیتراسیون استیک اسید با سدیم هیدروکسید را در نظر بگیرید. در هر نقطه از تیتراسیون، استیک اسید با و در حال تعادل است و واکنش تعادلی آن به صورت زیر خواهد بود:
برای محاسبه ثابت تعادل، به صورت زیر عمل میکنیم:
قبل از نقطه تعادل، به کمک روابط زیر، غلظتهای استیک اسید و را محاسبه میکنیم:
حجم کل / (تعداد مول اضافه شده سدیم هیدروکسید - تعداد مول اولیه استیک اسید) = غلظت استیک اسید
حجم کل / تعداد مول اضافه شده سدیم هیدروکسید =
با جایگذاری معادلات فوق در رابطه ثابت تعادل خواهیم داشت:
حجم نقطه تعادل از رابطه زیر بدست میآید:
در نهایت، با توجه به رابطه بالا خواهیم داشت:
برای حجمهای تیترانت قبل از نقطه تعادل، رسم نمودار در مقابل ، خطی مستقیم با عرض از مبدا و شیب بدست میدهد. این روش تحلیل دادهها که بخشی از نمودار تیتراسیون را به یک خط مستقیم تبدیل میکند، موسوم به «نمودار گرن» (Granplot) است.
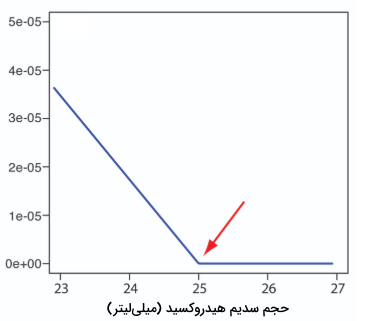
پیداکردن نقطه پایانی تیتراسیون اسید باز به کمک رصد دما
واکنش بین یک اسید و باز، از نوع گرماده است. گرمای آزاد شده از واکنش، توسط آنالیت جذب و موجب افزایش دما میشود. بررسی دمای آنالیت به هنگام اضافه کردن تیترانت، روش دیگری را برای رسم نمودار تیتراسیون و تعیین نقطه پایانی آن بدست میدهد.
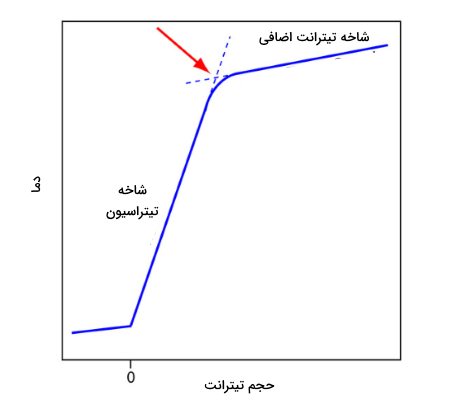
قبل از اضافه کردن تیترانت، هر تغییری در دمای آنالیت، نتیجه تعادل با محیط اطراف است. اضافه کردن تیترانت، واکنش گرماده اسید باز را موجب میشود که افزایش دمای آنالیت را به همراه دارد. این بخش از نمودار تیتراسیون ترمومتری (گرماسنجی) موسوم به «شاخه تیتراسیون» (Titration Branch) است. تا زمانی که به نقطه تعادل برسیم، با اضافه کردن تیترانت، دما افزایش پیدا میکند. بعد از نقطه تعادل، هر تغییری در دما، در اثر آنتالپی انحلال (رقیقشدگی) تیترانت و اختلاف دمای تیترانت و آنالیت است.
به طور ایدهآل، نقطه تعادل، به محل تقاطع خطوط شاخه تیتراسیون و «شاخه تیترانت اضافی» (Excess Titration Branch) میگویند. همانطور که در تصویر زیر مشاهده میکنید، نمودار تیتراسیون ترمومتری، انحنایی در نزدیکی نقطه تعادل از خود نشان میدهد که نتیجه واکنشهای ناقص خنثیسازی یا رقیقشدن اضافی آنالیت و تیترانت در طول تیتراسیون است. مشکل دوم را میتوان با استفاده از یک تیترانت با 10-100 برابر غلظت بیشتر از آنالیت، به حداقل کاهش داد، البته این کار سبب کاهش حجم نقطه پایانی و افزایش خطا خواهد شد. در صورت لزوم، نقطه پایانی را میتوان به کمک برونیابی بدست آورد.
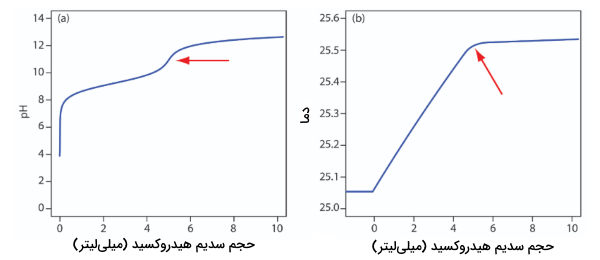
با وجود اینکه تیتراسیون ترمومتری، روشی معمول برای تیتراسیون اسید و باز نیست اما نقطه قوتی نسبت به روش رصد مستقیم pH دارد. همانطور که پیشتر نیز به آن اشاره شد، استفاده از معرف برای رصد pH، با محدودیتهایی همراه است. به طور مثال، تیتر کردن بوریک اسید با فرمول توسط سدیم هیدروکسید، نقطه پایانی مشخص و واضحی بدست نمیدهد زیرا ثابت تفکیک برای این اسید، بسیار کوچک است. به دلیل اینکه آنتالپی خنثیسازی بوریک اسید، مقدار بزرگی برابر با دارد، از تیتراسیون ترمومتری آن نقطه مناسبی میتوان بدست آورد.
انتخاب و استانداردسازی تیترانت
معمولترین اسیدهای قوی، ، و هستند. محلولهای این تیترانتها از طریق رقیق کردن محلولهای تجاری این مواد بدست میآیند. با توجه به اینکه غلظت اسیدهای تغلیظ شده، به طور دقیق مشخص نیستند، غلظت یک تیترانت را از طریق استانداردسازی در برابر یکی از بازهای ضعیف استاندارد در جدول زیر انجام میدهند.
| ردیف | محلول استاندارد | استانداردسازی تیترانتهای اسیدی |
| $$\begin{aligned} &\;left(\mathrm{HOCH}_{2}\right)_{3} \mathrm{CNH}_{2}+mathrm{H}_{3} \mathrm{O}^{+} \rightarrow\ &\;left(\mathrm{HOCH}_{2}\right)_{3} \mathrm{CNH}_{3}^{+}+mathrm{H}_{2} \mathrm{O} \end{aligned}$$ | ||
استانداردسازی تیترانتهای بازی نیز به کمک جدول زیر انجام خواهد شد.
| ردیف | محلول استاندارد | استانداردسازی تیترانتهای بازی |
| 1 | ||
| 2 | ||
| 3 |
قویترین بازی که در تیتراسیونهای اسیدباز مورد استفاده قرار میگیرد، سدیم هیدروکسید است و به شکلهای مایع و جامد یافت میشود. محلولهای سدیم هیدروکسید را به کمک محلولهای استاندارد در جدول بالا، استانداردسازی میکنند. البته استفاده از سدیم هیدروکسید به عنوان تیترانت، مشکلاتی نیز به همراه دارد که از آنجمله میتوان به امکان آلودگی آن با استفاده از واکنش بین دیاکسید کربن و اشاره کرد زیرا هر محلولی که با اتمسفر در تماس باشد، حاوی مقادیری از دیاکسید کربن محلول است.
در طول تیتراسیون، سدیم هیدروکسید با آنالیت و دیاکسید کربن واکنش میدهد که نتیجه آن، افزایش حجم سدیم هیدروکسید مورد نیاز برای رسیدن به نقطه پایانی تیتراسیون است. در صورتیکه pH نقطه پایانی، کمتر از ۶ باشد، مشکلی نخواهیم داشت. پایینتر از این pH، در واکنش قبل، با وارد واکنش میشود تا کربونیک اسید تشکیل دهد.
ترکیب شدن دو واکنش قبلی، به یک واکنش کلی منجر خواهد شد که در آن، اثری از یون هیدروکسید نیست:
تحت این شرایط، حضور دیاکسید کربن، تاثیری بر مقدار یون هیدروکسید مورد استفاده در تیتراسیون اسید باز نخواهد داشت و موجب خطای معین نمیشود.، اگر نقطه پایانی pH بین 6 تا 10 باشد، خنثیسازی به یک پروتون نیاز دارد.
واکنش بین دیاکسید کربن و یون هیدروکسید هم به صورت زیر است:
تحت چنین شرایطی، برخی از یونهای هیدروکسید برای خنثیسازی دیاکسید کربن مصرف میشوند و «خطای معین» (Determinate Error) را بوجود میآورد. سدیم هیدروکسید جامد، همواره به دلیل تماس با هوای اطراف، به کربنات آلوده می شود و نمیتوان از آن برای آمادهسازی سدیم هیدروکسید عاری از کربنات استفاده کرد. در نتیجه، از محلولهای سدیم هیدروکسید برای اینکار استفاده میشود چراکه در سدیم هیدروکسید غلیظ نامحلول است.

در این شرایط، زمانی که دیاکسید کربن جذب میشود، در ته ظرف رسوب میکند و به این ترتیب میتوان به سدیم هیدروکسید عاری از کربنات دست پیدا کرد. به هنگام آمادهسازی محلول سدیم هیدروکسید، حتما از آبی استفاده کنید که دیاکسید کربن در آن محلول نباشد. برای اینکار بهتر است آب را بجوشانیم و سپس سرد کنیم. برای پایداری محلول تهیه شده بهتر است آن را به دور از تماس با اتمسفر قرار دهیم. محلولهای استاندارد سدیم هیدروکسید را نباید در ظروف شیشهای نگهداری کرد چراکه با شیشه بمنظور تشکیل سیلیکات وارد واکنش خواهد شد. به همین دلیل، این محلولها را در ظروفی از جنس پلیاتیلن نگهداری میکنند.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی تجزیه ۲
- جرم مولی — به زبان ساده
- سرعت واکنش — به زبان ساده
^^













همون نقطه ابتدا که غلظت اسید کلرید رو حساب کردیم چرا 0.1 در نظر گرفیتم؟ تو صورت سوال گفته 1 مولار که
در ادامه هم که غلظت اسید کلرید اضافی حساب شده چرا غلظت باز . در نظر گرفته شده مگه نباید مولار باشه ؟
با سلام؛
از ارائه بازخورد شما بسیار سپاسگزاریم. حجمها به صورت ۰٫۱ و ۰٫۲ بود که در متن اصلاح شد. با توجه به متن، میبینیم که حجم سدیم هیدروکسید برای رسم نمودار تیتراسیون محاسبه شده است.
با تشکر از همراهی شما با مجله فرادرس
سلام نمودار مشتق اول ودوم برای اسید فسفریک رو چطوری رسم بکنم؟
سلام
میشه لطفا بگین برای تیتراسیون یک محلول تیره رنگ (اسید و باز)به چه ترتیبی عمل میکنیم ؟
با سلام؛
فسفریک اسید یک اسید چندپروتونه است و در نتیجه، برای رسم مشتقها باید دادههای مربوط به هر نقطه (نقاط عطف) مشخص باشد. به کمک مثال حل شده در داخل مطلب نیز میتوانید نحوه رسم مشتق اول و دوم را یاد بگیرید.
با تشکر از همراهی شما با مجله فرادرس
سلام
تفاوت تیتراسیون اسید قوی و ضعیف با Noah چیه لطفا جواب بدید
سلام وقت بخیر خسته نباشید
مگر نه برای تعیین میزان pH محلول از روش تیتراسیون استفاده میکنند؟!و با افزایش میزان محلول بازی افزوده شده به محلول اسیدی و ….، مدااام pH رو روی نمودار کاهش می دهیم ، پس چطور یک نمودار تیتراسیون ممکنه موج دار باشه؟!
با سلام؛
از شما بابت مطالعه مطلب سپاسگزاریم. برای آشنایی با نمودار تیتراسیون میتوانید مطلب «تیتراسیون — به زبان ساده» را مطالعه کنید.
با تشکر
سلام خسته نباشید
ممنون از مطالب مفیدتون
علت کر دادن بورت با سود چیه؟
چرا به هیج وجه نباید ارلن رو کر داد؟
برای تتراسیون اسید و باز یک محلول تیره رنگ به چه ترتیبی عمل میکنیم؟
سلام ببخشید نمودار گلوتامات توی ph خنثی ۷ چطوری هستش
با سلام؛
نمودار تیتراسیون گلوتامیک اسید را میتوان مانند یک اسید چندظرفیتی بررسی کرد چند نقطه تعادل دارند. البته نقطه ایزوالکتریک را نیز باید در این میان مد نظز قزاز داد.
با تشکز
با سلام؛
برای شستشوی تجهیزات آزمایشگاهی میتوان از آب مقطر و آبفشان استفاده کرد. برای شستشوی محلولهای اسیدی نیز در برخی مواقع از محلول استاندارد اسیدی بهره میگیرند. همچنین از محلول رقیق سدیم هیدروکسید نیز برای شستشوی بورت (در تیتراسیون) حاوی سدیم هیدروکسید بهره میگیرند چراکه استفاده از آب مقطر، شستشوی مناسبی را به همراه ندارد.
با تشکر