توالی یابی DNA ، روش ها و کاربردها – به زبان ساده
توالی یابی DNA یا (DNA Sequencing) فرآیندی است که در آن توالی نوکلئوتیدهای موجود در یک مولکول DNA تعیین میشود. DNA هر ارگانیسم از یک توالی منحصر به فرد از نوکلئوتیدها تشکیل شده است. تعیین توالی DNA قادر است به دانشمندان در مقایسه DNA بین ارگانیسمهای مختلف کمک کند که این کار میتواند در شناخت ارتباطات بین ارگانیسمها و روابط فیلوژنتیکی آنها موثر باشد.


بررسی اجمالی توالی یابی DNA
توالی یابی DNA بدان معنی است که با تعیین توالی یک قطعه از DNA، میتوان از ترتیب قرارگیری چهار باز نوکلئوتیدی آدنین، گوانین، سیتوزین و تیمین در آن مولکول اطلاع پیدا کرد. ضرورت توالی یابی DNA برای اولین بار توسط نظریه «فرانسیس کریک» (Francis Crick) تعیین شد که براساس این نظریه مشخص شد توالی نوکلئوتیدها در یک مولکول DNA مستقیماً بر توالی اسیدهای آمینه پروتئینها تأثیر میگذارد. در آن زمان اعتقاد بر این بود كه توالی یابی کامل ژنوم، منجر به جهش بزرگی در فهم بیوشیمیایی سلولها و ارگانیسمها میشود.
در تعیین توالی DNA مدرن، از «روشهای پرتوان» (High Throughput Methods) استفاده میشود که که این امکان را فراهم کردهاند که توالیهای DNA در طی چند ساعت مورد شناسایی قرار بگیرند. این فناوری برای بسیاری از شرکتها این امکان را به وجود آورده است تا بتوانند روشهایی برای آزمایشهای خانگی DNA را به مشتریان خود ارائه دهند. بسیاری از نتایج حاصل از این آزمایشها، صرفاً ارتباطی است که بین یک واریانت ژنتیکی و یک بیماری خاص وجود دارد. با این حال، این فناوری همچنین به دانشمندان اجازه داده است كه DNA بسیاری از ارگانیسمها را مورد بررسی قرار دهند تا روابط تكوینی و فیلوژنتیکی بین آنها را بهتر شناسایی کنند.
نمونهای از توالی یابی DNA
اگرچه تعیین توالی DNA در گذشته و در سالهای ابتدایی ابداع این فناوری به زمان بسیاری نیاز داشت و گاهی تا چندین سال به طول میانجامید، اما اکنون با رشد تکنولوژی تعیین توالی DNA را میتوان طی چند ساعت انجام داد. علاوه بر این، اولین پروژه «تعیین توالی کامل DNA انسانی» (Human Whole Genome Sequencing) حدود 3 میلیارد دلار هزینه در بر داشت، در حالی که اکنون، شرکتهای معتبر در این زمینه کل ژنوم انسان را با قیمت کمتر از 1000 دلار تعیین توالی میکنند و با پیشرفتهترین آزمایشها، نوکلئوتیدهای موجود در ژنوم انسان را مورد تجزیه و تحلیل قرار میدهند.
شرکتهای بیوتکنولوژی و ژنتیکی معتبر در سراسر جهان علاوه بر توالی یابی DNA خدماتی مانند آزمایشهای «پلی مورفیسم تک نوکلئوتیدی» (Single Nucleotide Polymorphism) برای شناسایی تغییرات و جهشهای ژنتیکی در ژنوم فرد را نیز ارائه میدهند.
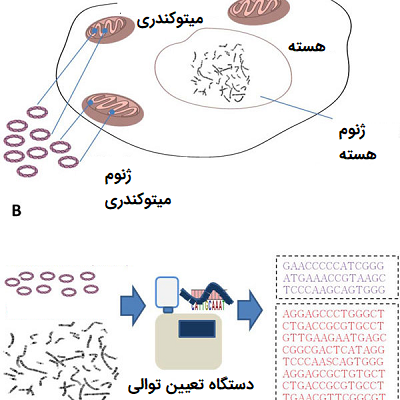
این آزمایشها بر نوکلئوتیدهای منفرد در ژنهایی تمرکز دارند که میتوانند واریانت ژنتیکی خاصی را نشان دهند. در واقع پلی مورفیسم تک نوکلئوتیدی، همان طور که در تحقیقات بالینی مشخص شده است، با شرایط خاصی ارتباط دارند و میتوانند در پیشبینی چگونگی تأثیر ژنهای بدن بر زندگی فرد کمک کنند. برخی از توالیهایSNP با بیماریهای مختلف ارتباط دارد، در حالی که برخی دیگر مربوط به متابولیسم بدن و چگونگی پردازش مواد مغذی در آن است. در مورد پلی مورفیسم تک نوکلئوتیدی هزاران رابطه مختلف یافت شده و میتوان از تعیین توالی DNA برای تشخیص اینکه ژنوم انسان چه تاثیری بر زندگی آن دارد، استفاده کرد.
روشهای توالی یابی DNA
توالی یابی DNA به دو روش اصلی در سراسر جهان انجام میگیرد. روش قدیمی آن به عنوان روش خاتمه زنجیرهای یا «روش سنگر» (Sanger Method) شناخته میشود. روشهای جدیدتر که میتوانند تعداد زیادی از مولکولهای DNA را به سرعت پردازش کنند، در مجموع به عنوان روش «توالی یابی با بازدهی بالا» (High Throughput Sequencing) یا روشهای توالی یابی نسل جدید (Next Generation Sequencing) یا (NGS) معروف هستند.
توالی یابی به روش سنگر
روش «سنگر» (Sanger) به یک آغازگر متکی است که به مولکول DNA دناتوره شده (تک رشتهای) متصل میشود و سنتز یک مولکول پلی نوکلئوتیدی تک رشتهای را در حضور یک آنزیم DNA پلیمراز، (با استفاده از DNA دناتوره شده به عنوان رشته الگو) آغاز میکند. در بیشتر شرایط، آنزیم با اضافه کردن نوکلئوتیدها به رشته آغازگر، واکنش را کاتالیز میکند. بنابراین پیوند کووالانسی بین اتم کربن ’3 مولکول قند دئوکسی ریبوز در یک نوکلئوتید و اتم کربن ’5 نوکلئوتید بعدی تشکیل میشود. در تصویر زیر نحوه شکلگیری این پیوند نشان داده شده است.
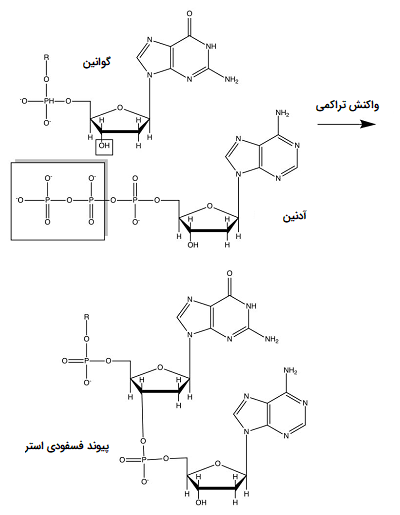
در یک مخلوط واکنش توالی یابی، ممکن است یک بخش کوچکی از نوکلئوتیدهای تغییر یافته که به دلیل فقدان گروه واکنشگر هیدروکسیل، نمیتوانند پیوند کووالانسی تشکیل دهند، واکنش تکثیر را متوقف کنند و دی دئوکسی ریبونوکلئوتیدها را ایجاد نکنند. در واقع این نوکلئوتیدها اتم اکسیژن ’2 یا ’3 را در مقایسه با سایر ریبونوکلئوتیدها ندارند. با این کار واکنش پلیمریزاسیون DNA به موقع خاتمه مییابد. در پایان چند دور از چنین پلیمریزاسیونهایی، مخلوطی از مولکولها با طولهای مختلف ایجاد میشود.
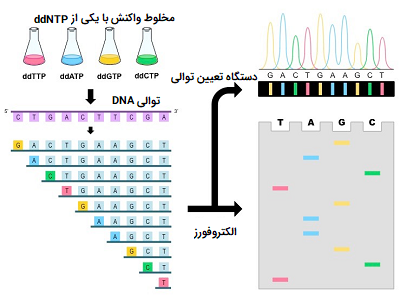
در اولین تلاش برای استفاده از روش سنگر، ابتدا مولکول DNA با استفاده از یک آغازگر دارای برچسب تقویت شده و سپس به چهار لوله آزمایش تقسیم میشود که هر کدام تنها یک نوع ddNTP دارند. یعنی هر مخلوط واکنش فقط یک نوع نوکلئوتید تغییر یافته دارد که میتواند باعث خاتمه زنجیره شود. پس از اتمام چهار واکنش، مخلوط مولکولهای DNA ایجاد شده توسط روش خاتمه زنجیره یا سنگر، تحت الکتروفورز با «ژل پلی آکریل آمید» (Polyacrylamide Gel) قرار گرفته و با توجه به طول هر قطعه از یکدیگر جدا میشوند.
در تصویر ۴، یک واکنش توالی با ddATP از طریق ستون دوم الکتروفورز میشود. هر خط یک مولکول DNA از یک طول خاص را نشان میدهد که در نتیجه یک واکنش پلیمریزاسیون است که با اضافه کردن یک نوکلئوتید ddATP خاتمه یافته است. ستونهای اول، سوم و چهارم به ترتیب شامل ddCTP ،ddGTP ،ddTTP بودند.
با گذشت زمان، این روش به گونهای مورد تغییرات قرار گرفت که در آن هر ddNTP دارای یک برچسب فلورسنت متفاوت بود. در این شرایط آغازگر دیگر منبع برچسب رادیواکتیو یا فلورسنت نبود. روش سنگر در این حالت به عنوان روش توالی یابی رنگ پایان دهنده شناخته میشود، این روش توالی یابی از چهار رنگ با طیف انتشاری بدون همپوشانی برای هر یک از ddNTP استفاده میکند.
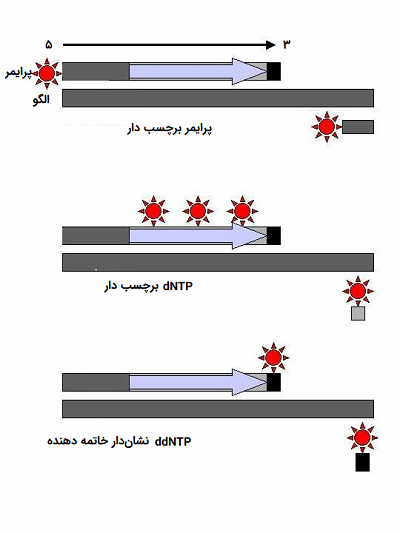
تصویر زیر نمایش شماتیک از روش توالی یابی رنگ خاتمه دهنده را نشان میدهد. یک مخلوط واکنش منفرد وجود دارد که تمام عناصر مورد نیاز برای طویل سازی مولکول DNA را در بر دارد. مخلوط واکنش همچنین حاوی غلظتهای کمی از چهار ddNTPs است که هر یک برچسب فلورسنت متفاوتی دارند. پس از اتمام واکنش توالی یابی، محصول واکنش بر روی ژل کپیلاری یا مویینی مورد الکتروفورز قرار میگیرد. نتایج از طریق آنالیز طیف انتشار از هر باند DNA روی ژل بدست میآید. سپس یک برنامه نرم افزاری طیفها را تجزیه و تحلیل میکند و توالی مولکول DNA را ارائه میدهد.
توالی یابی به روش ماکسام-گیلبرت
در سال ۱۹۸۰ همزمان با معرفی روش توالی یابی سنگر، روش توالی یابی ماکسام و گیلبرت (Maxam-Gilbert Sequencing) که به روش توالی یابی شیمیایی نیز معروف بود، در دنیای ژنتیک شناخته شد. در ابتدا روش ماکسام و گیلبرت از استقبال بهتری نسبت به روش سنگر برخوردار شدند، زیرا در روش ماکسام و گیلبرت، محققان میتوانستند از DNA تخلیص شده به صورت مستقیم استفاده کنند، در حالی که در روش سنگر برای شروع کار نیاز به کلونینگ ژن است. اما بعدها تکنیک ماکسام- گیلبرت به فراموشی سپرده شد.
روش ماکسام-گیلبرت شامل چهار مرحله است:
- در مرحله اول برای آماده سازی نمونه مولکول DNA را به صورت تک رشته دناتوره میکنند و پس از آن در انتهای ’۵ آن برچسب گذاری انجام میدهند که در این روش اغلب از فسفر ۳۲ استفاده میشود.
- در مرحله دوم DNA توسط پیپریدین (Piperidine) و دو ترکیب شیمیایی دیگر که به پورینها و پیریمیدینهای مولکول DNA حمله میکنند، شکسته میشود. هر کدام از ترکیبات شیمیایی، مولکول DNA را در محل یکی از ۴ باز آدنین، تیمین، گوانین و سیتوزین برش میدهند، با قرار دادن ۴ لوله آزمایش برای هر ترکیب شیمیایی، میتوان ۴ نمونه از قطعات با برشهای یکسان را به دست آورد.
- بعد از دستیابی به قطعات برش خورده DNA نمونه، هر کدام از آن بر روی ژل پلی آکریلامید با درصد بالا مورد الکتروفورز قرار میگیرند. برای تمایز بین قطعات مختلف از برچسبهای رادیواکتیو استفاده میشود.
- برای خوانش توالی DNA نمونه، باید از کوچکترین قطعه در پایین ژل شروع کرد.
توالی یابی توان بالا
توالی یابی به روش سنگر همچنان برای تعیین توالیهای مولکولهای نسبتاً طولانی DNA به ویژه در حجم کم مفید است. با این حال، وقتی تعداد زیادی از مولکولها به سرعت نیاز به توالی یابی داشته باشند، استفاده از روش سنگر میتوانند پرهزینه و زمانبر باشد. از این رو، اگرچه استفاده از روش سنتی برای توالی یابی DNA در مواردی مفید واقع میشود که مولکول DNA طولانیتر باشد، اما روشهای توالی یابی با توان بالا به ویژه هنگامی که کل ژنوم نیاز به توالی یابی دارند، مورد استفاده قرار میگیرند.
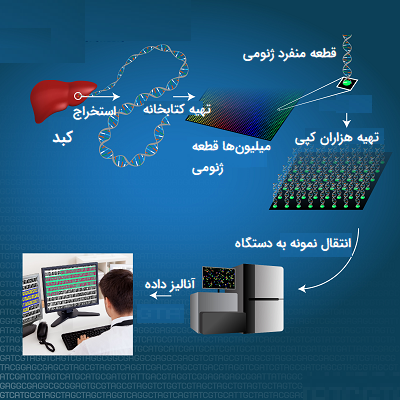
در روشهای توالی یابی با توان بالا سه تفاوت عمده در مقایسه با روش سنگر وجود دارند. اولین تفاوت توسعه یک سیستم عاری از سلول (Cell Free) برای کلون کردن قطعات DNA است. به طور سنتی، قطعهای از DNA که نیاز به توالی یابی داشت، برای اولین بار در پلاسمید پروکاریوتی کلون میشد و قبل از استخراج و خالص شدن در باکتریها، همانندسازی و تکثیر میشد. توالی یابی توان بالا یا فناوریهای تعیین توالی نسل جدید دیگر از این رویه سخت و زمانبر استفاده نمیکنند.
تفاوت دوم این است که این روشها فضایی را ایجاد کردند تا به طور موازی میلیونها واکنش تعیین توالی به صورت همزمان قابل انجام باشد. این یک گام بزرگ به جلو نسبت به روشهای اولیه توالی یابی محسوب میشود که در آن چهار مخلوط واکنش متفاوت برای تعیین توالی نوکلئوتیدهای یک مولکول DNA نیاز بود.
تفاوت سوم روشهای جدید نسبت به روش سنگر این است که در تکنیکهای جدید هیچ تفکیکی بین مراحل طویل شدن و تشخیص وجود ندارد. بازها در طی انجام واکنش توالی یابی مورد شناسایی قرار میگیرند. علاوه بر این موارد، استفاده از روشهای پرتوان باعث کاهش هزینههای آزمایش و افزایش سرعت آنها میشود، از طرفی دیگر، خواندن نتیجه واکنشهای توالی یابی نیاز به جمعآوری دادههای واکنش و تجزیه و تحلیل و محاسبات کامیپوتری پیشرفتهای دارد که در آزمایشگاههای مجهز تعیین توالی قابل انجام است.
ظهور تکنیکهای پرتوان توالی یابی کاربردهای ژنتیک در زمینههای مختلف را به طور وسیعی گسترش داده است. تعیین توالی DNA اکنون به بخشی جدایی ناپذیر از علوم پایه، تحقیقات ترجمه و پروتئینسازی، تشخیص پزشکی و تکنیکهای پزشکی قانونی تبدیل شده است.
کاربردهای توالی یابی DNA
روشهای کلاسیک مانند خاتمه زنجیره یا سنگر و روشهای توالی یابی پرتوان امروزه برای کاربردهای مختلف مورد استفاده قرار میگیرند. توالی یابی سنگر اکنون بیشتر برای تعیین توالی اولیه یک مولکول DNA جهت بدست آوردن دادههای توالی اولیه برای ارگانیسم یا ژنها به کار گرفته میشود.
خوانش قطعات نسبتا کوتاه حاصل از روشهای پرتوان (۳۰۰ تا ۴۰۰ جفت باز در مقایسه با قطعاتی با طول نزدیک به هزار جفت باز حاصل از تکنیک سنگر) این امر را مشکل کرده است که بتوان ژنوم کامل یک ارگانیسم را تنها به وسیله این روشهای نوین تعیین توالی کرد. گاهی اوقات، برای تایید نتایج حاصل از تکینیکهای پرتوان، نیاز است از توالی یابی سنگر نیز استفاده کرد.
از طرف دیگر، روشهای پرتوان با استفاده از توالی یابی DNA میتوانند پلی مورفیسمهای تک نوکلئوتیدی را از جمله رایجترین انواع تغییرات ژنتیکی در یک جمعیت را مورد شناسایی قرار دهند. این امر در زیست شناسی تکاملی و همچنین در تشخیص ژنهای جهش یافته که میتوانند منجر به بیماری شوند، اهمیت پیدا میکند. به عنوان مثال، تغییرات توالی در نمونههایی از آدنوکارسینوما ریه امکان شناسایی جهشهای نادر مرتبط با این بیماری را فراهم میکند. مکانهای اتصال کروماتین برای پروتئینهای هستهای خاص نیز با استفاده از این روشها میتوانند به طور دقیق شناسایی شوند.
به طور کلی، تعیین توالی DNA در حال تبدیل شدن به یک بخش لاینفک بسیاری از برنامههای مختلف زیست شناسی مولکولی و پزشکی است.
کاربردهای تشخیصی توالی یابی DNA
تعیین توالی ژنوم به ویژه برای شناسایی دلایل اختلالات نادر ژنتیکی بسیار اهمیت دارد. در حالی که بیش از 7800 بیماری از الگوی وراثت مندلی پیروی میکنند، کمتر از 4000 مورد از این بیماریها به طور قطعی با یک ژن یا جهش خاص در ارتباط هستند. تجزیه و تحلیل اولیه اگزون - ژنوم، یا اگزوم (Exome)، متشکل از تمام ژنهای بیان شده یک ارگانیسم، در شناسایی آللهای معمول برای بسیاری از بیماریهای ارثی امید بخش است.
در یک مورد خاص، توالی یابی ژنوم کودکی که از نوع شدید بیماری التهابی روده رنج میبرد، نشان داد که بیماری به یک جهش در یک ژن مربوط به التهاب به نام ژن XIAP مرتبط است. در حالی که بیمار در ابتدا علائم متعددی را نشان میداد که نشانگر بیماری نقص ایمنی است، پیوند مغز استخوان براساس نتایج توالی DNA پیشنهاد شد و پس از استفاده از این روش درمانی، کودک بهبود یافت.
علاوه بر این، روشهای توالی یابی با توان بالا نقش مهمی در ایجاد درک بیشتری از تومورها و سرطانها داشته است. شناخت اساس ژنتیکی تومور یا سرطان به پزشکان این امکان را میدهد تا برای تصمیم گیریهای تشخیصی، از یک ابزار اضافی در روشهای تشخیصی خود استفاده کنند.
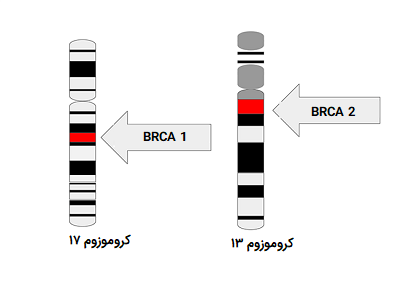
اطلس ژنوم سرطان و کنسرسیوم بین المللی ژنوم سرطان تعداد زیادی تومور را تعیین توالی کردهاند و نشان دادند که رشد سلولهای سرطانی از نظر جهشی که در آنها اتفاق میافتد، میتواند بسیار متفاوت باشد. این امر همچنین به درک بهتری از انواع گزینههای درمانی که برای هر بیمار ایده آل است، منجر شده است. به عنوان مثال، در تعیین توالی ژنوم سرطان پستان دو ژن BRCA1 و BRCA2 مورد شناسایی قرار گرفتهاند که انواع بیماریزا و پاتوژن این ژنها، تأثیر زیادی در احتمال ابتلا به سرطان پستان در فرد دارد. در مورد افرادی که برخی از آللهای بیماریزا را در ژنوم خود دارند، در برخی مواقع ممکن است انجام جراحیهای پیشگیرانه مانند «ماستکتومیهای دوگانه» (Double Mastectomies) صورت گیرد.
زیست شناسی مولکولی
توالی یابی DNA اکنون جزئی جدایی ناپذیر در اکثر آزمایشگاههای بیولوژیکی شده است. انواع روشهای توالی یابی برای تأیید نتایج آزمایشهای کلونینگ و برای درک تأثیر ژنهای خاص در ارگانیسمها استفاده میشود. فناوریهای توالییابی پرتوان برای بررسی تغییرات ژنتیکی پلاسمیدها، باکتریها، مخمرها، نماتدها یا حتی پستانداران مورد استفاده در آزمایشگاهها به کار گرفته میشوند.
به عنوان مثال، یک رده سلولی که از بافت سرطان پستان به نام HeLa به دست میآید، در بسیاری از آزمایشگاهها در سراسر جهان مورد استفاده قرار میگیرد، این رده سلولی قبلاً به عنوان یک رده سلولی قابل اعتماد که نمایانگر بافت پستان انسان است، مورد توجه قرار میگرفت. نتایج توالی یابی اخیر تغییرات زیادی را در ژنوم سلولهای HeLa از منابع مختلف نشان داده است، در نتیجه این امر باعث کاهش استفاده این سلولها در کاربردهای مختلف زیست شناسی سلولی و مولکولی شده است.
توالی یابی DNA شناخت دقیقی را از عناصر تنظیمی موجود در ژنوم هر سلول و تغییرات فعالیت آنها در انواع مختلف سلول و افراد را در اختیار محققان این حوزه قرار میدهد. به عنوان مثال، ممکن است یک ژن خاص در بعضی از بافتها به طور دائم خاموش شود، در حالی که در بعضی دیگر به صورت همیشگی فعال باشد و به شکل پروتئینهای عملکردی بیان شود. به طور مشابه، افراد مستعد ابتلا به یک بیماری خاص ممکن است یک ژن را متفاوت از کسانی که مصون هستند، تنظیم کنند. این اختلافات در مناطق تنظیمی DNA، از طریق توالی یابی نشان داده میشوند و میتوانند شناخت گستردهای را در زمینه تعیین فنوتیپ ارگانیسمهای مختلف نیز ایجاد کنند.
پیشرفتهای اخیر حتی به آزمایشگاههای کوچک خصوصی اجازه داده است تا تغییرات ساختاری در ژنوم انسان را مورد مطالعه قرار دهند، کاری که در دو دهه پیش به همکاری جهانی نیاز داشت.
کاربرد توالی یابی DNA در پزشکی قانونی
توانایی استفاده از غلظتهای پایین DNA برای دستیابی به نتایج قابل اطمینان از واکنشهای توالی یابی برای دانشمندان پزشکی قانونی بسیار اهمیت دارد. در پزشکی قانونی پتانسیل شناسایی هر مولکول DNA در یک نمونه بسیار مورد توجه قرار میگیرد، چرا که اغلب در یک صحنه جرم مواد ژنتیکی از افراد مختلف وجود دارد که شناسایی و توالی یابی جداگانه آنها از اهمیت ویژهای برخوردار است. روشهای توالی یابی با توان بالا، به آهستگی در بسیاری از آزمایشگاههای پزشکی قانونی برای شناسایی DNA انسان به عنوان روشی روتین پذیرفته شده و مورد استفاده قرار میگیرند.
علاوه بر این، پیشرفتهای اخیر به دانشمندان پزشکی قانونی اجازه میدهد تا از اگزوم شخص پس از مرگ، توالی یابی انجام دهند، این کار به خصوص برای تعیین علت مرگ انجام میشود. به عنوان مثال، مرگ ناشی از مسمومیت باعث تغییر در شکل ظاهری در اندامهای درگیر میشود. از طرف دیگر، تعیین توالی DNA همچنین میتواند تعیین کند که آن فرد فوت شده دارای بیماری ژنتیکی و یا مستعد بیماری ژنتیکی بوده است یا خیر. چالشهای موجود در این زمینه شامل توسعه نرم افزاری بسیار قابل اعتماد برای تجزیه و تحلیل است، به خصوص که نتایج حاصل از روشهای توالییابی با توان بالا را نمیتوان به صورت دستی بررسی کرد.












