ایزومر چیست؟ – به زبان ساده + انواع
در دنیای شیمی آلی، یونها و مولکولهایی وجود دارند که تعداد یکسانی از اتمهای یکسانی دارند اما دقیقا با یکدیگر برابر نیستند. برای مثال C5H12 میتواند فرمول شیمیایی بسته سه مولکول مختلف باشد که فرمول گسترده آنها فرق دارد، این دسته مولکولها ایزومر یکدیگر نامیده میشوند. اهمیت شناخت ایزومرها در این است که خواص زیستی، فیزیکی و شیمیایی متفاوتی دارند و در بسیاری از موارد نقطه ذوب، نقطه جوش، چگالی، حلالیت، نوع واکنشها، میزان واکنشپذیری، خاصیت دارویی، عملکرد آنزیمهای زیستی و... در مورد آنها فرق میکند. در ادامه در مورد چیستی ایزومر و انواع آن توضیح خواهیم داد.
- یاد میگیرید ایزومرها چگونه با فرمول برابر ساختار متفاوتی دارند.
- میآموزید انواع اصلی ایزومری ساختاری و فضایی را تشخیص دهید.
- خواهید توانست زیرگروههای معرف ایزومری را تحلیل کنید.
- یاد خواهید گرفت آرایش فضایی و مراکز کایرال چگونه بر خواص تاثیر میگذارند.
- خواهید آموخت بازآرایی ایزومری و نقش کاتالیزور را در تغییر ساختارها بررسی کنید.
- میآموزید اهمیت ایزومری را در داروسازی و زیستشناسی ارزیابی کنید.
ایزومر چیست ؟
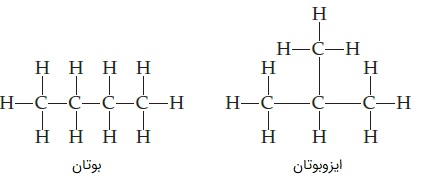
«ایزومر» (Isomer) یا «همپار» به دو یا چند ترکیب از مولکولها گفته میشود که فرمول شیمیایی یکسان دارند اما نحوه چیدمان اتمها در آنها متفاوت است. یعنی از نظر شکل ساختاری یا فضایی با یکدیگر فرق میکنند. برای مثال در آلکانها، بوتان و ایزو-بوتان فرمول شیمیایی هر دو C4H10 است اما در بوتان، کربنها به صورت راستزنجیر قرار گرفتهاند و در ایزوبوتان، شاخه دارند.
همین موضوع سبب میشود که تفاوتهایی بین این دو مولکول به وجود بیاید، مانند اینکه در ایزوبوتان به علت شاخه، مولکولها سختتر بهم نزدیک میشوند، درنتیجه ایزوبوتان در دمای درجه سانتیگراد میجوشد اما نقطه جوش بوتان از آن بیشتر و در حدود درجه سانتیگراد است.
واژه ایزومر اولین بار توسط شیمیدانی سوئدی به نام «جونز جیکوب برزلیوس» (Jöns Jacob Berzelius) استفاده شده است. این واژه از دو بخش «ایزو» از ریشه یونانی «Isos» و «مر» از ریشه «Meros» تشکیل میشود که به ترتیب به معنی «یکسان» و «بخش» هستند و در کل معنی «بخشهای یکسان» میدهد.
انواع ایزومر
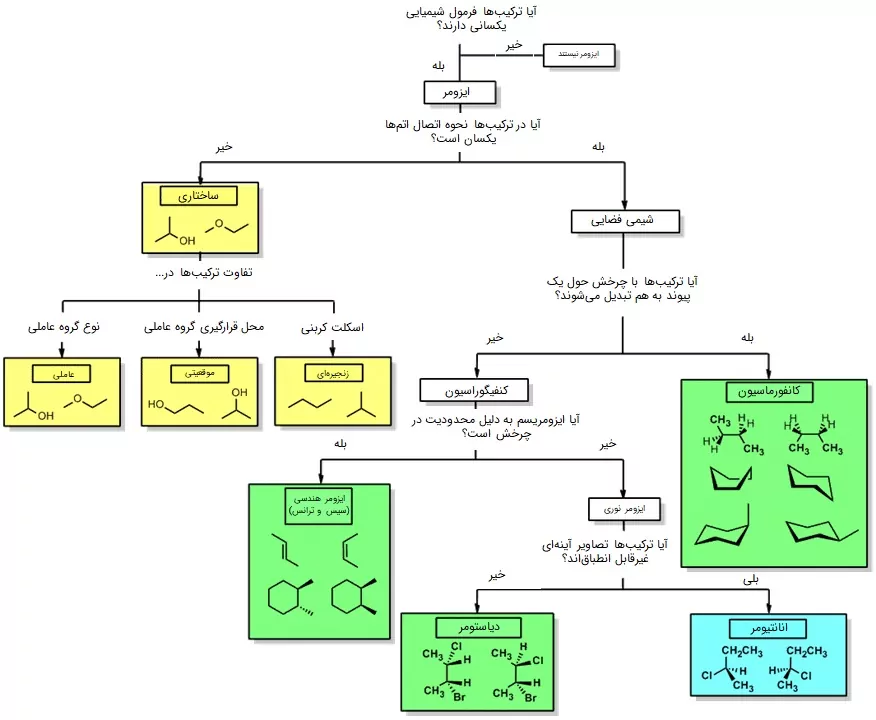
ایزومرها به طور کلی به دو دسته «ایزومرهای ساختاری» (Structural Isomers) و «ایزومرهای فضایی» (Stereoisomeres) تقسیم میشوند. هر کدام از این دو شکل، خود انواعی دارند. برای مشاهده نمودار خلاصه انواع ایزومر، بر روی تصویر زیر کلیک کنید.
انواع ایزومر های ساختاری
در ایزومرهای ساختاری، محل قرارگیری یک اتم یا دستهای از اتمها تغییر میکند، درواقع میتوان گفت اتمها به شکل متفاوتی بهم متصل میشوند. برای مثال 2-متیلپروپن، ۱-بوتن، متیلسیکلوپروپان و سیکلوبوتان همگی فرمول شیمیایی C4H8 دارند و ایزومر ساختاری یکدیگرند اما شکل ظاهری آنها کاملا متفاوت است.

ایزومرهای ساختاری به سه گروه تقسیم میشوند:
- ایزومرهای زنجیری (اسکلتی)
- ایزومرهای موقعیتی
- ایزومرهای گروه عاملی
ایزومر های زنجیری
«ایزومرهای زنجیری یا اسکلتی» (Chain Isomers یا Skeletal Isomerism) گروهی از ایزومرهای ساختاری هستند که در آرایش اسکلت کربنی خود با هم تفاوت دارند. در بسیاری از موارد، این تفاوت به شکل وجود شاخههای کربنی بر روی زنجیره اصلی دیده میشود، یعنی تعداد و محل شاخههای آنها با هم فرق میکند.
برای مثال در تصویر زیر، پنتان شکل کاملا راستزنجیر فرمول شیمیایی C5H12 است، در ۲-متیلبوتان با همین فرمول شیمیایی، یک شاخه متیل روی کربن دوم دیده میشود و در ۲-۲-دیمتیلپروپان، به جای یک شاخه متیل، دو شاخهدیده میشود.
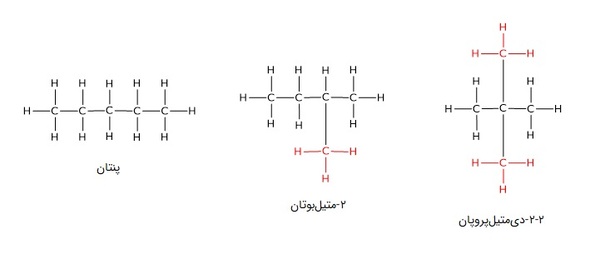
تعداد ایزومرهای ساختاری در آلکانها از فرمول خاصی تبعیت میکند. متان، اتان و پروپان ایزومر ندارند اما از بوتان به بعد، تعداد ایزومرهای ساختای در آلکانها برابر با است و با افزوده شدن کربن به زنجیره، بهشدت افزایش مییابد. تعداد ایزومرهای ساختاری ده آلکان اول در جدول زیر دیده میشود.
| نام آلکان | فرمول شیمیایی | تعداد کل ایزومرها |
| متان | 1 | |
| اتان | 1 | |
| پروپان | 1 | |
| بوتان | 2 | |
| پنتان | 3 | |
| هگزان | 5 | |
| هپتان | 9 | |
| اکتان | 18 | |
| نونان | 35 | |
| دکان | 75 |
همانطور که در مورد بوتان و ایزوبوتان بیان شد، هرچقدر یک زنجیره کربنی شاخهدارتر باشد، شکل فضاییاش باعث میشود مولکولها کمتر بتوانند بهم نزدیک شوند. درنتیجه نقطه ذوب و جوش پایینتری خواهد داشت. برای مثال نقطه ذوب ۲-۲-دیمتیلپروپان از پنتان کمتر خواهد بود.
ایزومر های موقعیتی
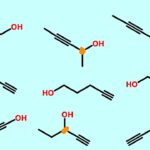
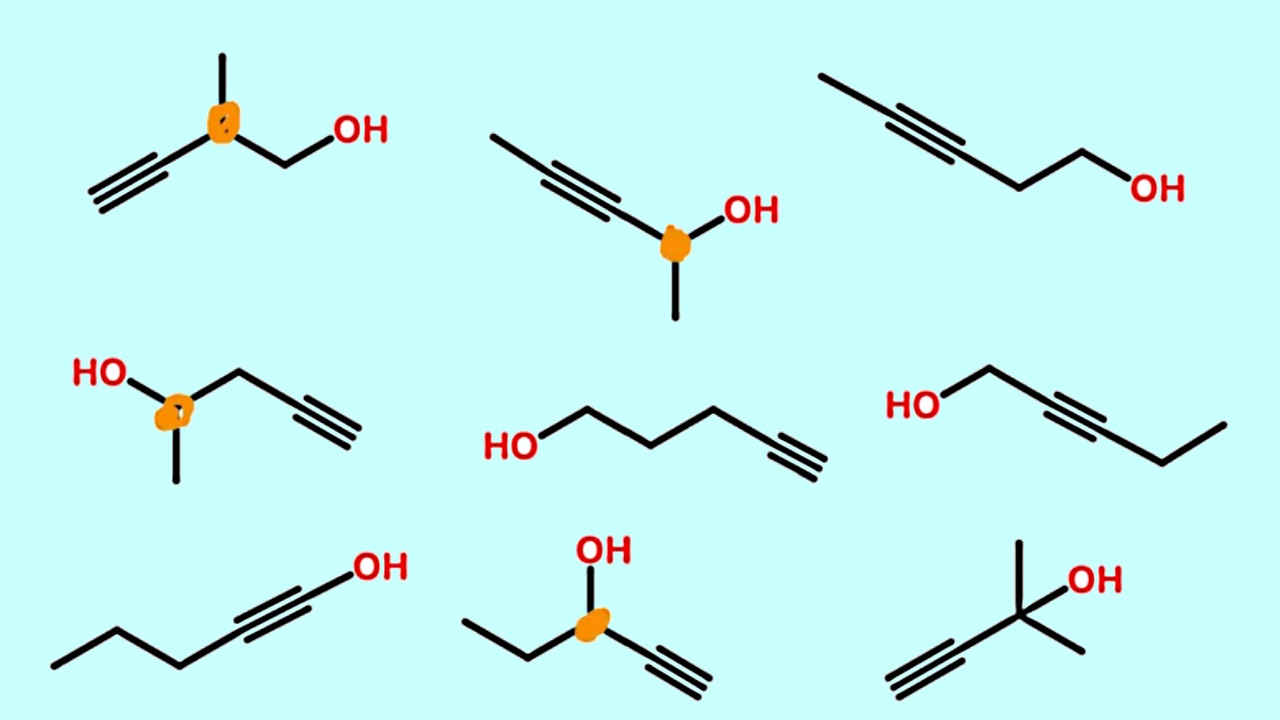
«ایزومرهای موقعیتی» (Positional Isomers) گروههای عاملی یکسانی دارند که در موقعیتهای متفاوتی از زنجیره کربنی قرار گرفتهاند. برای مثال هم در ۱-بروموپنتان و ۲-بروموپنتان، گروه عاملی هر دو برم (Br) است اما در یکی بر روی کربن اول و در دیگری بر روی کربن دوم متصل است.
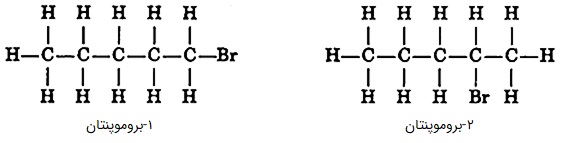
مثالهای دیگری از ایزومرهای موقعیتی را میتوانید در تصویر زیر مشاهده کنید:
در آلکنها و آلکینها، پیوند دوگانه و سهگانه خود نوعی گروه عاملی به شمار میآیند و با تغییر محل پیوند، ایزومر مولکول ساخته میشود.

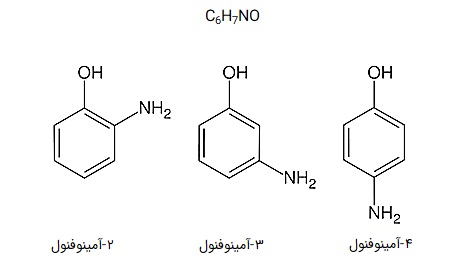
ایزومر های عاملی
ایزومرهای عاملی (Functional Isomers) ایزومرهایی هستند که به خاطر تغییر موقعیت اتمهایشان، گروههای عاملی متفاوت دارند. گروه عاملی در شیمی به دستههای شناختهشدهای از مولکولها گفته میشود که بر روی نوع و میزان واکنشپذیری مولکول اثر بسیار زیادی میگذارد.
هر گروه عاملی ویژگیهای خاص خودش را دارد و از بین این گروهها میتوان آمین، آمید، کربوکسیلیکاسید، هیدروکسیل و... را نام برد. به علت تاثیر بالای گروه عاملی روی مولکول، خواص ایزومرهای عاملی میتواند بسیار متفاوت باشد.
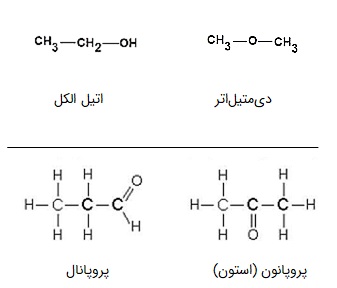
الکلها که با تغییر موقعیت اکسیژن خود، به اتر تبدیل میشوند، مثالی از ایزومرهای عاملی هستند. به عنوان مثال دیگر میتوان آلدهیدها را نام برد که با تغییر موقعیت اکسیژن خود، به کتون تبدیل میشوند. در تصویر زیر نحوه تبدیل این دو مثال نشان داده شده است.
یکی از رایجترین ایزومریهای عاملی در آلکنها، به شکل سیکلوآلکانها (Cycloalkans) دیده میشود. فرمول شیمیایی آلکنها و سیکلوهگزانها هر دو به شکل CnH2n است اما چون پیوند دوگانه در سیکلوهگزانها وجود ندارد، پس ایزومر عاملی همدیگرند. سیکلوهگزانها خود میتوانند به شکلهای مختلفی دربیایند، مثلا در شکل زیر پنج نوع سیکلوهگزان سیکلوپنان، متیلسیکلوبوتان، ۱-۱-دیمتیلسیکلوپروپان، ۱-۲-دیمتیلسیکلوپروپان و اتیلسیکلوپروپان، نسبت به ۱-پنتن، ۲-پنتن و انواع بوتن ایزومر عاملی هستند و همگی فرمول C۵H۱۰ دارند.
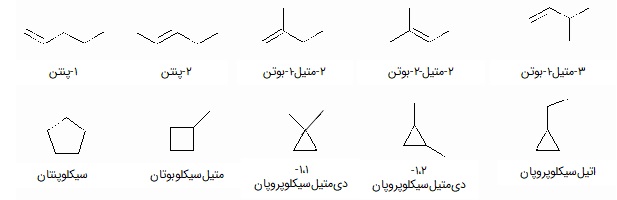
در این تصویر انواع دیگر ایزومرهای ساختاری نیز دیده میشود. حالتهای شاخهدار و راستزنجیر پنج کربنه مانند ۱-پنتن و ۲-متیل-۱-بوتن نیز ایزومر زنجیری هم هستند.
حالتهای شاخهدار در بوتن (و یا انواع راست زنجیر پنتن) مثل ۲-متیل-۱-بوتن، ۲-متیل-۲-بوتن و ۳-متیل-۱-بوتن ایزومر موقعیتی همدیگرند زیرا ساختار زنجیره کربنی تغییر نکرده است و محل پیوند دوگانه تفاوت دارد.
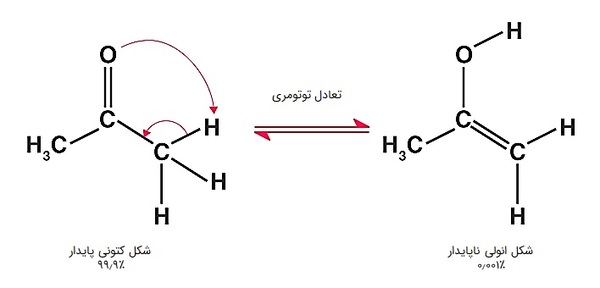
توتومر چیست ؟
توتومرها (Tautomers)، دستهای از ایزومرهای ساختاری هستند که در یک محلول به راحتی میتوانند بهم تبدیل شوند و با هم در تعادلند، مانند کتوها (کتونها و آلدهیدها) با انولها. در طبیعت این تعادل به نفع کتون است و مقدار بسیار کمی انول ناپایدار دیده میشود. به این تعادل، «توتومری کتو-انولی» (Keto-enol Tautomerism) گفته میشود.
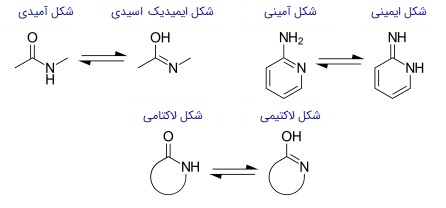
تعادلهای توتومری «لاکتام-لاکتیم»، «آمین-ایمین» و «آمین، ایمیدیکاسید» نیز در تصویر زیر مشاهده میشود:
ایزومرهای فضایی
در ایزومرهای فضایی، تعداد شاخهها، گروههای عاملی، نحوه اتصال و در کل شکل پیوندها تفاوتی ندارد، بلکه محل قرارگیری پیوند در فضا است که تغییر کرده است. ایزومرهای فضایی به دو دسته تقسیم میشوند:
- «کانفورماسیون» (Conformation)
- «کنفیگراسیون» (Configuration)
کانفورماسیون
در کانفورماسیونها این قابلیت وجود دارد که یک مولکول بدون شکستن هیچ پیوندی و تنها با چرخش حول محور یک یا چند پیوند یگانه (سیگما) کربن-کربن میتواند به شکلهای مختلفی دربیاید. به کانفورماسیونهای ایزومری، «کانفورمر» یا «همصورت» (Conformer) میگویند.
کانفورمرها به طور کامل پایدار نیستند و در دمای اتاق خودبهخود به یکدیگر تبدیل میشوند. ساختار دارای پایینترین سطح انرژی، پایدارتر و فراوانتر، و ساختار دارای بالاترین سطح انرژی ناپایدارتر و کمیابتر است. به روشی که در ادامه توضیح داده شده، میتوان سطح انرژی را در همصورتها بررسی کرد.
رسم فرم نیومن
برای بررسی سطح انرژی کانفورماسیونها، ابتدا آنها را به روش «ساختار نیومن» (Newman projection) نمایش میدهیم. در این روش در آغاز باید ببینیم که کدام پیوند کربن-کربن سیگما در مولکول را میخواهیم بررسی کنیم و سپس انتخاب کنیم از کدام جهت میخواهیم به آن نگاه کنیم. در پیوند انتخاب شده، کربنی از زنجیره که نزدیکتر به ما قرار دارد، کربن «پروکسیمال» یا «جلویی» (Proximal یا Front) و کربن دورتر «دیستال» یا «عقبی» (Distal یا Back) نام میگیرد.
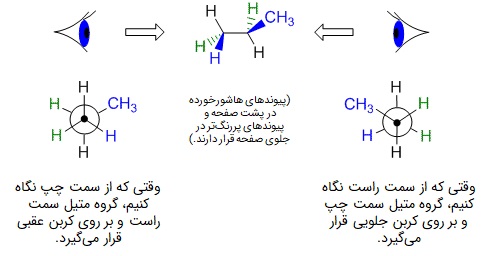
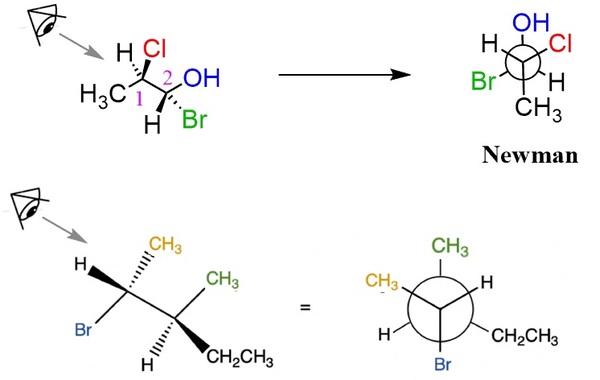
کربن جلویی را به شکل نقطه روی صفحه گذاشته و با نحوه جهتیابی که در تصویر قبلی توضیح داده شد، سه گروه متصل به آن را با رسم پیوندها نمایش میدهیم، بین این سه استخلاف باید زاویه ۱۲۰ درجه وجود داشته باشد. کربن عقبی پشت کربن جلویی قرار گرفته و به عنوان نماد آن، یک دایره رسم میشود. گروههای متصل به کربن دوم، به شکل پیوندهایی وصل به محیط دایره نمایش داده میشوند. در شکل زیر دو مثال از چگونگی رسم ساختار نیومن را مشاهده میکنید:
حال چرخش میتواند حول پیوند کربن اول و دوم رخ دهد و حالتهای بینهایتی را بهوجود آورد که هر کدام سطح انرژی خاص خودش را دارد. در حالتهایی که گروههای متصل به کربن اول و دوم در یک راستا قرار بگیرند، به علت ممانعت فضایی، دافعه واندروالانسی و «فشار پیچشی» (Torsional Strain) انرژی مولکول بیشتر میشود، به این حالتها، «پوشیده» (Eclipsed) میگویند.
هرچقدر گروههایی که در یک راستا قرار گرفتهاند، بزرگتر باشند، انرژی مولکول بیشتر است. برای مثال در تصویر زیر، در حالتی که دو گروه متان در یک راستا قرار میگیرند، انرژی مولکول بیشتر از وقتی است که یک گروه متان با هیدروژن همراستا است.
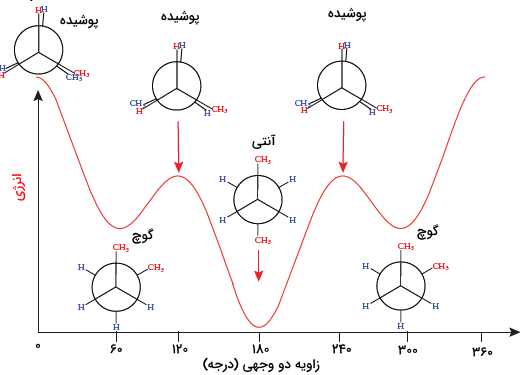
وضعیتی که گروههای متصل به کربن جلویی و عقبی در یک راستا نباشند، «نپوشیده» (Staggerd) نام دارد. دو حالت رایج نپوشیده، حالتهای «گوچ» (Gauche) و «آنتی» (Anti) هستند. در حالت گوچ زاویه پیچشی یا «زاویه دو وجهی» (Dihedral Angle) که در حقیقت زاویه بین پیوندهای کربن جلویی و پشتی است، ۶۰ درجه است. در حالت آنتی، این زاویه به ۱۸۰ درجه افزایش مییابد، درنتیجه گروهها در دورترین حالت و کمترین ممانعت فضایی ممکن قرار دارند و کمترین سطح انرژی را به خود اختصاص میدهند.
کانفورماسیون قایق و صندلی سیکلوهگزان
سیکلوهگزان یک آلکان حلقوی ششوجهی است که میتواند به شکل کانفورماسیونهای «قایق» (Boat)، «صندلی» (Chair)، «قایق پیچیده» (Skew Boat یا Twisted Boat) و «صندلی نیمه» (Half chair) دربیاید. شکل نیمهصندلی سیکلوهگزانها به علت داشتن بیشترین ممانعت فضایی ناپایدارترین و پرانرژیترین حالت سیکلوهگزان است. پس از آن به ترتیب قایق، قایق پیچیده و صندلی قرار دارند. در تصویر زیر سطح انرژی ساختارها را مشاهده میکنید:
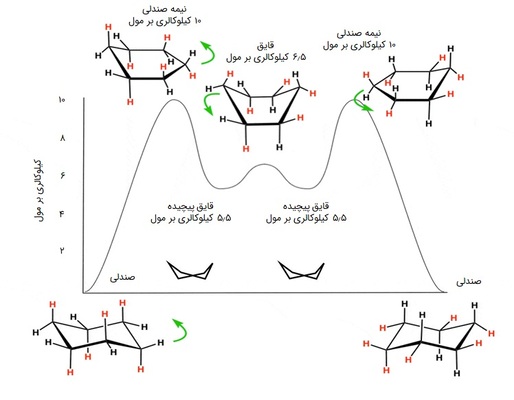
صندلی که پایدارترین و فراوانترین کانفورماسیون سیکلوهگزان است، خود به شکلهای مختلفی قابل رسم است. استخلافهای متصل به زنجیره کربنی در صندلی، میتوانند به حالت «استوایی» (equatorial) یا «محوری» (axial) قرار بگیرند. اگر بر روی شکل صندلی چرخش از نوع Flip انجام دهیم، باید پیوندهای استوایی را تبدیل به محوری و پیوندهای محوری را تبدیل به استوایی کنیم، اما بالا و پایین آنها تغییر نمیکند.
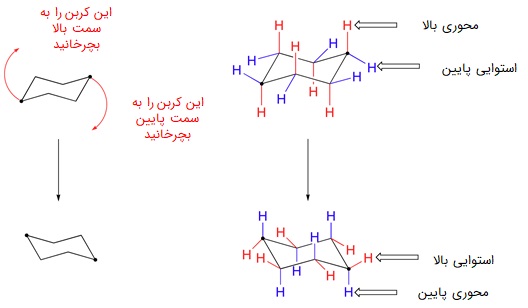
حالتی که استخلافهای بزرگتر، پیوند محوری دارند، پایدارتر است. همچنین اگر استخلافها نسبت هم در وضعیت ترانس باشند، از ایزومر سیس خود پایداری بیشتری دارند. نحوه تشخیص ایزومری سیس و ترانس در ادامه توضیح داده شده است.
کنفیگراسیون
«کنفیگراسیونها» (Configurations) ایزومرهای فضایی هستند که بدون شکستن پیوند نمیتوانند به یکدیگر تبدیل شوند و به دو شکل «ایزومر هندسی» (Geometric Isomers) و «ایزومر نوری» (Optical Isomer) وجود دارند.
ایزومر های هندسی: سیس و ترانس
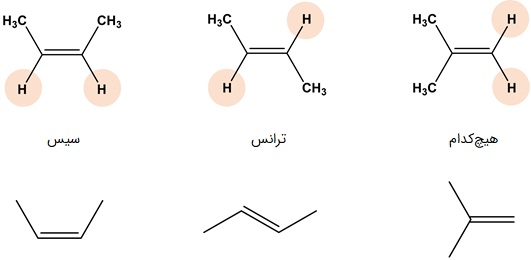
ایزومرهای هندسی اغلب در مولکولهای دارای پیوند دوگانه دیده میشوند. در دمای اتاق گردش حول محور پیوند دوگانه وجود ندارد و بدون شکسته شدن پیوند، این دو نمیتوانند بهم تبدیل شوند. یک گروه از ایزومرهای هندسی، ایزومرهای «سیس» یا «یکسو» (Cis) و «ترانس» یا «دوسو» (Trans) هستند. واژه سیس هنگامی که گروههای عاملی در یک سمت مولکول و واژه ترانس هنگامی که گروههای عاملی در دو سمت مولکول قرار گرفته باشند، استفاده میشود. ایزومر ترانس نسبت به سیس پایدارتر است و شبکه بلوری منظمتر و نقطه ذوب بیشتری دارد.
برای وجود ایزومری سیس و ترانس باید اتمهای کربن در پیوند دوگانه، هرکدام باید به دو گروه مختلف وصل باشند، در غیر این صورت مثل سمت راست تصویر زیر، ایزومر نخواهیم داشت. در آلکینها نیز شرایط به همین صورت است و چون امکان وجود دو مولکول مختلف به یک کربن درگیر در پیوند سهگانه وجود ندارد، ایزومری سیس و ترانسی در کار نیست.
ایزومرهای سیس و ترانس در هیدروکربنهای حلقوی نیز دیده میشود زیرا حلقهها ساختارهای سختی هستند و چرخش آزاد در آنها ممکن نیست:
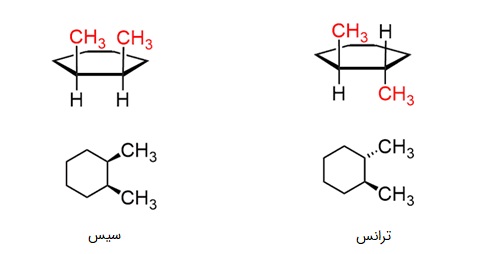
تشخیص ایزومر سیس و ترانس در سیکلوهگزانها
تشخیص سیس و ترانس در سیکلوهگزانها، قانون خاص خودش را دارد. در صورتی که دو استخلاف در وضعیتهای ۱-۲، ۱-۴، ۱-۶ نسبت بهم قرار گرفته باشند، اگر هر دو استوایی یا محوری باشند، در شکل ایزومری ترانس هستند. اگر یکی استوایی و دیگری محوری باشد، حالت ایزومری سیس برقرار است.
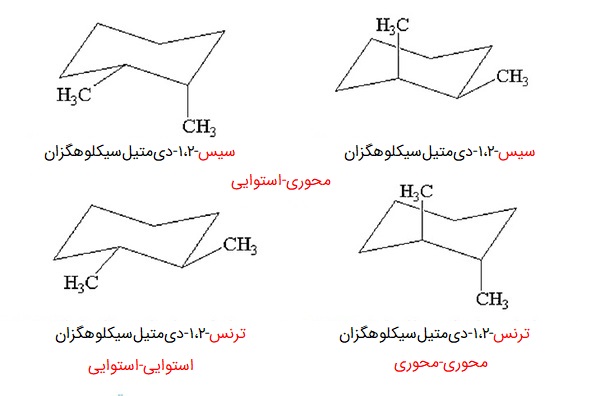
وقتی دو استخلاف در وضعیت ۱-۳ یا ۱-۵ نسبت به یکدیگر قرار دارند، شرایط برعکس است. یعنی اگر هر دو استوایی یا محوری باشند، ایزومری سیس و اگر یکی استوایی و دیگری محوری باشد، ایزومری ترانس داریم.
ایزومر های هندسی: Z و E
روش دیگر توصیف شیمی فضایی مولکولها در آلکانها، استفاده از دو نماد Z و E است. E از واژه آلمانی Entgegen به معنی «مقابل» و Z از واژه آلمانی Zusammen به معنی «همراه» گرفته شده است. این روش نامگذاری برای مولکولهای پیچیدهتر نیز به کار میآید و نسبت به سیس و ترانس توصیف دقیقتری دارد.
در این روش، از حق تقدم اتمهای متصل به کربنهای درگیر در پیوند دوگانه بر یکدیگر استفاده میشود. هر کربن دارای پیوند دوگانه، به دو استخلاف دیگر متصل است، پس باید بررسی کرد کدام یکی از این استخلافها در مجموع عدد اتمی بزرگتری دارد و بر دیگری مقدم است. اگر در هر دو کربن درگیر در پیوند دوگانه، استخلافهای مقدم بر دیگری، در یک سمت بودند، ایزومر Z و اگر در دو سمت بودند ایزومر E نام میگیرد.
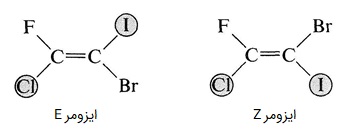
برای مثال در تصویر بالا، ابتدا باید برم و ید را با هم، و فلوئور و کلر را با هم مقایسه میکنیم. در درسته اول ید و در دسته دوم کلر عدد اتمی بزرگتری دارند و هر کدام در دسته خود مقدم هستند. در سمت چپ، کلر در سمت پایین و ید در سمت بالا قرار گرفته است، پس ایزومر از نوع E است و در سمت راست ید و کلر هر دو در سمت پایین واقع شدند پس ایزومر Z داریم.
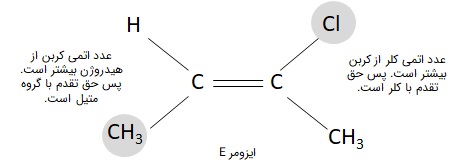
توجه نمایید که ممکن است دو گروه عاملی متصل به دو کربن پیوند دوگانه، هر دو در یک سمت قرار گرفته باشند اما الزاما تقدم بالاتری ندارند. یعنی سیس و ترانس برابر با ایزومریهای Z و E نیستند. مانند تصویر زیر که در آن، در سمت راست مولکول حق تقدم با کلر است زیرا عدد اتمی بالاتری از کربن دارد و در سمت چپ، حق تقدم با گروه متیل است زیر کربن عدد اتمی بالاتری از هیدروژن دارد. درنتیجه با وجود اینکه ایزومری سیس در این مولکول دیده میشود، ایزومر E است.
اگر اتمهای متصل به کربن درگیر در پیوند دوگانه یکسان بود چه کنیم؟
در چنین شرایطی باید، به اتمهای پس از آن توجه کنیم. به تصویر زیر توجه کنید:
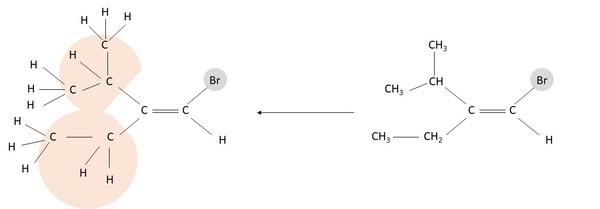
تکلیف ما با استخلافهای سمت راست مولکول روشن است. به وضوح برم حق تقدم بالاتر از هیدروژن دارد. برای سمت چپ مولکول، به شکلی که در تصویر دیده میشود، پیوندهای دو اتم متصل به کربن پیوند دوگانه را از هم باز کرده و رسم میکنیم. حال میبینیم که کربن به دو کربن دیگر و یک هیدروژن متصل است که در مجموع عدد اتمی برابر ۱۳ دارند. در سمت پایین کربن تنها به یک اتم کربن دیگر و دو هیدروژن متصل است که مجموع عدد اتمی آنها برابر با ۸ است، پس گروه بالایی بر پایینی حق تقدم دارد. هر دو گروه دارای تقدم در سمت بالا قرار گرفتهاند و مولکول ایزومری Z است.
در صورتی که وقتی مولکول را یک دور باز کردیم، باز هم به حق تقدم یکسانی رسیدیم، یک درجه بیشتر در استخلافها پیش میرویم و پیوندهای دورتر را باز و بررسی میکنیم.
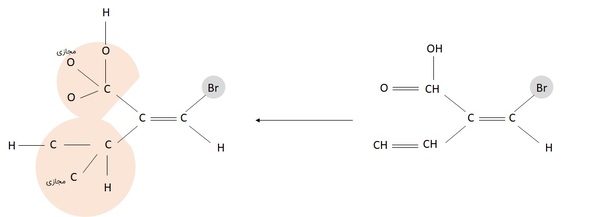
اگر اتمهای متصل به کربن درگیر در پیوند دوگانه خود پیوند دوگانه داشتند چه کنیم؟
موقعی که هنگام باز کردن مولکول، به پیوند دوگانه در استخلافها برخوردیم، پیوند دوگانه را برابر دو اتم از همان اتم درگیر در پیوند درنظر میگیریم. در مثال زیر، در گروه کربوکسیلیک اسید (استخلاف بالایی)، پیوند دوگانه کربن-اکسیژن برابر یک پیوند کربن-اکسیژن و یک پیوند کربن-اکسیژن مجازی در نظر گرفته شده است، گویی کربن به سه اکسیژن متصل باشد که در مجموع عدد اتمی ۲۴ میگیرد. در پایین، با پیوند کربن-کربن دوگانه همانند یک کربن-کربن و یک کربن-کربن مجازی برخورد میشود و عدد اتمی ۱۳ داریم. پس گروه بالایی بر پایینی تقدم دارد و ایزومری آن از نوع Z است.
ایزومرهای نوری
در ایزومرهای نوری، محل قرارگیری استخلافهای مختلف در اطراف زنجیره کربنی به گونهای متفاوت است که میتواند نور پلاریزه را به طریق راستگرد یا چپگرد از خود عبور دهد. آنها به دو دسته «انانتیومرها» (Enantiomers) و «دیاسترومرها» (Diastereomers) تقسیم میشوند.
کربن کایرال چیست ؟
شرط ایزومرهای نوری، وجود حداقل یک کربن «کایرال» (Chiral) است. کربن کایرال کربنی است که هیچ یک از چهار استخلاف آن با هم برابر نیستند. دقت کنید که کربن کایرال نباید به پیوند دوگانه یا سهگانه متصل باشد، چراکه برابر با دو و سه پیوند یکسان دانسته میشوند.
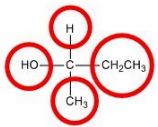
کربن کایرال «مرکز استرئوژنیک» (Stereogenic Center) مولکول نامیده میشود و در اغلب موارد باعث میشود که مولکول نتواند تقارنی داشته باشد.
مولکول کایرال چیست ؟
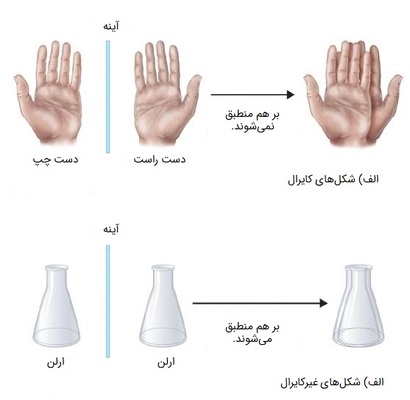
هنگامی که مولکول، کربن کایرال داشته باشد، به عنوان مولکول کایرال شناخته میشود و به معنی این است که بر تصویر آینهای خود منطبق نمیشوند، در نتیجه نمیتوان آن ها را یک مولکول دانست. یک مثال خوب از تصویرهای آیینهای غیرقابل انطباق، دستان ما هستند. اگر دستان خود را روی یکدیگر قرار دهید، خواهید دید که با وجود شباهت بسیار بالا بهم، دقیق با هم منطق نمیشوند. واژه کایرال هم از ریشه یونانی خود به معنی «دست» گرفته شده است.
گاه پیش میآید که مولکول کربن کایرال نداشته باشد اما ترکیب کایرال باشد. مثلا ترکیب زیر با اینکه کربن کایرال ندارد، کایرال است، زیرا هیچ نوع تقارنی در آن دیده نمیشود و شکل فضایی آن با تصویر آینهای خود منطبق نیست.
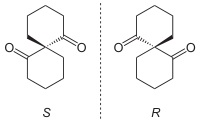
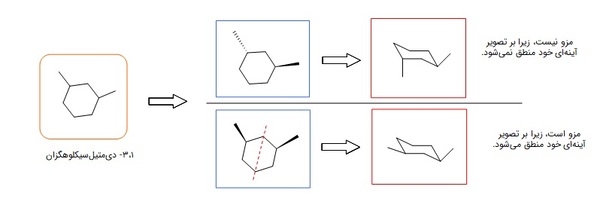
ترکیبات مزو
ترکیبهایی هستند که مرکز کایرال دارند، اما کایرال نیستد چراکه میتوان برای آنها صفحه تقارن رسم کرد. آنها بر تصویر آینهای خود منطبقاند و فعالیت نوری ندارند.
انانتیومرها
«اناتیومرها» (Enantiomers) مولکولهایی هستند با فرمول، ساختار و پیوندهای مشابه که با هم برابر نیستند زیرا تصویر آیینهای غیرقابل انطباق بر یکدیگر دارند، یعنی مولکولهایی کایرال هستند. آنها از لحاظ خواص شیمیایی و فیزیکی یکسانند اما دو تفاوت عمده دارند. اول اینکه آنزیمهای زیستی بدن در موردشان اختصاصی عمل میکنند، یعنی تنها بر روی یک فرم از آنها میتوانند فعالیت انجام دهند و دوم، هر کدام چرخش خاصی در نور پلاریزه ایجاد میکنند.
چرخش نور پلاریزه در ایزومرهای نوری
پرتوهای یک منبع نور عادی در بینهایت صفحه عمود بر جهت انتشار نور در حال نوساناند اما اگر یک منبع نور عادی را به فیلتر پلاریزهکننده (Polarizer) بتابانیم، نور پلاریزه میشود. یعنی فقط آن گروه از امواج الکترومغناطیسی که میدان الکتریکی آنها در راستای عمود نوسان میکند، از فیلتر پلاریزهکننده عبور خواهد کرد.
در دستگاه پلاریمتر (Polarimeter) به کمک فیلتر پلاریزهکننده، ابتدا نور پلاریزه با طول موج مشخص به دست میآید. در مقابل فیلتر، در مسیر نور، مقداری از شکل گازی محلولی که میخواهیم فعالیت نوری آن را بررسی کنیم، قرار گرفته است. پس نور با محلول برخورد کرده، از آن عبور میکند و دستخوش تغییراتی میشود.
اگر پرتوهای نور که تنها در یک جهت به محلول تابانده شده، دچار چرخش شود، بیانگر کایرال بودن مولکول است و گفته میشود مولکول دارای فعالیت نوری است. چرخش نور پلاریزه میتواند «راستگرد» (Dextrorotatory | D) یا ساعتگرد باشد که با «+» و میتواند «چپگرد» (Levorotatory | L) یا پادساعتگرد باشد که با «-» نمایش داده میشود. همچنین زاویه این چرخش با علامت «α» مشخص میشود.
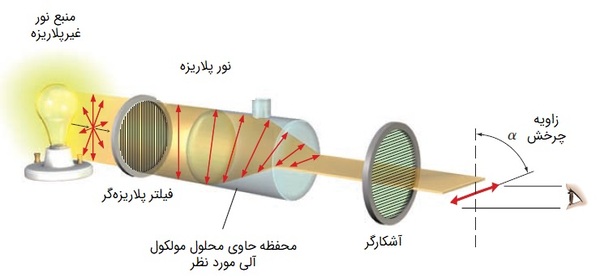
وقتی یک مولکول راستگرد باشد، انانتیومر آن چپگرد خواهد بود و برعکس. درنتیجه هنگامی که در محلولی به طور برابر از انانتیومر راستگرد و انانتیومر چپگرد یک مولکول بریزیم، محلول در نهایت فعالیت نوری نخواهد داشت و گفته میشود که محلول «راسمیک» (Racemic) است.
فرمول چرخش ویژه
میزان «چرخش ویژه» (Specific Rotation) نور در یک محلول، نه تنها به کایرال بودن آن، بلکه به عواملی چون غلظت و ساختار ماده بستگی دارد. این مقدار تحت شرایط معین برای یک ماده ثابت است و میتوان به عنوان یک ویژگی فیزیکی از آن استفاده کرد. چرخش ویژه با فرمول زیر به دست میآید:
در این فرمول نمادها به شرح زیر هستند:
- «[α]» نماد چرخش ویژه با واحد درجه
- «λ» نماد طول موج با واحد نانومتر
- «T» نماد دما با واحد درجه سانتیگراد
- «α» بیانگر چرخش مشاهده شده با واحد درجه
- «c» نشانه غلظ نمونه با واحد گرم بر میلیلیتر
- «l» بیانگر طول نمونه با واحد دسیمتر
طبق قرارداد جهانی، در دستگاه پلاریمتر برای مشخص کردن مقدار چرخش ویژه باید از لامپ سدیمی با طول موج 589 نانومتر در دمای ۲۵ درجه سانتیگراد و نمونهای به طول ۱ دسیمتر با غلظت ۱ گرم بر میلیمتر استفاده شود. در نهایت برای مثال اگر [α] به دست آمده برابر ۱۵/۴۲+ درجه باشد، یعنی نور پلاریزه ۱۵/۴۲ درجه ساعتگرد چرخیده است.
نامگذاری انانتیومرها: کنفیگراسیون R و S
برای تشخیص و نامگذاری اناتیومرها به شکل سهبعدی آنها نیاز داریم. هنگامی که یک مولکول چهار پیوندی را بر روی صفحه تنها با خطوط ساده رسم میکنیم، در حقیقت به شکل سهبعدی آن اشاره نکردهایم. در یک مولکول چهار وجهی، دو پیوند همراه با اتم مرکزی بر روی صفحه، یک پیوند پشت صفحه و یک پیوند جلوتر از صفحه قرار دارد. پیوند پشت صفحه با علامت هاشور (خطچین) و پیوند جلوی صفحه با مثلث مشکی (گوه) نشان داده میشود. زاویه بین پیوندها ۱۰۹/۵ درجه است.
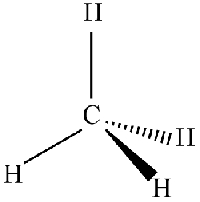
هر مرکز کایرال، به شکل S یا R نامگذاری میشود. S ابتدای واژه Sinister در لاتین به معنی «چپ» و R ابتدای واژه لاتین Rectus به معنی «راست» است. این نامها ربطی به چپگرد یا راستگرد بودن چرخش ویژه آلفا ندارد و بیانگر چپگرد یا راستگرد بودن ترتیب الویتهای بین استخلافهای کربن کایرال است. برای مثال یک مولکول S میتواند «+» یا «-» باشد:
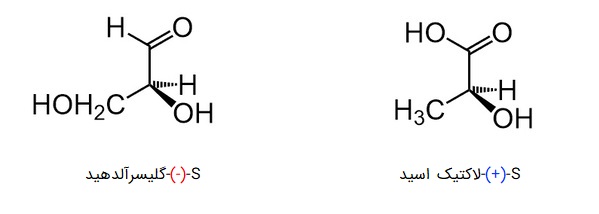
برای پی بردن به R یا S بودن یک ساختار چهار وجهی، ابتدا باید آن را به شکل سه بعدی رسم کنیم. سپس حق تقدم چهار استخلاف را نسبت به ترتیب با اعداد یک تا چهار یکدیگر مشخص میکنیم. الویت در اینجا همانند همان حق تقدمهایی است که در بخش ایزومرهای Z و E توضیح دادیم. در آخر باید مولکول را طوری بچرخانیم که الویت شماره چهار در پشت صفحه قرار بگیرد.
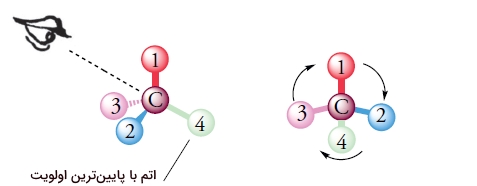
پس از قرارگیری الویت آخر در پشت صفحه، بررسی میکنیم که آیا جهت چرخش اعداد از الویتهای یک تا سه، ساعتگرد است یا پادساعتگرد، اگر ساعتگرد بود از علامت «R» و اگر پادساعتگرد بود از علامت «S» استفاده میکنیم.
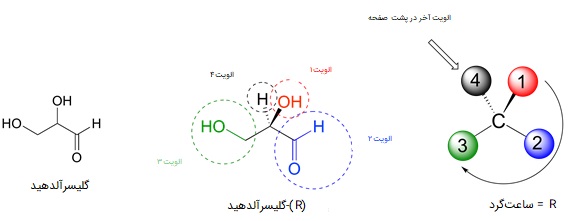
این نامگذاری را برای تمامی مراکز کایرال یک مولکول میتوان انجام داد، اگر در نهایت تمامی مراکز کایرال در دو مولکول با فرمول مشابه از نظر R و S جهت مخالف یکدیگر باشند، میتوانند گفت که آن دو انانتیومر هم هستند. یعنی هر گردشی که در یک مولکول به شکل R است، در انانتیومر آن S خواهد بود و برعکس.
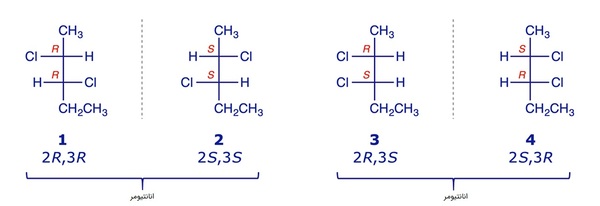
دیاسترومرها
دیاسترومرها نوعی ایزومر نوری هستند که جزو انانتیومرها دستهبندی نمیشوند، زیرا در دیاسترومرها، تمامی گردشهای حول مراکز کایرال معکوس هم نیستند و برخی مشابهاند، درنتیجه نمیتوان آنها را تصویر آینهای یکدیگر دانست. در تصویر قبلی، مولکولهای شماره یک و دو نسبت به مولکولهای شماره سه و چهار ایزومری دیاسترومری دارند. همچنین برخلاف انانتیومرها، دیاسترومرها خواص فیزیکی و شیمیایی متفاوتی دارند.
تعداد ایزومرهای فضایی یک مولکول فعال نوری از فرمول ۲n به دست میآید که n در این فرمول تعداد مراکز کایرال ترکیب است. با توجه به اینکه هر مولکول تنها یک انانتیومر دارد، ۲n-۱ تعداد دیاسترومرهای آن است.
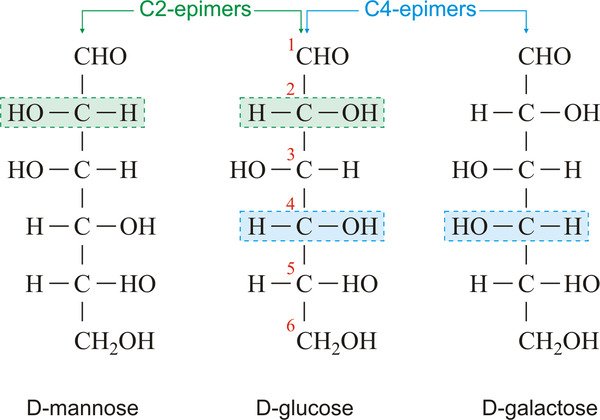
اپیمرها
«اپیمرها» (Epimers)، دستهای از دیاسترومرها هستند که فقط در یک چرخش حول کربن با یکدیگر تفاوت دارند. در تصویر زیر، D-مانوز و D-گلوکز به علت تفاوت در کربن دوم اپیمر یکدیگرند، D-گلوکز و D-گالاکتوز نیز چون تنها در چرخش حول کربن چهارم خود با هم فرق دارند، اپیمر هم محسوب میشوند.
واکنشهای بازآرایی
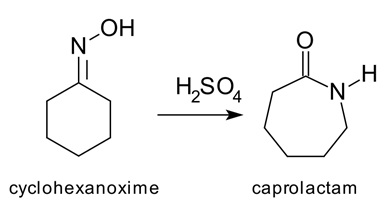
زمانی که «ایزومری شدن» (Isomerization) به صورت «درونمولکولی» (Intramolecular) صورت بگیرد، «واکنش بازآرایی» (Rearrangement Reaction) خواهیم داشت. از معروفترین بازآراییها میتوان «بازآرایی بکمن» (Beckmann Rearrangement) سیکلوهگزاناکسیم را نام برد.
در بازآرایی بکمن سیکلوهگزاناکسیم در حضور کاتالیزور اسیدی بدون تغییر فرمول شیمیایی (C6H11NO) به کاپرولاکتام تبدیل میشود. در این واکنش سیکلوهگزان تبدیل به سیکلوهپتان شده و گروه عاملی اکسیم به شکل آمید درمیآید.












مبحث ایزومرها بسیار عالی تنظیم شده
سلام
مگه دو مولکول انانتیومر با تقارن محوری به هم منطبق نمیشن ؟ پس چرا با هم فرق دارن؟!
با سلام؛
توجه داشته باشید که انانتیومرها از اتمهایی با مراکز کایرال تشکیل شدهاند. یک مرکز کایرال اتمی است که ۴ گروه متفاوت به آن وصل است پس از هیچ جهت و محوری نمیتواند تقارن داشته باشد. انانتیومرها تنها در فضا با یکدیگر قابل مقایسه هستند و تصویر آینهای یکدیگرند. مانند دو دست راست و چپ که تصویر آینهای هم هستند اما اگر در یک صفحه بر هم منطبق شوند، انگشتان بر هم منطبق نمیشوند. انانتیومرها تنها در بررسی اثر نورتابیده شده به آنها قابل تمییز هستند. این ترکیبات نور قطبی را به دوجهت متفاوت میچرخانند به همین دلیل با یکدیگر تفاوت دارند. همچنین ویژگیهای رفتاری این مولکولها در واکنشهای مختلف خصوصا واکنشهای زیستی با یکدیگر متفاوت است.
با تشکر از همراهی شما با مجله فرادرس
سلام
در مورد قسمت ترکیبات مزو
اونجایی که گفته شده
(ترکیب هایی هستند که مرکز کایرال دارند ولی )
منظور از مرکز کایرال همون کربن کایرال دیگه؟درسته؟!
عالی بود
عاالییی
ببخشید چطور تعداد ایزومر یک الکانو بدست بیاریم یعنی بفهمیم برا مثال هپتان چن الکان داره
با سلام؛
تعداد ایزومرهای زنجیری هر آلکان از فرمول خاصی تبعیت میکند که در متن بخش «ایزومر های زنجیری» توضیح داده شده است.