آلوتروپ – از صفر تا صد
آلوتروپ یا دگرشکل، شکلهای مختلفی از یک عنصر است. نحوه تشکیل پیوندهای مختلف میان اتمها موجب تشکیل موادی با ساختار و خواص فیزیکی و شیمیایی متفاوت میشود. «آلوتروپها» (Allotropes) تنها در برخی عناصر یافت میشوند. این عناصر بین گروههای ۱۳ تا ۱۶ جدول تناوبی عناصر قرار دارند. در این آموزش، آلوتروپهای گروههای ذکر شده را بررسی خواهیم کرد.


آلوتروپ در جدول تناوبی
آلوتروپی یا دگرشکلی، خاصیت برخی عناصر شیمیایی است که در یک حالت - جامد، مایع و گاز ـ با دو یا چند شکل مختلف خصور دارند. اتمهای عناصر با شیوههای مختلفی در آلوتروپها با یکدیگر پیوند دارند. به طور مثال، اتم کربن دارای آلوتروپهای مختلفی همچون الماس، گرافیت، گرافن و فولرن است. واژه آلوتروپ تنها برای عناصر استفاده میشود که به اشتباه در برخی موارد از آنها در بیان ترکیبات بهره میگیرند.
همانطور که گفته شد، این دگرشکلها تنها محدود به برخی گروههای جدول تناوبی است که در ادامه به توضیح آنها میپردازیم. البته، درصورتیکه سبک یادگیری شما بصری است و ترجیح میدهید یک فیلم آموزشی در مورد آلوتروپ مشاهده کنید، پیشنهاد میکنیم ویدیوی آموزشی رایگان زیر را مشاهده کنید:
گروه ۱۳
عنصر «بور» (Boron) در میان سختترین عناصر، جایگاه دوم را به خود اختصاص داده است و تنها عنصر آلوتروپ در گروه ۱۳ به شمار میآید. با توجه به آمورف بودن بور، دگرشکلهای مختلفی از این عنصر شناخته شده است. ساختارهای «شش وجهی» (رومبوهدرال) و «چهار وجهی» (تتراگونال) از این عنصر، دگرشکلهای آن را تشکیل دادهاند و همگی پلیمری هستند.
گروه ۱۴
در این گروه تنها کربن و قلع به صورت آلوتروپ قرار دارند. از زمانهای دور، الماس و گرافیت به عنوان آلوتروپهای کربن درنظر گرفته میشدند که هردو جامداتی پلیمری هستند. الماس، کریستالی سخت و بیرنگ و اولین عنصری است که ساختار آن بر اساس «پراش اشعه ایکس» (X-ray Diffraction) تعیین شد. از خواص این آلوتروپ، نقطه ذوب بسیار بالا (دارای بالاترین نقطه ذوب در میان مواد) ذکر شده است، همچنین الماس به عنوان سختترین جامد طبیعی شناخته میشود. در مقابل، گرافیت به عنوان پایدارترین شکل کربن، رنگی خاکستری دارد و به علت خاصیت مومی شکل آن، در روانکارها از آن بهره میگیرند. علاوه بر این، نوک مدادها نیز از جنس گرافیت تهیه شدهاند.
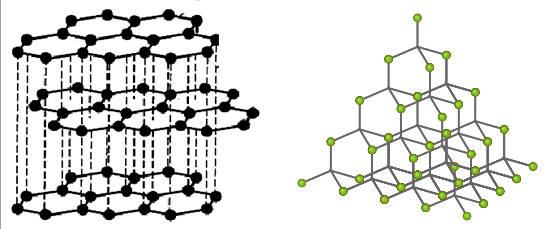
شبکه بلوری الماس شامل اتمهای کربنی است که به صورت چهاروجهی در یک شبکه نامحدود سه بعدی قرار دارند. گرافیت نیز شامل یک شبکه سه بعدی نامحدود با لایههایی قطبی است. این لایهها در نهایت به صورت حلقههای شش وجهی در طول شبکه تکرار میشوند. طول پیوند کربن-کربن در بین لایههای گرافیت کمتر از الماس است. همچنین این پیوندها از فاصله بین لایهها نیز کوتاهتر هستند. این خاصیت موجب میشود تا لایههای گرافیت به راحتی روی یکدیگر بلغزند که همین مورد، دلیلی برای بهرهگیری از آنها به عنوان روانکننده است.
الماس و گرافیت، آلوتروپهای غیر مولکولی کربن هستند. بعد از کشف کربن ، آلوتروپهای مولکولی نظیر «فولرنها» (Fullerenes) نیز به دگرشکلهای کربن اضافه شدند. فولرنها شامل تعداد ۶۰ یا 70 کربن هستند که یک کره متراکم شامل حلقههای کربنی را تشکیل میدهند. فولرنها به طور معمول در آزمایشگاه ساخته میشوند اما برخی از آنها با غلظتهای پایین در طبیعت یافت شدهاند. و ، بیشترین تعداد فولرنها را شامل میشوند.
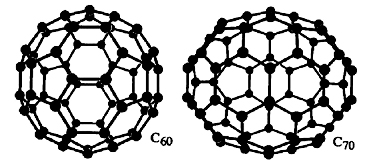
در سال 1991، نانولولههای کربنی کشف شدند. این مواد، انعطاف پذیرتر و مستحکمتر از فیبرهای کربن هستند که میتوانند در دسته رساناها یا نیمه رساناها قرار بگیرند. مکانیسم تشکیل آنها مشخص نیست اما معمولا به کمک غلتاندن (رول کردن) لایههای گرافیت بوجود میآیند. نحوه قرارگیری حلقههای کربنی در کنار یکدیگر موجب شکلگیری دامنه وسیعی از نانولولهها (نانوتیوب) با مقاومت مکانیکی و هدایت الکتریکی متفاوت شده است.
«قلع» (Tin) مادهای با نقطه ذوب پایین و دارای دو آلوتروپ در دما و فشار محیط است. آلوتروپهای قلع را با نامهای و میشناسند. قلع آلفا رنگ خاکستری و قلع بتا رنگ سفید دارند. قلع آلفا شکل پایدار این دگرشکل در دمای کمتر از ۱۳ درجه سانتیگراد است که ساختاری مشابه الماس دارد. قلع بتا به صورت فلزی با شبکه آشفته و فشرده است.
گروه ۱۵
در گروه ۱۵ از جدول تناوبی، دو عنصر فسفر و آرسنیک دارای آلوتروپ هستند. فسفر آلوتروپهای مختلفی دارد. از اصلیترین آلوتروپهای فسفر میتوان به سفید، قرمز و سیاه اشاره کرد. در صنعت، از آلوتروپهای سفید و قرمز فسفر استفاده میشود. فسفر سفید مومی شکل و نارسانا است و با هوا واکنش میدهد. این واکنش اکسیژن به همراه نور زردی است که همین نور عامل نامگذاری این عنصر قلمداد میشود.
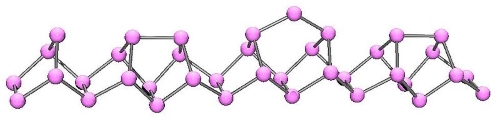
فسفری که به طور معمول از آن بهره میگیرند، حاصل حرارت دادن فسفر سفید در غیاب اکسیژن و در دمای است. ترکیب حاصل را فسفر قرمز مینامند که دمای ذوبی در حدود دارد و مکانیسم آن بدین صورت است که پیوندهای در هر مولکول شکسته میشوند و با تشکیل یک زنجیر پلیمری، ساختار فسفر قرمز را تشکیل میدهند که در تصویر زیر نشان داده شده است. همچنین با حرارت دادن فسفر قرمز و رساندن دمای آن به بیش از ، ساختارهای جدید و مختلف پلیمری نیز به تولید میرسند.
پایدارترین آلوتروپ فسفر با کمترین فعالیت، فسفر سیاه است که به سه شکل بلوری و یک شکل آمورف وجود دارد. همگی این آلوتروپها به صورت جامداتی پلیمری و غیر قابل اشتعال هستند. فسفرهای «اورتورومبیک» (Orthorhombic) و «رومبوهدرال» (Rhombohedral)، رنگی سیاه و مانند گرافیت ساختاری لایه لایه دارند.
آلوتروپِ بلوریِ فسفر به رنگ بنفش با ساختار «مونو کلینیک» (تک شیب) به نام «فسفر هیتورف» (Hittorf's Phosphorus) شناخته میشود که مکانیسم تولید آن به صورت فرآیندهای پیچیده حرارتی و الکترولیتی است. این دگرشکل ساختار بسیار پیچیدهای دارد. برشهای عرضی پنج وجهی، به صورت جفت جفت به یکدیگر متصل میشوند تا ساختاری دو لایه بوجود آورند که این ساختار در طول بلور تکرار میشود.
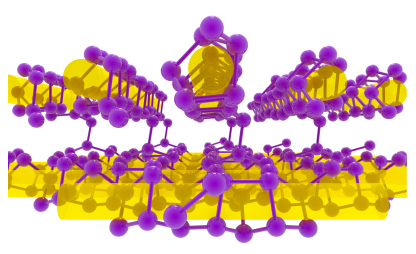
تعداد ۶ دگرشکل از آرسنیک گزارش شده است. از این میزان، ۳ آلوتروپ به صورت آمورف وجود دارند. پایدارترین شکل آرسنیک، جامدی خاکستری رنگ و شکننده موسوم به «آرسنیک آلفا» با ساختاری مشابه فسفر سیاه است. در بخار آرسنیک مولکولهای چهاروجهی حضور دارند که در صورت تراکم، به رنگ ناپایدار زرد دیده میشوند. آرسنیک به صورت طبیعی و همچنین در کانیها یافت میشود که ساختاری مشابه ساختار «اورترومبیک» (Orthorombic) فسفر سیاه دارند.
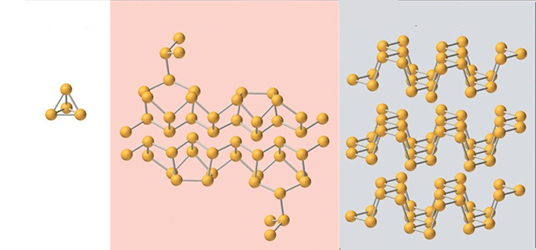
گروه ۱۶
سه عنصر اکسیژن، گوگرد و سلنیوم در این گروه دارای آلوتروپ هستند. دو آلوتروپ از اکسیژن به نامهای دیاکسیژن و اوزون شناخته شدهاند که هر دو در دما و فشار استاندارد در فاز گاز قرار دارند. دیاکسیژن به صورت رادیکالی با دو الکترون جفت نشده است که به این نوع مولکولها، دیرادیکال میگویند. این آلوتروپ تنها دگرشکل در میان تمام عناصر است که الکترون جفت نشده دارد. دیاکسیژن مایع و جامد هر دو به رنگ آبی دیده میشوند و این رنگ به علت جذب نور و افزایش سطح انرژی در این مولکول است. در فاز گاز نیز دیاکسیژن رنگی آبی دارد اما به علت غلظت کم ذرات در فاز گاز، تشخیص این رنگ دشوار است.
اوزون مولکولی شکل، سه اتمی، با رنگ آبی تیره و «مرتبه پیوند» (bond order) برابر با است. اوزون معمولا به روش تخلیه الکتریکی (مانند رعد و برق) به تولید میرسد که بویی تند مشابه با کلر دارد. اوزون از نظر ترمودینامیکی ناپایدار است و به طور خود به خودی به دیاکسیژن تبدیل میشود. رنگ آبی تیره در اوزون مهم است زیرا نتیجه جذب شدید رنگ قرمز و ماورا بنفش است و از همین مکانیسم برای حفاظت زمین در برابر اشعه ماورا بنفش بهره میگیرد. بعد از ، اوزون به عنوان قویترین اکسنده شناخته میشود.
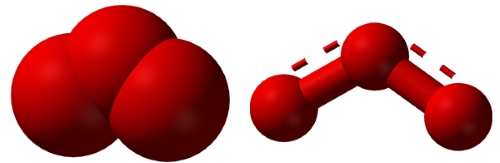
گوگرد (سولفور)، ۲۲ دگر شکل شناخته شده دارد. سادهترین آلوتروپ گوگرد، مولکول بنفش دیسولفور است. برخلاف ، دیسولفور به طور طبیعی در دما و فشار استاندارد وجود ندارد. این دگر شکل معمولا در اثر تولید بخار گوگرد در دمای تشکیل میشود و توسط تلسکوپ هابل به هنگام فوران آتشفانی قمر مشتری شناسایی شده است.
پایدارترین حالت در میان دگرشکلهای گوگرد، گوگرد اورتورومبیک به نام یا «سیکلو اکتا سولفور» (cyclooctasulfur) است. دومین آلوتروپ گوگرد با نام سیکلو هگزا سولفور شناخته میشود و کشف آن به سال 1891 بازمیگردد. سیلکلو هگزا سولفور به عنوان چگالترین آلوتروپ گوگرد ذکر شده است. آلوتروپهای گوگرد معمولا بلورهای زردرنگی با فرمول هستند که مقادیری تا 30 را نیز در بر میگیرد. رنگ محلول گوگرد از زرد کمرنگ به نارنجی، قرمز و در نهایت زمانی که به نقطه جوش خود در دمای میرسد به رنگ سیاه تغییر پیدا میکند. همچنین در دمای به دلیل تشکیل گوگرد پلیمری، ویسکوزیته آن نیز افزایش پیدا میکند.
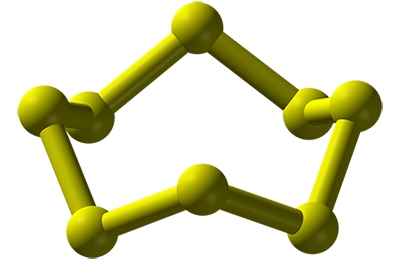
سلنیوم هم دگرشکلهای مختلفی دارد. چگالترین و همچنین پایدارترین شکل سلنیوم به لحاظ ترمودینامیک، «سلنیوم خاکستری» (Gray Selenium) است. این آلوتروپ زنجیره اتمهای سلنیوم را با ساختاری مارپیچ شامل میشود. لازم به ذکر است که صورتهای دیگر سلنیوم بر اثر گرم شدن به سلنیوم خاکستری تبدیل میشوند. سلنیوم خاکستری تنها آلوتروپ فلزی با خاصیت رسانایی در میان دگرشکلهای سلنیوم است.

با بررسی جدول تناوبی عناصر در مییابیم که خاصیت فلزی در هر گروه از بالا به پایین افزایش مییابد. گوگرد نارسانا است اما سلنیوم و تلوریم نیمهرسانا هستند. این درحالی است که هدایت الکتریکی پولونیوم همانند یک فلز است.
در جداول زیر، آلوتروپهای نافلزات، فلزات و شبه فلزات آورده شده است:
نافلزات
| نام عنصر | آلوتروپ | نام عنصر | آلوتروپ | نام عنصر | آلوتروپ |
| کربن | الماس | فسفر | فسفر سفید | اکسیژن | دیاکسیژن |
| لونسدالیت | فسفر قرمز آمورف | ||||
| گرافن | فسفر سرخ | اوزون | |||
| کربن Q | فسفر بنفش | ||||
| گرافیت | تترا اکسیژن | ||||
| کاربین | فسفر سیاه | ||||
| کربن آمورف | اکتا اکسیژن | ||||
| فولرن | دیفسفر | ||||
| نانولولههای کربنی | |||||
| نام عنصر | آلوتروپ | نام عنصر | آلوتروپ | ||
| سولفور | سیکلو-پنتاسولفور | سلنیوم | سلنیوم قرمز | ||
| سیکلو-هگزاسولفور | سلنیوم خاکستری | ||||
| سیکلو-هپتاسولفور | سلنیوم سیاه | ||||
| سیکلو-اکتاسولفور | سلنیوم مونوکلینیک (تک شیب) | ||||
شبه فلزات
| نام عنصر | آلوتروپ | نام عنصر | آلوتروپ | نام عنصر | آلوتروپ |
| بور | بور آمورف | سیلیکون | سیلیکون آمورف | آرسنیک | آرسنیک زرد |
| بور آلفا رومبوهدرال | |||||
| بور بتا رومبوهدرال | سیلیکون بلوری | آرسنیک خاکستری | |||
| بور گاما اوتورومبیک | |||||
| بور آلفا تتراگونال | سیلیسن | آرسنیک سیاه | |||
| بور بتا تتراگونال | |||||
| فاز ابررسانا با فشار زیاد | |||||
| نام عنصر | آلوتروپ | نام عنصر | آلوتروپ | نام عنصر | آلوتروپ |
| ژرمانیوم | ژرمانیوم آلفا | آنتیموان | آنتیموان آبی-سفید | تلوریم | تلوریم آمورف |
| ژرمانیوم بتا | آنتیموان زرد | ||||
| ژرمانن | آنتیموان سیاه | تلوریم بلوری | |||
| آنتیموان انفجاری |
فلزات
| نام عنصر | آلوتروپ | نام عنصر | آلوتروپ | نام عنصر | آلوتروپ |
| قلع | قلع خاکستری | آهن | آهن آلفا (فریت) | کبالت | کبالت آلفا |
| قلع سفید | آهن بتا | کبالت بتا | |||
| قلع گاما | آهن گاما (آستنیت) | پولونیوم | پولونیوم آلفا | ||
| استانن | آهن دلتا | پولونیوم بتا | |||
| قلع سیگما | آهن اپسیلون (هگزافروم) |
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش هایسیس HYSYS برای شبیه سازی فرایندهای شیمیایی
- کلوئید — به زبان ساده
- استرها — به زبان ساده
^^













عالی بود.من طبق کتاب هاب درسی مون فکر میکردم اتم کربن فقط دو آلوتروپ داره،ولی الان متوجه شدم فولرن هم آلوتروپ کربن هستش. خیلی ممنون.
عالییییی
خیلی به من کمک کرد که تکلیف شیمی ام را انجام بدم.
دست شما درد نکنه.