گروه دوم جدول تناوبی چیست؟ – به زبان ساده + خواص، کاربرد و آرایش الکترونی
بهاحتمال بالا شما بهعنوان خواننده این مطلب آموزشی، تاحدی با یکی از اساسیترین ابزارهای سرزمین شگفتیساز شیمی، یعنی جدول تناوبی آشنا باشید. جدولی متشکل از گروهها و ردیفهای دربرگیرنده عناصر کشف و تا حدودی رمزگشایی شده است که بههمت دانشمندان فاخر که صدرنشین آنها آقای «دمیتری مندلیف» (Dmitri Mendeleev) است، با روال مشخصی به صف شدهاند. در این مقاله از مجله فرادرس قصد داریم بهطور ویژه بهبررسی عناصر جایگرفته در گروه دوم جدول تناوبی، یعنی شش عنصر فلزی مهم و نامآشنای بریلیم، منیزیم، کلسیم، استرانسیم، باریم و رادیوم بپردازیم. ممکن است در منابع مختلف با نامهایی از قبیل عناصر قلیایی خاکی (Alkaline Earth Elements) و فلزات قلیایی خاکی (Alkaline Earth Metals)، با این گروه برخورد داشته باشیم. در کنار آشنایی با عناصر مذکور از جنبههای مختلف، از نکات و تصاویر تکمیلی نیز برای تسهیل فرایند یادگیری استفاده میکنیم.
- یاد خواهید گرفت عناصر گروه دوم جدول تناوبی را بهدرستی نام ببرید.
- رفتار شیمیایی و فیزیکی فلزات قلیایی خاکی را یاد میگیرید.
- میآموزید گروه نخست و گروه دوم جدول تناوبی را بهطور علمی با هم مقایسه کنید.
- یاد میگیرید روندهای تناوبی را بشناسید و دلیل تفاوت خواص عناصر را بررسی کنید.
- دلایل استثنایی بودن بریلیم در گروه دوم را خواهید شناخت.
- با کاربردهای مهم صنعتی و بیولوژیکی عناصر این گروه آشنا خواهید شد.


فلزات قلیایی خاکی در جدول تناوبی
«گروه دوم جدول تناوبی»، که عنوانشان نیز گویای موقعیت آنها در جدول تناوبی است، شامل شش عنصر قرار گرفته در ستون دوم از سمت چپ جدول تناوبی است. همانگونه که در شکل زیر مشخص است، این گروه یا ستون، مجاور عناصر گروه اول (عناصر قلیایی) هست. تمامی عناصر این گروه فلز بوده (شش عنصر فلزی) و قرارگیری آنها در یک گروه، حاکی از ویژگیهایی مشترک است که در ادامه به آن میپردازیم.
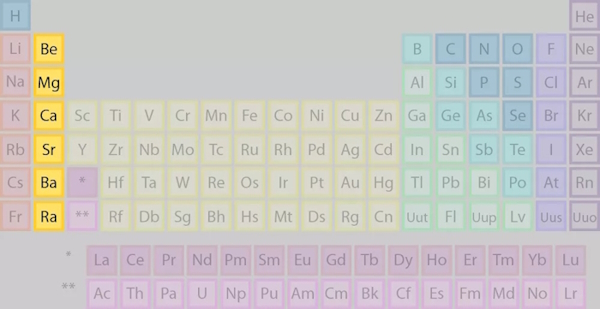
نامگذاری عناصر گروه دوم جدول تناوبی
همانطور که اشاره شد، این گروه، شامل شش عنصر فلزی است که با نام «فلزات قلیایی خاکی» نیز شناخته میشود و مانند تمامی عناصر کشف شده، هریک دارای نماد شیمیایی ویژه خود بهقرار جدول زیر است.
| نام عنصر | نام عنصر در زبان اصلی | نماد شیمیایی |
| بریلیم | Beryllium | Be |
| منیزیم | Magnesium | Mg |
| کلسیم | Calcium | Ca |
| استرانسیم | Strontium | Sr |
| باریم | Barium | Ba |
| رادیوم | Radium | Ra |
- با توجه به جدول بالا متوجه میشویم که به غیر از دو عنصر منیزیم و استرانسیم، نماد شیمیایی چهار عنصر دیگر (بریلیم، کلسیم، باریم و رادیوم)، ترکیبی از دو حرف اول نام آنها، هم در تلفظ فارسی و هم در تلفظ انگلیسی است.
تصویرسازی ذهنی برای یادگیری سادهتر ترتیب عناصر
برای سهولت در بهخاطر سپردن این عناصر، میتوانیم از متصل کردن ابتدای نام هرکدام بههم استفاده کنیم و به علامت اختصاری «بِمَک ابر!» (برگرفته از ابتدای نام عناصر بریلیم، منیزیم، کلسیم، استرانسیم، باریم و رادیوم) برسیم که میتواند تداعی کننده تصویر «ابری اسفنجی یا باب اسفنجی که بهش دستور جذب یا مکش مایعات را میدهیم» باشد.
- بهموقعیت عناصر بریلیم و باریم که هر دو با حرف یکسانی آغاز میشود، دقت بیشتری داشته باشیم.

مثال بالا تنها نمونهای از کد کردن یا تصویرسازی ذهنی از محتوا است که نیاز به حفظ کردن دارد. بهتر است تصاویر و تداعیها توسط خود ما ایجاد و در جایی مختصرا نوشته یا به آن اشاره شود. بدیهی است وقتی در تمرینها و تکرارها، این کدها نیز بهطور اجمالی مرور شود، باعث همافزایی در حفظ و تثبیت آنها خواهد شد.
به خاطر داشته باشیم، در کنار یادگیری کار با جدول تناوبی، داشتن دید کلی از موقعیتهای بهویژه عناصر مهم آن، باعث ارتقای قدرت تحلیل و عمق دانش ما خواهد شد.
چرا نام فلزات گروه دوم، فلزات قلیایی خاکی است؟
اشاره شد که ازجمله نامهای متداول عناصر این گروه، (عناصر قلیایی خاکی) برگرفته از ترجمه عبارت (Alkaline Earth Elements)، است. حال اینکه چرا عناصر این گروه را با این عنوان میشناسیم، میتواند محل سوال باشد که در ادامه به آن پاسخ میدهیم.
بررسی واژه «قلیایی» در نامگذاری این گروه
واژه «قلیایی» در نامگذاری این عناصر، برای ترجمه واژه «Alkaline»، بهمعنای «قلیایی» بهکار میرود. اینکه چرا در نامگذاری آنها به قلیایی بودن اشاره میشود، به این علت است که در زمان واکنش این فلزات با آب، هیدروکسید تشکیل میشود که در طبیعت ماهیت قلیایی (بازی) دارد (). از اینرو در نامگذاری این گروه، از واژه قلیایی استفاده میشود.
میتوانیم معادله کلی زیر را برای واکنش فلزات قلیایی خاکی با آب و تشکیل هیدروکسید در نظر داشته باشیم.

بررسی واژه «خاکی» در نامگذاری این گروه
واژه «خاکی» در نامگذاری این عناصر را برای ترجمه واژه «Earth» بهمعنای «زمین» استفاده میکنیم. به این علت که این فلزات را اکثرا از پوسته زمین و در فرم اکسیدی خود بهدست میآوریم. (این کانیهای اکسیدی در برابر حرارت نیز پایدارند).
از اینرو فلزات دارای دو معیار زیر، به عنوان فلزات قلیایی خاکی در نظر گرفته میشود.
- در واکنش با آب، تشکیل هیدروکسیدهای با ماهیت قلیایی (Alkaline) میدهند.
- کانیهای اکسیدی آنها بیشتر در پوسته زمین (Earth) یافت میشود -خاکی- و در برابر حرارت پایدار است.
یادآوری: تمامی عناصر قرار گرفته در گروه دوم جدول تناوبی را فلزات تشکیل میدهند. از اینرو گاهی بهجای واژههای عنصر در عباراتی مثل «عناصر گروه دوم» یا «عناصر قلیایی خاکی»، واژه «فلز» جایگزین میشود مانند: «فلزات گروه دوم»، «فلزات قلیایی خاکی» و... .
یک استثنا
دنیای شیمی استثناهایی در قواعد خود دارد که در اینجا نیز با یکی از این استثناها مواجه هستیم و آن عنصر بریلیم (Be) است. بریلیم تنها عنصر گروه دوم جدول تناوبی است که با آب واکنش نداده و تشکیل محلول قلیایی نمیدهد، به دو علت:
- اندازه اتمی کوچک
- انرژی یونش (یونیزاسیون) بالا
در قسمتهای بعدی مطلب، با پرداختن به شعاع اتمی و انرژی یونش، رفتار بریلیم را از این دو بعد بیشتر مورد تحلیل قرار میدهیم.
برای درک بهتر، موارد بالا را در قالب چند مثال بررسی میکنیم.
بررسی عنصر منیزیم بهعنوان فلز قلیایی خاکی
واکنش فلز منیزیم با آب را در نظر میگیریم:
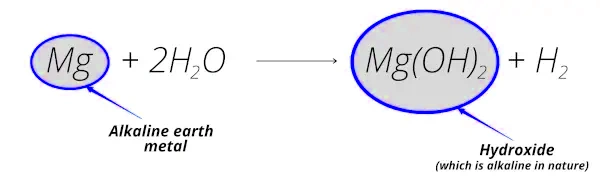
اشاره شد که فلزات قلیایی خاکی در واکنش با آب تشکیل هیدروکسیدهایی با رفتار قلیایی میدهند. همانطور که در واکنش بالا نیز میبینیم:
- وقتی منیزیم با آب وارد واکنش میشود، تشکیل هیدروکسید منیزیم () میدهد که رفتار قلیایی دارد.
- علاوه بر این، «عنصر منیزیم» از «کانی منیزیت» بهدست میآید که به طور معمول در پوسته زمین یافت میشود (خاکی).

بنابراین «فلز منیزیم» بهعنوان «فلز قلیایی خاکی» شناخته میشود.
بررسی عنصر کلیسیم بهعنوان فلز قلیایی خاکی
واکنش فلز کلیسیم با آب را در نظر میگیریم:
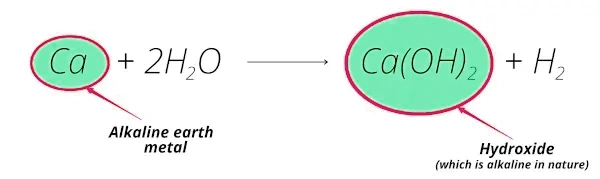
در این واکنش نیز میبینیم که:
- واکنش کلیسیم با آب، تشکیل هیدروکسید کلسیم () میدهد که ماهیت قلیایی دارد.
- «عنصر کلیسیم» از کانیهایی مثل «سنگ آهک»، «سنگ گچ»، «کلسیت»، و... بهدست میآید که بیشتر در پوسته زمین یافت میشوند (خاکی).

بنابراین «فلز کلیسیم»، بهعنوان «فلز قلیایی خاکی» شناخته میشود.
بررسی عنصر استرانسیم بهعنوان فلز قلیایی خاکی
واکنش فلز استرانسیم با آب را در نظر میگیریم:
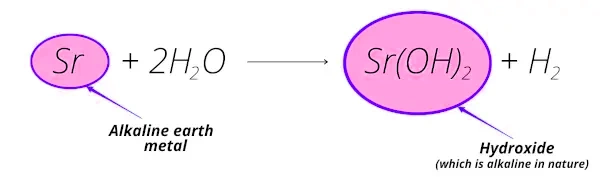
- واکنش استرانسیم با آب، تشکیل هیدروکسید استرانسیم () میدهد که ماهیت قلیایی دارد.
- «عنصر استرانسیم» از کانیهایی مانند «سلستیت»، «استرونتیانیت» بهدست میآید که بیشتر در پوسته زمین یافت میشوند (خاکی).

بنابراین «فلز استرانسیم» بهعنوان «فلز قلیایی خاکی» شناخته میشود.
بررسی عنصر باریم بهعنوان فلز قلیایی خاکی
واکنش فلز باریم با آب را در نظر میگیریم:
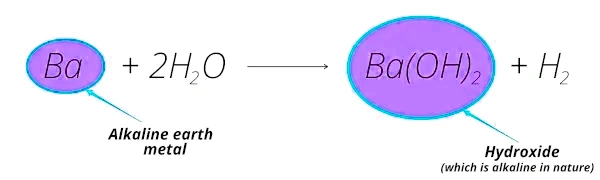
- واکنش باریم با آب، تشکیل هیدروکسید باریم () میدهد که ماهیت قلیایی دارد.
- «عنصر باریم» از کانیهایی مثل «باریت»، «ویتریت» و... بهدست میآید که بیشتر در پوسته زمین یافت میشوند (خاکی).

بنابراین «فلز باریم» نیز بهعنوان «فلز قلیایی خاکی» شناخته میشود.
خواص فیزیکی مشابه در عناصر گروه دوم جدول تناوبی
عناصر قرار گرفته در این گروه، دارای شباهتهایی در برخی خواص فیزیکی خود هستند که به برخی از آنها اشاره میشود.
- بهرنگ سفید نقرهای براق
- فلزاتی نرم، چکشخوار با سختیهای متنوع
- نقاط ذوب و جوش نسبتا پایین (بالاتر از فلزات قلیایی و پایینتر از فلزات واسطه)
- چگالی نسبتا کم

نمونههایی از فلزات گروه دوم و شباهتهای سطح ظاهری آنها بهلحاظ رنگ
نکاتی در ارتباط با خواص فیزیکی عناصر گروه دوم نسبت به گروه اول:
- تغییرات در خواص فیزیکی این گروه، به اندازه گروه اول (فلزات قلیایی)، منظم نیست، بهعنوان مثال نقاط ذوب و جوش منظمی ندارد. علت این است که عناصر گروه دوم با شبکه بلوری یکسان متبلور نمیشوند.
- با وجود اینکه در حالت کلی عناصر گروه دوم نقطه ذوب و نقطه جوش پایینی دارند، ولی نقاط ذوب و جوش آنها در مقایسه با فلزات گروه اول بالاتر است که علت آن مربوط به بیشتر بودن تعداد الکترونهای پیوندی است.
خواص شیمیایی مشابه در عناصر گروه دوم جدول تناوبی
موارد زیر را میتوانیم بهعنوان برخی خواص شیمیایی مشابه و مشترک در عناصر این گروه در نظر داشته باشیم.
- واکنشپذیری بالا (واکنشپذیری کمتر نسبت به فلزات قلیایی و بیشتر نسبت به فلزات واسطه)
- دارای دو الکترون در لایه ظرفیت

علت خواص فیزیکی و شیمیایی مشابه در عناصر این گروه، شباهت بالای ساختار الکترونی آنهاست که ادامه مطلب در همین راستا است.
ساختار اتمی و آرایش الکترونی عناصر گروه دوم جدول تناوبی
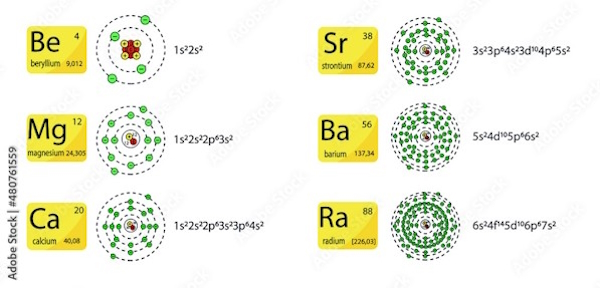
در جداول و تصویر زیر، به اعداد اتمی، ساختارها و آرایش الکترونی این عناصر و ارتباط آنها با یکدیگر میپردازیم.
عدد اتمی و تعداد الکترونها در اوربیتالها
در ستون وسط جدول زیر، عدد اتمی مربوط به هر عنصر آورده شده است. ستون سمت چپ، نحوه چیدمان الکترونها در لایههای اتمی را نمایش میدهد. با اندکی دقت در این دو ستون، میتوانیم به ارتباط بین این دو ستون پی ببریم. اما علت این ارتباط چیست؟ و آیا همواره عدد اتمی برابر با مجموع الکترونهای آن اتم خواهد بود؟
| عنصر | عدد اتمی | ترکیب تعداد الکترونها در اوربیتالها |
برای پاسخ به سوال بالا (شرایط برابر بودن عدد اتمی با تعداد الکترونها)، لازم است نگاهی گذرا به مبحث عدد اتمی داشته باشیم. طبق تعریف، عدد اتمی یا عدد پروتون برای یک عنصر شیمیایی، برابر تعداد پروتونهای هسته هر اتمِ آن عنصر است. حال در چه حالتی تعداد پروتونها (عدد اتمی در ستون وسط) با تعداد الکترونها (ستون سمت چپ) برابر خواهد بود؟ در پاسخ میگوییم که این حالت صرفا در مورد اتم خنثی و نه یون، مانند اتمهای مورد بحث، صدق میکند. پس مطابق آنچه صحبت شد، در یک اتم خنثی (اتم در تعادل، اتم بدون بار، اتم بدون دریافتی یا خروجی الکترون)، عدد اتمی برابر با تعداد الکترونهای آن اتم نیز خواهد بود.
آرایش الکترونی ساده و فشرده عناصر گروه دوم جدول تناوبی
توجه به آرایشهای الکترونی و آرایش الکترونی فشرده این عناصر نشان میدهد که در هر عنصر، اتم خنثی بعد از آرایش الکترونی گاز خنثی (گاز نجیب)، دارای دو الکترون مازاد است. این دو الکترون در اوربیتال s لایه والانس که لایه تکمیلکننده است قرار میگیرند. یعنی آرایش الکترونی لایه بیرونی هریک از عناصر بهفرم است که n تعداد لایههای الکترونی ظرفیت در هرکدام را نشان میدهد.
| عنصر | آرایش الکترونی | آرایش الکترونی فشرده |
با ارزیابی جدول بالا، میتوانیم به نکاتی پی ببریم ازجمله:
- ساختار الکترونی تمامی عناصر گروه دوم جدول تناوبی همواره به ختم میشود.
- در ستون مربوط به آرایش الکترونی فشرده که آرایش الکترونی عناصر مبتنی بر گازهای خنثی یا همان گازهای نجیب (Rn و He، Ne، Ar، Kr، Xe) را میبینیم، روش کار بدینصورت است که از آرایش الکترونی گاز خنثی فاکتور گرفته، سپس آرایش الکترونی باقیمانده را پیشروی آن مینویسیم، به همین سادگی. بهعنوان مثال اگر ساختار الکترونی گاز هلیم را در نظر بگیریم، ، در بازنویسی ساختار الکترونی بریلیم () بهفرم فشرده، از ساختار گاز هلیم فاکتور میگیریم، و آنچه را که باقی میماند کنار آن مینویسیم. پس ساختار الکترونی فشرده بریلیم، بهفرم است و بههمین ترتیب برای سایر عناصر.
- نکته: آنچه خارج گاز خنثی میبینیم، آرایش الکترونی لایه ظرفیت است. یعنی آرایش الکترونی لایه ظرفیت بریلیم بهفرم ، استرانسیم بهفرم است و بههمین ترتیب.
نمایش تصویری ساختارهای اتمی عناصر گروه دوم جدول تناوبی
هدف این قسمت نمایش ساختار لایههای الکترونی اتم هر یک از عناصر مورد بحث است. مشاهده میکنیم که در لایه آخر هر کدام، دو عدد الکترون قرار دارد. بهعبارتی تعداد الکترونهای ظرفیت در هریک دو است.
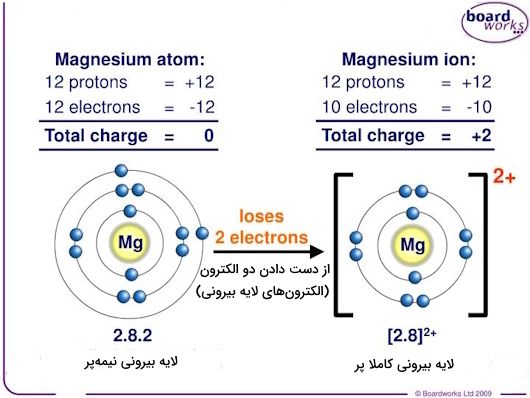
تشکیل نمکهای یونی
در واکنشهای فلزات گروه دوم، دو الکترون خارجی واقع در اوربیتال s، بهسادگی حذف شده و به ساختار الکترونی گاز نجیب میرسیم. حذف این دو الکترون بهمعنی تشکیل ترکیبات با دو بار مثبت، یعنی نمکهای یونی توسط اکثر - و نه همه - این عناصر است که در تصویر زیر این فرآیند را در قالب مثالی برای عنصر منیزیم میبینیم.
نکته: و باز استثنا در این قاعده، عنصر بریلیم است که تشکیل «مولکولهای کووالانسی» و نه «ترکیبات یونی» را میدهد. علت این امر در روند تغییرات الکترونگاتیوی این عناصر است که در ادامه به آن میپردازیم.
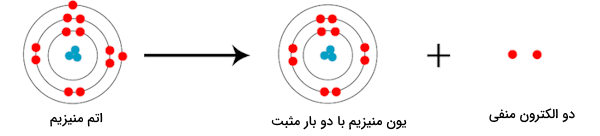
فرآیند بالا را در قالب تصویر پایین نیز میتوانیم شبیهسازی کنیم. در تصویر سمت چپ، فلز منیزیم را میبینیم که با از دست دادن دو الکترون، به یون منیزیم (تصویر سمت راست)، تبدیل میشود.
مقایسه فلزات قلیایی و قلیایی خاکی
فلزات قلیایی و قلیایی خاکی بهعنوان دو گروه مهم جدول تناوبی مجاور عناصر فلزی، از جنبههای متعدد دارای شباهتها و نیز تفاوتهایی هستند که در این قسمت به برخی از آنها میپردازیم.
شباهت فلزات قلیایی و قلیایی خاکی
در تصویر زیر که دستهبندی عناصر جدول تناوبی را نشان میدهد، میبینیم که عناصر قلیایی و قلیایی خاکی، هر دو در عناصر دسته s طبقهبندی میشود. این طبقهبندی بهاین علت است که الکترون بیرونی در عناصر هر دوی این گروهها، در زیرلایه s آنها قرار دارد.
در صحبت از شباهتهای بین عناصر قلیایی و قلیایی خاکی، میتوانیم به موارد زیر اشاره داشته باشیم.
هر دو گروه از عناصر قلیایی و قلیایی خاکی شرایط زیر را داریم:
- در طبیعت، در حالت ترکیبی یافت میشوند و نه در حالت آزاد.
- در مجاورت رطوبت، بهرنگ کدر درمیآیند.
- از طریق فرآیند الکترولیز، از کلریدهای ذوب شده خود بهدست میآیند.
- تشکیل محلولهای قلیایی از هیدروکسیدهای خود را میدهند.
- بهرنگ سفید نقرهای هستند.
- فلزاتی نرم هستند.
- در طبیعت بهعنوان کاهنده (عامل کاهش) عمل میکنند.
- الکتروپوزیتیو هستند (تمایل به از دست دادن الکترون دارند).
- همه آنها با هیدروژن ترکیب میشوند.
- اکسیدهای آنها بهرنگ سفید است.
- در حرارتدهی بدون تغییر میمانند.
- در واکنش با آب، تشکیل هیدروکسید میدهند.
تفاوت فلزات قلیایی و قلیایی خاکی
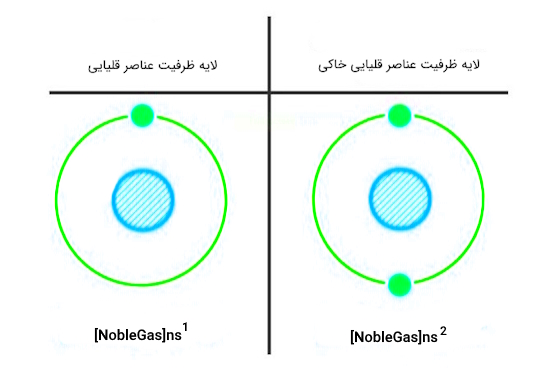
با اینکه هر دو گروه فلزات قلیایی و قلیایی خاکی، جزو فلزات دسته s طبقهبندی میشود، دارای تفاوتهایی نیز هستند که به برخی از آنها اشاره میشود. لازم به یادآوری است که اساسیترین تفاوت بین فلزات قلیایی و فلزات قلیایی خاکی، تعداد الکترونهای لایه بیرونی آنها است.
فلزات قلیایی، در لایه ظرفیت خود، دارای یک الکترون هستند. در حالیکه فلزات قلیایی خاکی، دارای دو الکترون در این لایه هستند. این تفاوت، منشا اصلی سایر تفاوتها در ویژگیهای مختلف این عناصر است.
| فلزات قلیایی (گروه IA) | فلزات قلیایی خاکی (گروه IIA) |
| دارای یک الکترون ظرفیت | دارای دو الکترون ظرفیت |
| نرم - نرمتر از فلزات قلیایی خاکی | نسبت به فلزات قلیایی کمی سختتر (در کل نرم) |
| فقط دارای حالت اکسیداسیون ۱+ | فقط دارای حالت اکسیداسیون ۲+ |
| دارای ساختار الکترونی | دارای ساختار الکترونی |
| دارای انرژی یونش پایینتر | دارای انرژی یونش بالاتر (نسبت به فلزات قلیایی) |
| واکنشپذیری بالاتر | واکنشپذیری کمتر |
| دارای نقطه ذوب پایین | دارای نقطه ذوب بالا |
| دارای وزن مخصوص پایین و سبکتر از آب | دارای وزن مخصوص پایین ولی سنگینتر از آب |
| بهجز لیتیم، هیچیک با نیتروژن ترکیب نمیشوند. | همگی با نیتروژن ترکیب و تشکیل نیتریدهای مربوطه را میدهند. |
| تجزیه در آب با انرژی بالاتر | تجزیه در آب با انرژی پایینتر (نسبت به فلزات قلیایی) |
| واکنش با آمونیا و تشکیل آمیدها | واکنش با آمونیا در دمای پایین و تشکیل هگزامینها |
| سولفات تمامی فلزات آنها در آب محلول است. | سولفات فلزات آنها به جز Be و Mg، در آب نامحلول است. |
| در دمای اتاق، بیکربناتهای آنها در حالت جامد است. | در دمای اتاق، بیکربناتهای آنها در حالت محلول است. |
| دارای اکسیدهای بسیار بازی | دارای اکسیدهای بهنسبت کمتر بازی |
| الکتروپوزیتیوی بالاتر | الکتروپوزیتیوی کمتر |
| سولفاتهای آنها با سولفاتهای فلزی سهظرفیتی تشکیل آلوم میدهد. | سولفاتهای آنها تشکیل آلوم نمیدهد. |
| فلزات قلیایی (بهجز Li)، ترکیبات پیچیده تشکیل نمیدهند. | فلزات قلیایی خاکی، ترکیبات پیچیده تشکیل میدهد. |
همانطور که تاکید شد، یکی از عمدهترین تفاوتهای عناصر این دو گروه با یکدیگر، ساختار لایه ظرفیت آنها است که میتوانیم بهصورت تصویر زیر بهآن اشاره کنیم.
ویژگی های عناصر گروه دوم بر اساس روند های تناوبی
قانون تناوبی یا دورهای، عبارت است از تغییراتی که در خواص اتمهای جدول تناوبی، در طول گروهها و دورهها، بهطور متناوب مشاهده میشود. این الگوها، به تغییراتی در ساختار اتمی، اندازه اتمی و خواص عناصر اشاره دارد. روند عمومی این تغییرات در دورهها از چپ به راست و در گروهها از بالا به پایین بررسی میشود. چون در این مقاله موضوع بحث ما به یک گروه مشخص از اتمها اشاره دارد، از اینرو، این روال را صرفا در گروهها مورد بررسی قرار میدهیم.
حال به بررسی چند مورد از مهمترین شاخصها در روندهای دورهای میپردازیم.
بررسی روند تغییرات شعاعهای اتمی و شعاع یونی در عناصر گروه دوم جدول تناوبی
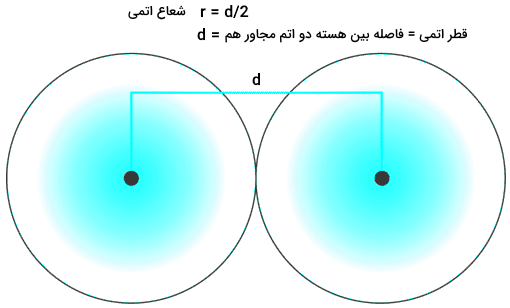
در ابتدا میخواهیم نگاهی به تعریف شعاع اتمی و سپس شعاع یونی داشته باشیم و در مرحله بعدی وارد روال تغییرات آنها در گروهها شویم. شعاع اتمی را بهصورت نصف فاصله بین هستههای دو اتمِ در تماس با یکدیگر تعریف میکنیم.
عوامل تعیین کننده در شعاع اتمی عبارتاند از:
- تعداد لایههای الکترونی اطراف هسته
- نیروی کششی که از طرف هسته به الکترونهای بیرونی وارد میشود.
شعاع یونی نصف فاصله بین دو یون است که در یک ترکیب به سختی با یکدیگر در تماس قرار گرفتهاند.
نکته: شعاع اتمی و شعاع یونی روند یکسانی را در جدول تناوبی طی میکنند.
روند تغییرات شعاع اتمی و یونی در گروهها
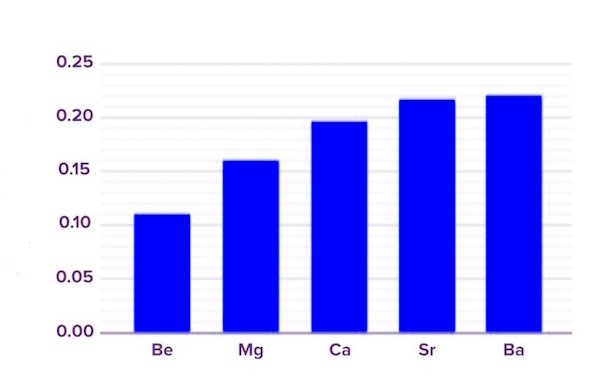
شعاع اتمی در جدول تناوبی در یک گروه از بالا به پایین افزایش مییابد. در قسمت بالا متوجه شدیم که عامل تاثیرگذار بر اندازه اتمی، تعداد لایههای الکترونهای داخلی اتم است. پس هر چه لایههای الکترونی بیشتری در اطراف اتم داشته باشیم، این لایهها فضای بیشتری را به خود اختصاص خواهند داد. (الکترونها یکدیگر را دفع میکنند و با فاصله از هم قرار میگیرند) که این بهمعنی بزرگتر شدن اندازه اتمها است.
حال با لحاظ اینکه تعداد الکترونهای داخلی در یک گروه از بالا به پایین افزایش مییابد، پس به دنبال آن اندازه یا شعاع اتمها نیز افزایش پیدا میکند. یعنی با حرکت از بالا به پایین در گروههای جدول، هر عنصر نسبت به عنصر قبلی خود، دارای الکترونهای بیشتر، لایههای الکترونی بالاتر و در نتیجه شعاع اتمی بالاتری است. پس شعاع اتمی در یک گروه از بالا به پایین افزایش (از پایین به بالا کاهش) مییابد.
بررسی مقایسهای شعاع اتمی منیزیم و کلسیم
اگر بخواهیم نگاه مقایسهای بین دو عنصر داشته باشیم، منیزیم (عنصر واقع در سطر دوم از گروه دوم جدول تناوبی)، دارای ۱۲ الکترون است که در سه لایه الکترونی قرار گرفتهاند. عنصر بعد از منیزیم در گروه دوم، یعنی کلسیم، دارای ۲۰ الکترون واقع در چهار لایه الکترونی است که مشاهده میشود شعاع اتمی بالاتری نیز دارد. یعنی با افزایش عدد اتمی، الکترونهای لایه خارجی در فاصله دورتری از هسته قرار گرفته و شعاع اتمی افزایش مییابد که این موضوع در تصویر هم نشان داده میشود.
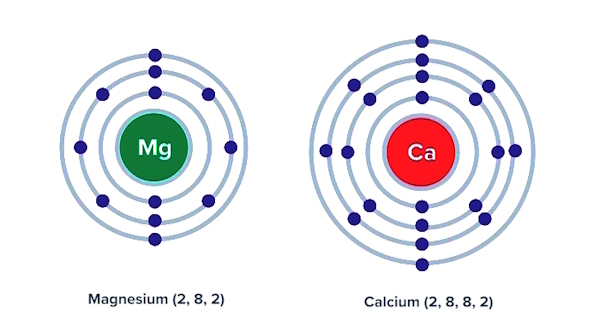
توجه: در بررسی روندها، به واژههای (بالا و پایین) و (افزایش یا کاهش) و ارتباط آنها با یکدیگر توجه شود.
بررسی روند تغییرات الکترونگاتیوی در عناصر گروه دوم جدول تناوبی
الکترونگاتیوی، بهعنوان معیاری از توانایی اتم برای جذب «جفتالکترون پیوندی» تعریف میشود. به این معنی که الکترونگاتیوی بالاتر، نشانی از قدرت بالاتر اتم در جذب الکترون است و بالعکس. این معیار معمولا توسط معیار پاولینگ «Pauling Scale» سنجیده میشود. به این صورتکه عنصر فلوئور (F)، بهعنوان الکترونگاتیوترین عنصر، با الکترونگاتیوی ۴ لحاظ شده و الکترونگاتیوی سایر عناصر متناسب با آن ارزیابی میشود.
نکته: بهطور کلی تمامی عناصر گروه دوم جدول تناوبی، دارای الکترونگاتیوی پایینی هستند.
روند تغییرات الکترونگاتیوی در گروهها
الکترونگاتیوی در یک گروه از بالا به پایین کاهش مییابد. یعنی قدرت اتم در جذب جفتالکترونهای پیوندی کمتر و کمتر میشود. همانطور که در قسمت قبل بررسی کردیم، اندازه اتمها در یک گروه (از بالا به پایین) افزایش پیدا میکند. به دنبال آن و بهواسطه فاصله ایجاد شده بین هسته و الکترونهای ظرفیت، جاذبه الکترواستاتیکی بین آنها کاهش مییابد که باعث سختتر شدن جذب الکترونها توسط اتم و در نهایت کاهش الکترونگاتیوی میشود. بنابراین در یک گروه، الکترونگاتیوی از بالا به پایین کاهش (یا به تعبیری از پایین به بالا افزایش) پیدا میکند.
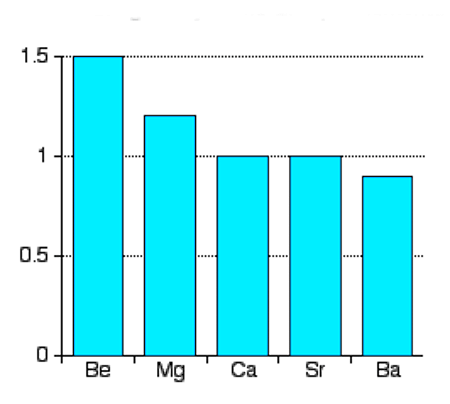
بررسی روند تغییرات انرژی یونش در عناصر گروه دوم جدول تناوبی
انرژی یونش (Ionisation Energy) را بهصورت حداقل انرژی لازم برای جداسازی (حذف) الکترون آزاد (الکترون با پیوند سست) از یک اتم یا مولکول در حالت گازی تعریف میکنیم. یعنی معیاری برای ظرفیت الکتروندهی یک اتم در طی واکنش شیمیایی.
از نقطهنظر دیگری نیز میتوان عنوان کرد که الکترون یک اتم پایدار، بهتنهایی نمیتواند از مدار خارج شود و برای این کار نیاز به مقداری انرژی خارجی دارد که به این انرژی، انرژی یونش گفته میشود.
نکته: انرژی یونش، نقطه مقابل میل ترکیبی الکترون یا الکترونخواهی (Electron Affinity) است.
انرژی یونش اول (نخستین انرژی یونش)
از آن جا که در فرایند توصیف شده در تعریف انرژی یونش، تنها یک الکترون حذف میشود، آن را تحت عنوان انرژی یونش اول، (First Ionisation Energy) میشناسیم. پس اگر به شماره انرژی یونش اشاره نشد، انرژی یونش اول مد نظر است.
در این فرایند هر اتم، تشکیل یک کاتیون با یک بار مثبت میدهد. معادله کلی زیر را میتوانیم بهعنوان واکنش شیمیایی برای نخستین انرژی یونش در نظر بگیریم.
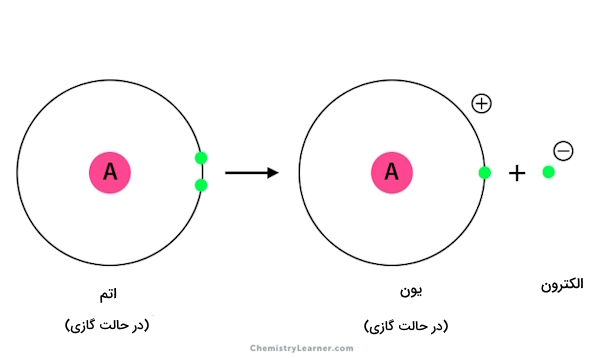
نکته: تمامی عناصر جدول تناوبی دارای انرژی یونش هستند. برای عناصری که از دست دادن الکترون در آنها سادهتر است، مقدار انرژی یونش پایینتر و در مقابل برای عناصری که بهسختی الکترونهای خود را از دست میدهند، مقدار بالاتری دارد.
موارد بالا را در قالب مثالی از عناصر گروه دوم بررسی میکنیم. برای این منظور، عنصر منیزیم را در نظر میگیریم. مطابق موارد گفته شده، انرژی یونش اول برای این عنصر بهصورت زیر تعریف میشود.
روند تغییرات انرژی یونش اول در گروهها
انرژی یونش اول، در یک گروه از بالا به پایین کاهش مییابد. با حرکت به سمت پایین گروه، شعاع اتمی بهسرعت افزایش و الکترونهای ظرفیت از هسته دورتر میشوند. علاوه بر این، از آنجاییکه الکترونهای داخلی از هسته در برابر نیروی الکترونهای بیرونی محافظت میکند و بار موثر هستهای (Zeff) را کاهش میدهند (الکترونهای داخلی بهعنوان سپری در برابر اعمال قدرت هسته بر الکترونهای ظرفیت عمل میکنند)، بنابراین با افزایش شعاع اتمی و تعداد الکترونهای داخلی، الکترونهای ظرفیت، جاذبه الکترواستاتیکی ضعیفتری را تجربه کرده و جدا شدن آنها از مدارشان و در کل اتم سادهتر شده و انرژی یونش کاهش پیدا میکند. بنابراین انرژی یونش در یک گروه، از بالا به پایین کاهش مییابد.
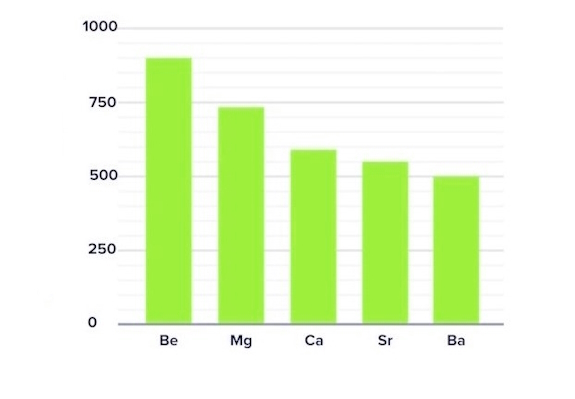
عوامل موثر بر انرژی یونش
با توجه به موارد بررسی شده، میتوان گفت عوامل موثر بر انرژی یونش عبارتند از:
- اندازه اتم
- بار هستهای
- اثر پوششی الکترونها
انرژی یونش دوم (دومین انرژی یونش)
تا اینجا در مورد انرژی یونش اول یا نخستین انرژی یونش صحبت کردیم که در آنها تنها یک الکترون از اتم حذف میشد. علاوه بر انرژی یونش اول، انرژیهای یونش در درجات بالاتر هم وجود دارد. یعنی انرژی یونش دوم، سوم و ... . در اینجا قصد داریم نگاهی به آنها داشته باشیم.
انرژی یونش دوم یا دومین انرژی یونش را بهصورت انرژی لازم برای حذف یک الکترون از کاتیون تکظرفیتی (Monovalent Cation) در حالت گازی آن تعریف میکنیم که میتوانیم معادله زیر را برای آن در نظر بگیریم.
- مانند انرژی یونش اول، انرژی یونش دوم نیز تحت تاثیر عوامل، اندازه اتم، بار هستهای و اثر پوششی الکترون قرار دارد.
- در انرژی یونش اول، الکترون از اتم و در انرژی یونش دوم، از یون جدا میشود.
انرژیهای یونش بالاتر
در ادامه مواردی که برای انرژی یونش اول و دوم صحبت کردیم، بهترتیب مقدار انرژی لازم برای حذف یک الکترون از کاتیون دوظرفیتی (Divalent Cation) در حالت گازی آن را، تحت عنوان انرژی یونش سوم یا سومین انرژی یونش تعریف میکنیم.
معادله شیمیایی کلی برای انرژی یونش سوم را نیز میتوانیم بهحالت زیر در نظر بگیریم.
و بههمین ترتیب برای انرژیهای یونش بالاتر.
چرا انرژی یونش دوم بالاتر از انرژی یونش اول است؟
دلیل این امر را میتوانیم اینگونه بیان کنیم که یک کاتیون، انرژی کمتری نسبت به اتم خود دارد (یادآوری اینکه در انرژی یونش دوم با کاتیون و در انرژی یونش اول با اتم سر و کار داریم). بنابراین دافعه بین الکترونی در کاتیون که الکترون خود را از دست داده است، و شعاع کمتری از اتم دارد، کمتر بوده و الکترونها توسط هسته، محکمتر نگه داشته میشوند. در نتیجه کاتیون به انرژی بالاتری برای یونش نیاز خواهد داشت.
در حالت کلی میتوانیم بگوییم:
انرژی یونش n ام، از انرژی یونش (n-۱) ام بزرگتر است.
نمایش شماتیکی انرژی یونش اول و دوم و مقادیر هریک برای عنصر منیزیم در تصویر زیر آورده شده است. میبینیم که انرژی یونش دوم، مقادیر بالاتری را نسبت به انرژی یونش اول به خود اختصاص داده است.
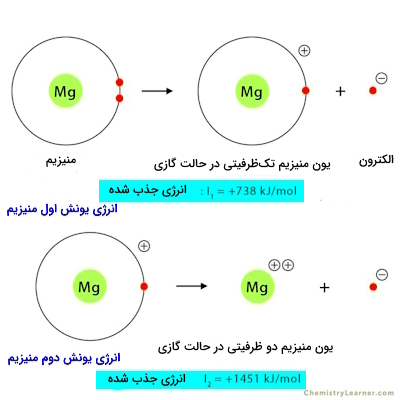
بررسی علت عدم واکنشپذیری بریلیم با آب بهعنوان یک استثنا
حال که با مفاهیم شعاع اتمی و انرژی یونش و روال تغییرات آنها در عناصر گروه دوم جدول تناوبی آشنا شدیم، میخواهیم علت عدم واکنشپذیری بریلیم با آب را که در قسمت قبل بهعنوان یک استثنا به آن اشاره و علت آن دو عامل شعاع اتمی کوچک و انرژی یونش بالا عنوان شد، مورد بررسی قرار بدهیم و ببینیم چرا این عوامل باعث عدم واکنش بریلیم با آب میشود.
بررسی عامل شعاع اتمی
از عامل اول یعنی شعاع اتمی شروع میکنیم. همانطور که دیدیم، بریلیم دارای کمترین شعاع اتمی و در نتیجه کوچکترین اندازه اتمی است. شعاع اتمی کوچک باعث میشود الکترونهای لایه بیرونی آن به هسته نزدیکتر بوده و با شدت بیشتری از سوی هسته جذب شوند (هسته احاطه بسیار بالاتری بر الکترونهای ظرفیت در بریلیم دارد و به سادگی اجازه خروج آنها را نمیدهد). این جاذبه بالا بین هسته و الکترونهای لایه بیرونی، باعث میشود اتمهای بریلیم در طی واکنش شیمیایی الکترونهای لایه بیرونی خود را به سادگی از دست ندهند و وارد واکنش نشود. در نتیجه بریلیم با آب واکنش نمیدهد.
بررسی عامل انرژی یونش
با توجه به اینکه بریلیم دارای انرژی یونش بالایی است. یعنی انرژی بسیار بالایی برای حذف الکترونهای آن مورد نیاز است و این امر از دست دادن الکترونهای ظرفیت را در آن دشوار میکند که در نتیجه آن، بریلیم با آب وارد واکنش نمیشود.
روند تغییرات نقطه ذوب عناصر گروه دوم جدول تناوبی
جامد بودن این فلزات (حالت پایدار تمامی فلزات به جز جیوه جامد است)، باعث تشکیل شبکههای فلزی توسط آنها میشود که در آن کاتیونهای فلزی مثبت توسط دریایی از الکترونهای منفی احاطه شدهاند که نمونهای از آن برای فلز کلسیم در تصویر نشان داده میشود. شبکههای فلزی توصیف شده، بهوسیله نیروی جاذبه الکترواستاتیکی قوی بین بارهای منفی الکترونها و هسته کاتیونهای مثبت کنار یکدیگر نگاه داشته میشوند. از آنجایی که شعاع اتمی با حرکت به سمت پایین گروه افزایش مییابد، در نتیجه فاصله بین هستهها و الکترونهای غیر مستقر که متعلق به هیچ اتم خاصی نیست (Delocalized) افزایش مییابد که به دنبال آن جاذبه الکترواستاتیکی ضعیفتر شده و انرژی کمتری برای غلبه بر آن و ذوب جامد، مورد نیاز خواهد بود و این یعنی پایین آمدن نقطه ذوب آنها.

روند تغییرات نقطه ذوب در گروهها
بهطور کلی مطابق آنچه بیان شد، نقطه ذوب عناصر در یک گروه در جدول تناوبی، از بالا به پایین کاهش مییابد. در مورد گروه دوم جدول تناوبی نیز به غیر از تغییر روال توسط عنصر منیزیم، نقطه ذوب با پایین آمدن در گروه کاهش مییابد.
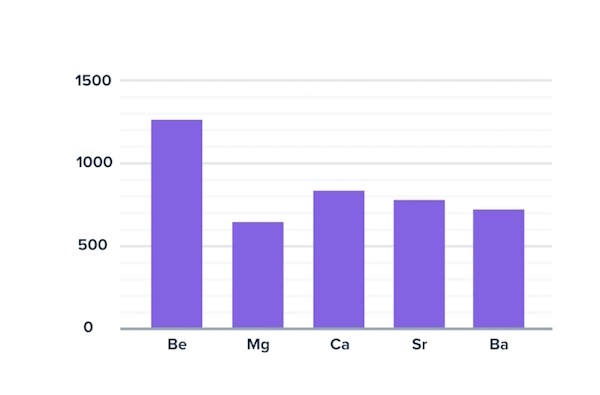
همانطور که در نمودار بالا نیز نمایان است، نقطه ذوب منیزیم از روال کلی عناصر گروه دوم جدول تناوبی تبعیت نمیکند که متاسفانه توضیح سادهای برای آن در دسترس نیست. همانطور که نقطه جوش این عناصر نیز روال مشخصی را نشان نمیدهد.
کاربردهای فلزات گروه دوم جدول تناوبی
اکثر عناصر قلیایی خاکی دارای طیف کاربردی وسیعی در صنایع مختلف مثل پزشکی، هستهای، فضایی و ... هستند که به مواردی از آنها اشاره میشود. ولی قبل از پرداختن به مقوله کاربرد، اشاره مختصری به کاشفان این عناصر، دانشمندانی که حق بزرگی بر گردن علم و بهدنبال آن بشریت نهادهاند میاندازیم. لازم است عنوان کنیم، فرآیند کشف و ثبت برخی عناصر توسط چند دانشمند صورت گرفته که اشاره به تمامی آنها در طول فرآیند کشف، خارج از حیطه این بحث است.
بریلیم
عنصر بریلیم، تقریبا در سی گونه معدنی مختلف یافت میشود که مهمترین آنها بریل است. کاشف این عنصر دانشمند فرانسوی آقای «لوئیس نیکلاس واکوئلین» (Louis Nicolas Vauquelin) در سال ۱۷۹۸ است.

- بریلیم بهعنوان نخستین عنصر از عناصر گروه دوم در آلیاژهای مس یا نیکل برای ساخت ژیروسکوپ، فنر، کنتاکتهای الکتریکی، الکترودهای جوش نقطهای و ابزارهای بدون جرقه استفاده میشود. اختلاط بریلیم با این فلزات رسانایی الکتریکی و حرارتی آنها را افزایش میدهد.
- آلیاژهای بریلیم بهعنوان مواد ساختاری در هواپیماهای پرسرعت، موشکها، فضاپیماها و ماهوارههای ارتباطی استفاده میشود.
- بریلیم در برابر اشعه ایکس بهنسبت شفاف است که این ویژگی باعث کاربرد ورق بریلیم بسیار نازک در لیتوگرافی اشعه ایکس میشود.
- در راکتورهای هستهای، بریلیم به عنوان بازتابنده یا تعدیلکننده نوترونها مورد استفاده قرار میگیرد.
- نقطه ذوب بسیار بالای اکسید بریلیم باعث کاربردی بودن آن در صنایع هستهای و همچنین سرامیکی میشود.

آینههای بریلیمی که نمونهای از آن را در تصویر میبینیم، در سازههایی مانند ماهوارهها مورد بهرهبرداری قرار میگیرد که از طرفی نیاز به آینههای بزرگ داریم و از طرف دیگر توانایی تحمل وزنهای بالا قابل توجیه نیست. در این سازهها از ویژگیهای بریلیم ازجمله وزن پایین و پایداری دراز مدت ابعاد استفاده میشود.
نقش بیولوژیکی و هشدارها
از نگاه بیولوژیکی و هشدارهای پیرامون تبعات خطرساز این مواد، میتوانیم به مواردی ازجمله:
- سمی و سرطانزا بودن بریلیم و ترکیبات آن
- التهاب حاد ریه بهنام بریلیوز با استنشاق گرد و غبار یا بخارات آن
منیزیم
منیزیم هشتمین عنصر فراوان در پوسته زمین است. همانطور که در قسمتهای قبل با آن آشنا شدیم، این عنصر بهطور خالص در طبیعت یافت نمیشود و بهصورت ترکیبی در مواد معدنی مثل منیزیت و دولومیت وجود دارد. کاشف این عنصر دانشمند اسکاتلندی آقای «جوزف بلک» (Joseph Black) در سال ۱۷۵۵ است.

در اصل این ماده در ابتدا برای دوچرخههای مسابقهای معرفی شد که اولین وسایل نقلیهای بودند که در آنها از فریمهای منیزیم خالص استفاده میشد و ترکیب بهتری از استحکام و سبکی را نسبت به سایر فلزات ارائه میدادند. (یک قاب فولادی تقریباً پنج برابر سنگینتر از منیزیم است).
- آلیاژ بهدست آمده از فلز منیزیم با چند درصد آلومینیوم، بهاضافه روی و منگنز، باعث بهبود استحکام، مقاومت در برابر خوردگی و کیفیت جوشکاری میشود.
- آلیاژ توصیفی فوق، برای صرفهجویی در انرژی با سبکسازی تجهیزات نیز استفاده میشود.
- بهدلیل سبک وزن بودن این ماده، در محصولاتی که این ویژگی امتیازی مثبت است، مورد استفاده قرار میگیرد. ازجمله صندلیهای اتومبیل و هواپیما، چمدانهای سبکوزن، ماشینهای چمنزنی، ابزارهای برقی، دیسکها و دوربینها. در پایان عمر مفید، منیزیم موجود در تمام این محصولات را میتوان با هزینه بسیار مناسبی بازیافت کرد.
- بهدلیل اشتعالپذیری بالای منیزیم در هوا و تولید نور روشن، در تولید لوازم آتشبازی و برای تولید جرقه استفاده میشود.
- از هیدروکسید منیزیم بهعنوان ماده افزودنی در پلاستیکها برای افزایش مقاومت آنها در برابر آتش استفاده میشود.
- اکسید منیزیم برای ساخت آجرهای مقاوم در برابر حرارت در کورهها و شومینهها استفاده میشود.

نقش بیولوژیکی
در مورد عنصر منیزیم میتوانیم از موارد زیر، بهعنوان اصلیترین نقشهای بیولوژیکی آنها اشاره داشته باشیم.
- کلروفیل (Chlorophyll) یا همان سبزینه که عامل شیمیایی اصلی در فرآیند فتوسنتز است و باعث جذب نور خورشید توسط آنها میشود، در ساختار خود دارای منیزیم است و این حاکی از میزان حیاتی بودن این عنصر برای بقای گیاهان و به دنبال آن جانوران است.
- پورفیرین (Porphyrin) نیز که ترکیبی درشت مولکول و ازجمله عوامل بقا در گیاهان و بهدنبال آن سایر جانوران است، ترکیبی منیزیممحور است.
- در انسان، منیزیم برای عملکرد طیف وسیعی از آنزیمها ضروری است.
کلسیم
عنصر کلسیم با ۴٫۱ درصد فراوانی، پنجمین عنصر فراوان در پوسته زمین است. کاشف این عنصر، دانشمند بریتانیایی آقای «همفری دیوی» (Humphry Davy) در سال ۱۸۰۸ است.

- ترکیبات کلسیم بهوفور یافت میشوند و ذخایر وسیعی از سنگ آهک یا همان کربنات کلسیم وجود دارد که بهطور مستقیم، بهعنوان
سنگهای ساختمانی و بهطور غیرمستقیم، در صنعت سیمان، صابون و... مورد استفاده قرار میگیرند. - وقتی سنگ آهک در کورهها حرارت داده میشود، گاز کربن دیاکسید آزاد و آهک زنده (اکسید کلسیم) ایجاد میشود که بهشدت با آب واکنش داده و تبدیل به آهک آبدار(آهک مرده) میشود. آهک آبدار در کاربردهایی مثل فراوری سیمان، بهعنوان نرم کننده خاک، تصفیه آب برای کاهش اسیدیته و در صنایع شیمیایی مورد استفاده قرار میگیرد.
- سولفات کلیسیم یا ژیپس (Gypsum) در صنایع ساختوساز به عنوان پلاستر و در صنایع پزشکی برای ترمیم شکستگیها تحت عنوان گچ پاریس استفاده میشود.

نقش بیولوژیکی
عنصر کلسیم به عنوان یکی از مهمترین عناصر در راستای فرایندهای بیولوژیکی تعریف میشود که به چند مورد از آن ها اشاره میکنیم.
- کلسیم یکی از مهمترین عوامل حیاتی در بدن انسان بوده و برای عملکرد بسیاری از ارگانها ضروری است.
- کلسیم در همه موجودات زنده، بهویژه برای رشد استخوانها و دندانها ضروری است. کلسیم فسفات ازجمله اجزای اصلی سازنده استخوان است.
- عنصر کلیسیم نقش ساختاری در گیاهان داشته و به شکلگیری دیواره سلولی، غشای سلولی و لایه میانی کمک میکند.
استرانسیم
در حال حاضر، کشور چین بزرگترین تولید کننده استرانسیم در جهان است. کاشف این عنصر دیگر دانشمند بریتانیایی آقای «ویلیام کرویکشانگ» (William Cruickshank)، در سال ۱۷۸۷ است.

- ازجمله کاربردهای این فلز از گروه دوم جدول تناوبی، بهرهگیری از رنگ قرمز درخشان نمکهای آن و استفاده در آتشبازیها است.
- آلومینات استرانسیم در محصولات نوین ازجمله «رنگها و پلاستیکهای درخشان در تاریکی» استفاده میشود. به این صورتکه این محصولات در طول روز نور را جذب و سپس آن را بهآرامی آزاد میسازند.
- در تولید انرژی الکتریکی برای وسایل نقلیه فضایی، ایستگاههای هواشناسی از راه دور و... از این ماده استفاده میشود.
- این ماده در ضخامتسنجهای مهندسی دقیق و نیز در حذف بارهای ساکن از کاغذ یا پلاستیک ماشینآلات، مورد استفاده قرار میگیرد.
- یکی از ترکیبات استرانسیم بهنام هگزا هیدرات کلرید استرانسیوم () در تولید خمیردندانهای مخصوص دندانهای حساس استفاده میشود.
نقش بیولوژیکی و هشدارها
در خصوص نقش بیولوژیکی و هشدارهای پیرامون این ماده، میتوانیم به مواردی به شرح زیر اشاره داشته باشیم.
- ضروری برای برخی از مرجانها
- در انفجارهای هستهای آزاد میشود و رادیواکتیو و خطرناک است.
- بهدلیل شباهت با کلیسیم، در فرآیندهای بیولوژیکی میتواند جایگزین آن شده و بسیار پرخطر باشد بهخصوص در کودکان.
باریم
کاشف این عنصر دانشمند سوئدی آقای «کارل ویلهیلم شیله» (Carl Wilhelm Scheele)، در سال ۱۷۷۲ است.

- این ماده عمدتا در سیالات حفاری چاههای نفت و گاز استفاده میشود.
- در صنایع رنگ و شیشهسازی این ماده مورد استفاده قرار میگیرد.
- تمامی ترکیبات باریم سمی هست. ولی چون سولفات باریم نامحلول است و میتواند بلع شود، گاهی اوقات بهتشخیص تیم پزشکی، از این ترکیب در بیماران مبتلا به اختلالات گوارشی استفاده میشود.
- در تصویربرداری با اشعه ایکس مورد استفاده قرار میگیرد. چون عنصری سنگین است که باعث پراکندگی اشعه ایکس میشود.
- از نیترات باریم در تولید نور سبزرنگ در آتشبازیها استفاده میشود.

نقش بیولوژیکی و هشدارها
استرانسیوم تا به امروز نقش بیولوژیکی شناخته شدهای ندارد.
- وقتی بهصورت ترکیبات محول در آب یا اسید باشد، سمی و خطرناک است.
- از تبعات فرعی آنها در استفاده از مواد آتشبازی و تهدید و آسیب جانی انواع حیوانات در کنار انسانها است.
رادیوم
عنصر رادیوم در سال ۱۸۹۸ توسط زوج دانشمند فرانسوی، خانم «ماری کوری» (Marie Curie)، نخستین بانوی برنده جایزه نوبل، و آقای «پیر کوری» (Pierre Curie) کشف شد. این دو دانشمند، موفق به استخراج یک میلیگرم رادیوم از ده تن سنگ معدن اورانیوم (Pitchblende)، در قالب یکی از اکسیدهای اورانیوم () شدند، که این مقدار، با توجه به امکانات و روشهای شیمیایی جداسازی در دسترس در آن زمان، یک شاهکار بهحساب میآید.

- رادیوم بهدلیل خاصیت رادیواکتیویته بالا، دارای کاربردهای بهنسبت محدودی بوده و میتوان گفت تنها کاربرد تجاری فعلی آن در پزشکی هستهای، برای درمان نوع خاصی از سرطانها است.
- در برخی موارد رادیوم ۲۲۳، برای درمان سرطان پروستات گسترش یافته به استخوانها مورد استفاده قرار میگیرد. از آن جا که استخوانها حاوی کلسیم هست و رادیوم نیز همگروه عنصر کلسیم است، لذا از آن برای هدف قرار دادن سلولهای سرطانی در استخوانها استفاده میشود.
- از رادیوم در ایجاد رنگهای درخشان ازجمله در ساعتها استفاده میشود.

تصویر بالا، صفحه ساعت رادیومی قدیمی را بعد از قرار گرفتن در معرض نور UV-A نشان میدهد که بهتدریج نور را ساطع میکند. اگرچه پرتوی آلفا از شیشه و فلز عبور نمیکند، ولی امروزه این کاربرد بسیار خطرناک در نظر گرفته میشود.
نقش بیولوژیکی و هشدارها
عنصر بریلیم تا به امروز نقش بیولوژیکی شناخته شدهای ندارد ولی بهلحاظ رادیواکتیو و سمی بودن، در مورد استفاده از آن هشدار داده میشود.
جمعبندی
در مطلب حاضر، بهبررسی عناصر قلیایی خاکی، متشکل از شش عنصر فلزی واقع در گروه دوم جدول تناوبی، از ابعاد مختلف پرداختیم. از موقعیت آنها در جدول تناوبی و علت نامگذاری آنها بهاین نام آغاز و در ادامه اشارههایی کلی به خواص فیزیکی و شیمیایی آنها شد. ساختارهای این فلزات بهعنوان منشا بسیاری از رفتارهای آنها و تفاوتهای آنها با عناصر سایر گروهها مورد بررسی قرار گرفت.
- تداوم مطلب با نگاهی مقایسهای بین عناصر گروه دوم با عناصر گروه اول (گروه فلزی همجوار خود در ردیف نخست) همراه بود.
- روندهای تناوبی بر مبنای شاخصهای مختلف تعریف و در گروههای جدول تناوبی و مشخصا عناصر گروه دوم، بهتفصیل مورد واکاوی قرار گرفت.
در قسمت انتهایی مطلب، با اشارهای به کاشفان عناصر، به کاربردهای آنها بههمراه نقش بیولوژیکی هریک پرداخته شد. سعی شد در طول مباحث، مثالهایی در راستای تبیین هرچه بهتر مطالب آورده شود.












