کاتالیزگر چیست و چه تاثیری بر واکنش شیمیایی دارد؟ – به زبان ساده
کاتالیزگر مادهای است که برای افزایش سرعت انجام شدن واکنش به مواد واکنشدهنده افزوده میشود، اما خود در واکنش شیمیایی شرکت نمیکند. در واقع، کاتالیزگر، سطح انرژی فعالسازی واکنش را پایین آورده و به عنوان یک میانبر برای انجام واکنش عمل میکند. حدود ٪۹۵ واکنشهای شیمیایی در مقیاس صنعتی شامل استفاده از انواع مختلفی از کاتالیزگر میشوند. در این مطلب از مجله فرادرس میآموزیم کاتالیزگر چیست و چگونه باعث افزایش سرعت واکنش شیمیایی میشود.
- میآموزید کاتالیزگر چیست و چگونه سرعت واکنش را افزایش میدهد.
- با عملکرد و مفهوم انتخاب پذیری کاتالیزگر آشنا میشوید.
- انواع کاتالیزگر همگن، ناهمگن، مثبت و منفی را میشناسید.
- با نقش آنزیمها به عنوان کاتالسیت آشنا میشوید.
- مفاهیم واکنش کاتالیستی، مسمومیت کاتالیزگر و پشتیبان کاتالیزگر را یاد میگیرید.
- میتوانید اهمیت و کاربردهای انواع کاتالیزگر را به همراه مثال درک کنید.


در ابتدای این مطلب میآموزیم کاتالیزگر چیست و چگونه باعث افزایش سرعت واکنش میشود. سپس انواع کاتالیزگر را بررسی کرده و با نقش آنزیمها به عنوان یک کاتالیزگر آشنا میشویم. سپس یاد میگیریم کاتالیزگر خودرو چیست و واکنش کاتالیستی چه واکنشی است. در ادامه با مفاهیمی چون مسمومیت کاتالیزگر و پشتیبان کاتالیزور آشنا شده و کاربرد و اهمیت کاتالیستها را بررسی میکنیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید کاتالیزگر چیست.
کاتالیزگر چیست؟
کاتالیزگر (کاتالیزور یا کاتالیست) ماده ای است که سرعت انجام واکنش شیمیایی را (با استفاده از کاهش میزان انرژی فعالسازی)، افزایش داده و خودش در واکنش شیمیایی مصرف نمیشود. پس از انجام واکنش شیمیایی با حضور کاتالیزگر، این ماده به حالت اولیه خود باز میگردد.
در نوشتن معادله واکنشهای شیمیایی، کاتالیزگر را با نوشتن فرمول شیمیایی آن در بالای جهت (فلش) واکنش مشخص میکنند. برای مثال، در واکنش زیر، دی اکسید منگنز کاتالیزگر است.
کاتالیزگر با تغییر دادن مسیر انجام واکنش (مکانیسم) عمل میکند. این خروجی مهم استفاده از کاتالیزگر باعث میشود مقدار انرژی فعالسازی واکنش کاهش یابد. بدین صورت، واکنش برای انجام شدن به صرف انرژی کمتری احتیاج خواهد داشت. این عملکرد در تصاویر زیر مشخص شده است.
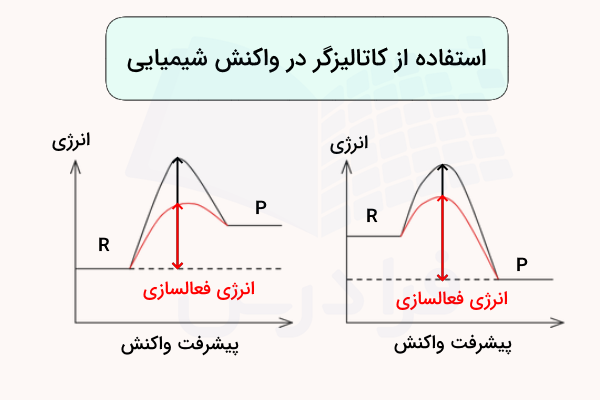
خطوط قرمز در نمودارهای بالا نشانگر مسیر انجام واکنش با استفاده از کاتالیزگر هستند. همانطور که مشاهده میکنید، انرژی فعالسازی این مسیرها از مقدار انرژی واکنش اصلی کمتر است. اما انرژی کلی واکنش (اختلاف انرژی بین واکنشدهندهها و فرآوردهها) تغییری نمیکند. همچنین حرف انگلیسی R برگرفته از واژه (Reactant) به معنی واکنشدهنده و حرف P برگرفته از واژه (Product) به معنی فرآورده است.
یادگیری علوم هشتم با فرادرس
برای درک بهتر این موضوع که کاتالیزگر چیست، ابتدا باید با مفاهیمی چون تغییرات شیمیایی و تغییرات فیزیکی، واکنشهای شیمیایی، آنزیم و .... آشنا شویم. پیشنهاد میکنیم برای درک بهتر این مسائل و مفاهیم، به مجموعه فیلم آموزش دروس پایه هشتم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازد.
همچنین، با مشاهده فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه کاتالیزگر دسترسی داشته باشید.
- فیلم آموزش علوم تجربی پایه نهم بخش شیمی فرادرس
- فیلم آموزش شیمی ۱ پایه دهم فرادرس
- فیلم آموزش شیمی ۲ پایه یازدهم رشته علوم تجربی و ریاضی و فیزیک فرادرس
عملکرد کاتالیزگر
در قسمتهای قبل آموختیم کاتالیزگر چیست. کاتالیزگرها موادی هستند که مسیر انجام واکنش شیمیایی را کوتاه کرده و باعث میشوند انرژی فعالسازی واکنش کاهش یابد. کاتالیزگرها خود در واکنش شیمیایی مصرف نمیشوند و برای انجام بسیاری از واکنشهای شیمیایی مقدار کمی کاتالیزگر برای افزایش سرعت واکنش نیاز است.
مقدار جرم کاتالیزگر در ابتدا و انتهای واکنش شیمیایی مقداری مساوی خواهد داشت. اکثر کاتالیزگرها با استفاده از فرآیند جذب سطحی به شکستن سریعتر پیوندهای واکنشدهندهها کمک میکنند. در نتیجه، مقدار انرژی کمتری برای شکستن پیوندهای بین اتمهای واکنشدهنده نیاز خواهد بود و واکنش سریعتر انجام میشود. در ادامه به مهمترین نکات در عملکرد کاتالیست اشاره شده است.
- واکنش شیمیایی با کاتالیست آغاز نمیشود.
- کاتالیزگر در واکنش مصرف یا تولید نمیشود.
- کاتالیست طی فرآیندی فیزیکی به شکستن پیوند واکنشدهندهها و تولید پیوند فرآوردهها کمک میکند.
- کاتالیست در طی انجام واکنش دست نخورده باقی میماند و جرم آن در ابتدا و انتهای واکنش برابر است.

نکته مهم
کاتالیزگرها نمیتوانند واکنشهایی را که از نظر سینتیکی یا ترمودینامیکی کاملا غیرممکن هستند، ممکن کنند. زیرا در صورت استفاده از کاتالیزگرها یا عدم استفاده از آنها، مقدار انرژی نهایی واکنش تغییر نمیکند. کاتالیزگرها تنها انرژی مورد نیاز برای فعالشدن واکنش را کاهش میدهند و میتوانند به سرعت انجام واکنش و تولید فرآوردهها در دمای پایینتر کمک کنند.
مثال عملکرد کاتالیزگر
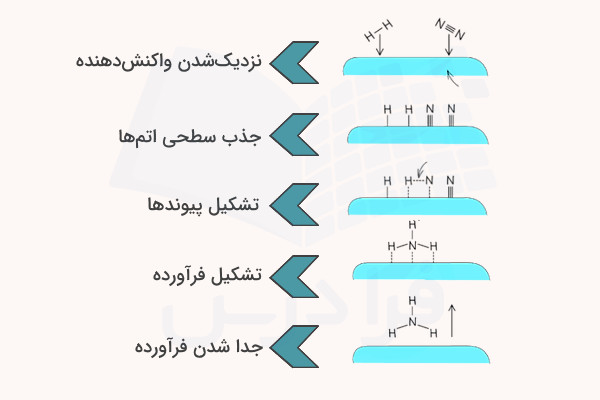
عملکرد کاتالیزگرها بسته به نوع کاتالیزگر، میتواند متفاوت باشد. با این حال، بیشتر آنها فرآیند شکستن پیوند بین اتمهای واکنشدهنده را از طریق فرآيند جذب سطحی تسریع میکنند. برای مثال، فرآیند تولید آمونیاک از هیدروژن و نیتروژن با استفاده از کاتالیزور آهن در تصاویر زیر نشان داده شده است.
- در مرحله اول، مولکولهای هیدروژن و نیتروژن به سطح کاتالیزگر آهن نزدیک شده و به صورت اتمهای تکی به آن میچسبند و پیوندهای آنها به صورت موقت شکسته میشود.
- در مرحله بعد، اتمها در سطح کاتالیزگر با یکدیگر واکنش داده و پیوندهای جدید تشکیل میدهند.
- در نهایت مولکولهای فرآوده از سطح کاتالیزور جدا میشوند.
انتخاب پذیری کاتالیزگر چیست؟
خاصیت انتخابی یا انتخاب پذیری کاتالیزگر بدین معنی است که کاتالیزگر میتواند یک واکنش خاص را ممکن کند که در آن واکنشهای جانبی ممکن به حداقل برسند. به عبارت دیگر، با کمک برخی از کاتالیزگرها در واکنشها، میتوان از تولید فرآوردههای جانبی که مورد نیاز نیستند جلوگیری کرد. این خاصیت مخصوصا در مواقعی که انجام واکنشهای جانبی بسیار محتمل است، به افزایش بازده واکنش و بالا بردن خلوص فرآورده کمک میکند.
انتخابی بودن کاتالیزگر به عوامل مختلفی وابسته است. برای مثال، خواص شیمیایی و طبیعت مراکز فعال کاتالیزگر و واکنشپذیری ویژه مواد واکنشدهنده یکی از این عوامل است. برای مثال، پلاتین یکی از رایجترین مواد کاتالیزگر استفاده شده در صنعت است زیرا میتواند به شکل انتخابی عمل کند و از انجام واکنشهای جانبی جلوگیری کند.
انواع کاتالیزگر
کاتالیزگرها معمولا به سه دسته همگن، ناهمگن و آنزیمها تقسیم میشوند. کاتالیزگر همگن در یک فاز با واکنشدهندهها و کاتالیزگر ناهمگن در فاز متفاوت با واکنشدهندهها قرار دارد. کاتالیزگرها میتوانند مایع، جامد یا گاز باشند. فلزات و اکسیدهای آنها از رایجترین کاتالیزگرهای جامد هستند. همچنین، شبه فلزاتی مانند بور، آلومینیوم و سیلیسیم میتوانند کاتالیزگر باشند.
کاتالیزگرها بسته به اثری که بر سرعت واکنش میگذارند نیز میتوانند به دو دسته کاتالیزگر مثبت و منفی تقسیم شوند. در ادامه این انواع کاتالیزگر را بررسی میکنیم. همچنین پیشنهاد میکنیم برای آشنایی بیشتر با انواع کاتالیزگر، فیلم آموزش کاتالیزگرهای همگن و ناهمگن فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
کاتالیزگر همگن
کاتالیزگر همگن کاتالیزگری است که با واکنشدهندهها در واکنش شیمیایی همفاز است. این بدین معنی است که اگر برای مثال واکنشدهندهها در فاز مایع باشند، کاتالیزگر نیز در فاز مایع است. در این نوع کاتالیزگر، مقدار برخوردهای موثر بین مواد واکنش و کاتالیزگر به حداکثر مقدار خود میرسد زیرا در این حالت، کاتالیزگر به صورت یکدست و همگن در مخلوط واکنش پخش میشود.
بیشتر کاتالیزگرها از فلزات واسطه تهیه میشوند و تهیه فاز محلول از این مواد مشکل است. بسیاری از کاتالیزگرهای همگن موجود در صنعت باید دماهای بسیار پایین استفاده شوند و همچنین به آرامی در محلول تجزیه میشوند. با وجود این مشکلات، بسیاری از فرآیندهای تجاری مفید روی این مواد، استفاده از آنها را برای مصرف کنندگان به صرفه کرده است. برای مثال، پلی اتیلن و پلیپروپیلن با چگالی بالا، با استفاده از کاتالیزگرهای همگن تولید میشوند.
مثال کاتالیزگر همگن
همانطور که در قسمت قبل آموختیم، کاتالیزگرهای همگن محدود و گرانقیمت هستند اما با این وجود از بسیاری از آنها در فرآیند تولید بسیاری از مواد در مقیاس صنعتی استفاده میشود. در ادامه برخی از این موارد را معرفی میکنیم.
- آنیون دییدو دیکربونیل رودات در تولید استیک اسید
- کمپلکسهای مولیبدن (VI) در تولید پروپیلن اکسید
- کمپلکسهای رادون دارای فسفین ترشری در تولید آلدهیدها
- کمپلکسهای نیکل دارای فسفین ترشری در تولید برای تولید نایلون
- ترکیبات زیرکونوسن دیکلرید برای تولید پلیاتیلن چگالی-بالا
مزایا و معایب کاتالیزور همگن
استفاده از کاتالیزورهای همگن در واکنشهای شیمیایی با وجود اینکه مزایایی مانند سطح تماس بالا را دارد، مشکلاتی مانند سخت بودن جداسازی از محیط آزمایش را نیز دارند. در ادامه برخی از مزایا و معایب کاتالیزگر را بررسی میکنیم.
| مزایای کاتالیزگر همگن | معایب کاتالیزگر همگن |
| فعالیت شیمیایی بالا در محلولها | دشوار بودن جداسازی از محلول |
| انتخابپذیری بالا با جایگزینی لیگاندها برای جانشینی عناصر الکترونی یا استری | تجزیه در دمای بالا و دشوار بودن استفاده دوباره |
کاتالیزگر ناهمگن
کاتالیزگر ناهمگن کاتالیزگری است که در فاز متفاوتی با مواد واکنشدهنده قرار دارد. برای مثال، اگر واکنشدهندهها در فاز محلول یا مایع باشند، کاتالیزگر جامد خواهد بود. در استفاده از این نوع کاتالیزگرها، معمولا حداقل یکی از مواد واکنشدهنده محلول به سطح کاتالیزگر جامد متصل میشود. این فرآیند، فرآیندی فیزیکی به نام جذب سطحی است که در آن پیوندهای شیمیایی واکنشدهنده ضعیف شده و میشکند.
مثال کاتالیزگر ناهمگن
برخی از مهمترین کاتالیزگرهای ناهمگن مورد استفاده در واکنشها و فرآیندهای صنعتی و تولیدی در ادامه معرفی شده است. تمامی این کاتالیزگرها با فرآیند جذب واکنشدهنده روی سطح خود به کاهش انرژی فعالسازی واکنش و افزایش سرعت واکنش کمک میکنند.
| کاتالیزگر ناهمگن | فرآیند مورد استفاده |
| وانادیوم اکسید یا پلاتین | فرآیند تماس برای تولید اسید سولفوریک |
| آهن، اکسید پتاسیم یا اکسید آلومینیوم | فرآیند هابر برای تولید آمونیاک |
| پلاتین یا رادون | فرآیند استوالد برای تولید اسید نیتریک |
| آهن، اکسید کروم یا مس | واکنش جابجایی آب - گاز برای تولید برخی سوختها |
| نیکل | اصلاح بخار برای تولید هیدروژن |
| اکسید روی و اکسید کروم | سنتز متانول |
| بیسموت فسفومولیبدات | فرآیند سوهیدو برای تولید استونیتریل |
| نیکل، پالادیومم یا پلاتین | هیدروژناسیون کاتالیستی برای هیدروژندار کردن آلکنها |
مثال عملکرد کاتالیزگر ناهمگن
یکی از مثالهای کاتالیزگر ناهمگن، برهمکنش گاز هیدروژن به سطح یک فلز مانند نیکل، پالادیم یا پلاتین است. همانطور که در تصویر زیر نمایش داده شده است، پیوند بین اتمهای هیدروژن شکسته شده و هر یک از هیدروژنها به صورت فیزیکی بر سطح فلز جذب میشوند. این اتمهای هیدروژن میتوانند آزادانه بر سطح فلز حرکت کرده و با تشکیل پیوند دوباره، به شکل اولیه مولکول هیدروژن باز گردند. این اتمهای هیدروژن جداشده، راحتتر از اتمهای درگیر در مولکول هیدروژن واکنش میدهند. زیرا پیوند محکم بین اتمهای هیدروژن شکسته شده است.
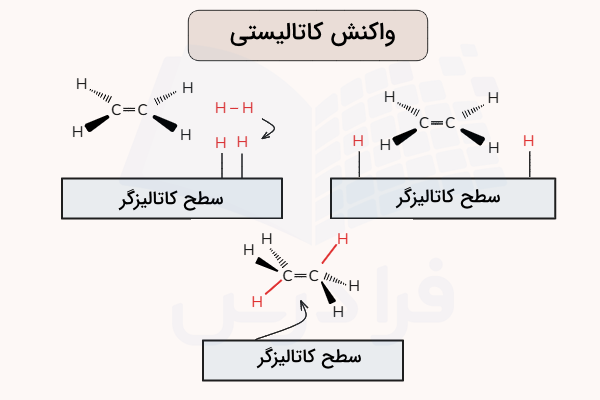
از کاتالیزگرهای ناهمگن در اگزوز خودروها و فرآیند خالصسازی نفت خام استفاده میشود.
مزایا و معایب کاتالیزگر ناهمگن
کاتالیزگرهای ناهمگن که معمولا در حالت جامد ساخته و استفاده میشوند، معمولا گران قیمت هستند اما میتوان از آنها چندین بار استفاده کرد. در ادامه برخی از مزایا و معایب کاتالیزگرهای ناهمگن را بررسی میکنیم.
| مزایای کاتالیزگر ناهمگن | معایب کاتالیزگر ناهمگن |
| جداسازی راحت از فرآورده | انتخابپذیری کم |
| قابل استفاده در دمای بالا | سطح تماس کمتر از کاتالیزگر همگن |
آنزیم ها
آنزیمها کاتالیزگرهایی هستند که در بدن موجودات زنده به صورت طبیعی وجود دارند. تقریبا تمامی مولکولهای پروتئین با جرم مولکولی بین ۲۰هزار تا ۱۰۰هزار amu، آنزیم هستند. برخی از این آنزیمها، کاتالیزگرهای همگنی هستند که در محلول، با قسمتهای سلولی ارگانیسم واکنش میدهند. برخی دیگر از آنها کاتالیزگرهای ناهمگنی هستند که درون دیواره سلولی وجود دارند. واکنشدهنده یک واکنش آنزیمی کاتالیستی، پیش ماده (سوبسترا) نام دارد.
آنزیمها میتوانند سرعت واکنش را تا مقادیر بسیار بالایی زیاد کنند، بسیار خاص هستند و مورد مطالعه قرار گرفتهاند. آنزیمها را نمیتوان به صورت صنعتی و در مقیاس بالا تولید کرد. با این وجود دانشمندان موفق شدهاند برخی از آنزیمها را برای استفاده در مایع لباسشویی، مایع محلول لنز و نرمکنندههای گوشت تولید کنند. برخی از حشرات مانند سوسک بمب افکن، آنزیمی را در بدن خود حمل میکنند که میتواند واکنش تجزیه هیدروژن پروکسید به آب را کاتالیز کند.
مهارکننده آنزیم
برخی از مواد به نام مهارکننده آنزیم وجود دارند که میتوانند سرعت واکنشهای آنزیمی کاتالیستی را کاهش دهند. این مواد با اتصال به قسمت مشخصی از آنزیم، جلوی انجام واکنش کاتالیستی را میگیرند. برای مثال، یکی از معروفترین و رابج ترین مهارکنندههای آنزیم، مولکول آسپرین است. این مولکول یکی از آنزیمهایی که مسئول التهاب است را مهار میکند.

پیشنهاد میکنیم برای درک بهتر عملکرد این کاتالیزگرهای آنزیمی، مطلب واکنش آنزیمی چیست مجله فرادرس را مطالعه کنید.
کاتالیزگر مثبت
در قیمت های قبل آموختیم مفهوم کاتالیزگر چیست. کاتالیزگر مثبت، کاتالیزگری است که با پایین آوردن مقدار انرژی فعالسازی واکنش، باعث سریعتر شدن انجام واکنش و افزایش سرعت واکنش میشوند. برای مثال، در فرآیند تولید آمونیاک به وسیله روش هابر، اکسید آهن به عنوان یک کاتالیزگر مثبت عمل میکند و مقدار بازده واکنش را افزایش میدهد.
کاتالیزگر منفی
در برخی از واکنشهای شیمیایی نیاز است تا سرعت واکنش برای افزایش مقدار بازده یا افزایش مقدار ماده فرآورده تولید شده، سرعت واکنش کاهش یابد. برخی از مواد میتوانند سرعت این واکنشهای شیمیایی را کاهش دهند. به این مواد کاتالیزگر منفی گفته میشود. کاتالیزگر منفی با افزایش انرژی فعالسازی واکنش، مقدار سرعت واکنش شیمیایی را کاهش میدهند.
برای مثال، استانیلید به عنوان یک کاتالیزگر منفی کار کرده و مقدار سرعت تجزیه هیدروژن پراکسید (آب اکسیژنه) به هیدروژن و اکسیژن را کاهش میدهد. بدین ترتیب میتوان برای مدت طولانیتری از هیدروژن پراکسید به فرم تجزیه نشده استفاده کرد.
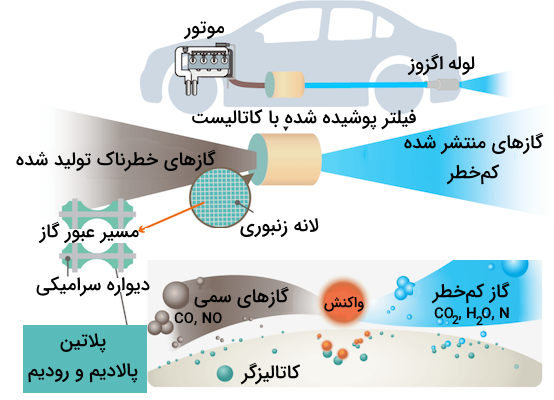
کاتالیزگر خودرو چیست؟
در موتور خودروها، سوخت ناقص سوختها باعث آزاد شدن گازهای خطرناکی مانند کربنمونوکسید میشود. جرقه الکتریکی و دمای بالا نیز به اکسیژن و نیتروژن اجازه میدهد واکنش داده و نیتروژن مونوکسید و نیتروژن دی اکسید آزاد کنند. این مواد مسئول تولید مهدود فوتوشیمیایی و باران اسیدی هستند.
تبدیل کنندههای کاتالیستی خوردو، مقدار انتشار این گازها را کاهش داده و کربن مونوکسید و نیتروژن مونوکسید را جذب میکنند. در این مرحله، این گازها وارد واکنشهای اکسایش کاهش شده و به گازهای کم خطر کربن دی اکسید و نیتروژن تبدیل میشوند.
بسیاری از کاتایزورهای خوردو معمولا پس از انجام فرآیند شیمیایی دوباره ترمیم میشوند و میتوان از آنها برای مدت طولانی استفاده کرد. استفاده از این نوع کاتالیزگرها برای اگزوز خودرو هم باعث کاهش آلودگی هوا شده و هم هزینه، انرژی و بازیافت کمتری را نیاز دارند.
واکنش کاتالیستی
واکنش کاتالیستی، واکنشی است که شامل استفاده از کاتالیزگر باشد. این واکنش به برهمکنش شیمیایی بین کاتالیزگر و واکنشدهنده اشاره دارد. در نتیجه این واکنش، مواد حدواسط با پیوندهای موقت تشکیل میشوند و در نهایت فرآورده واکنش تشکیل میشود. واکنش شیمیایی بین کاتالیزگر و واکنشدهندهها معمولا بسیار متنوع است و در مواردی که کاتالیزگر جامد است، این واکنشها بسیار پیچیده هستند.
واکنشهای اسید - باز، واکنشهای اکسایش - کاهش، واکنشهای کملپلکس کوئوردیناسی و تولید رادیکالهای آزاد همگی میتوانند از نوع واکنش کاتالیستی باشند. خواص سطح کاتالیزگر و ساختار بلوری کاتالیزگرها اثر زیادی بر مکانیسم واکنش کاتالسیتی کاتالیزگرهای جامد دارند. برخی از کاتالیزگرهای جامد (بخصوص کاتالیزگرهای چند عملکردی) میتوانند به روشهای متفاوت و متنوعی با واکش دهندهها برهمکنش داشته باشند.
الکتروکاتالیست
در الکتروشیمی و واکنشهای الکتروشیمیایی، به خصوص در سلولهای سوختی، بسیاری از فلزات به عنوان کاتالیزگر استفاده میشوند. در این موارد، از این فلزات برای افزایش کارایی نیمسلولهای موجود در پیل استفاده میشود. یکی از رایجترین الکتروکاتالیزورها، استفاده از ذرات نانو (نانوپارتیکل) پلاتین است. در صورت استفاده از این نوع کاتالیزگر، سرعت نیم واکنش اکسایش کاهش افزایش مییابد. معمولا این کاتالیزگرها به نیمسلولی افزوده میشوند که در آن گاز اکسیژن کاهش یافته و آب تولید میشود.
مسمومیت کاتالیزگر چیست؟
در قسمتهای قبل آموختیم روش عملکرد کاتالیزگر چیست. برخی از مواد میتوانند در عملکرد کاتالیزگر اخلال ایجاد کرده و از فعالیت آن جلوگیری کنند. به این مواد، «سم کاتالیزور» یا «محدودکننده کاتالیزور» گفته میشود. برای مثال، باریم سولفات مسموم کننده کاتالیزور پالادیوم است. در واکنش هیدروژناسیون آلکین، از این ماده در محلول کینولین استفاده میشود تا واکنش در مرحله هیدروژناسیون آلکن متوقف شده و ادامه پیدا نکند.
فعالیت کاتالیزگر چیست؟
مقدار فعالیت کاتالیزگرها را با استفاده از سرعت انجام واکنش میتوان اندازهگیری کرد. واحد SI کاتال (Katal)، یک واحاد اندازهگیری برای سنجش فعالیت کاتالیزور است. همچنین مقدار فعالیت کاتالیزور را با استفاده از واحد مول بر ثانیه نیز میتواند اندازهگیری کرد.
اگر بخواهیم مقدار ماده تولیدی توسط کاتالیزور را بیان کنیم، میتوانیم از عدد بازده (عدد بازگشت) کاتالیزور (turnover number) استفاده کنیم که با حروف (TON) مشخص میشود. طبق این واحد، مقدار فعالیت کاتالیزگر را میتواند با استفاده از فرکانس بازگشتی (turnover frequency) کاتالیزور TOF که مقدار بازگشت کاتالیست در واحد زمان است بیان کرد. واحد شمارش فعالیت آنزیم نیز برابر با اکیوالان بیوشیمی آن است.
کاربرد کاتالیزگر
استفاده از کاتالیزگرها یکی از مهمترین فرآیندهای مورد استفاده در صنایع شیمیایی است. تولید صنعتی بسیاری از مواد شیمیایی مهم شامل استفاده از کاتالیزور است. برای مثال، تولید صنعتی آمونیاک که به تنهایی بازده بسیار پایینی دارد و غیر ممکن است، با کاتالیزور آهن ممکن میشود. همچنین، از این کاتالیزور در فرآیند فیشر - تروپش نیز استفاده میشود. برخی دیگر از کاربردهای مهم کاتالیزورها در صنایع مختلف در ادامه معرفی شده است.
- استفاده از منگنز دی اکسید برای تولید هیدروژن
- استفاده از کاتالیزگر پلاتین و منگنز در کاتالیزور اگزوز خوردرو
- استفاده از آهن در فرآیند هابر برای تولید آمونیاک
- کاتالیزور زیگلر - ناتا برای تولید پلیاتیلن و پلیپروپیلن
- کاتالیزور گرابز برای انجام واکنش تبادل اولفینی
- استفاده از کاتالیزورهایی در فرآیند مونسانتو برای تولید استیک اسید
- استفاده از کاتالیزور پالادیوم تترا کلرید برای تولید استالدهید در فرآیند واکر
- استفاده از پالادیوم برای تولید آلکن جانشین شده در فرآند هِک

کاتالیزگر قربانی چیست؟
در قسمتهای قبل آموختیم کاتالیزگرها در واکنش شیمیایی مصرف یا تولید نمیشوند و جرم ابتدایی و انتهایی این مواد با هم برابر است. اما نوع دیگری از کاتالیزگر به نام کاتالیزگر قربانی نیز وجود دارد که طی انجام واکنش شیمیایی، به انجام واکنش کمک کرده و خود طی فرآیندی بازگشت ناپذیر، مصرف میشود. این کاتالیزگرها با نام کاتالیزگر استوکیومتری نیز شناخته میشوند و با مقادیر دقیق استوکیومتری به واکنش اضافه میشوند.
کاتالیزگرهای معمولی که در واکنش مصرف نمیشوند، گران قیمت هستند و در کمترین مقادیر ممکن به واکنش افزوده میشوند. اما کاتالیزگر استوکیومتریک باید ارزان و فراوان باشد تا مصرف شدن آن در واکنش شیمیایی مشکلی را به وجود نیاورد.
اهمیت کاتالیزگر
کاتالیزگرها بخش مهمی از واکنشهای شیمیایی را تشکیل میدهند. در صورت عدم حضور کاتالیزگرها ممکن است مهیا کردن شرایط لازم برای انجام بسیاری از واکنشهای شیمیایی از نظر سینتیکی یا ترمودینامیکی ممکن نباشد. برای مثال، آنزیمهای موجود در بدن، به عنوان کاتالیزگرهای طبیعی عملکرده و به انجام واکنشهای بیوشیمیایی بسیار مهمی در بدن کمک میکنند.
بسیاری از شرکتها و کارخانجات تولیدی، همواره به دنبال یافتن کاتالیزگرهایی بهتر با سرعت بالاتر هستند تا بتوانند سود خود را افزایش دهند. استفاده از کاتالیزگرها برای افزایش سرعت واکنشها خصوصا در علوم فیزیک و شیمی ترکیبات آلی فلزی رواج دارد.
افزایش کارایی
کاتالیزگرها، مقدار کارایی واکنشهای شیمیایی را افزایش میدهند. زیرا این مواد این امکان انجام واکنش با سرعت بیشتر و در دمای کمتر را فراهم میکنند.
کنترل مقدار فرآورده تولیدی
با استفاده از کاتالیزگرها میتوان از تولید فرآوردههای جانبی و فرآوردههایی که تولید آنها ضروری نیست، جلوگیری شود. بدین ترتیب، فرآوردههایی با کیفیت و خلوص بالاتر تولید شده و مقدار ناخالصی کاهش مییابد.
صرفه جویی در انرژی
کاهش مقدار انرژی فعالسازی واکنش با استفاده از کاتالیزگر باعث میشود واکنش در دمای پایینتری و با صرف انرژی کمتر انجام شود. بدین ترتیب، مصرف انرژی برای انجام واکنش تا حد قابل توجهی کاهش مییابد. همچنین، کاهش مصرف انرژی میتواند به کاهش هزینه مورد نیاز برای انجام واکنش نیز کمک کند.
حفاظت از محیط زیست و کنترل انتشار آلودگی
کاتالیزگرها نقش مهمی در علوم محیط زیست دارند. استفاده از کاتالیست خودرو نقش مهمی در کاهش آلودگی محیط زیست داشته است. استفاده از واکنشهای کاتالیستی نقش مهمی در فرآیندهای دوستدار محیط زیست و شیمی سبز دارند. در ادامه بررسی میکنیم مهمترین عوامل اهمیت کاتالیزگر چیست.
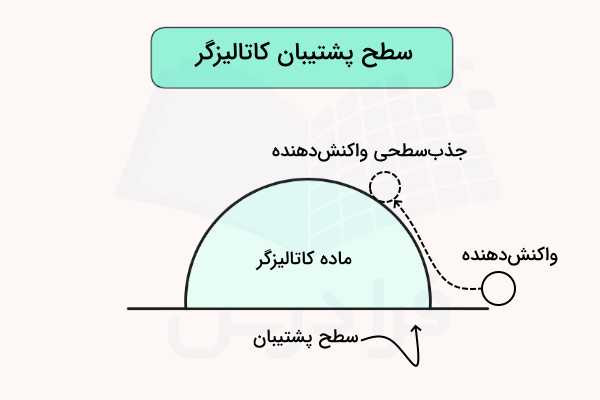
پشتیبان کاتالیزور چیست؟
در این مطلب از مجله فرادرس آموختیم کاتالیزگر چیست. برخی از کاتالیزگرها، که شامل فلزات و مواد گرانبها هستند، بر روی یک سطح پشتیبان ثابت میشوند. این سطوح پشتیبان میتوانند موادی مانند اکسید فلزات، کربن فعال، سیلیکا یا آلومینا باشند. با استفاده از این روش، مقدار سطح ویژه در دسترس کاتالیزور در برخی از واکنشها افزایش یافته و از از دست رفتن کاتالیزور جلوگیری شده و کارایی آن بیشتر میشود. تصویر زیر نمایانگر یک کاتالیزور روی سطح پشتیبان است.