مقایسه واکنش پذیری فلزات – به زبان ساده
هنگامی که فلزات با مواد دیگر وارد واکنش میشوند، الکترون از دست داده و یون مثبت تولید میکنند. مقایسه واکنش پذیری فلزات با استفاده از جدولی به نام سری واکنشپذیری فلزات انجام میشود. این مقایسه به ما این امکان را میدهد تا تشخیص دهیم کدام فلز راحتتر الکترون از دست داده و واکنش با چه شدت و سرعتی انجام میشود. از مقایسه واکنش پذیری فلزات برای پیشبینی واکنشهای شیمیایی و استفاده از ویژگی واکنش فلزات برای انجام آزمایشات علمی مانند آبکاری و تولید پیل الکتروشیمیایی استفاده میشود. در این مطلب از مجله فرادرس میآموزیم مقایسه واکنش پذیری فلزات چگونه انجام میشود.
- میآموزید مقایسه واکنش پذیری فلزات بر چه اساسی انجام میشود و اهمیت آن چیست.
- با سری واکنش پذیری فلزات آشنا میشوید.
- دلیل تفاوت واکنش پذیری فلزات و عوامل موثر بر آن را میشناسید.
- میتوانید انواع واکنشهای فلزات و فرآوردههای آنها را تشخیص دهید.
- با سری واکنش پذیری نافلزات آشنا میشوید.
- رابطه واکنش پذیری فلزات و پتانسیل استاندارد را میشناسید.


در ابتدای این مطلب میآموزیم مقایسه واکنش پذیری فلزات به چه منظور و چگونه انجام میشود. سپس به بررسی سری واکنشپذیری فلزات و دلیل تفاوت واکنشپذیری فلزات میپردازیم. در ادامه کاربردهای این مقایسه و روش استفاده از آن را آموخته و سری واکنشپذیری نافلزات را نیز مرور میکنیم. در نهایت رابطه واکنشپذیری فلزات را با پتانسیل استاندارد الکترون میآموزیم. با مطالعه این مطلب تا انتها میتوانید به شکلی کامل بیاموزید مقایسه واکنش پذیری فلزات چیست.
مقایسه واکنش پذیری فلزات
مقایسه واکنش پذیری فلزات، برای مقایسه قدرت آنها در تولید کاتیون و واکنشپذیری انجام میشود. این مقایسه به کمک سری واکنشپذیری فلزات انجام میشود. سری واکنشپذیری فلزات جدولی است که در آن فلزات بر اساس قدرت واکنشپذیری از زیاد به کم مرتب شدهاند.
به طور کلی، واکنشپذیری فلزات قلیایی بیشتر از سایر فلزات است و این واکنشپذیری در این گروه از جدول تناوبی از بالا به پایین افزایش مییابد. همچنین در ردیفهای جدول تناوبی، واکنشپذیری فلزات به طور کلی از چپ به راست کاهش مییابد. بهترین روش برای تشخیص و مقایسه واکنش پذیری فلزات، به خاطر سپردن سری واکنشپذیری فلزات است.
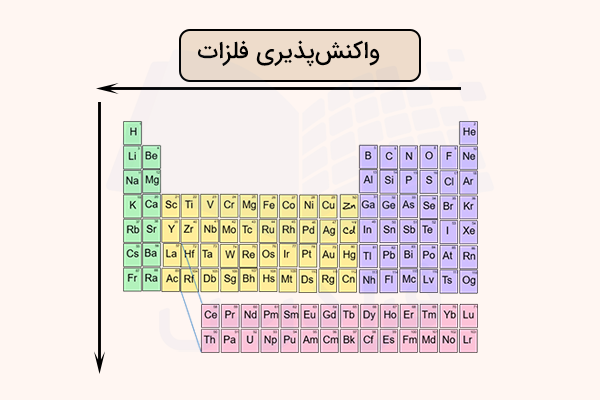
اهمیت مقایسه واکنش پذیری فلزات چیست؟
از مقایسه واکنش پذیری فلزات در تشخیص فرآورده واکنشهای جانشینی، مواد معدنی و غیرمعدنی و واکنشهای فلزات و نافلزات استفاده میشود. همچنین، مقایسه واکنش پذیری فلزات برای پیشبینی رفتار فلزات در واکنش با موادی مانند آب، اسیدها، نمکها و اکسیژن و برای درک فرآیندهایی مانند زنگ آهن، خوردگی فلزات و استخراج فلزات استفاده میشود.
سری واکنش پذیری فلزات چیست؟
سری واکنشپذیری فلزات، جدولی است که نشان میدهد کدام فلزات واکنشپذیرتر هستند و کدام فلزات واکنشپذیری کمتری دارند. واکنشپذیری فلزات به قدرت آنها در تشکیل کاتیون و خصلت فلزی ارتباط دارد. در تصویر زیر، شکل کلی این جدول که شامل فلزات مهم است، آورده شده است.
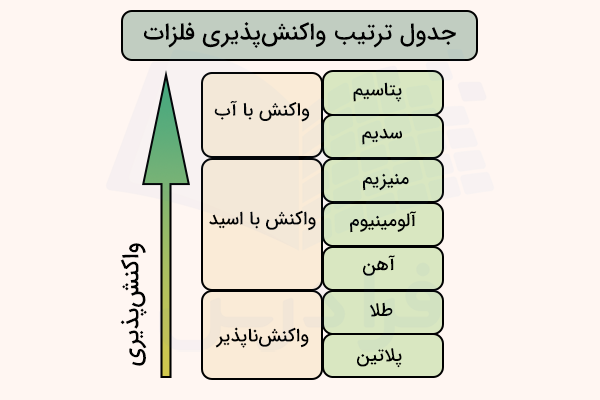
این جدول، با محاسبه و تجربیات علمی به دست آمده و همواره به ترتیب از زیاد به کم مرتب میشود. در حرکت از بالا به پایین این جدول، مقایسه واکنش پذیری فلزات اطلاعات زیر را مشخص میکند.
- واکنشپذیری فلزات کاهش مییابد.
- از دست دادن الکترون دشوارتر میشود.
- خوردگی و کدر شدن فلزات آهستهتر انجام میشود.
- جداسازی فلزات از ترکیب آنها آسانتر میشود.
- قدرت کاهندگی فلزات کاهش مییابد.
یادگیری شیمی یازدهم با فرادرس
برای درک بهتر این موضوع که مقایسه واکنش پذیری فلزات چیست، ابتدا باید با مفاهیمی چون شعاع اتمی، آرایش الکترونی، نام عناصر جدول تناوبی و بارهای جدول تناوبی آشنا شویم. پیشنهاد میکنیم برای آشنایی بیشتر با این مفاهیم، به مجموعه فیلم آموزش دروس پایه یازدهم فرادرس مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه واکنشپذیری فلزات دسترسی داشته باشید.
- فیلم آموزش شیمی ۱ پایه دهم گواهینامه فرادرس
- فیلم آموزش شیمی ۱ پایه دهم حل سوالات تشریحی امتحانات نهایی فرادرس
- فیلم آموزش شیمی ۳ پایه دوازدهم فرادرس
لیست کامل سری واکنش پذیری فلزات
در قسمت قبل آموختیم مقایسه واکنش پذیری فلزات چگونه انجام میشود. جدول کامل سری واکنشپذیری فلزات برای بررسی و مقایسه قدرت واکنشپذیری فلزات، در ادامه ارائه شده است. در این جدول به ترتیب از واکنشپذیرترین فلز تا فلزات با کمترین واکنشپذیری به هراه یونهای آنها نوشته شده است.
| سری واکنشپذیری فلزات | |
| نام فلز | یون تشکیل شده |
| سزیم | |
| روبیدیوم | |
| پتاسیم | |
| سدیم | |
| لیتیوم | |
| باریم | |
| استرانسیم | |
| کلسیم | |
| منیزیم | |
| برلیم | |
| آلومینیوم | |
| تیتانیوم | |
| منگنز | |
| روی | |
| کرم | |
| آهن | |
| کادمیم | |
| کبالت | |
| نیکل | |
| قلع | |
| سرب | |
| آنتیموان | |
| بیسموت | |
| مس | |
| تنگستن | |
| جیوه | |
| نقره | |
| طلا | |
| پلاتین | |
درک تفاوت واکنش پذیری فلزات
فلزات موجود در ردیفهای بالایی سری واکنشپذیری فلزات، آن فلزاتی هستند که به راحتی الکترون را از دست میدهند و کاتیون تشکیل میدهند. به عبارتی، خصلت فلزی برای این فلزات بیشتر از سایرین است. این پدیده، این فلزات را به شدت واکنشپذیر میکند. به همین دلیل است که فلزی مانند پتاسیم و سدیم، به سرعت و شدت با آب واکنش میدهند.
اگر تا اینجای مطلب را مطالعه کردهاید، با مقایسه واکنش پذیری فلزات و روش انجام آن آشنا شدهاید. در ادامه مطلب نیز واکنشهای فلزات را بر اساس آن بررسی میکنیم.
پیشنهاد میکنیم برای مطالعه بیشتر این نوع مطالب و دسترسی همیشگی و رایگان به آنها در موبایل خود، اپلیکیشن رایگان مجله فرادرس را نصب کنید تا همیشه به مطالب مجله فرادرس دسترسی داشته باشید.
برای نصب اپلیکیشن رایگان مجله فرادرس، کلیک کنید.
هر چه به سمت پایین این جدول حرکت کنیم، مقدار جاذبه بین لایه آخر الکترونی فلز (لایه ظرفیت) و هسته اتم افزایش یافته و از دست دادن الکترون برای آنها دشوارتر میشود. زیرا جاذبه هسته بر الکترونهای اتم بسیار زیاد است. در نتیجه، غلبه بر این نیروی جاذبه قوی دشوارتر خواهد بود. به همین دلیل است که فلزاتی مانند طلا و پلاتین، بیشتر برای جواهرسازی استفاده میشوند. زیرا این فلزات به دلیل واکنشپذیری بسیار کم، خیلی دیرتر از سایر فلزات اکسید میشوند.
عوامل موثر بر واکنش پذیری فلزات
عواملی که بر میزان قدرت هسته اتم فلزات بر الکترونهای لایه ظرفیت آنها اثر میگذارند، به شکل مستقیم با واکنشپذیری آنها در ارتباط است. هرچه اثر جاذبه هسته بر الکترونها بیشتر باشد، جدا شدن آنها از اتم سختتر بوده و تشکیل یون و واکنشپذیری آنها کمتر خواهد بود.
بالعکس، هرچه الکترونها آسانتر از اتم فلزی جدا شوند، تشکیل یون و واکنشپذیری راحتتر خواهد بود. عوامل موثر بر واکنشپذیری فلزات موارد زیر هستند.
- تعداد الکترونها
- اثر پوششی الکترون درونی
- اندازه اتم (شعاع اتمی)
- الکترونگاتیوی و الکتروپوزتیوی
- خصلت فلزی
- انرژی یونش
در ادامه اثر عوامل موثر بر واکنشپذیری فلزات را توضیح میدهیم.

تعداد الکترونها
اگر تعداد الکترونها در لایههای بیرونی اتم بسیار کم یا زیاد باشد، آن اتمها واکنش پذیرتر هستند. برای مثال، اتمهای فلزی با یک یا دو الکترون در آخرین لایه الکترونی، راحتتر آنها را از دست داده و واکنش پذیرتر هستند.
همچنین، فلزاتی که تعداد بسیار زیادی الکترون در لایههای الکترونی خود دارند، به دلیل دافعه بین الکترونها، راحتتر میتوانند الکترون از دست داده و یون تشکیل دهند. در نتیجه، واکنشپذیرتر خواهند بود. پیشنهاد میکنیم برای درک بهتر این پدیده، مطلب بارهای جدول تناوبی مجله فرادرس که لینک آن در ادامه آورده شده است را مطالعه کنید.
اثر پوششی الکترون درونی
اثر پوششی الکترون درونی در اتمهایی اتفاق میافتد که تعداد زیادی الکترون در لایههای میانی الکترونی خود دارند. این الکترونها، اثر جاذبه هسته را بر الکترونهای لایه بیرون و لایه ظرفیت کاهش داده و در نتیجه باعث راحتتر جدا شدن آنها میشود. در نتیجه هرچه مقدار اثر پوششی در اتمی بیشتر باشد، آن اتم واکنش پذیرتر است.
اندازه اتمی
هرچه اندازه اتم (شعاع اتمی) بزرگتر باشد، الکترونهای لایه ظرفیت آن در فاصله بیشتری از هسته اتم قرار دراند. به همین دلیل، جدا شدن آنها از اتم راحتتر خواهد بود. به همین دلیل است که فلزی مانند سزیم، نسبت به سدیم واکنشپذیرتر است.
الکترونگاتیوی و الکتروپوزیتیوی
هرچه الکتروپوزیتیوی یک اتم بیشتر و الکترونگاتیوی آن کمتر باشد، بدین معنی است که راحتتر الکترون خود را از دست میدهد. به همین دلیل، تشکیل یون و واکنشپذیری در آن بیشتر است. به همین دلیل است که مقدار واکنشپذیری اتمهای فلزی سمت چپ جدول تناوبی نسبتا بیشتر است.
خصلت فلزی
خصلت فلزی به تمایل اتمهای فلزی به از دست دادن الکترون و تشکیل یون مربوط میشود. در نتیجه، هرچه خصلت فلزی یک اتم فلزی بیشتر باشد، راحتتر یون تشکیل داده و واکنشپذیرتر خواهد بود.
انرژی یونش
انرژی یونش به مقدار انرژی مورد نیاز برای جدا کردن یک الکترون از اتم گفته میشود. بدین ترتیب، هرچه انرژی یونش اتمی بالاتر باشد، جدا کردن الکترون از اتم و تشکیل یون سختتر خواهد بود. بالعکس، هرچه انرژی یونش یک اتم فلزی کمتر باشد، جدا کردن الکترون از آن و تولید یون راحتتر بوده و در نتیجه، واکنش پذیری آن اتم بیشتر خواهد بود.
کاربردهای مقایسه واکنش پذیری فلزات
مقایسه واکنش پذیری فلزات در درک بسیاری از واکنشها و پدیدههای شیمیایی به کار میرود. به کمک مقایسه واکنش پذیری فلزات میتوان فرآورده واکنشهای مختلف را حدس زد، خواص فلزات را شناخت و از آنها در فرآیندهای مختلف برای تولید فرآوردههای مختلف استفاده کرد.
در ادامه برخی از مهمترین کاربردهای مقایسه واکنش پذیری فلزات را توضیح میدهیم.
واکنش های جانشینی یگانه
واکنش جانشینی (جابهجایی) واکنشی است که در آن یک ماده با ماده دیگری در ترکیب دیگر جایگزین میشود. با دانستن مقدار واکنشپذیری هر فلز میتوان متوجه شد که کدام فلز جایگزین شده و آیا واکنش صورت میگیرد یا خیر. در واکنش جابجایی یگانه تنها فلزی با واکنشپذیری بالاتر میتواند جایگزین فلز دیگر شود. برای مثال، در واکنش روی با سولفات مس، روی میتواند جایگزین مس شده ( روی واکنش پذیرتر است) و سولفات روی تولید کند.
اما عکس این واکنش امکان پذیر نبوده و مس نمیتواند جای روی را در ترکیبی مانند روی سولفات بگیرد زیرا واکنشپذیری آن از روی کمتر است.
استخراج فلزات از سنگ معدن
مقایسه واکنش پذیری فلزات به ما این امکان را میدهند که فرآیند صحیح برای استخراج فلزات از سنگ معدن آنها را تشخیص دهیم. برای مثال، فلزات بسیار واکشپذیر مانند آلومینیوم، از طریق فرآیند الکترولیز استخراج میشوند. در حالی که فلزاتی که کمتر واکنشپذیر هستند، مانند آهن را میتوان با استفاده از کاهش کربن به دست آورده و استخراج کرد.
پیشنهاد میکنیم برای درک بهتر این فرآیند، فیلم آموزش اصول استخراج فلزات (پیرومتالورژی) فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
واکنش فلزات با آب و خوردگی فلزات
هنگامی که یک فلز واکنشپذیر با آب واکنش میدهد، یک هیدروکسید فلزی به همراه هیدروژن تولید میشود. برای مثال، فلز سدیم به سرعت و شدت با آب واکنش داده و سدیم هیدروکسید و هیدروژن تولید میکند. معادله این واکنش به شکل زیر است.
فلزاتی که واکنشپذیری کمی دارند مانند طلا و پلاتین، به راحتی وارد واکنش نشده و در برابر خوردگی مقاوم هستند. در مقابل، فلزات واکنشپذیرتر مانند آهن راحتتر خورده میشوند. برای فلزات دیگر، مقدار واکنشپذیری آنها تعیین کننده روشهای محافظت از آنها در برابر خوردگی است. فلزات زیر به راحتی با آب سرد واکنش میدهند.
- پتاسیم
- سدیم
- کلسیم
سایر فلزات به راحتی با آب سرد وارد واکنش نشده ولی میتوانند با بخار آب داغ واکنش دهند و اکسید فلزی و گاز هیدروژن تولید کنند. برای مثال، واکنش فلز منیزیم با بخار آب به شکل زیر است.
واکنش فلزات با اسید
هنگامی که یک اسید رقیق با یک فلز واکنش میدهد، نمک و هیدروژن تولید میشود. برای مثال، از واکنش منیزیم و اسید هیدروکلریک رقیق، منیزیم کلرید و هیدروژن تولید میشود. معادله این واکنش به شکل زیر است.
به همین ترتیب، فلزات میانی موجود در سری واکنشپذیری فلزات، ماند آهن میتوانند با اسیدهایی مانند اسید سولفوریک وارد واکنش شده و نمک و گاز هیدروژن تولید کنند. این واکنش به شکل زیر است. اما این فلزات با آب سرد وارد واکنش نمیشوند.
سری واکنشپذیری و مقایسه واکنش پذیری فلزات به ما کمک میکند تشخیص دهیم کدام فلزات با اسیدها واکنش میدهند. فلزات واکنشپذیر (بالاتر از هیدروژن در سری واکنشپذیری) با سرعت بالایی با اسیدها واکنش میدهند. واکنش بین فلزات پایین سری واکنشپذیری با اسیدهای رقیق امکان پذیر نیست. برخی دیگر از مثالهای واکنش فلزات با اسیدها در ادامه آورده شده است.
- واکنش منیزیم با اسید سولفوریک
- واکنش روی با اسید سولفوریک
واکنش فلزات با اکسیژن
برخی از فلزهای واکنش پذیر، مانند فلزات قلیایی به راحتی با اکسیژن وارد واکنش میشوند. فلزاتی مانند نقره، مس و آهن نیز میتوانند با اکسیژن واکنش دهد اما واکنش این فلزات با اکسیژن مقداری آهستهتر است. هنگامی که یک فلز با اکسیژن واکنش میدهد، اکسید فلزی تولیدمیشود. برای مثال، واکنش فلز مس با اکسیژن به شکل زیر است.
فلز آهن با اکسیژن واکنش نمیدهد.
تشخیص واکنش فلزات
با استفاده از مقایسه واکنش پذیری فلزات میتوان واکنشپذیری آنها و واکنشهایی را که در آنها شرکت میکنند درک کرده و فرآورده آنها را حدس زد. برای درک بهتر این واکنشها بهتر است نکات زیر را به خاطر بسپاریم.
- فلزات با واکنشپذیری بالاتر در واکنش جانشینی، جانشین فلز دیگر میشوند.
- فلزات با واکنشپذیری کمتر نمیتوانند جایگزین فلز فعالتر شوند.
- فلزات فعالتر از هیدروژن، میتوانند جایگزین هیدروژن اسیدها شوند.
- فلزات پایینتر از هیدروژن در سری الکتروشیمیایی به راحتی با اسید واکنش نمیدهند.
- واکنش فلزات با آب به راحتی قابل تشخیص نیست. برای مثال کلسیم به شدت با آب واکنش داده و منیزیم با آب سرد واکنش نمیدهد.
سری واکنش پذیری نافلزات
با وجود اینکه بررسی واکنشپذیری بیشتر برای فلزات انجام میشود، واکنشپذیری برخی از مواد مانند هالوژنها نیز بررسی میشود. نافلزات، برعکس فلزات، تمایل دارند الکترون دریافت کرده و آنیون تشکیل دهند. مقدار واکنشپذیری نافلزات با الکترونگاتیوی و خصلت نافلزی آنها در ارتباط است.
برای هالوژنها، واکنشپذیری در یک گروه از بالا به پایین کاهش مییابد و برعکس الگوی واکنشپذیری فلزات است. از مقایسه واکنشپذیری نافلزات و خصلت نافلزی برای بررسی واکنشهای نافلزات و رفتار آنها در واکنشهای شیمیایی استفاده میشود. در ادامه، لیست سری واکنشپذیری نافلزات ارائه شده است. در این جدول از بالا به پایین، مقدار واکنشپذیری کاهش مییابد.
| نافلز | یون |
| فلوئور | |
| اکسیژن | |
| کلر | |
| برم | |
| ید | |
| گوگرد | |
| فسفر | |
| کربن | |
| هیدروژن |
رابطه واکنش پذیری فلزات و پتانسیل استاندارد الکترود
پتانسیل استاندارد الکترود، مقدارهای عددی پتانسیل الکتریکی واکنش کاهش الکترود فلزی در شرایط استاندارد در سلول الکتروشیمیایی هستند. مقدار پتانسیل استاندارد کاهش فلزات با مقدار واکنشپذیری آنها رابطه کاملا عکس دارند.
در واقع با برعکس کردن سری واکنشپذیری میتوانیم حدودا به سری الکتروشیمیایی فلزات دست پیدا کنیم. با این حال، پتانسیل استاندارد تنها در شرایط استاندارد و کنترل شده قابل استناد و با مقادیر مشخص است. همچنین این موارد تنها در محلول آبی تعریف و اندازهگیری میشوند. در صورتی که سری واکنشپذیری فلزات در هر شرایطی قابل استناد است.
دلیل تفاوت واکنشپذیری فلزات چیست؟
در این مطلب آموختیم مقایسه واکنش پذیری فلزات برای چه هدفی و بر چه اساسی انجام میشود. تفاوت مقدار واکنشپذیری فلزات به دلیل تفاوت آنها در آرایش الکترونی است. تمامی فلزات، تنها یونهای مثبت (کاتیون) تولید میکنند. اما مقدار بار الکتریکی تولید شده توسط هر فلز یا عدد اکسایش آن و قدرت آن در تولید یون و ترکیبات مختلف، به آرایش الکترونی آن بستگی دارد.
برای مثال، در فلزات قلیایی و قلیایی خاکی، فلزات با از دست دادن به ترتیب یک و دو الکترون به آرایش الکترونی گاز نجیب رسیده و پایدار میشوند. به همین دلیل، تمایل آنها به از دست دادن الکترون و رسیدن به آرایش الکترون اوکتت بسیار زیاد است و بسیار واکنش پذیر هستند.
فلزات گرانبهایی که در قطعه d (فلزات واسطه) جدول تناوبی قرار دارند نمیتوانند به آرایش الکترونی گاز نجیب برسند و تنها میتوانند مقدار به پایداری نسبی برسند. همچنین، فلزاتی که تعداد الکترون بیشتری دارند (مانند سزیم) راحتتر الکترونهای لایه ظرفیت خود را از دست داده و به همین دلیل، واکنش پذیرتر هستند.
آزمون مقایسه واکنش پذیری فلزات
برای درک بهتر آنچه در این مطلب از مجله فرادرس آموختید، به سوالات زیر پاسخ دهید. در نهایت میتوانید با کلیک بر روی گزینه «دریافت نتجه آزمون»، تعداد پاسخهای صحیح خود را مشاهده کنید.
تمرین و آزمون
۱. کدام فلزم واکنشپذیرتر است؟
مس
آهن
روی
آلومینیوم
در سری واکنشپذیری، آلومینیوم بالاتر از روی، آهن و مس قرار دارد.
۲. نتیجه واکنش زیر چیست؟
واکنشی رخ نمیدهد.
روی از مس واکنشپذیرتر است و جانشین آن میشود.
۳. نتیجه واکنش زیر چیست؟
واکنش انجام نمیشود.
مس پایینتر از آهن است و نمیتواند جانشین آن شود.
۴. کدام فلز با اسید کلریدریک واکنش میدهد؟
مس
نقره
روی
آهن
روی بالاتر از هیدروژن است و با اسید واکنش میدهد.
۵. واکنش زیر چه فرآوردهای دارد؟
واکنش انجام نمیشود.
۶. کدام فلز با آب سرد به شدت واکنش میدهد؟
آهن
مس
نقره
سدیم
۷. آیا واکنش زیر انجام میشود و فرآورده آن کدام است؟
خیر. واکنش انجام نمیشود.
۸. کدام فلز کمترین واکنشپذیری را دارد؟
آلومینیوم
روی
آهن
نقره
۹. کدام فلز سریعتر با اکسیژن واکنش میدهد؟
مس
آهن
منیزیم
نقره
۱۰. کدام واکنش قطعا انجام میشود؟












