شعاع واندروالسی چیست؟ – توضیح و تفاوت با شعاع کووالانسی
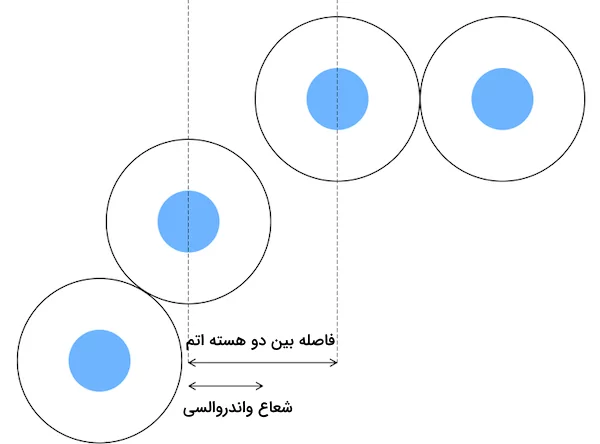
شعاع واندروالسی برابر با نصف فاصله بین دو اتم غیرپیوندی است، زمانی که نیروهای الکترواستاتیکی بین آنها در حالت تعادل قرار دارند. به عبارت دیگر، شعاع واندروالسی نصف نزدیکترین فاصله بین دو اتمی است که پیوند شیمیایی ندارند یا در یک مولکول قرار نگرفتهاند. معمولا این مقدار با واحد پیکومتر (pm) گزارش میشود. شعاع کووالانسی برابر با نصف فاصله بین هسته اتمهایی است که در دو سمت یک پیوند کووالانسی قرار دارند. اندازه شعاع واندروالسی از شعاع کووالانسی بیشتر است زیرا در شعاع واندروالسی مولکولها پیوندی ندارد و الکترونهایشان را به اشتراک نگذاشتهاند. در این مطلب از مجله فرادرس توضیح میدهیم شعاع واندروالسی چیست و چه تفاوتهایی با شعاع کووالانسی دارد.
- خواهید آموخت که شعاع واندروالسی چیست و چگونه تعیین میشود.
- میآموزید چه تفاوتهایی میان شعاع کووالانسی و واندروالسی وجود دارد.
- انواع نیروهای واندروالسی و نقش آنها را یاد میگیرید.
- خواهید توانست روند تغییر شعاع واندروالسی را در جدول تناوبی توضیح دهید.
- یاد میگیرید از معادله واندروالس و مفاهیم فشار و حجم استفاده کنید.
- میآموزید چگونه محدودیتها و دقت شعاع واندروالسی را ارزیابی کنید.


در ابتدای این مطلب میآموزیم شعاع واندروالسی چیست و سپس تفاوتهای این شعاع را با شعاع کووالانسی بین اتمها بررسی میکنیم. سپس برای یادگیری بهتر شعاع واندروالسی، مفهوم شعاع اتمی را دوره میکنیم و به توضیح نیروی واندروالسی و معادله واندروالسی میپردازیم. در ادامه مطلب، روشهای اندازهگیری شعاع واندروالسی را برمیشماریم. سپس میآموزیم روند تغییر شعاع واندروالسی در جدول تناوبی چیست و چگونه باید این پارامتر را برای اتمهای مختلف مقایسه کنیم. در نهایت، مفاهیمی مانند حجم واندروالسی و محدودیتهای تعریف شعاع واندروالسی را توضیح داده و از اهمیت شعاع واندروالسی صحبت خواهیم کرد. با مطالعه این مطلب تا انتها میتوانید با این مبحث مهم آشنا شده و تفاوتها و شباهتهای آن را با سایر انواع شعاع اتمی بیاموزید.
شعاع واندروالسی چیست؟
شعاع واندروالسی به نیمی از فاصله بین هستههای دو اتم مشابه و غیرمتصل یا دو اتم مشابه در مولکولهای همسایه یک عنصر در حالت جامد گفته میشود. نیروی ضعیفی که به عنوان نیروی واندروالس شناخته میشود، به نحوه قرارگیری اتمها در حالت جامد بستگی دارد. بهعنوان مثال، فاصله بین هستههای دو اتم کلر مجاور در حالت جامد برابر با ۳۶۰ پیکومتر است. بنابراین شعاع واندروالس اتم کلر ۱۸۰ پیکومتر محسوب میشود.
شعاع واندرواسی مفهومی است که برای مشخص کردن اندازه اتمها یا مولکولها بر اساس حجمی که اشغال میکنند، بیان میشود. شعاع واندروالسی نشاندهنده تأثیر نیروهای بینمولکولی (مانند نیروهای دوقطبی-دوقطبی و ... ) است. دانستن این موضوع که شعاع واندروالسی چیست، در پیشبینی میزان نزدیکی اتمها برای تشکیل یک جامد مفید است. شعاع واندروالسی که با عبارت () نشان داده میشود، به شعاع یک کره فرضی سخت اشاره دارد که نشاندهنده نزدیکترین فاصله ممکن برای نزدیکی یک اتم به یک اتم دیگر است به شکلی که با یکدیگر پیوندی برقرار نکنند.
این شعاع به نام یوهانس دیدریک واندروالس «Johannes Diderik van der Waals»، برنده جایزه نوبل فیزیک در سال ۱۹۱۰ نامگذاری شده است، زیرا او نخستین کسی بود که نشان داد اتمها تنها نقاطی ساده نیستند و با استفاده از معادله حالت واندروالس، ویژگیهای فیزیکی اندازه آنها را بهطور علمی توضیح داد. تصویر زیر نمایانگر تعریف تئوری شعاع واندروالسی است.

شعاع واندروالسی با استفاده از معادله واندروالس تعیین میشود. این معادله برای حجم و نیروهای جاذبه بین مولکولهای گاز بیان میشود. بر خلاف باقی روشهای اندازهگیری، شعاع واندروالسی اتمها و مولکولها را به صورت حجمهای کروی سخت در نظر میگیرد که مرز الکترونی آنها مشخص باشد. این اتمها و مولکولها میتوانند با یکدیگر تماس داشته باشند اما به شکلی محکم با یکدیگر برهمکنش و پیوندی برقرار نکنند. شعاع واندروالسی معمولا برابر با نصف اندازه فاصله بین هستههای دو اتم یا مولکول که در هیچ پیوندی با یکدیگر برهمکنش ندارند اما به یکدیگر نزدیک هستند بیان میشود. شعاع واندروالسی در درک این موضوع که در مواد جامد و مایع مولکولها چگونه در کنار یکدیگر قرار گرفتهاند کمک میکند.
یادگیری شیمی یازدهم با فرادرس
انواع مختلف شعاع اتمی مانند شعاع کووالانسی و شعاع واندروالسی از مجموعه مباحثی هستند که در کتاب شیمی یازدهم دوره دوم متوسطه بیان میشوند. برای شناخت شعاع اتمی و شعاع واندروالسی ابتدا باید با مفاهیمی مانند رفتارها و خواص مواد فلزی و نافلزها، فعالیت شیمیایی عناصر و پیوندهای شیمیایی آشنا شوید. شناخت و درک مباحث مربوط به شعاع اتمی و شعاع واندروالسی، قدمی مهم در شناخت رفتار اتمها و نحوه قرارگیری و چیدمان آنها در انواع مولکولها است. پیشنهاد میکنیم برای شناخت و یادگیری بهتر این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس پایه یازدهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل میپردازد.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه شعاع اتمی و شعاع واندروالسی دسترسی پیدا کنید.
- فیلم آموزش شیمی ۱ پایه دهم
- فیلم آموزش شیمی ۱ پایه دهم، حل سوالات تشریحی امتحانات نهایی
- فیلم آموزش شیمی دبیرستان، نکته و حل تست کنکور
تفاوت شعاع کووالانسی و شعاع واندروالسی چیست؟
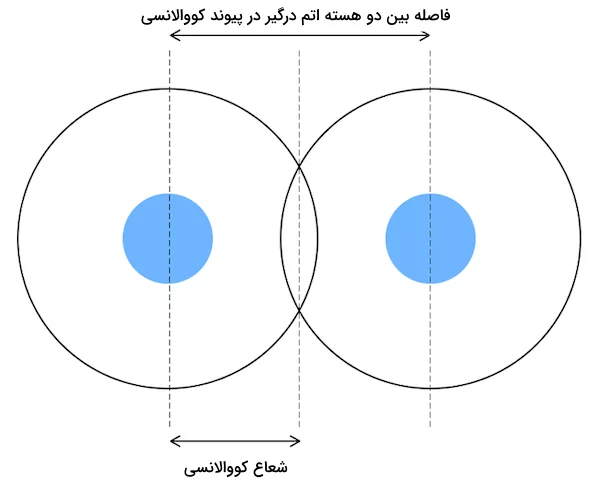
تفاوت شعاع کووالانسی و واندروالسی در این است که طول شعاع واندروالسی بیشتر از شعاع کووالانسی است. همچنین، در پیوند کووالانسی الکترونها به اشتراک کذاشته میشوند درحالی که در شعاع واندروالسی، ابرهای الکترونی همپوشانی ندارند. شعاع کووالانسی () به نیمی از فاصله بین هستههای دو اتم پیوندی تعریف میشود.
این فاصله بین دو اتم پیوندی به عنوان طول پیوند شناخته میشود. شعاع پیوند کووالانسی به نیمی از فاصله بین دو اتم هم نوع که با یک پیوند منفرد کووالانسی به یکدیگر متصل هستند (پیوند همهسته X-X) گفته میشود. به عبارتی دیگر، این شعاع به عنوان نیمی از طول پیوند کووالانسی در صورتی که دو اتم پیوند داده شده هم هسته باشند تعریف میشود. اندازه شعاع کووالانسی اتم در پیوندهای کووالانسی بررسی میشود. تصویر زیر نشاندهنده شعاع اتم کووالانسی است.
حال که تعریف شعاع کووالانسی را آموختیم، باید بررسی کنیم تفاوت آن با پیوند واندروالسی چیست. شعاع واندروالسی به نیمی از فاصله بین هستههای دو اتم مشابه، غیرپیوندی و مجزا یا اتمهای مشابه مجاور در مولکولهای همسایه یک عنصر در حالت جامد گفته میشود. این شعاع تحت تأثیر ضعیفترین نیروها، که با نام نیروهای واندروالس شناخته میشوند، قرار دارد و به چیدمان اتمها در حالت جامد بستگی دارد. شعاع واندروالسی برای دو اتم مشابه به طور معمولا بزرگتر از شعاع کووالانسی آن اتمها است.
دلیل اصلی بزرگتر بودن شعاع واندروالس نسبت به شعاع کووالانسی این است که در تعریف شعاع واندروالس، همپوشانی الکترونی در نظر گرفته نمیشود. وقتی دو اتم یک پیوند کووالانسی تشکیل میدهند، ابرهای الکترونی آنها با یکدیگر همپوشانی میکنند. در واقع، همین همپوشانی میان اوربیتالها باعث تشکیل پیوند کووالانسی میشود.
از آنجا که بخشی از ابرهای الکترونی این دو اتم با هم همپوشانی دارند، اتمها کمی به یکدیگر نزدیکتر میشوند. به همین دلیل، هنگامی که فاصله بینهستهای آنها اندازهگیری و بر ۲ تقسیم میشود، مقدار کوچکتری به دست میآید.
نیروی واندروالسی چیست؟
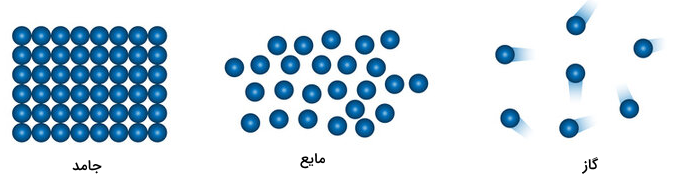
نیروی واندروالسی ضعیفترین نوع از نیروهای بین مولکولی در مولکولهای مواد مختلف است. این نیرو باعث منسجم نگه داشتن ساختار مواد میشود. این نیرو شامل نیروی جاذبه و دافعه بین اتمها و مولکولهای مختلف است. در واقع، نیروی واندروالسی نیرویی است که حالت ماده (جامد، مایع، گاز) را تعیین میکند.
نیروی واندروالسی در مولکولهای جامد بیشتر از مایع و در مایعات بیشتر از مولکولهای گاز است. نیروهای واندروالسی با افزایش بیش از اندازه فاصله اتمها و مولکولها از یکدیگر از بین میروند. به همین علت، اثر این نیروها بیشتر در مورد مواد مایع و جامد بررسی میشود. با شناخت نیروی واندروالسی می توان پی برد شعاع واندروالسی چیست.

نیروی واندروالسی بر خلاف نیروی پیوندهای یونی و کووالانسی، شامل انتقال یا اشتراک الکترون توسط اتمها نیست. در نتیجه، نیروهای واندروالسی از نیروهای یونی و کووالانسی ضعیفتر است. اندازه قدرت نیروهای واندروالسی بین ۰٫۴ کیلوژول بر مول تا ۴ کیلوژول بر مول است. با افزایش فاصله بین اتمها تا ۰٫۶ نانومتر، مقدار نیروی واندروالسی به حداقل مقدار خود میرسد. نیروهای واندروالسی تاثیر مستقیمی در نقطه ذوب، نقطه جوش و ویسکوزیته مواد مختلف دارند. نیورهای واندروالسی محدود به یک جهت نیستند و میتوانند بر مولکولها و اتمهای مجارو خود در تمامی جهات اثر بگذارند.
انواع نیروهای واندروالسی
نیروهای واندروالسی به سه دسته برهمکنش کیسون، نیروی دبای و نیروی پراکندگی لاندن تقسیم میشوند. در ادامه هریک از این نیروها توضیح داده میشوند.
برهمکنش کیسون (دوقطبی - دوقطبی)
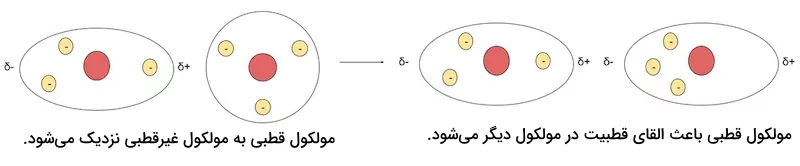
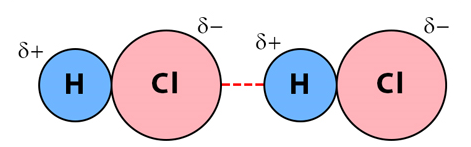
برهمکنش کیسون نوعی از نیروهای بین مولکولی است که از جاذبه الکترواستاتیک بین دوقطبیهای پایدار در مولکولهای قطبی به دست میآید. پیوند هیدروژنی بر اساس نیروی برهمکنش کیسون به دست میآید. این نیرو تنها بین پیوندهای دوقطبی - دو قطبی وجود دارد.
برخی از نمونههای برهمکنش کیسون، پیوند بین اتمها در مولکولهای ، آب، کربن دی اکسید، گوگرد دی اکسید، آمونیاک و ... هستند. تصویر زیر نشاندهنده نیروی واندروالس کیسون در مولکول دو قطبی هیدروژن کلرید است.
نیروی دبای (دو قطبی القایی)
این نیرو از برهمکنش بین دو قطبیهای پایدار و مولکولهای قطبی شده بر اثر گشتاور این دو قطبیها به وجود میآید. این برهمکنشها همواره برقرارند و حتی با افزایش فاصله اتمها در یک مولکول از بین نمیروند. نیروی دبای از مقدار نیروی پراکندگی لاندن قویتر است ولی از نیروی برهمکنش کیسون ضعیفتر است. برخی از نمونههای نیروی دبای، برهمکنشهای بین مولکولی در مولکولهای هیدروژن برمید و یک مولکول غیر قطبی مانند مولکولهای دواتمی یا مولکولهای گازهای نجیب است. تصویر زیر نشاندهنده تشکیل دو قطبی القایی در یک مولکول تحت اثر نیروی یک مولکول قطبی مجارو آن است.
نیروی پراکندگی لاندن (دو قطبی لحظهای)
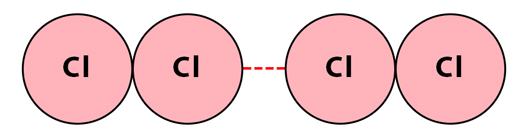
نیروهای پراکندگی لاندن بین هر دو مولکول موجود، برقرار است. این نیروها حتی بین مولکولهای قطبی نیز برقرار است. این نیرو زمانی برقرار میشود که مولکولها در حد تماس به یکدیگر نزدیک شوند و حداقل فاصله ممکن را داشته باشند اما پیوندی تشکیل ندهند. این نیرو گاهی با عنوان نیروی دو قطبی القایی نیز شناخته میشود. این نیرو، از انواع پایدار نیروهای بین مولکولی است . این نیرو در نتیجه قرارگیری ابرهای الکترونی دو اتم مجاور نزدیک یکدیگر و ایجاد دو قطبی لحظهای به وجود میآید. این نوع نیرو از انواع نیروهای واندروالسی موجود است و عامل به وجود آورنده حالت ماده (جامد، مایع یا گاز) است.
دو قطبیهای لحظهای در اثر حرکت الکترونها در اطراف اتم و تجمیع بیشتر آنها در یک سمت اتم در اثر نیروهای خارجی لحظهای به وجود میآید. به بیان سادهتر، با حرکت الکترونها و تحت تاثیر قرار گرفتن آنها توسط الکترونهای دیگر اتمها، بیشتر در یک سمت اتم تجمع میکنند. این تجمع الکترونی باعث به وجود آمدن یک دوقطبی ناپایدار لحظهای میشود. خود این دوقطبیهای لحظهای میتوانند دو قطبیهای لحظهای دیکری در مولکولها و اتمهای مجاور به وجود بیاورند. تصویر زیر نشاندهنده نیروی لاندن بین دو مولکول دو اتمی کلر است.
عوامل موثر بر نیروی واندروالسی
عوامل مختلفی میتوانند بر مقدار نیروی واندروالسی در مولکولهای مختلف تاثیر بگذارند. از این عوامل میتوان به اندازه مولکول، شکل مولکول، قطبیت مولکول، گشتاور دوقطبی مولکول، سطح در دسترس و دما اشاره کرد. در ادامه اثر هر یک از این عوامل بررسی خواهد شد.
اثر اندازه مولکول
مولکولهای با اندازه بزرگتر باعث به وجود آمدن نیروهای واندروالس قویتر میشود. زیرا بزرگتر بودن اندازه مولکول باعث افزایش قطبیت مولکول میشود. ایجاد دوقطبیهای القایی برای مولکولهای بزرگ، راحت تر از مولکولهای کوچک است.
اثر شکل مولکول
شکل مولکولها تأثیر مهمی در قدرت نیروی بین مولکولی آنها دارد. مولکولهایی با شکل خطی میتوانند به یکدیگر نزدیکتر شده و سطح تماس در دسترس بیشتری به نسبت مولکولهایی با اشکال دیگر داشته باشند. مولکولهای شاخهای، نیروی واندروالسی ضعیفتری دارند.
اثر قطبش پذیری مولکول
مولکولهایی که ابر الکترونی آنها بیشتر تحت تاثیر قرار میگیرند، نیروهای واندروالسی قویتر دارند. قطبش پذیری یک مولکول به این موضوع اشاره دارد که ابر الکترونی اطراف یک مولکول تا چه اندازه میتواند تحت اثر نیروهای خارجی قرار بگیرد. مولکولهایی که بزرگتر هستند، ابر الکترونی بزرگتری داشته و راحتتر قطبی میشوند.
گشتاور دوقطبی
نیروهای واندروالسی برای مولکولهایی با گشتاور دوقطبی بزرگتر، قویتر است. نیروهای واندروالس برای مولکولهای قطبی و غیر قطبی وجود دارند. مولکولهای قطبی، میتوانند به شکلی قرار بگیرند که قطب مثبت و منفی آنها یکدیگر را جذب کند.
سطح تماس
با افزایش سطح در دسترس مولکولها، نیروهای واندروالس قویتر خواهند بود. اندازه سطح در دسترسی که مولکولها در اختیار مولکولها و اتمهای مجاور آنها قرار میدهند، میتواند به شکل مستقیمی با نیروهای واندروالس در ارتباط باشد.
اثر دما
افزایش دما میتواند باعث ضعیف شدن نیروهای واندروالسی شود . این پدیده به این علت است که افزایش انرژی سینتکی که در اثر افزایش دما به وجود میآید میتواند باعث شود مولکولها راحتتر بر نیروهای ضعیف واندروالسی غلبه کنند. در مقابل، کاهش دما میتواند باعث افزایش نیروهای واندروالسی شود.
شناخت خواص و ساختار مولکولها یک قدم اساسی در شناخت پیوندهای شیمیایی و نوع حالات ماده است. پیشنهاد میکنیم برای یادگیری بهتر ساختار و خواص مولکولها، فیلم آموزش مولکول چیست فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
معادله واندروالسی چیست؟
معادله واندروالس رابطهای را بین حجم گازها (گاز ایدهآل) و نیروهای بین مولکولی آنها بیان میکند. معادله واندروالس برای گازها به شکل زیر بیان میشود.
که در این رابطه، p فشار اندازهگیری شده، V حجم گاز بر اساس مول، a و b ثابتهای معادله مربوط به مولکولهای گاز ، R ثابت جهانی گازها و T دما است. با استفاده از این معادله میتوان به اطلاعات ارزشمندی در زمینه رفتار مولکولها به شکل غیر پیوندی دست یافت.
شعاع اتمی چیست؟
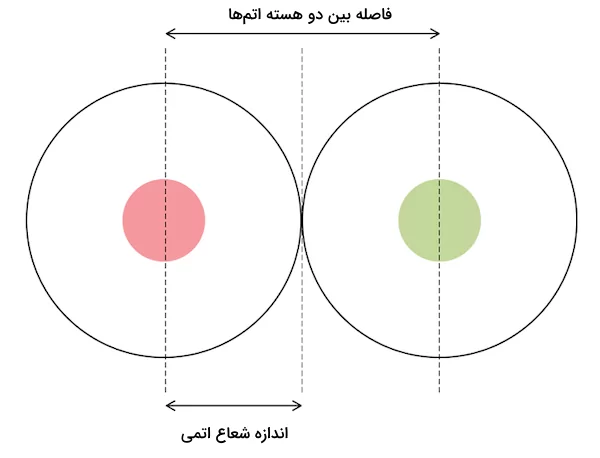
شعاع اتمی، اندازه فاصله مرکز هسته اتم تا دورترین لایه الکترونی ( لایه ظرفیت) آن اتم است. شعاع اتمی یک عنصر شیمیایی، معیاری برای اندازه اتم است. این شعاع به طور معمول به فاصله بین مرکز هسته تا مرز اتم که الکترونها آن را احاطه کردهاند، اشاره دارد. شعاع اتمی به سه تعریف متداول تقسیم میشود: شعاع یونی، شعاع واندروالسی و شعاع کووالانسی. اندازه دقیق و عملی شعاع اتمی قابل اندازهگیری نیست زیرا بر اساس اصل عدم قطعیت هایزنبرگ، الکترونها در مدارهای خود ثابت باقی نمیماانند و موقعیت آنها نمیتواند با دقت بالایی ارزیابی و تعیین شود.
در بیشتر تعاریف، شعاع اتمی اتمهای خنثی بین ۳۰ تا ۳۰۰ پیکومتر (یا بین ۰٫۳ تا ۳ آنگستروم) متغیر است. شعاع اتمی بیش از ۱۰،۰۰۰ برابر شعاع هسته است که بین ۱ تا ۱۰ پیکومتر قرار دارد. شعاع اتمی کمتر از یکهزارم طول موج نور مرئی (۴۰۰ تا ۷۰۰ نانومتر) است. تصویر زیر نمایانگر شعاع اتمی به دست آمده از فاصله بین دو هسته اتم مشابه است. شعاع اتمی معمولا از شعاع غیر پیوندی واندروالسی بزرگتر است زیرا در هنگام تشیل پیوند، اتمها الکترونهای خود را به اشتراک میگذارند و این پدیده باعث نزدیکی بیشتر هسته اتمها و کوچکتر شدن اندازه شعاع اتمی خواهد شد.
از آنجا که لایههای الکترونی به شکلی دقیق و با قطعیت وجود ندارند، تعاریف متفاوتی برای شعاع اتمی میتواند بیان شود. شعاع اتمی عناصر مختلف میتواند تحت اثر عوامل زیر، تغییر کند. این عوامل به شرح زیر هستند.
- تعداد پیوندهایی که اطراف عنصر وجو دارد و نوع این پیوندها ( یگانه، دوگانه یا سهگانه)
- عدد اکسیداسیون (عدد اکسایش) اتم، که تعداد الکترونهای درگیر در پیوندها را مشخص میکند.
- درصد یونی بودن پیوندهای اتم
- عدد کئوردینانسیون اتم
- اثر دافعه اتمها
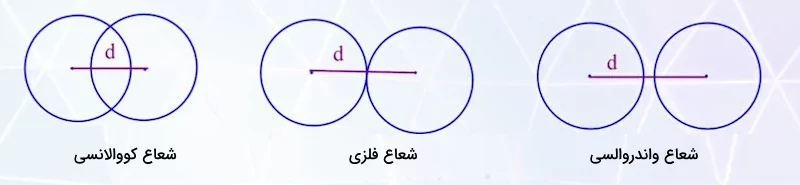
شعاع اتمی عناصر مختلف با عباراتی مانند شعاع کووالانسی، شعاع واندروالسی، شعاع یونی، شعاع فلزی، شعاع کریستالی و ... تعریف میشود. هریک از این تعاریف، شعاع اتم را در انواع پیوندهای شیمیایی مختلف بیان میکند. تصویر زیر، نشاندهنده شعاع کووالانسی، شعاع فلزی و شعاع واندروالسی اتم است.
در ادامه هریک از این انواع دیگر شعاع اتمی را توضیح میدهیم.
شعاع کووالانسی
شعاع کووالانسی، به فاصله بین هستهای یا فاصله بین دو اتم یکسان که با یک پیوند کووالانسی به یکدیگر متصل شدهاند گفته میشود. شعاع کووالانسی، نصف فاصله بین هسته این اتمها است. تصویر زیر نشاندهنده شعاع کووالانسی اتم است.
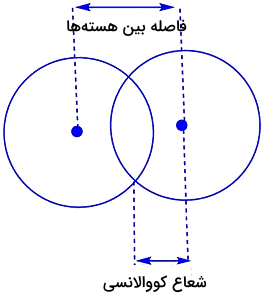
برای مولکولهای دواتمی مانند، و ... شعاع کووالانسی میتواند برابر با نصف طول پیوند کووالانسی درنظر گرفته شود. برای مولکولهای دواتمی با دو عنصر متفاوت، فاصله بین دو هسته اتم برابر با جمع شعاع کووالانسی هر دو اتم است. برای مثال، اگر اتمهای A و B با یک پیوند کووالانسی به یکدیگر متصل شده باشند، فاصله بین دو هسته اتم برابر با شعاع کووالانسی اتمهای A و B خواهد بود.
شعاع یونی
شعاع یونی برابر با فاصله بین مرکز هسته اتم و دورترین الکترون یا لایه الکترونی یک یون تعریف میشود. در شعاعهای یونی، همواره شعاع کاتیون کوچکتر از شعاع اتمی اتم خنثی است. به همین ترتیب، شعاع یونی آنیون همواره بزرگتر از شعاع اتمی اتم خنثی آن است. عواملی مانند اثر پوششی الکترونهای درونی و بار موثر هسته اتم باعث تحت تاثیر قرار گرفتن شعاع یونی یونهای مختلف میشود.
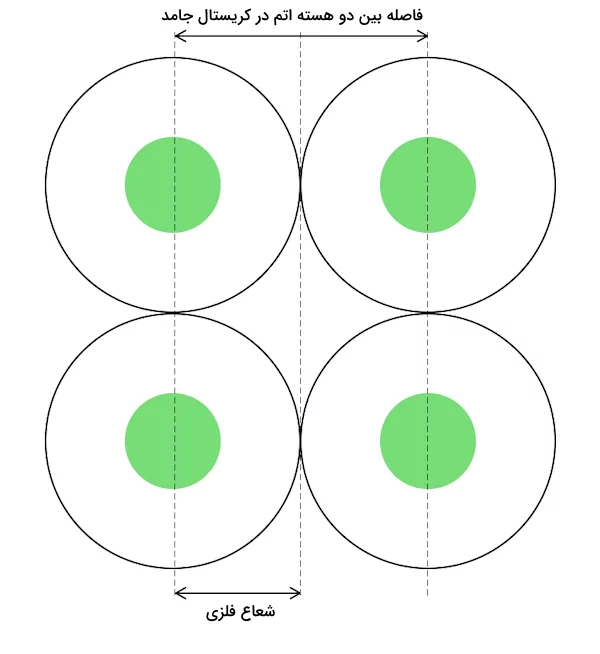
شعاع فلزی
شعاع فلزی برابر با نصف فاصله بین هستهها اتمهای مجاور درگیر در پیوند فلزی موجود در یک کریستال جامد است. این اتمها در کریستال جامد به وسیله پیوندهای فلزی به یکدیگر متصل شدهاند. پیوندهای فلزی عموما ضعیفتر از پیوند کووالانسی هستند و هسته اتمهای درگیر در این گونه پیوندها، اثر جاذبه کمتری به یکدیگر وارد میکنند. به همین علت، ابر الکترونی در این گونه پیوندها همپوشانی ندارد. این پدیده باعث میشود اندازه شعاع فلزی از شعاع کووالانسی بزرگتر باشد.
بار موثر هسته اتم چیست؟
بار موثر هسته اتم، مقدار تاثیر بار مثبت هسته اتم در جذب الکترونهای یک اتم است. اتمها از هستههایی کوچک و متمرکز، متشکل از پروتونها با بار مثبت و نوترونهای خنثی تشکیل شدهاند. الکترونها در مدارهایی ابری در اطراف هسته اتم در حال حرکت هستند. این الکترونها بار منفی دارند و توسط هسته اتم در جای خود نگه داشته میشوند. این بار مثبت هسته به اندازهای است که الکترونها در جای خود قرار بگیرند و نه مدار الکترون خود را ترک کنند و نه به هسته اتم بچسبند.
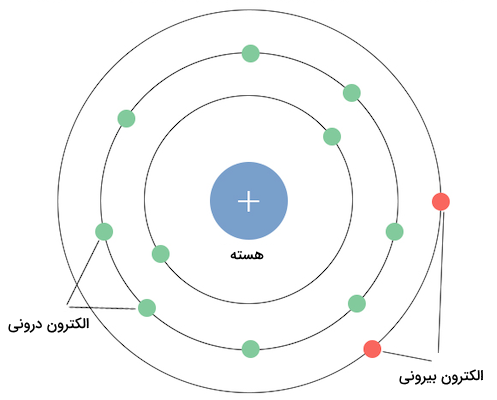
میزان بار موثر هسته اتم با عبارت انگلیسی «» نمایش داده میشود. الکترونهای دورتر از هسته و الکترونهای لایه ظرفیت به اندازه سایر الکترونها اثر این بار مثبت هسته اتم را حس نمیکنند. این پدیده به این علت است که الکترونهای لایههای درونی تا حدودی این اثر را برای الکترونهای لایههای بیرونی خنثی میکنند. بار موثر هسته اتم تاثیر به سزایی در اندازه اتم و شعاع اتمی دارد. با کاهش اثر بار مثبت هسته اتم، اندازه شعاع اتمی افزایش مییابد. در واقع هرچه هسته اتم بتواند الکترونها و ابرهای الکترونی را بیشتر جذب کند، باعث کوچکتر شدن اندازه اتم و شعاع اتمی میشود.
اندازهگیری شعاع واندروالسی
شعاع واندروالسی را میتوان با روشهای مختلفی تعیین کرد. این روشها به شرح زیر هستند.
- نقطه بحرانی گازها
- اندازهگیری فواصل اتمی میان جفت اتمهای غیرمتصل در بلورها
- اندازهگیری خواص الکتریکی یا نوری مانند قطبش پذیری و شکست پذیری مولی
برای تعیین شعاع واندروالسی یک عنصر، ابتدا باید دو اتم از آن عنصر را به نزدیکترین فاصله ممکن از یکدیگر رساند. در این حالت، فاصله بین هستههای دو اتم (فاصله بینهستهای) اندازهگیری میشود و سپس بر ۲ تقسیم میگردد. توجه داشته باشید که این اتمها با یکدیگر پیوند ندارند، بلکه فقط بسیار نزدیک به هم اما بدون همپوشانی قرار گرفتهاند.
روند تغییر شعاع واندروالسی در جدول تناوبی
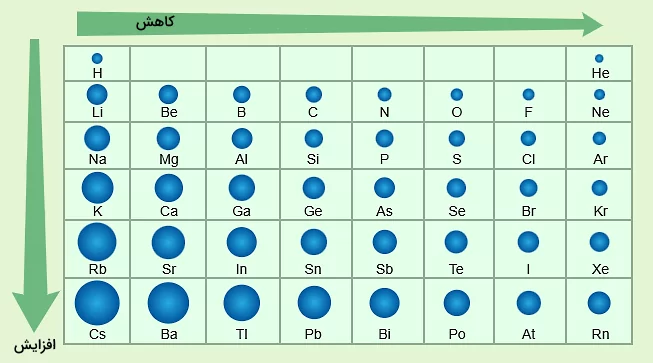
تا اینجا اموختیم نیرو و شعاع واندروالسی چیست. شعاع واندروالسی در یک گروه از بالا به پایین افزایش، و در یک ردیف از چپ به راست کاهش مییابد. شعاع واندروالسی مانند شعاع اتمی در جدول تناوبی تغییر میکند. روند این تغییر برآیندی از تعداد پروتونها و الکترونهای اتمها، آرایش الکترونی لایه ظرفیت آنها، اثر پوششی الکترونهای درونی و بار موثر هسته اتم است.
درک روندهای تناوبی برای پیشبینی رفتار و ویژگیهای عناصر بسیار مهم است. شعاع اتمی در جدول تناوبی الگوی مشخصی دارد. در یک گروه از بالا به پایین، شعاع اتمی افزایش مییابد زیرا لایههای الکترونی جدیدی اضافه میشوند که اندازه اتم را با وجود افزایش بار هستهای بزرگتر میکند. برعکس، در یک دوره از چپ به راست، شعاع اتمی کاهش مییابد زیرا بار موثر هستهی اتم بیشتر میشود. این بار مثبت قویتر، الکترونها را به هسته نزدیکتر میکند و اندازه اتم را کاهش میدهد. این روندها تعادل بین اثر پوششی الکترونها و بار مؤثر هستهای تجربه شده توسط الکترونهای لایه خارجی را نشان میدهند.
مفهوم شعاع واندروالسی بهطور مستقیم با استفاده از از این روندهای تناوبی توجیه میشود. با افزایش شعاع اتمی در یک گروه از بالا به پایین، شعاع واندروالسی نیز افزایش مییابد. دلیل این موضوع این است که شعاع واندروالسی نشان دهنده اندازه ابر الکترونی در زمانی است که اتم به اتم دیگری پیوند ندارد، و لایههای الکترونی اضافی این ابر را بزرگتر میکنند. بنابراین، در یک گروه انتظار میرود که شعاعهای واندروالسی مانند شعاعهای اتمی از بالا به پایین افزایش یابند.
شعاع واندروالسی در هر گروه
شعاع واندروالسی در یک گروه از بالا به پایین افزایش مییابد. هر لایه الکترونی اضافی اندازه یک اتم را افزایش میدهد، زیرا الکترونهای خارجیتر را دورتر از هسته قرار میدهد. علاوه بر این، این الکترونها کمتر به هسته جذب میشوند، زیرا لایههای داخلی تا حدی بار هسته را از الکترونهای خارجیتر محافظت میکنند. این اثر حفاظتی، همراه با افزایش تعداد لایههای الکترونی، باعث میشود شعاع واندروالس در یک گروه افزایش یابد.
شعاع واندروالسی در هر ردیف (دوره)
در هر دوره جدول تناوبی شعاع اتمی و به دنبال آن، شعاع واندروالسی از چپ به راست کاهش مییابد. این پدیده به این علت است که اثر بار مثبت هسته اتم بر الکترونهای لایه ظرفیت افزایش یافته و این الکترونها بیشتر به سمت هسته کشیده میشوند. در نتیجه، اندازه کلی اتم کاهش مییابد.
برای مثال به جدول زیر که نمایانگر شعاع واندروالسی چند اتم در یک ردیف است توجه کنید.
| اتم | شعاع واندروالسی |
| بور | ۲۰۸ |
| کربن | ۱۸۵ |
| نیتروژن | ۱۵۴ |
| اکسیژن | ۱۴۰ |
| فلوئور | ۱۳۵ |
برخی از خواص اتمها در جدول تناوبی به صورت دورهای و با الگوی خاصی تغییر میکنند. این پدیده به این علت است که اتمها در جدول تناوبی به ترتیب افزایش عدد اتمی قرار گرفتهاند. پیشنهاد می کنیم برای یادگیری بهتر این خواص، مطلب قانون دورهای عنصرها را در مجله فرادرس مطالعه کنید. لینک این مطلب در ادامه درج شده است.
مقایسه شعاع واندروالسی
در قسمتهای قبل آموختیم شعاع واندروالسی چیست و چگونه در جدول تناوبی تغییر میکند. شعاع واندروالسی اندازه فاصله هسته دو اتم مجاور است که با یکدیگر پیوند شیمیایی نداشته باشند. در ادامه برای درک بهتر روند تغییر شعاع واندروالسی، گروه هالوژنها را بررسی خواهیم کرد. اتمهای فلوئور، کلر و برم به گروه هالوژنها تعلق دارند. با حرکت در گروه از بالا ( اتم فلوئور) به پایین (اتم برم)، تعداد لایههای الکترونی افزایش مییابد.
با توجه به آرایش الکترونی هریک از این اتمها در مییابیم که در اتم فلوئور، ۲ لایه الکترونی، اتم کلر ۳ لایه الکترونی و اتم برم ۴ لایه الکترونی دارد. با افزایش تعداد لایههای الکترونی به اتمهای یک گروه، اندازه شعاع اتمی آنها و به دنبال آن اندازه شعاع واندروالسی آنها افزایش مییابد.
در جدول زیر، مقادیر شعاع واندروالسی برای هریک از این اتمها بر حسب آنگستروم مشخص شده است.
| اتم | شعاع واندروالسی |
| فلوئور | ۱٫۵ |
| کلر | ۱٫۸ |
| برم | ۲٫۰۰ |
| ید | ۲٫۱۵ |
این مقادیر اندازهگیری شده با استفاده از محاسبات مربوط به حجم مولی این اتمها در مواد متراکم به دست آمده است. مقادیر شعاع واندروالسی در اتمهای مختلف با توجه به روش اندازهگیری آنها میتواند متغیر باشد. با اینحال، روندهای تغییر ارائه شده برای اتمها در هر گروه و ردیف یکسان خواهد بود. تصویر زیر، نموداری مقایسهای برای اندازه شعاع واندروالسی اتمهای مختلف جدول تناوبی را نمایش میدهد.
مثال
اتمهای اکسیژن، نیتروژن و فلوئور را بر اساس افزایش اندازه شعاع واندروالسی مرتب کنید. توضیح دهید برای این اتمها روند تغییر شعاع واندروالسی چیست.
پاسخ
برای پاسخ به این سوال باید روند تغییر شعاع اتمی در جدول تناوبی و اثر بار موثر هسته و اثر پوششی الکترونی را در نظر بگیریم. برای پاسخ بهتر و دقیق تر به این سوال، لازم است ابتدا موقعیت هر عنصر را در جدول تناوبی به همراه تعداد پروتونها و الکترونهای آن (عدد اتمی) مشخص کنیم. اتم اکسیژن در گروه ۱۶ و ردیف دوم و اتم نیتروژن در گروه ۱۵ و ردیف دوم جدول تناوبی هستند. اتم اکسیژن ۸ الکترون و پروتون و اتم نیتروژن ۷ الکترون و پروتون دارد. اتم فلوئور در گروه ۱۷ جدول تناوبی و ردیف دوم قرار دارد. عدد اتمی این عنصر برابر با ۹ است.
حال با دانستن موقعیت این اتمها میتوانیم در مورد روند تغییر شعاع واندروالسی آنها تصمیمگیری کنیم. در هر ردیف از چپ به راست اندازه شعاع واندروالسی کاهش مییابد. پس شعاع واندروالسی اتم فلوئور کوچکتر از اکسیژن و شعاع واندروالسی اتم اکسیژن کوچکتر از اتم نیتروژن است.
حجم واندروالسی چیست؟
حجم واندروالسی که با نام حجم اتمی یا حجم مولکولی نیز تعریف میشود، کمیتی مربوط به اتمها است که به شکلی مستقیم با شعاع واندروالسی آنها در ارتباط است. حجم واندروالسی را میتوان با استفاده از شعاع واندروالسی برای مولکولها به دست آورد. برای یک اتم مجزا، حجم کره اتم آن با استفاده از مقدار شعاع واندروالسی از طریق زیر به دست میآید.
حجم واندروالسی با استفاده از سطح اتمها در حالت غیرپیوندی محاسبه میشود. حجم واندروالسی یک مولکول همواره کوچکتر از جمع حجم اتمهای مجزا است. زیرا اتمها در حالت پیوندی و مولکولی، الکترونهای خود را به اشتراک گذاشته و به یکدیگر نزدیکتر میشوند. حجم واندروالسی یک اتم یا مولکول همچنین با استفاده از اندازهگیریهای تجربی درباره گازها تعیین میشود.
این اندازهگیریها در مقایاس ماکروسکوپی انجام شده و در نهایت حجم واندروالسی مولی گازها را تعیین میکند. برای به دست آوردن حجم واندروالسی یک اتم تنها، باید حجم واندروالسی مولی آن را بر عدد آووگادرو تقسیم کنیم. توجه داشته باشید که حجم مولی نباید با حجم مولی واندروالسی اشتباه گرفته شود. حجم مولی واندروالسی اتمها حدود یک هزارم برابر حجم مولی گاز در دما و فشار استاندارد است.
محدودیت های شعاع واندروالسی
شعاع واندروالسی بر اساس اندازه شعاع اتمی عناصر مختلف تعیین میشود. مفهوم شعاع اتمی خود محدودیتهایی دارد که باعث میشود اندازه شعاع واندروالسی یک مفهوم نظری باشد و تعیین دقیق آن دشوار باشد. محدودیتهای این تعاریف در ادامه آورده شده است.
- شعاع اتمی یک عنصر بر اساس دانسیته الکترونی و مفهوم ابر الکترونی بیان شده است که خود مقدار دقیق و مرزبندی مشخصی به صورت عملی ندارد.
- شعاع اتمی معمولا برای اتمهای تنها در نظر گرفته میشود. در صورتی که اندازه گیری شعاع اتمی یک اتم تک ممکن نیست و مقادیر شعاع اتمی از روی فواصل و طول پیوندهای مختلف کووالانسی یا یونی اندازهگیری میشود.
- مقادیر شعاع اتمی به دست آمده به دلیل وجود نیروهای خارجی اعمال شده توسط اتمهای مجاور میتواند مقادیر متفاوتی داشته باشد.
- شعاع اتمی معمولا در یک بعد اندازهگیری میشود. این مقادیر اطلاعاتی درباره شکل سهبعدی اتم یا توزیع الکترونی واقعی آن ارائه نمیکند.
- شعاع اتمی بر اساس اندازه گیریهای متفاوت و روشهای مختلف تئوری بیان میشود.
- انجام روشهای متفاوت برای این اندازهگیریها باعث میشود مقادیر متفاوتی برای شعاع اتمی و به دنبال آن شعاع واندروالسی به دست بیاید.
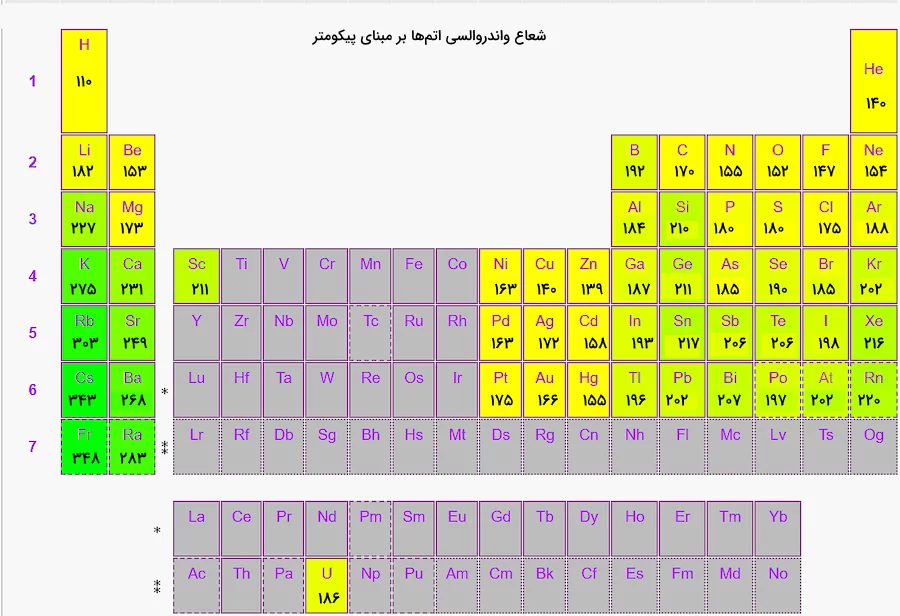
تصویر زیر نشاندهنده مقدار شعاع واندروالسی اندازهگیری شده برای برخی از اتمهای موجود در جدول تناوبی است. برای مواردی که با رنگ خاکستری مشخص شدهاند، اندازه شعاع واندروالسی اندازه گیری نشده است. مقادیر شعاع واندروالسی در این تصویر بر حسب پیکومتر بیان شدهاند. همچنین، با توجه به این تصویر میتوان تشخیص داد روند تغییر شعاع واندروالسی چیست.
اهمیت شعاع واندروالسی
درک این مفهوم که شعاع واندروالسی چیست برای کسب اطلاعات در مورد نحوه قرارگیری اتمها و مولکولها در مواد مختلف حیاتی است. با شناخت شعاع واندروالسی و نیروهای واندروالسی میتوانیم دریابیم که اتمها چگونه در حالت مایع و جامد مواد در کنار یکدیگر قرار گرفتهاند.
همچنین، دانستن این موضوع که شعاع واندروالسی چیست، برای پیشبینی رفتار مولکولها مخصوصا در مواد بزرگ و پیچیده ضروری است. شعاع واندروالسی در تصویرسازی شکل مولکولها، مطالعه برهمکنش مولکولها و واکنشهای شیمیایی و مطالعه اندازه و ساختار مولکولی مواد نقشی عمده و حیاتی دارد.
یادگیری شیمی دانشگاهی با فرادرس
شعاع واندروالسی یکی از مهمترین مباحث مطرح شده در شناخت ساختارهای جامد و مایع مولکولی است. با یادگیری خواص نیروهای واندروالسی و دانستن اینکه شعاع واندروالسی چیست، میتوان بسیاری از رفتارهای مواد را در مقیاس مولکولی پیشبینی کرد. برای یادگیری شعاع واندروالسی اتمها و معادله واندروالس، ابتدا باید با مباحثی مانند پیوند شیمیایی و انواع آن (کووالانسی و پیوند یونی) آشنا شوید. همچنین، شناخت ساختار اتم و آرایش الکترونی نیز میتواند قدمی مهم در درک ساختارهای جامد با پیوندهای واندروالسی باشد. پیشنهاد میکنیم برای یادگیری بیشتر درباره این مباحث و مفاهیم، به مجموعه فیلم آموزش دروس شیمی از دروس دانشگاهی تا کاربردی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازند.
همچنین، با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آمده است، میتوانید به آموزشهای بیشتری در زمینه پیوند واندروالسی دسترسی داشته باشید.
- فیلم آموزش کریستالوگرافی یا بلورشناسی جامع و کاربردی
- فیلم آموزش شیمی عمومی ۱ و ۲ مرور و حل مساله
- فیلم آموزش آزمایشگاه شیمی عمومی به زبان ساده
جمعبندی
در این مطلب از مجله فرادرس آموختیم شعاع واندروالسی چیست. شعاع واندروالسی به فاصله بین دو اتم غیر پیوندی گفته میشود که کمترین فاصله ممکن را با یکدیگر دارند. شعاع واندروالسی با واحد پیکومتر یا آنگستروم سنجیده میشود. شعاع واندروالسی معمولا از شعاع کووالانسی بزرگتر است زیرا در پیوندهای واندروالسی، الکترون بین اتمها به اشتراک گذاشته نمیشود.
شعاع واندروالسی در جدول تناوبی مانند شعاع اتمی تغییر میکند. در هر گروه شعاع واندروالسی از بالا به پایین افزایش مییابد و در هر دوره از چپ به راست کاهش مییابد. شناخت شعاع واندروالسی و نیروهای واندروالسی بین اتمها به درک حالت و ساختار ماده، اندازه مولکولها و برهمکنش بین اتمها کمک میکند.