حالت برانگیخته اتم چیست؟ – در شیمی و به زبان ساده
حالت برانگیخته اتم یا اتم برانگیخته، اتمی است که الکترون یا الکترونهای آن انرژی دریافت کرده و حالت پایه اتم را ترک کرده و به سطوح انرژی بالاتر رفتهاند. حالت برانگیخته اتم ناپایدار است و الکترونهای برانگیخته با از دست دادن انرژی دریافت شده، دوباره به حالت پایه باز میگردند. الکترونها در حالت عادی در حالت پایه قرار دارند و تنها در صورتی که میزان مشخصی انرژی دریافت کنند برانگیخته میشوند. این میزان انرژی باید دقیقا برابر با اختلاف انرژی بین حالت اولیه و ثانویه الکترون باشد. الکترونها پس از جذب انرژی میتوانند به اوربیتالها و سطوح انرژی بالاتر رفته و سپس با دفع انرژی به صورت فوتون یا نور، به حالت پایه برسند. در این مطلب از مجله فرادرس توضیح میدهیم حالت برانگیخته اتم چیست و ویژگیهای آن و تفاوت آن با حالت پایه اتم را بررسی میکنیم.
- یاد میگیرید که حالت برانگیخته و شرایط وقوع آن چیست.
- خواهید آموخت چگونه انتقال الکترون منجر به انتشار نور میشود.
- یاد میگیرید قوانین اصل آفبا، هوند و طرد پائولی را به کار ببرید.
- خواهید توانست تفاوت حالت پایه و برانگیخته را تحلیل کنید.
- نقش طیفسنجی و خطوط طیفی در شیمی را میآموزید.
- رابطه فرمولی انرژی فوتون و طول موج را یاد خواهید گرفت.


در ابتدای این مطلب میآموزیم حالت برانگیخته اتم چیست و چه ویژگیهایی دارد. سپس برای درک بهتر این حالت، ساختار اتم را بررسی میکنیم. پس از مرور ساختار و آرایش الکترونی اتم، به بررسی آرایش الکترونی اتم در حالت برانگیخته میپردازیم. سپس تفاوتهای حالت پایه اتم و حالت برانگیخته اتم را برمیشماریم و مفهوم نشر اتمی را در مورد اتمهای برانگیخته توضیح میدهیم. در ادامه در مورد پایستگی انرژی در اتمها توضیح میدهیم و در انتهای مطلب، مثالهای روزمره حالت برانگیخته اتم را نام میبریم. با مطالعه این مطلب تا انتها میتوانید با این مفهوم مهم و ویژگیهای آن به شکلی کامل و کاربردی آشنا شوید.
حالت برانگیخته اتم چیست؟
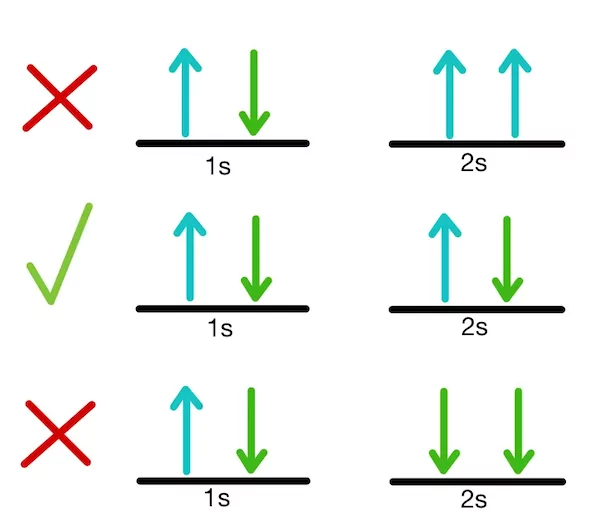
الکترونهای بیرونیترین لایه الکترونی، الکترون ظرفیت نام دارند. هنگامی که یک اتم انرژی حراراتی یا نور دریافت میکند، الکترون یا الکترونهای ظرفیت میتوانند این انرژی را جذب کرده و به لایههای الکترونی دیگر یا سایر اوربیتالها بروند (بپرند). در صورت انجام این اتفاق گفته میشود اتم در حالت برانگیخته است. در تصویر زیر، انتقال الکترون از حالت پایه به یکی دیگر از لایههای الکترونی نشان داده شده است.
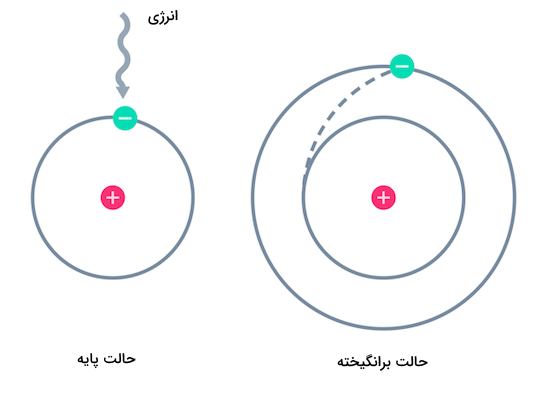
هنگامی که یک اتم انرژی حرارتی یا نور دریافت میکند، باید جابهجا شود تا انرژی دریافت شده را با این حرکت، مصرف کند. الکترونها تنها میتوانند در اوربیتالها با فاصله و انرژی مشخصی جابهجا شوند. به همین علت، الکترونها تنها مقادیر مشخصی انرژی دریافت میکنند. مقدار این انرژی به نور یا فوتونهای مشخص با طول موجی مشخص مربوط است. انرژی که یک اتم دریافت میکند الکترون را به اوربیتالهای دیگر میفرستد و اتم به حالت برانگیخته میرود. حالت برانگیخته اتم بسیار ناپایدار است و الکترون به سرعت به حالت پایه بازمیگردد. با برگشتن الکترون به حالت پایه، باید انرژی دریافت شده را به صورتی آزاد کند. این انرژی به صورت یک فوتون نور آزاد میشود. فوتون آزاد شده، مقدار مشخصی انرژی دارد که به یک موج الکترومغناطیسی با طول موجی مشخص مربوط میشود. با بازگشت الکترون به حالت پایه، انرژی آزاد شده به صورت نور دیده میشود.
مقدار انرژی بیشینهای که الکترون میتواند دریافت کند و هنوز جزوی از اتم باشد، مقدار مشخصی دارد. اگر الکترون بیش از این مقدار بیشینه انرژی دریافت کند، از اتم جدا شده و یون تولید میکند. برای انتقال الکترون به لایهها یا اوربیتالهای بالاتر و برانگیخته شدن، الکترون باید مقدار انرژی مشخصی که دقیقا برابر با فاصله بین اوربیتال الکترون و اوربیتال بالاتر است را دریافت کند.
یادگیری شیمی دهم با فرادرس
حالت پایه و برانگیخته اتم، از مباحثی هستند که در کتاب شیمی پایه دهم متوسطه بیان میشوند برای یادگیری این مباحث ابتدا باید با مباحثی مانند ساختار اتم، الکترون، آرایش الکترونی، اصل آفبا و ... آشنا شوید. پیشنهاد میکنیم برای یادگیری بیشتر درباره این مباحث به مجموعه فیلم آموزش دروس پایه دهم، بخش شیمی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مفاهیم میپردازند.
همچنین با مشاهده فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری درباره ساختار اتم دسترسی داشته باشید.
- فیلم آموزش جرم مولی شیمی (دهم) حل مثال (رایگان)
- فیلم آموزش شیمی ۲ پایه یازدهم رشته علوم تجربی و ریاضی و فیزیک
- فیلم آموزش آزمایشگاه شیمی عمومی به زبان ساده
ساختار اتم
در قیمت قبل آموختیم حالت برانگیخته اتم چیست. در بررسی این حالت ساختار اتم بررسی میشود. ساختار اتم به این شکل است که اتمها از ذرات کوچکتری به نام پروتون، الکترون و نوترون تشکیل شدهاند. هسته متمرکز و کوچک اتمها، ترکیبی از نوترونهای خنثی و پروتونهای مثبت است. الکترونها با بار منفی در فضایی ابری و با فاصله مشخص نسبت به هسته اتم در حال حرکت هستند و هیچها به طور کامل به هسته نمیچسبند. یک اتم خنثی، از تعداد برابری پروتون و الکترون تشکیل شده است. هر الکترون در یک لایه الکترونی مشخص در حرکت است که فاصلهای ثابت با هسته اتم دارد. هریک از این لایههای اتمی، از اجزای کوچکتری به نام اوربیتال تشکیل شدهاند. هرچه لایه الکترونی فاصله بیشتری از هسته اتم داشته باشد، تعداد اوربیتالهای آن بیشتر است.
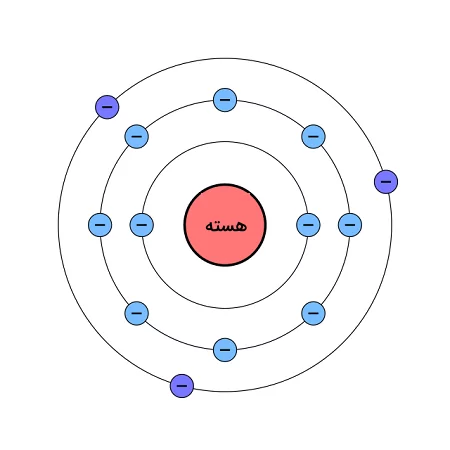
هر یک از این اوربیتالها میزان متفاوتی انرژی دارند. اوربیتالهایی که به هسته اتم نردیکتر هستند انرژی کمتر و اوربیتالهایی که از هسته اتم دورتر هستند، انرژی بیشتری دارند. الکترونها برای پر کردن این اوربیتالها از کمانرژیترین اوربیتال خالی به سمت اوربیتالهای با انرژی بالاتر پیش میروند. هنگامی که تمامی الکترونها در پایینترین سطح انرژی ممکن باشند، گفته میشود اتم در حالت پایه قرار دارد. در تصویر زیر که مربوط به اتم آلومینیوم است، الکترونها در پایینترین سطح انرژی ممکن قرار دارند و اتم در حالت پایه قرار دارد. در این تصویر تنها لایههای الکترون مشخص شدهاند و اوربیتالها نشان داده نشدهاند.
طیف نشری و جذبی اتم
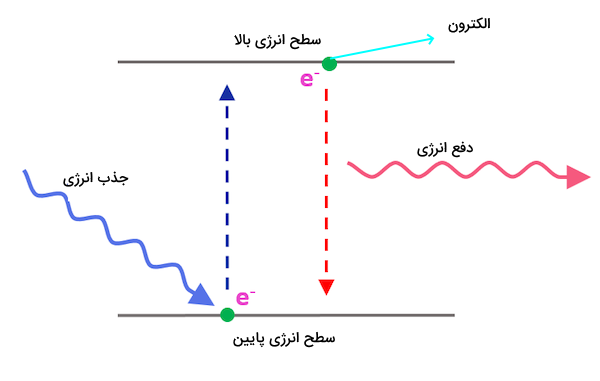
در بررسی این موضوع که حالت برانگیخته اتم چیست، باید طیف جذبی و نشری اتم را بررسی کنیم. طیف جذبی و نشری اتم مجموعهای از خطوط با طول موج مشخص مربوط به انتقالات الکترونی بین حالت پایه و برانگیخته اتم است. انتقالات بین اوربیتالهای مختلف اتم، مقادیر مشخص و منحصر به فردی انرژی نیاز دارد. این خاص بودن میزان انرژی به این دلیل است که هر اتم تعداد مشخصی نوترون، الکترون و پروتون دارد. در نتیجه مقادیر انرژی کوانتومی بین سطوح مختلف انرژی الکترونی برای هریک از اتمها منحصر به فرد است. این مقادیر انرژی دقیقا برابر با میزان اختلاف انرژی بین سطح اولیه و سطح برانگیخته اتم است. هنگامی که الکترونهای یک اتم مشخص به اوربیتالهای حالت پایه باز میگردند، فوتونهایی که آزاد میشوند انرژی مشخصی آزاد میکنند که برای شناسایی اتم به کار میروند.
این مقادیر انرژی آزاد شده برای هر اتم مشخص مقدار متفاوتی دارد و مانند اثر انگشت اتمها عمل میکند. با آشکارسازی این فوتونهای آزاد شده، میزان انرژی و طول موج آنها به وسیله دستگاههای روش طیفسنجی مشخص، میتوان طیف جذبی یا طیف نشری اتمها را به دست آورد و از آنها برای شناسایی ترکیبات مختلف استفاده کرد. در تصویر زیر این انتقالات انرژی همراه با حرکت الکترون بین لایهها مشخص شده است.
آرایش الکترونی حالت برانگیخته
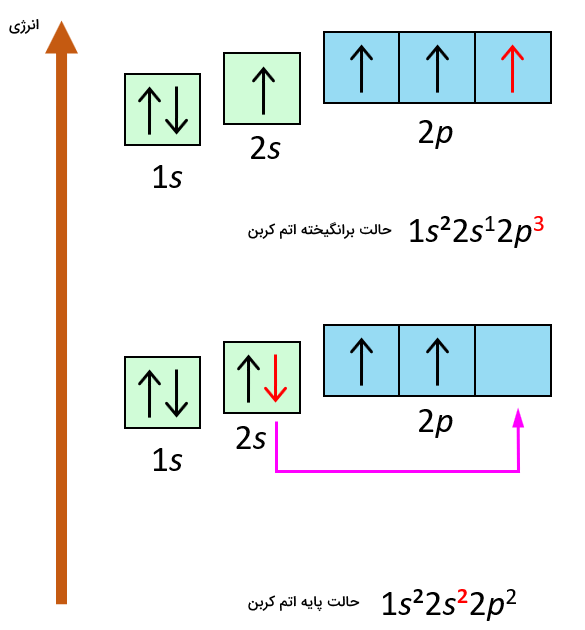
در قسمتهای قبل توضیح دادیم که حالت برانگیخته اتم چیست. یک اتم برانگیخته اتمی است که الکترونهای آن اوربیتالهای حالت پایه را با دریافت انرژی ترک کرده و به اوربیتالهای دیگر با انرژی بالاتر رفته باشند. در نمایش آرایش الکترونی اتمها به شکل مدل جعبه-الکترون میتوان به راحتی مدل آرایش الکترونی اتم برانگیخته را نشان داد. در آرایش الکترونی اتمها، شماره لایه الکترونی و اوربیتالهای آن با استفاده از جعبهها یا خطوط خالی که نمایانگر اوربیتالهای خالی هستند نشان داده میشوند. سپس الکترونها با فلشهایی طبق اصل آفبا، این اوربیتالها را اشغال میکنند.
در تصویر زیر، نمایش آرایش الکترونی حالت پایه و برانگیخته اتم کربن را مشاهده میکنید.
نمایشهای متفاوتی برای آرایش الکترونی اتمها در حالت برانگیخته ممکن است. هر یک از الکترونها میتوانند برانگیخته شده و به اوربیتالها و لایههای بالاتر الکترونی بروند. هرچند در حالت طبیعی و واقعی، برانگیخته کردن تعداد زیادی از الکترونها انرژی زیادی نیاز دارد و دشوار خواهد بود.
الکترونها همچنین نمیتوانند به لایههایی بروند که تمامی ظرفیت الکترونی آنها قبلا پر شده است. برای مثال، الکترون ظرفیت اتم سدیم که در لایه سوم وجود دارد نمیتواند به لایه دوم برود. اما الکترون لایه دوم اتم سدیم میتواند به لایه سوم برود زیرا این لایه ظرفیت خالی دارد.
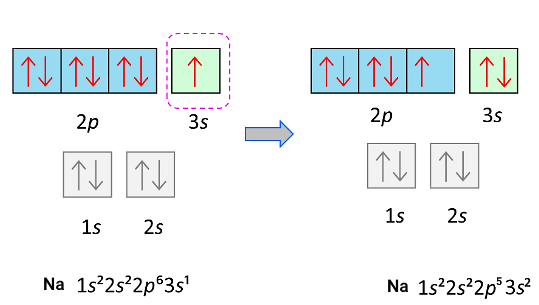
آرایش الکترونی حالت پایه اتم
حالت پایه اتم حالتی است که الکترونها در کم انرژیترین حالت خود قرار گرفتهاند. در ساختار الکترون اتمها به حالت پایه، ۳ اصل در تعیین مکان جایگیری الکترونها برقرار است. این قوانین اصل آفبا، قانون هوند و اصل طرد پائولی هستند.
اصل آفبا
اصل آفبا بیان میکند که الکترونها در حالت پایه تمایل دارند ابتدا اوربیتالها با انرژی کمتر را اشغال کنند. بنابر این اصل برای یک اتم در حالت پایه، ترتیب پر شدن الکترونها در اوربیتالها را بیان میکند. این ترتیب پر شدن به شکل زیر است.
هر یک از این اوربیتالها تعداد مشخصی الکترون میپذیرند. زیرلایه s دو الکترون میپذیرد و یک اوربیتال در ساختار خود دارد. زیرلایه p سه اوربیتال دارد و ۶ الکترون در خود جای میدهد. زیرلایه d پنج اوربیتال دارد و ۱۰ الکترون در آن جای میگیرند. زیرلایه f هفت اوربیتال دارد و جمعا ۱۴ الکترون را در خود جای میدهد.
قائده هوند
قانون هوند بیان میکند که در هر زیرلایه، اوربیتالها ابتدا با تک الکترونها پر میشوند و بعد از آن در هر اوربیتال نیمهپر، دو الکترون جفت میشوند. طبق این اصل، امکان ندارد تا وقتی در یک زیرلایه (برای مثال زیرلایه p) اوربیتال خالی وجود دارد، دو الکترون در اوربیتال دیگر به صورت دوتایی وجود داشته باشند. پیروی از این اصل باعث پایداری بیشتر ماده و رسیدن به حالت پایه میشود.
اصل طرد پائولی
اصل طرد پائولی بیان میکند که امکان ندارد در یک اتم دو الکترون تمامی اعداد کوانتومی آنها برابر باشد. اعداد کوانتومی اعدادی هستند که برای نشان دادن ساختار الکترونی و مکان جایگیری الکترونها به کار میروند و در حالت کلی ۴ عدد کوانتومی برای هر الکترون بیان میشود. این اعداد کوانتومی، عدد کوانتومی اصلی «n»، عدد کوانتومی فرعی «l»، عدد کوانتومی مغناطیسی «» و عدد کوانتومی مغناطیسی اسپین هسته «» هستند. در ادامه به شکل مختصری هریک از این اعداد کوانتومی را توضیح میدهیم.
عدد کوانتومی اصلی
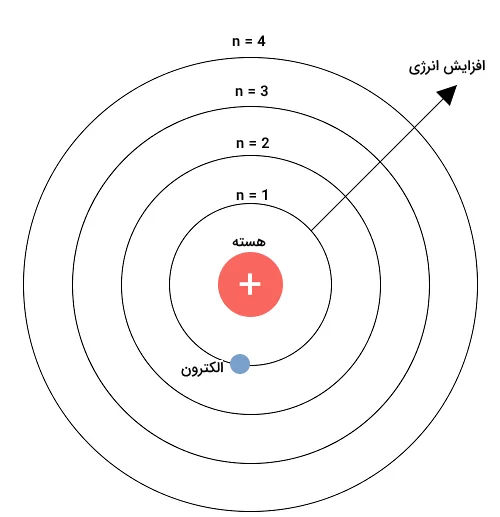
این عدد کوانتومی نشاندهنده فاصله الکترونها از هسته اتم است. عدد کوانتومی اصلی میتواند اعداد صحیح و بزرگ تر از ۱ داشته باشد. در واقع این عدد کوانتومی نمایانگر این است که الکترون در کدام لایه الکترونی وجود دارد. تصویر زیر نمایانگر عدد کوانتومی اصلی برای هریک از لایههای الکترونی است.
عدد کوانتومی فرعی
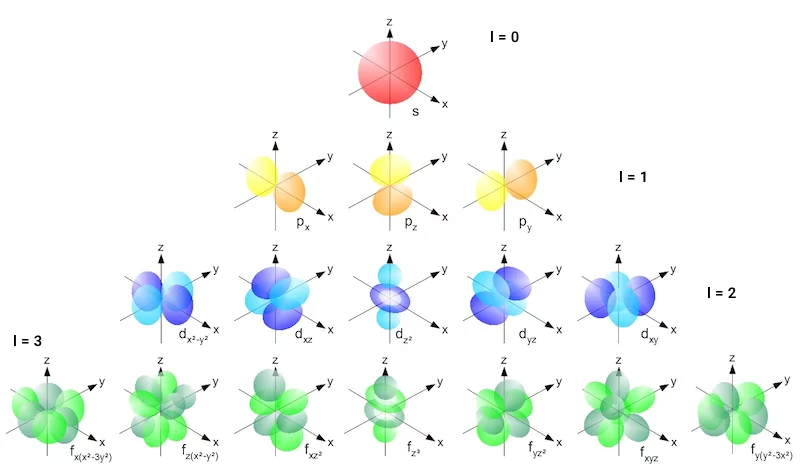
عدد کوانتومی فرعی که با حرف «l» نمایش داده میشود برای مشخص کردن شکل اوربیتالها و زیرلایهها استفاده میشود. عدد کوانتومی «l» میتواند مقادیری از «n-1» به بالا داشته باشد. هریک از مقادیر عدد کوانتومی فرعی، نشاندهنده یک شکل اوربیتال یا زیرلایه هستند. برای مثال عدد کوانتومی فرعی ۰ نمایانگر زیرلایه s، عدد کوانتتومی فرعی ۱ نمایانگر زیرلایه p، عدد کوانتومی فرعی ۲ نمایانگر زیرلایه d و عدد کوانتومی فرعی ۳ نمایانگر زیرلایه f هستند. تصویر زیر نمایانگر عدد کوانتومی فرعی و شکل اوربیتالها است.
عدد کوانتومی مغناطیسی
عدد کوانتومی مغناطیسی «» نمایانگر جهتگیری شکل اوربیتال در فضا است. این عدد کوانتومی میتواند مقادیری بین «l- تا l+» که «l» مقدار عدد کوانتومی فرعی است، داشته باشد. برای مثال برای زیرلایه p که عدد کوانتومی فرعی آن برابر با l = ۱ است، عدد کوانتومی مغناطیسی مقادیر ۱- ، ۰ و ۱ دارد.
عدد کوانتومی مغناطیسی اسپین هسته
این عدد کوانتومی نمایانگر جهت چرخش الکترون در اوربیتال است. این عدد کوانتومی تنها مقادیر ۱/۲+ و ۱/۲- را دارد. در هر اوربیتال تنها دو الکترون با اسپین متفاوت میتوانند وجود داشته باشند.
حال که با اعداد کوانتومی مختلف آشنا شدید، میتوانید دریابید که حتی اگر سه عدد کوانتومی اول اصلی، فرعی و مغناطیسی برای دو الکترون برابر باشد، عدد کوانتومی اسپین هسته آنها متفاوت خواهد بود و در هر اوربیتال تنها دو الکترون با چرخشهای متفاوت وجود خواهد داشت. این مفهوم بیانگر اصل طرد پائولی است. این اصل در تصویر زیر نمایش داده شده است.
حالت پایه و برانگیخته اتم، میزان انرژی آزاد شده از آنها و بررسی ساختار اتم از مباحثی هستند که در پایههای بالاتر دانشگاهی در دروس شیمی عمومی ۱ و ۲ آموخته و بررسی میشوند. برای یادگیری بیشتر درباره مباحث این دروس پیشنهاد میکنیم فیلم آموزش شیمی عمومی ۱ و ۲ با مرور و حل مسئله فرادرس را مشاهده کنید. لینک این آموزش در ادامه آورده شده است.
تفاوت حالت پایه و حالت برانگیخته اتم چیست؟
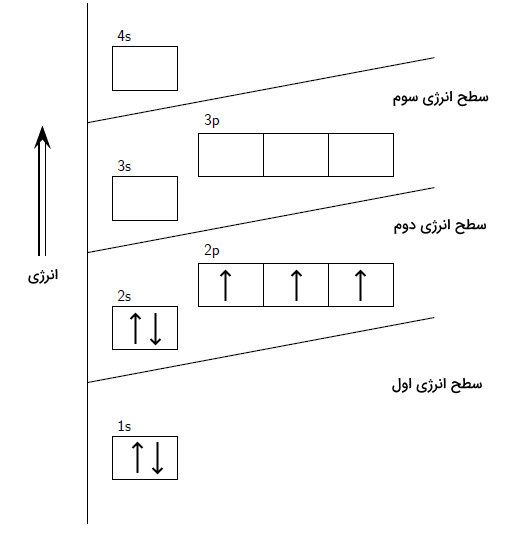
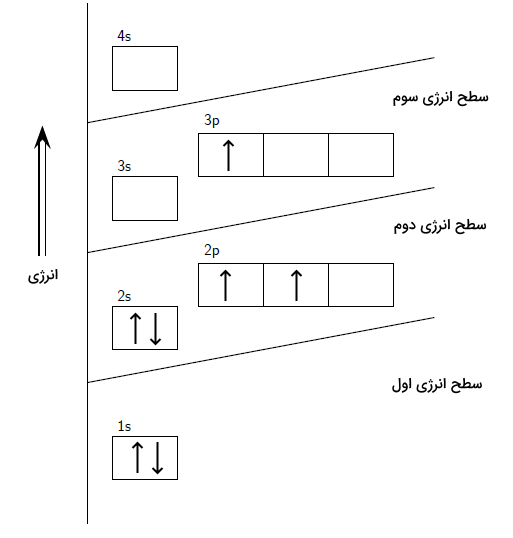
در قسمت قبل آموختیم آرایش الکترونی حالت پایه و حالت برانگیخته اتم چیست. حال به بررسی تفاوتهای این دو حالت میپردازیم. اتم در حالت پایه کمترین انرژی را دارد و پایدار است. در حالی که اتم برانگیخته ناپایدار است و الکترونهای آن به لایهها و اوربیتالها با انرژی بالاتر رفته است. اتم در حالت پایه، کمترین انرژی را دارد. این بدان معنا است که الکترونهای اتم در پایینترین لایهها و اوربیتالها و با رعایت سه قانونی که در قسمت قبلی توضیح داده شد وجود دارند. در حالت برانگیخته، الکترونها با دریافت انرژی به صورت نور یا گرما، به اوربیتالها و لایههای دیگر میروند. این بدان معنا است که اصل آفبا برای اتم در حالت برانگیخته برقرار نیست. همچنین به دلیل انتقال الکترون از یک اوربیتال به اوربیتال دیگر، قانون هوند نیز برهم میخورد. سپس الکترون با از دست دادن انرژی دریافت شده و بازگشت به حالت پایه، دوباره طیق این اصول در لایهها و زیرلایهها قرار میگیرد. برای درک بهتر این مفاهیم، به حالت پایه و برانگیخته اتم نیتروژن دقت کنید.
در تصویر بالا آرایش الکترونی نیتروژن را در حالت پایه مشاهده میکنید. در این آرایش الکترونی ابتدا زیرلایه 1s سپس 2s و 2p پر شده است پس اصل آفبا رعایت شده است. با توجه به اوربیتالهای زیرلایه 2p، مشاهده میکنیم که اوربیتالها به ترتیب و با تک الکترونها پر شدهاند پس اصل هوند هم رعایت شده است. همچنین، الکترونهای جفت با اسپینهای متفاوت در اوربیتالها وجود دارد پس قانون طرد پائولی نیز رعایت شده است. حال اگر به یکی از الکترونهای این اتم به مقدار مشخصی انرژی بدهیم، میتواند به اوربیتالهای خالی بالاتر برود.
در تصویر بالا، یکی از الکترونهای زیرلایه ۲p انرژی دریافت کرده و به زیرلایه 4p که دارای انرژی بیشتری است رفته است. در آرایش الکترونی اتم نیتروژن برانگیخته که در تصویر بالا مشخص است، اصل آفبا رعایت نشده است. پس از زیرلایه ۲p، زیرلایه 3p پر شده است. همچنین، قاعده هوند نیز رعایت نشده است. زیرا با وجود خالی بودن یکی از اوربیتالهای 2p، زیرلایه 3p را اشغال کرده است. بدین ترتیب با مشاهده آرایش الکترونی اتمها میتوانیم دریابیم که اتم در حالت پایه یا در حالت برانگیخته قرار دارد.
حالت برانگیخته اتم هیدروژن
تا اینجا آموختیم که حالت برانگیخته اتم چیست و چه ویژگیهایی دارد. در حالت برانگیخته، الکترون اتم انرژی گرفته و به سطوح انرژی بالاتر میرود. در ادامه حالت برانگیخته اتم هیدروژن را بررسی میکنیم. بررسی انتقالات الکترونی این اتم بود که به نیلز بور کمک کرد تا مدل اتمی لایهای را بیان کند.
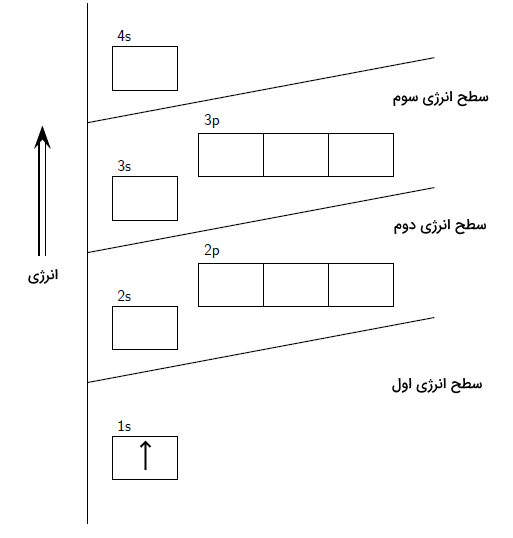
اتم هیدروژن از یک پروتون و یک الکترون که به اطراف آن میچرخد تشکیل شده است. این الکترون در اولین لایه الکترونی و در زیرلایه s قرار دارد. آرایش الکترونی و نمایش اوربیتالهای این اتم به شکل زیر است.
حالت برانگیخته اول اتم هیدروژن
با گذار الکترون هیدروژن از لایه اول به لایه دوم، حالت برانگیخته اول اتم هیدروژن تشکیل میشود. همانطور که مشاهده میکنید، در حالت پایه، این تک الکترون در لایه اول و اوربیتال اول وجود دارد. با دریافت انرژی، این الکترون میتواند به لایههای بالاتر برود و برانگیخته شود. در حالت پایه اتم هیدروژن، الکترون آن در لایه اول الکترونی قرار دارد.
اگر این الکترون به اندازه اختلاف انرژی بین لایه اول و دوم این اتم انرژی دریافت کند (۱۰٫۲ الکترون ولت)، به لایه دوم میرود. به این وضعیت اتم هیدروژن حالت برانگیخته اول گفته میشود. با بازگشت الکترون از این حالت به حالت پایه، نوری با طول موج ۱۲۱٫۶ نانومتر آزاد میشود.
حالت برانگیخته دوم اتم هیدروژن
تک الکترون هیدروژن ممکن است بیشتر نیز انرژی دریافت کند. اگر مقدار انرژی دریافت شده توسط الکترون اتم هیدروژن برابر با اختلاف انرژی بین حالت پایه و لایه سوم باشد (۱۲٫۱ الکترون ولت) گفته میشود هیدروژن به حالت برانگیخته دوم رفته است.
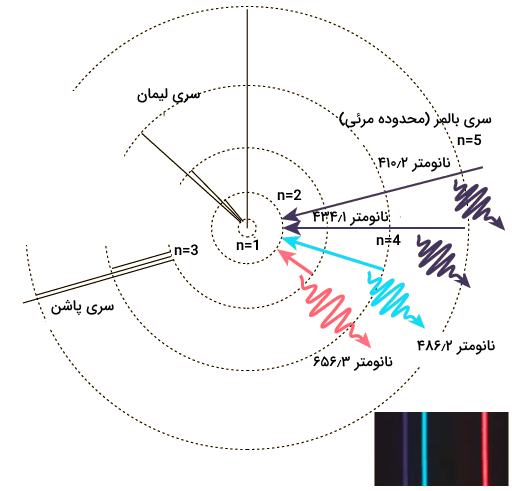
هریک از لایههای الکترونی اتم هیدروژن مقادیر انرژی متفاوتی دارد و انتقال الکترون هیدروژن بین این لایهها میتواند مقادیر مختلفی انرژی با طول موجهای متفاوت آزاد کند. در تصویر زیر برخی از این انتقالات الکترونی را به همراه طول موجشان مشاهده میکنید.
همانطور که مشاهده میکنید هریک از این انتقالات ویژگیهای خود را دارند. بررسی طیفهای نشری هیدروژن بسیار حائز اهمیت است به همین دلیل، هریک از این انتقالات در دسته بندی خاصی قرار گرفته است.
- سری لیمان که مربوط به انتقالات الکترونی از سایر لایهها به حالت پایه (لایه اول) هیدروژن است و فوتونهای نشر شده از این رسته در محدوده فرابنفش قرار دارد.
- سری بالمر که مربوط به انتقالات الکترونی از حالت برانگیخته به حالت برانگیخته اول (لایه دوم) است و فوتونهای این رشته در محدوده مرئی قرار دارند. هریک از این فوتونها یک رنگ را در محدوده طیف نشری خطی هیدروژن مشخص میکنند.
- سری پاشن که مربوط به انتقالات الکترونی از حالات برانگیخته به حالت برانگیخته دوم (لایه سوم) هستند. فوتونهای این رشته در محدوده فروسرخ قرار دارند.
اگر به الکترونهای اتم هیدروژن به اندازهای انرژی داده شود که از لایه چهارم الکترونی اتم خارج شوند، اتم یونیزه شده و الکترون دیگر تحت اثر هسته اتم قرار نمیگیرد و به کلی از اتم خارج میشود.
نشر اتمی
یکی از روشهای درک این موضوع که حالت برانگیخته اتم چیست، بررسی نشر اتم است. فرآیند نشر اتمی زمانی اتفاق میافتد که یک اتم برانگیخته، به حالت پایه خود بازگردد. این فرآیند در زندگی در پدیدههایی همچون رنگ درخشان لامپهای نئونی و جرقههای رنگی مواد آتشبازی دیده میشود. با عبور الکترونها از لایههای بالاتر به لایههای پایینتر الکترونی، انرژی را در فرم ذراتی به نام فوتون که در واقع از جنس نور یا همان امواج الکترومغناطیس هستند، نشر میدهند.
انرژی این فوتونها مقداری تصادفی و بدون نظم ندارد. این مقدار انرژی دقیقا برابر با تفاوت انرژی بین دو لایه انرژی مربوط به اتقال الکترون است. بنابراین، اگر یک الکترون از لایههای بسیار دور از هسته به حالت پایه خود بازگردد، فوتون آزاد شده، انرژی بسیار زیادی خواهد داشت. اگر انرژی این فوتون بالا باشد، نور آزاد شده احتمالا در محدوده فرابنفش خواهد بود. همچنین، مقادیر کمتر انرژی ممکن است فوتونی در محدوده نور مرئی یا حتی فروسرخ آزاد کنند.
خطوط نشر شده از اتمها به وسیله دستگاههایی به نام آشکارساز رسم شده و بررسی میشوند. این آشکارسازها در دستگاههایی به نام طیف سنج تعبیه شدهاند. در یکی از مطالب مجله فرادرس به توضیح و بررسی انواع روشهای طیفسنجی پرداختهایم. در ادامه نشر برخی از اتمهای برانگیخته و رنگی که آزاد میکنند را بررسی خواهیم کرد.
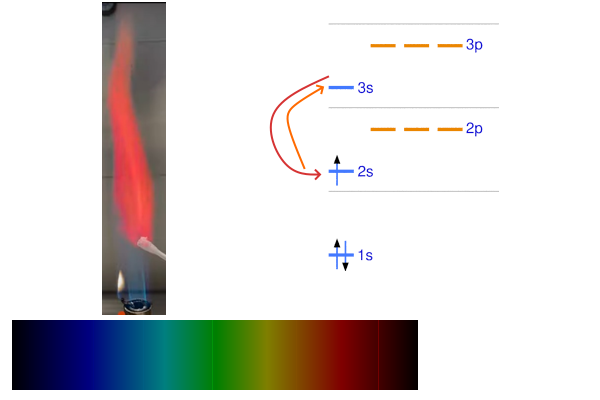
اتم سدیم
اتم سدیم ۱۱ الکترون دارد و در گروه فلزات قلیایی قرار دارد. الکترونهای این اتم در صورت برانگیخته شدن فوتونی در محدوده زرد - نارنجی آزاد میکنند. به همین علت است ک در صورت قرار دادن این فلز در مجاورت آتش شعله بونزن، رنگ شعله به زرد تغییر میکند.
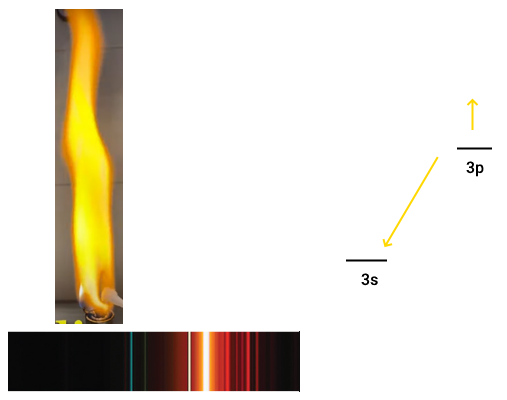
اتم لیتیوم
اتم لیتیوم ۳ الکترون دارد. دو الکترون در زیرلایه 1s و یک الکترون در زیرلایه 2s. الکترون زیرلایه 2s به راحتی میتواند برانگیخته شود. این الکترون در صورت بازگشت به حالت پایه، رنگ قرمزی به رنگ شعله میدهد.
رنگ شعلههایی که اتمهای مختلف در صورت برانگیخته شدن و آزادسازی انرژی به شعله میدهند در تصویر زیر مشخص شده است.
همانطور که در تصویر بالا مشاهده میکنید، ترکیبات حاوی کلسیم به شعله رنگ قرمز نارنجی، ترکیبات حاوی مس رنگ آبی، ترکیبات حاوی استرانسیوم رنگ قرمز، ترکیبات حاوی پتاسیم رنگ بنفش و ترکیبات حاوی باریم به شعله رنگ زرد-سبز میدهد. هریک از خطوط به دست آمده در طیف نشری یا جذبی اتمها، نشاندهنده یک انتقال الکترونی در لایههای الکترونی اتم است. این خطوط به ما در یافتن عناصر موجود در یک نمونه مجهول کمک خواهند کرد.
طیف سنجی که یکی از شیوههای شناسایی مواد است، با دستگاهها و روشهای به خصوص با ما در شناخت عناصر و ترکیبات مجهول کمک میکند. با بررسی طیف به دست آمده از انرژی نشر شده از اتمها میتوان به ساختار مواد دست پیدا کرد. علم طیف سنجی، یک علم بسیار کاربردی در بسیاری از علوم مانند فیزیک نجومی، شیمی و علم مواد است. این علم و بررسی طیفهای نشری، به دانشمندان کمک میکند تا ترکیبات موجود در اجرام آسمانی را بیابند.
پایستگی انرژی در اتم ها
یکی از قوانین موجود در فیزیک، قانون پایستگی انرژی است که بیان میکند انرژی نمیتواند به وجود بیاید یا از بین برود تنها از فرمی به فرم دیگر و از جایی به جای دیگر منتقل میشود. درون اتم، این قانون به خوبی در سطوح انرژی الکترونهای اتم به تصویر کشیده شده است. سطوح انرژی الکترونها بین حالات مختلف تغییر میکند. هنگامی که یک الکترون به سطوح انرژی پایینتر میرود، انرژیای که قبلا داشته است ازبین نمیرود. این انرژی به صورت تشعشات الکترومغناطیسی آزاد میشود.
میزان انرژی هر تک فوتونی که با حرکت الکترون از حالت برانگیخته به حالت پایه میرود، از طریق فرمول زیر محاسبه میشود.
در این رابطه، h ثابت پلانک است، c سرعت نور است و طول موج نشر انجام شده است.
یادگیری ساختار اتمی کوانتومی با فرادرس
ساختار کوانتومی اتم، ساختاری است که پایه و اساس شناخت رفتارهای اتم، الکترونها و ترکیب مواد و تشکیل پیوندهای شیمیایی را شکل میدهد. بررسی شیوه انجام واکنشهای شیمیایی با این ساختار اتمی توجیه میشود. این بررسی به درک این موضوع که حالت برانگیخته اتم چیست، کمک میکند. برای یادگیری مدل کوانتومی اتم باید با مباحثی چون توابع موج، اصل عدم قطعیت و ... آشنا شوید. پیشنهاد میکنیم برای یادگیری بیشتر درباره این مفاهیم و مباحث به مجموعه فیلم آموزش مکانیک کوانتومی مراجعه کنید که با زبانی ساده ولی کاربردی به توضیح این مسائل و مفاهیم میپردازد.
همچنین با مراجعه به فیلمهای آموزش فرادرس که لینک آنها در ادامه آورده شده است، میتوانید به آموزشهای بیشتری در زمینه کوانتوم دسترسی داشته باشید.
- فیلم آموزش مکانیک کوانتومی مرور و حل تست
- فیلم آموزش محاسبات کوانتومی با مفاهیم کلیدی
- فیلم آموزش مکانیک کوانتومی ۱ با مرور و حل تمرین
مثال حالت برانگیخته اتم
یکی از مثالهای طبیعی حالت برانگیخته اتم، فرآیند فتوسنتز است. در این فرآیند، الکترونهای کلروفیل گیاهان به وسیله نور خورشید برانگیخته میشود. این واکنش، نقطه شروع تمامی قسمتهای فرآیند فتوسنتز است که به تولید قند توسط گیاهان میانجامد.
اندازهگیری سطح انرژی حالت برانگیخته اتم
سطح انرژی حالت برانگیخته اتم تنها برای اتمهایی با ۱ الکترون بیان میشود. برای مثال یون هلیوم ۱ بار مثبت یا یون لیتیوم دو بار مثبت اتمهایی با ۱ الکترون هستند. برای اینگونه اتمها، انرژی لایه n ام میتواند با استفاده از فرمول زیر محاسبه شود.
که در آن، z عدد اتمی اتم و n لایه ای است که اتم به آن رفته است. با استفاده از این فرمول، میزان انرژی حالت برانگیخته اتم محاسبه میشود.
جمعبندی
در این مطلب از مجله فرادرس آموختیم حالت برانگیخته اتم چیست و چه تفاوتی با حالت پایه اتم دارد. حالت برانگیخته اتم حالتی است که در آن یک الکترون از لایههای حالت پایه اتم انرژی دریافت کرده و به لایههای بالاتر با انرژی بیشتر رفته باشد. حالت برانگیخته اتم ناپایدار است و با دفع انرژی به صورت نور یا امواج الکترومغناطیسی، به حالت پایه بازمیگردد. در آرایش الکترونی حالت برانگیخته اتم، قوانین هوند و آفبا برهم میخورد.