الکتروشیمی – به زبان ساده
الکتروشیمی شاخهای از شیمیفیزیک به شمار میآید که به مطالعه رابطه بین الکتریسیته - به عنوان پدیدهای کمی و قابل اندازهگیری - و تغییر شیمیایی و تاثیر این دو بر یکدیگر میپردازد. این واکنشها شامل حرکت بارهای الکتریکی بین الکترود و یک آنالیت هستند. بنابراین، الکتروشیمی به رابطه بین انرژی الکتریکی و تغییر شیمیایی مرتبط میشود. زمانی که یک تغییر شیمیایی در اثر یک جریان خارجی اتفاق بیافتد، یک واکنش الکتروشیمیایی داریم. این جریان خارجی را میتوان در الکترولیز مشاهده کرد یا اینکه جریان الکتریکی به کمک یک واکنش شیمیایی خود به خودی ایجاد شود که نمونه آن را در باتریها شاهد هستیم.

واکنشهای شیمیایی که در آنها، الکترونها به طور مستقیم بین مولکولها یا اتمها منتقل میشوند، به واکنشهای اکسایش کاهش (ردوکس) موسوماند. به طور کلی، الکتروشیمی به توضیح واکنش های کلی میپردازد که در آنها، واکنشهای ردوکس به صورت مجزا انجام میگیرند اما این واکنشها به کمک یک مدار خارجی و یک الکترولیت بین آنها، به یکدیگر متصل شدهاند. در این آموزش قصد داریم تا با زبانی ساده و به طور اجمالی، مباحث مطرح شده در علم الکتروشیمی را مورد بررسی قرار دهیم.
واکنشهای مستقیم اکسایش و کاهش (ردوکس)
زمانی همانند تصویر زیر که نواری از فلز روی را درون محلول آبی رنگ مس (II) سولفات قرار دهیم، به سرعت، واکنشی رخ میدهد که در اثر آن، رنگ نوار روی، تیره خواهد شد. اگر این نوار را برای مدت بیشتری در محلول قرار دهیم، به علت اکسایش روی و تبدیل آن به یون روی، این نوار به مرور از بین میرود.
در همین زمان، یونهای مس (II)، در اثر کاهش، به فلز مس تبدیل میشوند. در اثر این تبدیل، رنگ آبی محلول، بیرنگ خواهد شد. در تصویر زیر، این دو فرآیند قابل مشاهده هستند.

فرآیندی که در واکنش ردوکس بالا اتفاق میافتد، در زیر به صورت دو نیمواکنش نشان داده شده است که با جمع زدن این دو نیمواکنش، به واکنش کلی ردوکس میرسیم.
نیمواکنش اکسایش:
نیمواکنش کاهش:
واکنش کلی:
اما این سوال پیش میآید که چرا چنین واکنشی به طور خود به خودی انجام میشود. برای پاسخ به این سوال باید با «سریهای واکنشپذیری» (Activity Series) در الکتروشیمی آشنا باشیم. سریهای واکنشپذیری، فهرستی از عناصر با ترتیب کاهشی در واکنشپذیری هستند. عنصری که در بالای این فهرست قرار گرفته باشد، در یک واکنش جابجایی ساده، میتواند موجب جابجایی عناصر پایینتر خود در یک واکنش شیمیایی شود. این فهرست همچنین، عناصر را به ترتیب سادگی اکسایش، مرتب میکند. عنصر بالاتر، سادهتر اکسید میشود درحالیکه پایینترین عنصر، سختترین آن برای اکسایش به شمار میآید. جدول زیر، این عناصر را به همراه نیمواکنش اکسایش آنها نشان میدهد:
| نام عنصر | نیمواکنش اکسایش |
| لیتیوم | |
| پتاسیم | |
| باریم | |
| کلسیم | |
| سدیم | |
| منیزیم | |
| آلومینیوم | |
| روی | |
| آهن | |
| نیکل | |
| قلع | |
| سرب | |
| هیدروژن | |
| مس | |
| جیوه | |
| نقره | |
| پلاتین | |
| طلا |
توجه داشته باشید که در فهرست بالا، روی، بالاتر از مس قرار گرفته است. این بدان معنی است که روی نسبت به مس، بسیار راحتتر اکسید میشود. به همین دلیل است که یونهای مس (II) زمانی که در تماس با فلز روی قرار میگیرند میتوانند به عنوان عامل اکسنده عمل کنند. هر یون فلزی همچون سرب یا نقره که پایینتر از روی قرار داشته باشد، در یک واکنش مشابه، روی را اکسید میکنند. این نوع از واکنشها موسوم به واکنشهای ردوکس مستقیم هستند زیرا الکترونها به طور مستقیم از یک اتم فلزی به کاتیون فلز دیگر جریان پیدا میکنند. با این وجود، اگر نواری از مس را درون یک محلول از یونهای روی قرار دهیم، هیچ واکنشی انجام نمیشود زیرا یونهای روی، توانایی اکسید کردن مس را ندارند. به عبارت دیگر، چنین واکنشی خود به خودی نخواهد بود.
واکنشها در الکتروشیمی
انرژی جذب شده یا آزاد شده در واکنشهای شیمیایی ممکن است به صورت انرژی الکتریکی باشند. همانطور که گفته شد، الکتروشیمی شاخهای از علم شیمی است که به تبدیل انرژیهای شیمیایی و الکتریکی به یکدیگر میپردازد. علم الکتروشیمی کاربردهای بسیاری در زندگی روزمره دارد. تمامی باتریها، از چراغ قوه تا خودرو، بر مبنای واکنشهای الکتروشیمیایی بنا شدهاند. از الکتروشیمی همچنین در آبکاری فلزات استفاده میشود. از جمله کاربردهای دیگر الکتروشیمی باید به انتقال پیامهای عصبی در بدن موجودات زنده اشاره کرد. پایه تمامی این واکنشها، واکنشهای ردوکس و به عبارتی انتقال الکترون است.
همانطور که در بالا بررسی کردیم، واکنش یونهای مس (II) موسوم به واکنشهای مستقیم ردوکس یا فرآیند مستقیم ردوکس هستند. الکترونهای انتقالی در این واکنشها به طور مستقیم از اتمهای سطح نوار روی به طرف یونهای در محلول حرکت میکنند. از طرف دیگر، الکتریسیته برای مسیر حرکت الکترونها و انجام کار به یک محیط هادی همچون سیم الکتریکی نیاز دارد که این مفهوم به خوبی در پیوند فلزی بیان میشود. این کار میتواند شامل روشن کردن یک لامپ یا بکار انداختن سیستم گرمایشی باشد. در واکنشهای الکتروشیمیایی باید فرآیندهای اکسایش از فرآیندهای کاهش جدا شوند و الکترونها از یک محل به محل دیگری حرکت کنند. این عمل، اساس تمامی سلولهای الکتروشیمیایی است. یک سلول الکتروشیمیایی به دستگاهی میگویند که انرژیهای شیمیایی و الکتریکی را به یکدیگر تبدیل میکند.
برای انجام یک واکنش الکتروشیمیایی، به سه جزء نیاز داریم. در ابتدا یک محلول برای انجام واکنشهای ردوکس مورد نیاز است. چنین واکنشهایی برای تسهیل حرکت یونها و الکترونها به طور معمول در آب انجام میشوند. همچنین، به یک محیط هادی جهت انتقال الکترونها نیاز داریم که در بیشتر موارد، یک سیم الکتریکی است. یونها نیز برای حرکت از بخشی به بخش دیگر به محیطی موسوم به پل نمکی احتیاج دارند.
مثالی از واکنشهای الکتروشیمیایی
حتما به مجسمهها و اشیا فلزی زنگ زده نگاه کردهاید. در حقیقت، اگر فلز این اشیا بدون محافظت، در مجاورت هوا قرار بگیرند، دچار خوردگی میشوند. فرآیند خوردگی شامل مجموعهای از واکنشهای ردوکس است که در این مجسمهها و اشیا رخ میدهند.
در برخی موارد، این فلزات و آثار هنری، به عمد بدون محافظت رها میشوند تا خوردگی، ارزش زیباییشناسی آنرا افزایش دهد.

سلولهای ولتاییک در الکتروشیمی
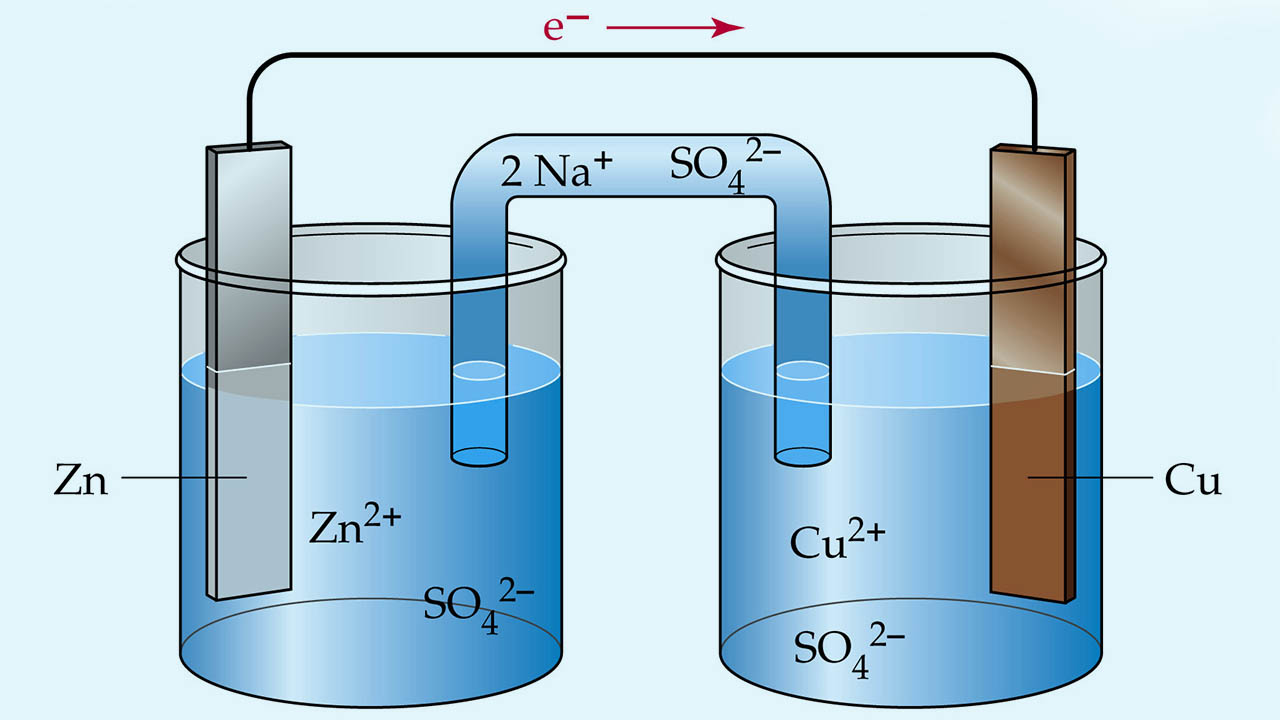
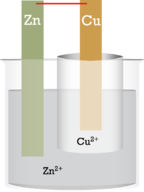
یک «سلول ولتاییک» (Voltaic Cell)، نوعی سلول الکتروشیمیایی است که برای تولید انرژی الکتریکی از واکنشهای خودبهخودی ردوکس بهره میگیرد. همانطور که در تصویر زیر مشاهده میکنید، یک سلول ولتاییک از دو بخش مجزا تشکیل شده است. به عبارت دیگر در این سلول، ۲ نیمسلول داریم که در هر کدام، نیمواکنشهای اکسایش یا کاهش انجام میشوند. نیمسلول سمت چپ، نوار فلزی روی در محلولی از سولفات روی است. در نیمسلول سمت را نیز، نوار مسی در محلول مس (II) سولفات قرار دارد. این نوارهای فلزی، موسوم به الکترود هستند. یک الکترود، نوعی هادی در مدار محسوب میشود که بمنظور حمل الکترونها به بخش نافلزی مدار، مورد استفاده قرار میگیرد.
بخش نافلزی مدار، همان محلول الکترولیت است که الکترودها در داخل آن قرار میگیرد. این الکترودها توسط سیم فلزی به یکدیگر متصل میشوند. یک کلید نیز وظیفه قطع و وصل این مدار را به عهده دارد. در نهایت، برای تکمیل مدار، غشایی متخلخل بین دو نیمسلول قرار میگیرد.
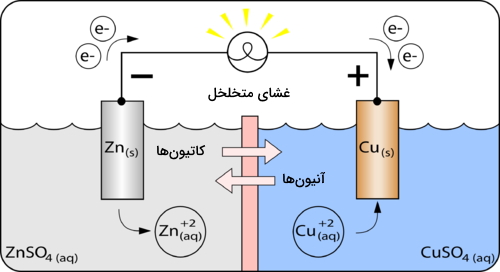
تمامی این واکنشها در سلول، به طور همزمان انجام میگیرند. این واکنشها را میتوان در چند مرحله و به سادگی، با توجه به مثال مس-روی، توضیح داد.
- مرحله اول: اتمهای الکترود روی، پس از اکسایش، به یون روی تبدیل میشوند. دلیل این امر، موقعیت بالاتر روی نسبت به مس در جدول واکنشپذیری است. نیمواکنش اکسایش روی، در زیر آورده شده است:
الکترودی که اکسایش در آن اتفاق میافتد، آند نام دارد. با پیشرفت واکنش، آند روی به مرور از بین میرود و غلظت یون روی در نیمسلول افزایش پیدا میکند. به دلیل تولید الکترون در آند، به آن الکترود منفی میگویند.
- مرحله دوم: الکترونهایی که در آند روی تولید شدند، با گذر از سیم فلزی، ولتاژی را در ولتسنج ثبت میکنند و به مسیر خود به سمت الکترود مس، ادامه میدهند.
- مرحله سوم: الکترونها با ورود به الکترود مس، با یونهای مس (II) در محلول ترکیب میشوند و این یونها به فلز مس کاهش پیدا میکنند. نیمواکنش کاهش نیز در زیر آورده شده است:
الکترودی که کاهش در آن اتفاق میافتد، موسوم به کاتد است. به دلیل تولید فلز مس در اثر این واکنشها، جرم کاتد به مرور افزایش پیدا میکند. غلظت یونهای مس (II) نیز در محلول کاهش مییابند. لازم به ذکر است که کاتد، الکترود مثبت به شمار میآید.
- مرحله چهارم: بمنظور حفظ حالت خنثی در سلول، یونها از طریق غشای متخلخل، در نیمسلولها جابجا میشوند. در تصویر بالا، یونهای سولفات از بخش مس به بخش روی حرکت میکنند تا کاهش و افزایش پیدا کند. در نهایت، مجموع دو نیمواکنش، واکنش ردوکس کلی را در سلول ولتاییک نشان بدست میدهد:
پتانسیل الکتریکی در الکتروشیمی
پتانسیل الکتریکی، معیاری برای سنجش توانایی یک سلول ولتاییک برای تولید جریان الکتریکی است. پتانسیل الکتریکی را با ولت بیان میکنند. ولتاژی که یک سلول ولتاییک تولید میکند، برابر با اختلاف پتانسیل الکتریکی بین دو نیمسلول است. به عبارت دیگر، نمیتوان پتانسیل الکتریکی یک نیمسلول مجزا را اندازهگیری کرد. به طور مثال، اگر تنها یک نیمسلول روی ساخته میشد، هیچ واکنش اکسایش و کاهشی رخ نمیداد و در نتیجه، هیچ پتانسیل الکتریکی را نیز نمیتوانستیم اندازهگیری کنیم. بنابراین، تنها زمانی اختلاف پتانسیل، قابل اندازهگیری خواهد بود که نیمسلول دیگری با نیمسلول روی ترکیب شود.
پتانسیل الکتریکی یک سلول در مباحث الکتروشیمی نتیجه رقابت بین الکترونها است. در سلول ولتاییک روی-مس، یون مس (II) به فلز مس کاهش پیدا میکند. این امر به این دلیل اتفاق میافتد زیرا یونهای مس نسبت به یونهای روی، جاذبه بیشتری برای الکترونها دارند. «پتانسیل کاهش» (Reduction Potential) معیاری برای اندازهگیری تمایل یک نیم واکنش برای وقوع در یک سلول الکتروشیمیایی به صورت واکنش کاهشی است. در یک سلول ولتاییک، نیمسلولی که پتانسیل کاهش بیشتری داشته باشد، نیم سلولی است که واکنش کاهش در آن رخ میدهد. به همین ترتیب، نیمسلولی که پتانسیل کاهش کمتری داشته باشد، واکنش اکسایش در آن رخ میدهد. پتانسیل سلول، به اختلافت پتانسیل کاهش بین دو نیمسلول در سلول الکتروشیمیایی میگویند.
الکترود استاندارد هیدروژن (SHE)
جدول واکنشپذیری که در ابتدای متن آورده شد، به ما کمک میکند تا واکنشپذیری ترکیبات مختلف را در فرآیندهای اکسایش و کاهش پیشبینی کنیم. میدانیم که به کمک فرآیندهای شیمیایی میتوان انرژی الکتریکی تولید کرد. اما چطور میزان جریان الکتریکی را پیشبینی کنیم؟ برای این کار باید راهی پیدا کرد که مقدار جریان الکترونها را در سیستمهای شیمیایی مختلف با یکدیگر مقایسه کنیم. در این خصوص بهتر است که یک مرجع داشته باشیم یعنی یک استانداردی که بتوان بر اساس آن تصمیمگیری کرد و مقایسه انجام داد.
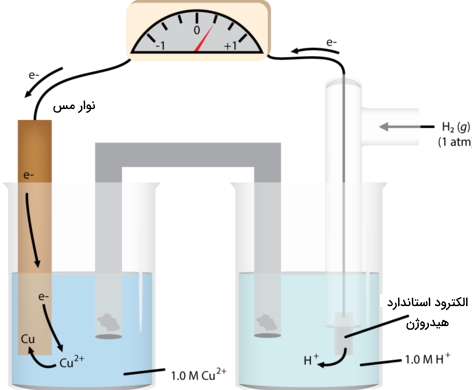
در مباحث الکتروشیمی برای مشخص کردن جریان الکتریکی و ولتاژها در نیمواکنش، از مفهومی به نام «الکترود استاندارد هیدروژن» (Standard Hydrogen Electrode) یا همان «SHE» بهره میگیریم. تصویر زیر، این الکترود را نشان میدهد. به کمک یک سیم از جنس پلاتین، جریان الکتریکی در مدار منتقل میشود. این سیم داخل محلول 1 مولار اسید قوی غوطهور و گاز هیدروژن نیز با فشار یک اتمسفر و دمای 25 درجه سانتیگراد به صورت حباب به داخل محلول فرستاده میشود. نیمواکنش در این الکترود به صورت زیر خواهد بود:
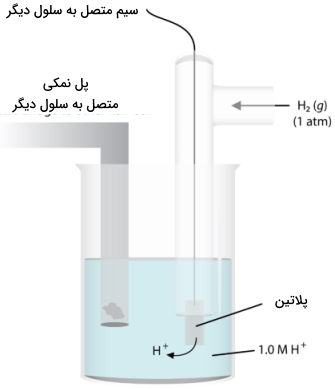
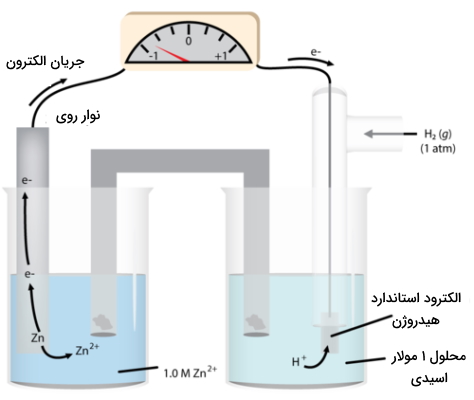
تحت این شرایط، پتانسیل کاهش هیدروژن، به مقدار صفر ذکر میشود که به آن یا پتانسیل استاندارد کاهش میگوییم. از چنین سیستمی به عنوان مرجع استفاده میکنیم تا پتانسیل سایر الکترودها در نیمسلول را اندازهگیری کنیم که این نیمسلول، شامل یک فلز و نمک آن - به طور معمول سولفات - خواهد بود. میتوانیم از همان مثال روی استفاده کنیم که در تصویر زیر نمایش داده شده است.
نیروی الکتروموتوری
با مشاهده فرآیند بالا در مییابیم که جرم روی در طول واکنش، کاهش پیدا میکند. این امر، نیمواکنش را در نیمسلول مشخص خواهد کرد:
در نتیجه، فرآیندهای زیر در سلول اتفاق میافتند ولتاژ اندازهگیری شده نیز برابر با 0/76 ولت است:
اکسایش در آند:
کاهش در کاتد:
در این خصوص، مفهوم دیگری با نام «نیروی الکتروموتوری» (Electromotive Force) در سلول یا همان emf سلول در الکتروشیمی مطرح و به صورت زیر تعریف میشود:
همین محاسبات را میتوان در خصوص مس نیز انجام داد:
با بررسی واکنش، درمییابیم که جرم مس افزایش پیدا میکند. درنتیجه، نیمواکنش کاهش آن به صورت زیر خواهد بود:
با توجه به واکنش، کاتد، الکترود مس خواهد بود. حال، با داشتن دو نیمواکنش میتوانیم را محسابه کنیم که برابر با 0/34 ولت خواهد شد.
نیمواکنش آند:
نیمواکنش کاتد:
حال میخواهیم سیستمی را توسعه بدهیم که هر دو فلز مس و روی در آن دخیل باشند. از جدول واکنشپذیری فلزات میدانیم که روی، اکسایش و مس، کاهش مییابند. بنابراین، پتانسیل سلول به راحتی قابل محاسبه خواهد بود:
اندازهگیری پتانسیل استاندارد سلول در الکتروشیمی
همانطور که در بالا نیز به آن اشاره شد، در الکتروشیمی برای بررسی عملکرد یک سلول، باید دو نیمسلول داشته باشیم. از جدول پتانسیل استاندارد کاهش میتوان برای تعیین واکنشهای اکسایش و کاهش و همچنین پتانسیل استاندارد سلول استفاده کرد بدون اینکه نیاز به ساخت سلول و آزمایش آن باشد. این جدول در مطلب «پتانسیل سلول — به زبان ساده» آورده شده است که میتوانید در محاسبات خود از آن استفاده کنید.
بر اساس این جدول، نیمسلولی که پتانسیل کاهش بالاتری داشته باشد، در سلول، کاهش پیدا میکند. به همین ترتیب، سلول با پتانسیل کاهش کمتر نیز دچار اکسایش میشود. در صورتی که این شرایط برقرار باشد، مقدار پتانسیل سلول، عدد مثبتی خواهد بود. اگر این مقدار، مثبت باشد، واکنشهای ردوکس در سلول به طور خود به خودی انجام میگیرند. اگر مقدار محاسبه شده، منفی شد، بدان معنی است که این واکنش در جهت عکس، خود به خودی خواهد بود.
مثال محاسبه پتانسیل استاندارد سلول
پتانسیل استاندارد یک سلول ولتاییک را محاسبه کنید که از نیمواکنشهای و بهره میگیرد. معادله موازنه شده کلی را بنویسید و آند و کاتد را مشخص کنید.
در مرحله اول، مقادیر معلوم را مشخص میکنیم:
از آنجایی که مقدار پتانسیل استاندارد کاهش در نیمسلول نقره بیشتر است، این نیمسلول دچار کاهش خواهد شد و به دنبال آن، نیمسلول قلع اکسایش مییابد. پتانسیل سلول نیز به کمک رابطه زیر بدست میآید:
واکنشهای اکسایش و کاهش در نیمسلول به صورت زیر خواهد بود:
اکسایش در آند:
کاهش در کاتد:
پیش از آنکه بخواهیم این دو واکنش را با یکدیگر جمع کنیم، باید این مورد را در نظر بگیریم که تعداد الکترونهای از دست رفته در فرآیند اکسایش باید با تعداد الکترونهای جذب شده در فرآیند کاهش یکسان باشد. بنابراین، نیمواکنش نقره در عدد ۲ ضرب خواهد شد. بعد از این کار و جمع کردن نیمواکنشها با یکدیگر، به رابطه کلی واکنش میرسیم که در زیر نشان داده شده است:
پتانسیل سلول به کمک رابطه زیر محاسبه میشود:
بحث در خصوص جواب سوال: پتانسیل استاندارد سلول، عددی مثبت محاسبه شد و بنابراین، واکنش به صورت خودبهخودی صورت میگیرد. قلع در آند، اکسید میشود و یون نقره در کاتد، کاهش مییابد. توجه داشته باشید که ولتاژ برای نیمواکنش کاهش در نقره با وجود ضریب ۲، دو برابر نخواهد شد.
عوامل اکسنده و کاهنده
مادهای که به سادگی کاهش مییابد، به عنوان یک عامل اکسنده قوی شناخته میشود. به عکس، مادهای که به سادگی اکسید شود، عامل کاهنده قوی به شمار میآید. بر اساس جدول پتانسیل استاندارد، قویترین عامل اکسنده محسوب میشود و هر مادهای در جدول را اکسید میکند. به طور مثال، فلوئور طبق واکنش زیر، موجب اکسید شدن طلا میشود:
بر اساس همین جدول نیز، فلز لیتیوم، قویترین عامل کاهنده به شمار میآید و تمامی مواد را در بالای جدول کاهش میدهد. به طور مثال، این فلز، آب را طبق واکنش زیر کاهش میدهد:
به کمک جدول پتانسیل استاندارد کاهش، انجامپذیر بودن یک واکنش، قابل پیشبینی خواهد بود. به طور مثال، فلز نیکل میتواند یونهای مس (II) را کاهش دهد اما نمیتواند موجب کاهش یونهای روی شود زیرا نیکل پایینتر از و بالاتر از قرار دارد.
تاریخچه مختصری در خصوص سلولهای ولتاییک
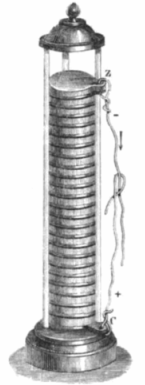
در سال 1800، «الساندرو ولتا» (Alessandro Volta) اولین سلول ولتاییک را توسعه داد. همانطور که در تصویر زیر مشاهده میکنید، این باتری از صفحات روی و نقره تشکیل شده است که به صورت یک در میان روی یکدیگر قرار گرفتهاند. در میان این صفحات نیز، مقواهایی وجود دارد که در آب نمک غوطه شدهاند. از آنجایی که هیچ ولتسنجی در آن زمان وجود نداشت و هیچ ایدهای هم در خصوص وجود جریان الکتریکی بر اثر حرکت الکترونها مطرح نشده بود، ولتا مجبور شد تا راه دیگری را برای اندازهگیری قدرت باتری پیدا کند. این راه عجیب، مقدار شوک حاصل از قدرت باتری بود. او دریافت که هرقدر تعداد صفحات فلزی بیشتر شود، شوک ایجاد شده نیز قدرت بیشتری خواهد داشت و دستگاهی با 20 صفحه فلزی، شوکی دردناک ایجاد میکرد.
باتریها و الکتروشیمی
در ادامه مباحث الکتروشیمی و بعد از آنکه با سلولهای ولتاییک آشنا شدیم، باید به مبحث باتریها بپردازیم و به طور مختصر با انواع باتری و سلولهای ولتاییک آشنا شویم. لازم به ذکر است که سلولهای ولتاییک در دو نوع سلولهای خشک و باتریهای سربی وجود دارند.
سلولهای خشک
بسیاری از باتریهای معمول همچون باتریهای چراغ قوه یا کنترل تلویزیون، از نوع سلولهای خشک ولتاییک هستند. از آنجایی که الکترولیت این باتریها، خمیری شکل است، به آنها سلول خشک میگویند. این نوع از سلولها، قیمت و همچنین عمر پایینی دارند و قابل شارژ مجدد نیستند. در تصویر زیر، یک سلول خشک روی-کربن را مشاهده میکنید.
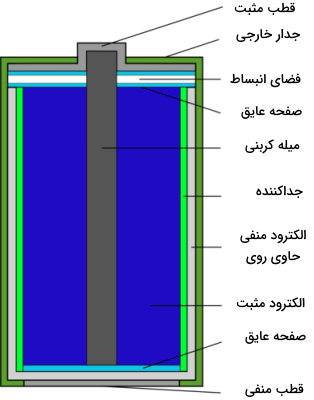
در سلول خشک روی-کربن، آند، محفظهای از جنس روی است و کاتد را یک میله کربنی در مرکز سلول تشکیل میدهد. خمیر این سلول از منگنز (IV) اکسید ، آمونیوم کلرید و روی کلرید در آب تشکیل شده است. نیمواکنشهای این سلول خشک به صورت زیر است:
اکسایش در آند:
کاهش در کاتد:
وجود خمیر باعث میشود تا محتویات سلول خشک به راحتی با یکدیگر مخلوط نشوند و در نتیجه، نیازی به پل نمکی نخواهد بود. میله کربنی هم نقش هادی را ایفا میکند و در واکنشها دخالتی ندارد. ولتاژ تولیدی توسط این سلول خشک در حدود 1/5 ولت است اما این ولتاژ با ادامه مصرف، کاهش مییابد.
یک باتری قلیایی، نوع دیگری از سلول خشک روی-کربن است. این نوع باتری، میله کربنی ندارد و به جای بهرهگیری از آند جامد فلزی، خمیر آن شامل روی و پتاسیم هیدروکسید است. نیمواکنش کاتد، همانند قبل اما نیمواکنش کاهش، به صورت زیر خواهد بود:
اکسایش در آند:
از نکات قوت این نوع باتریها میتوان به عمر بیشتر و عدم کاهش ولتاژ به هنگام استفاده اشاره کرد.
باتریهای سربی
یک باتری، مجموعهای از سلولهای الکتروشیمیایی است که در ترکیب با یکدیگر، منبعی از برق مستقیم با ولتاژ ثابت را تشکیل میدهند. سلولهای خشک به معنای حقیقی، یک باتری محسوب نمیشوند زیرا تنها از یک سلول تشکیل شدهاند. از باتریهای سربی که به باتری سرب-اسید نیز معروف هستند، به طور معمول در خودروها و سایر وسایل نقلیه استفاده می شود. این باتریها در بیشتر موارد از اتصال ۶ سلول بوجود میآیند. هرکدام از این سلولها، یک آند سربی و کاتدی از جنس سرب (IV) اکسید دارند که درون یک صفحه فلزی قرار گرفتهاند. در این باتریها، کاتد و آند، هردو در محلول آبی سولفوریک اسید غوطهور شدهاند که نقش الکترولیت دارد. واکنشهای سلول به شکل زیر هستند:
اکسایش در آند:
کاهش در کاتد:
واکنش کلی:
هر سلول در این نوع از باتریها، ولتاژی برابر با 2 ولت تولید میکنند. در نتیجه، در یک باتری شش سلولی، ۱۲ ولت برق به تولید میرسد که از آن برای روشن کردن خودرو یا سایر سیستمهای الکتریکی استفاده میکنند. بر خلاف سلول خشک، یک باتری اسیدی را میتوان شارژ کرد. توجه داشته باشید که در واکنش کلی و سمت راست واکنش، سرب (II) سولفات تولید میشود که مقدار آن به مرور روی صفحات افزایش پیدا میکند. علاوه بر این، غلظت سولفوریک اسید نیز کاهش مییابد. زمانی که خودرو روشن باشد، ژنراتور (دینام) خودرو از طریق اعمال نیرو برای انجام واکنش با جهت عکس، باتری را شارژ میکند. بنابراین، به هنگام شارژ باتری، واکنش زیر را خواهیم داشت:
واکنش بالا، به طور مجدد، واکنشدهندههای مورد نیاز برای عملکرد مناسب باتری را فراهم میکند. به لحاظ نظری، یک باتری اسیدی به هیچ عنوان از بین نمیرود و عمری بسیار طولانی دارد. اما در عمل، بازده واکنش برگشت به صورت ۱۰۰ درصد نیست، چراکه بخشی از سرب (II) سولفات ایجاد شده، در کف سلول جمع میشود.
سلولهای الکترولیتی
یک سلول ولتاییک، از واکنشهای خودبهخودی ردوکس برای ایجاد جریان الکتریکی بهره میگیرد. اما این کار را میتوان در جهت عکس نیز انجام داد. زمانی که یک منبع خارجی جریان مستقیم را در سلولی الکتروشیمیایی اعمال کنیم، واکنشی که به طور عادی، خود به خودی نباشد نیز انجام خواهد شد. در اینجا باید مفهوم الکترولیز را بیان کنیم. الکترولیز، فرآیندی است که در آن از انرژی الکتریکی بمنظور وقوع واکنشهای غیر خودبهخودی استفاده میشود. محصولات حاصل از الکترولیز را هر روزه در زندگی خود مشاهده میکنیم که از آنجمله میتوان به جواهرآلات آبکاری شده اشاره کرد.
برای انجام الکترولیز، از دستگاهی موسوم به سلول الکترولیتی کمک میگیرند. در یک سلول الکترولیتی، برای انجام واکنش در جهت عکس و تامین منبع الکترونها، از جریان الکتریکی استفاده میشود. در یک سلول ولتاییک، واکنش در جهتی انجام میگیرد که به طور خودبهخودی، الکترون آزاد شود. در یک سلول الکترولیتی، الکترون ورودی از منبع خارجی، سبب انجام واکنش در جهت عکس میشود. در تصویر زیر، یک سلول روی-مس را مشاهده میکنید.
جهت واکنش خود به خودی برای واکنش بین روی و مس، به این صورت است که فلز روی، به اکسید شود و به Cu کاهش پیدا کند. در چنین شرایطی، الکترود روی به آند و الکترود مس به کاتد تبدیل میشود. زمانی که همین نیمسلولها را از طریق یک سیم خارجی، به یک باتری متصل کنیم، واکنش در جهت عکس انجام میگیرد. در این شرایط، الکترود روی، کاتد و الکترود مس، آند خواهد بود. نیمواکنشها و همچنین واکنش کلی، در زیر آورده شده است:
اکسایش در آند:
کاهش در کاتد:
واکنش کلی:
علامت الکترودها
همانطور که در بالا مشاهده میکنید، پتانسیل استاندارد سلول، عددی منفی است که نشان میدهد این واکنش به صورت خودبهخودی انجام نمیگیرد. برای اینکه واکنش انجام شود، باتری مورد استفاده باید اختلاف پتانسیلی با مقدار حداقل بیش از 1/10 ولت ایجاد کند. تفاوت دیگر بین سلول ولتاییک و سلول الکترولیت، علامت الکترودها است. در یک سلول ولتاییک، علامت الکترودهای آند و کاتد به ترتیب، منفی و مثبت است. در یک سلول الکترولیتی اما علامت مثبت برای آند ذکر میشود چراکه به قطب مثبت باتری متصل شده است. الکترونها نیز همچنان از آند به طرف کاتد حرکت میکنند.
الکترولیز آب
در اثر الکترولیز آب، گازهای هیدروژن و اکسیژن آزاد میشوند. سلول الکترولیتی در اینجا شامل یک جفت الکترود از جنس پلاتین در آب غوطهور است. مقادیری از یک الکترولیت همچون نیز اضافه میشود. اضافه کردن الکترولیت از ضروریات به شمار میآید چراکه آب خالص به دلیل فقدان یون کافی، توانایی حمل بار الکتریکی را ندارد. در آند، آب به گاز اکسیژن و یون هیدروژن تبدیل میشود. در کاتد، آب، طی یک واکنش کاهشی به گاز هیدروژن و یون هیدروکسید تبدیل خواهد شد. نیمواکنشهای اکسایش و کاهش در این سلول آورده شدهاند:
اکسایش در آند:
کاهش در کاتد:
واکنش کلی:
توجه داشته باشید که واکنش کاهش را در عدد ۲ ضرب کردیم تا تعداد الکترونها موازنه شود. یون هیدروژن و هیدروکسیدی که در هر نیمواکنش تولید شد، در ترکیب با یکدیگر، تشکیل آب میدهند. نیز در واکنش مصرف نمیشود. در تصویر زیر، تولید گاز هیدروژن و اکسیژن را به کمک الکترولیز آب مشاهده میکنید.
الکترولیز نمک مذاب و آب شور
سدیم کلرید مذاب را میتوان الکترولیز کرد تا از طریق آن، فلز سدیم و گاز کلر تولید شود. سلول الکترولیتی که در این فرآیند از آن استفاده میشود، «سلول دانز» (Down's Cell) نام دارد که نمونهای از آنرا در تصویر زیر میبینید.
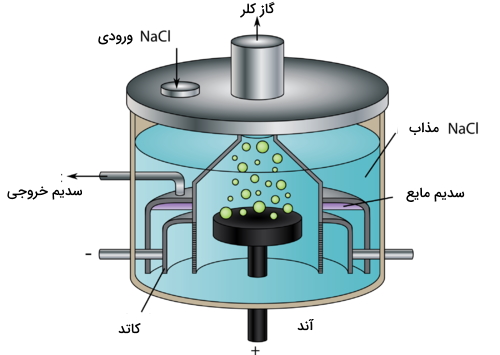
در سلول دانز، یونهای سدیم مایع در کاتد کاهش مییابند و به فلز سدیم تبدیل میشوند. در آند، یونهای کلرید مایع، اکسید و به گاز کلر تبدیل خواهند شد. واکنشها و پتانسیل سلول در زیر آورده شدهاند:
اکسایش در آند:
کاهش در کاتد:
واکنش کلی:
همانطور که مشاهده میکنید، برای انجام این الکترولیز، به اختلاف پتاسیل بیش از 4 ولت در باتری نیاز داریم. واکنش بالا، منبع اصلی تولید گاز کلر و تنها راه تولید فلز سدیم خالص به شمار میآید. از گاز کلر به طور گسترده در مصارف شستشو و ضدعفونی و همچنین در استخرها استفاده میشود.
الکترولیز محلول سدیم کلرید
منطقی است که فرض کنیم الکترولیز محلول آبی سدیم کلرید (آب شور) نیز همان نتایج الکترولیز بالا را داشته باشد. با این وجود، واکنش کاهشی که در کاتد اتفاق میافتد، سبب تولید فلز سدیم نخواهد شد چراکه به جای سدیم، آب کاهش مییابد. دلیل این امر، مقدار کم پتانسیل کاهش آب در مقایسه با پتانسیل کاهش یونهای سدیم است که این مقادیر به ترتیب، و ذکر میشوند. اما گاز کلر همچنان در آند تولید خواهد شد. واکنشها و پتانسیلهای سلول در زیر آورده شده است:
اکسایش در آند:
کاهش در کاتد:
واکنش کلی:
از آنجایی که یونهای هیدروکسید نیز از فرآوردههای واکنش کلی به شمار میآیند، در پایان هیدرولیز، به کمک تبخیر محلول آبی، ماده شیمیایی مهم سدیم هیدروکسید بدست میآید.
آبکاری
حال که با الکتروشیمی و کاربرد آن در سلولهای الکترولیتی آشنا شدیم، بهتر است که به بیان بخش دیگری در علم الکتروشیمی یعنی آبکاری بپردازیم. بسیاری از اشیا تزئینی که در اطراف خود میبینیم به کمک آبکاری ساخته شده اند.
آبکاری فرآیندی است که در آن، یک یون فلزی در سلول الکترولیتی کاهش مییابد و و فلز نیز بر روی یک سطح رسوب میکند. تصویر زیر، سلولی الکترولیتی را نشان میدهد که در آن، فلز مس به کمک آبکاری، در سطح فلز دیگر قرار میگیرد.
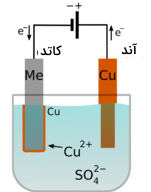
سلول تصویر بالا، از یک محلول مس (II) سولفات و نواری از مس تشکیل شده است که نقش آند را ایفا میکند. فلز که در اینجا با Me نشان داده شد است، کاتد را تشکیل میدهد. آند به الکترود مثبت باتری وصل و فلز به الکترود منفی وصل میشود. زمانی که مدار بسته شود، فلز مس در بخش آند اکسید خواهد شد و یونهای مس به محلول وارد میشوند. نیمواکنش اکسایش در آند را در زیر مشاهده میکنید.
در همین زمان نیز، یونهای مس در محلول، بعد از واکنش کاهشی، روی سطح کاتد به صورت فلز رسوب میکنند که نیمواکنش آن در زیر آورده شده است:
غلظت یونهای مس در محلول ثابت میمانند. دلیل این امر این است که در آبکاری، فلز از بخش آند به بخش کاتد سلول منتقل میشود. فلزات دیگری که به طور معمول از طریق آبکاری بر روی دیگر فلزات قرار میگیرند عبارتند از: کروم، طلا، نقره و پلاتین.
فیلم آموزش الکتروشیمی کاربردی
همانطور که در طول این آموزش مشاهده کردید، کاربردهای بسیار گستردهای را میتوان برای علم الکتروشیمی متصور شد. از محافظت در برابر خوردگی، تا باتریهای مختلف و آبکاری، همگی از کاربردهای علم الکتروشیمی به شمار میآیند که به طور خلاصه، مباحث آنها را در این آموزش مطرح کردیم. با توجه به اهمیت علم الکتروشیمی و ارتباط تنگاتنگ آن با صنعت، فرادرس اقدام به انتشار دوره آموزشی ویدیویی با عنوان «آموزش الکتروشیمی کاربردی» در قالب یک آموزش 12 ساعته کرده که از این لینک قابل دسترس است. این آموزش در ۱۶ درس تدوین شده است که به طور کاملا کاربردی، تمامی مباحث الکتروشیمی را پوشش میهد.
مفاهیم بنیادی الکتروشیمی در سه درس به طور کامل بررسی میشوند. برخی از این مباحث بنیادی در زیر آورده شدهاند:
- سری الکتروشیمیایی
- قوانین فارادی
- قانون کولن
- نیروی الکتروموتوری
- رابطه نرنست
- پولاریزاسیون
- سینتیک فرآیندهای شیمیایی
مبحث الکترولیز که در بالا به طور خلاصه به آن پرداخته شد، در دو درس به طور کامل بررسی خواهد شد که موضوعاتی همچون الکترولیز آب نمک، ولتاژ سل الکترولیزی و محاسبات مهندسی الکترولیز از جمله این مباحث به شمار میآیند. علم الکتروشیمی در تصفیه و استخراج فلزات، نقش اساسی ایفا میکند و این موضوع نیز در دو درس بررسی شده است. «ترسیب» (Sequestration) الکتروشیمیایی، استخراج و تولید آلومینیوم، استخراج و تولید مس و همچنین پالایش الکتروشیمیایی مس، تنها بخشی از این آموزش را شامل میشوند. انواع باتریها و اساس کار آنها نیز در قالب سه درس، مورد بررسی قرار میگیرند. موضوعات آبکاری و رفع آلودگی صنایع نیز از مواردی هستند که در دوره آموزشی الکتروشیمی کاربردی تدریس میشوند.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی فیزیک
- پیل سوختی چیست؟ — به زبان ساده
- خوردگی فلزات در شیمی — به زبان ساده
- جدول تناوبی — از صفر تا صد
^^













سلام عزیز
مکانیسم عمل تشخیص یون برم در الکتروشیمی همراه با سنس نقره چیست؟
منت
سلام
آیا یون طلای 1 ppb در پساب که البته حاوی فلزات سنگین و نمک ها هم هست به روش الکتروشیمیایی قابل بازیافت هست؟
لطفا در صورت اطلاع به من ایمیل بدین.
تشکر
با سلام؛
برای آشنایی با نحوه استخراج طلا پیشنهاد میکنیم مطلب «استخراج طلا با سیانوراسیون — از صفر تا صد» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس