رسانای یونی چیست؟ – به زبان ساده + مثال و کاربرد
رسانای یونی که با حرف نشان داده میشود، به توانایی یک ترکیب یونی در هدایت جریان الکتریکی از طریق حرکت یونها در یک بستر مایع یا جامد گفته میشود. این ویژگی برای تشخیص میزان رسانایی الکتریکی محلولهای مختلف بسیار حائز اهمیت است. رسانایی یونی با مواردی مانند غلظت محلول و میزان حرکت یونها تحت تاثیر قرار میگیرد. با انحلال الکترولیتها در آب یا از طریق جهش یونها بین حفرههای ترکیب کریستالی، یونهای این ترکیبات منتقل شده و رسانایی الکتریکی محلول افزایش مییابد. رسانایی الکتریکی که با وجود یونها در محلول ایجاد میشود را رسانایی یونی میگویند. دز این مطلب از مجله فرادرس به بررسی این خاصیت و عوامل تاثیرگذار بر آن میپردازیم و کاربردهای آن را توضیح میدهیم.
- یاد میگیرید چگونه یونها جریان الکتریکی را در مواد منتقل میکنند.
- میآموزید چه عواملی بر رسانایی یونی مواد و محلولها تاثیر دارند.
- تفاوت رسانایی یونی و الکتریکی را درک خواهید کرد.
- یاد خواهید گرفت رسانایی یونی چطور در ابزارهایی مثل باتری بهکار میرود.
- با نقش الکترولیتها در بدن و صنعت آشنا میشوید.
- خواهید آموخت رسانایی یونی چگونه با دما، غلظت و نوع یون تغییر میکند.


در این مطلب با تعریف رسانای یونی آشنا میشویم و سیستم رسانایی یونی را در محلولهای یونی، مایعات و جامدات بررسی میکنیم. سپس به بررسی تفاوتهای رسانایی یونی و رسانایی الکتریکی میپردازیم. در ادامه عوامل تأثیرگذار بر رسانایی یونی را توضیح میدهیم. اصول کار و روش اندازهگیری این نوع رسانایی را توضیح میدهیم. در نهایت کاربردهای این ویژگی را بررسی میکنیم. با مطالعه این مطلب تا انتها با این مفهوم و کاربردهای آن آشنا شوید.
رسانای یونی چیست؟
رسانای یونی به موادی گفته میشود که به سبب حرکت یونهای سازندهشان دارای جریان الکتریکی هستند. در واقع رسانایی یونی به حرکت جریان الکتریکی به وسیله حرکت یونها گفته میشود. این یونها میتوانند اتم یا مولکولهایی باشند که یک یا تعداد بیشتری الکترون گرفتهاند یا از دست دادهاند در نتیجه دارای بار الکترونی هستند. این نوع رسانایی معمولا در محلولهای الکترولیت یافت میشود. همچنین برخی از مواد جامد مانند سرامیکها نیز توانایی انتقال جریان از طریق رسانایی یونی را دارند.
رسانش یونی فرایندی است که در آن انرژی از طریق حرکت ذرات یون در یک بستر انجام میگیرد. در طی فرایند رسانش یونی ترکیبات یونی باردار متفاوت از نقطهای به نقطه دیگر رفته و این حرکت بسته به شیب تغییرات حضور یونها در نقاط مختلف انجام میگیرد. یونها ذرات بارداری هستند که میتوانند بار مثبت یا منفی داشته باشند. یونهای با بار مثبت به سمت قسمتهایی که بار منفی در آنها زیاد است حرکت کرده و یونهای با بار منفی به سمت محلها و نقاطی که بار مثبت در آنها بیشتر است حرکت میکنند. میزان تمایل یک ماده برای داشتن رسانش یونی با پارامتری به نام رسانایی یونی اندازه گیری میشود که با حرف یونانی لاندا نشان داده میشود.
بیشتر اوقات عبارت رسانای یونی برای بررسی رسانش در شبکههای کریستالی مواد است. در مورد این مواد، عبارت رسانایی یونی عبارت است از عبور یونها از یک شبکه کریستالی به شبکه دیگر است. فرایند رسانایی یونها یک سازوکار از جریانی است که به صورت انرزی از جایی به جای دیگر حرکت میکند.
رسانایی یونی به عاملهای مختلفی بستگی دارد. این عوامل میتوانند نوع الکترولیت افزوده شده، سایز یونهای اضافه شده، خاصیتهای حلال و ویسکوزیته آن، غلظت الکترولیت و دما باشد. عبور یک جریان متناوب DC به محلولهای حاوی یون، پس از گذشت مدت زمانی میتواند به تغییر ساختار و ترکیبات ماده به وسیله واکنشهای الکتروشیمیایی منجر شود.

یادگیری شیمی دوازدهم با فرادرس
رسانایی مواد یکی از مهمترین مباحث موجود در زندگی است که به تولیدات بسیار مهمی در زمینه انرژی الکتریکی میانجامد. رسانایی الکتریکی میتواند به وسیله مواد رسانا و در حضور میدان مغناطیسی انجام شود و همچنین میتواند به وسیله حرکتیونها در یک رسانای یونی انجام شود. رساناهای یونی از مهمترین مواد تشکیل دهنده باتریهای گالوانی و باتریهای خشک هستند. برای یادگیری ویژگیها و روشکار این سیستمها باید با مفهوم رسانایی و الکتریسیته و یون آشنا شد که همگی از مباحث شیمی دوازدهم هستند. هم چنین برای شناسایی رسانش یونی باید با مفاهیمی مانند نوع ترکیبات موجود در محلول، از جمله پیوند یونی و پیوند کووالانسی را بشناسیم. برای مطالعه و یادگیری این مفاهیم پیشنهاد میکنیم به مجموعه فیلم آموزش دروس پایه دوازدهم مراجعه کنید که با زبانی ساده ولی کاربردی این مفاهیم را توضیح میدهند.
همچنین با مراجعه به فیلمهای آموزشی فرادرس که لینک آنها در زیر آورده شده است، میتوانید به آموزشهای بیشتری در زمینه رسانای یونی دسترسی داشته باشید.
- فیلم آموزش تئوری و فناوری ساخت ادوات نیمه هادی
- فیلم آموزش آشنایی با فیزیک قطعات نیم رسانا
- فیلم آموزش بازیافت باتری لیتیومی بررسی روش ها و تجهیزات فرایندی
محلولهای یونی
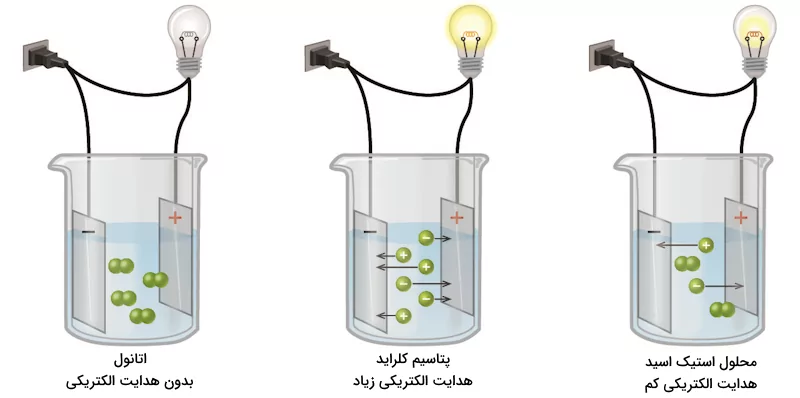
محلول یونی به محلولی گفته میشود که از انحلال یک ترکیب یونی در حلالی به وجود میآید. در واقع محلول یونی به محلولی گفته میشود که شامل یون است و رسانایی الکتریکی دارد. هرزمانی که یک الکترولیت در یک محلول میشکند، به یونهای سازندهاش گسسته میشود. الکترولیتی که به یونهای سازندهاش شکسته میشود، تنها در محلولهای آبی یا در حالت مذاب میتوانند رسانای الکتریکی باشند.
مواد الکترولیت در حالت جامد نمیتوانند رسانای الکتریسیته باشند. محلولهای یونی بسیاری وجود دارند که برای مثال میتوان به پتاسیم نیترات، سدیم کلراید، پتاسیم کلراید و ... اشاره کرد.
تفاوت رسانایی یونی و رسانایی الکتریکی
رسانایی یونی و رسانایی الکتریکی هردو فرمی از انتقال انرژی هستند که بر اساس بستری که از آن انرژی جریان پیدا میکند دستهبندی شده اند. اصلیترین تفاوت رسانایی یونی و رسانایی الکتریکی در نوع گونههایی است که مسئول هدایت الکتریکی در بستر مواد هستند. رسانایی الکتریکی از طریق موادی انجام میشود که الکترونهای آزاد با بار منفی دارند و این الکترونها میتوانند به راحتی حرکت کنند. از این دسته مواد میتوان به فلزات و نیمه رساناهای جدول تناوبی اشاره کرد. میزان رسانایی الکتریکی مواد به توانایی و میزان آزادی حرکت الکترونهای آزاد بستگی دارد.
میزان رسانایی الکتریکی در واقع حرکت بارها در جواب به یک میدان الکتریکی ایجاد شده است. به همین ترتیب در ترکیبات جامد رسانا مانند آهن و مس و نیمه رساناها، حرکت بارها یا جریان الکتریکی از طریق حرکت الکترونها یا وجود حفرهها در ساختار مولکولی این ترکیبات است و رسانایی الکتریکی خوانده میشود.
معنی رسانای یونی، هدایت جریان الکتریکی از درون مواد توسط یونهای آزاد موجود در محلول یا ماده است. این پدیده به خصوص در مورد محلولهای الکترولیت و برخی از جامدات مانند سرامیکها اتفاق میافتد.
رسانایی یونی در واقع رسانایی الکتریکی است که که از حرکت یونها به جود میآید. علوم پایه این پدیده را به ویژگی محلولهای الکترولیت نسبت میدهند. در حالت جامد، رسانایی یونی نسبت به رسانایی الکتریکی اولیت پیدا میکند. این پدیده توسط فارادی که در حال مطالعه رسانایی الکتریکی سرب فلوئورید در دمای بالا بود کشف شد. رسانایی در این ترکیب توسط حرکت یونهای فلوئور در سطح ماده بود. این نوع رسانایی جامدات یکی از علایق اصلی دانشمندان در راستای شناسایی و بهبود فرایندهای خوردگی بوده است.

جدول مقایسه رسانایی یونی و رسانایی الکتریکی
همانطور که اشاره شد، رسانایی یونی و الکتریکی با یکدیگر تفاوتهایی دارند که در جدول زیر آمده است.
| رسانایی الکتریکی | رسانایی یونی |
| الکترونها مسئول ایجاد جریان الکتریکی هستند. | یونها مسئول ایجاد جریان الکتریکی هستند. |
| در موادی مانند فلزات و نیمه رساناها اتفاق میافتد. | در محلولهای الکترولیت و برخی از مواد جامد مانند سرامیکها اتفاق میافتد. |
| میزان رسانایی با افزایش دما کاهش مییابد. | میزان رسانایی با افزایش دما افزایش مییابد. |
| میزان رسانایی اغلب بسیار زیاد است. | میزان رسانایی اغلب کم است. |
| ترکیب فلزات با عبور جریان از آنها تغییر نمیکند. | غلظت محلول الکترولیت با عبور جریان DC از درون آن دچار تغییر میشود. |
| بار مواد رسانا تنها میتواند منفی باشد. (الکترون بار منفی دارد) | مواد رسانا میتوانند یون با باری مثبت یا منفی داشته باشند. |
عوامل تاثیرگذار بر رسانایی الکتریکی محلولهای یونی
رسانایی الکتریکی محلولهای یونی یا همان رسانایی یونی میتواند به تولید باتریها و وسایل مهم دیگری منجر شود. رسانایی الکتریکی این ترکیبات میتواند تحت تاثیر عوامل مختلفی قرار بگیرد. این عوامل در ادامه توضیح داده شده اند.
غلطت یونها
مهم ترین دلیلی که باعث هدایت الکتریکی این محلولها میشود، وجود یونها درون آنها است. هرچه میزان غلظت یونها در محلول بیشتر باشد، میزان تفکیک آنها و همچنین میزان رسانایی یونی بیشتر میشود. هرچه تعداد یونها بیشتر باشد، میزان باری که میتواند منتقل شود بیشتر شده در نتیجه توانایی رسانش محلول افزایش مییابد. هنگامی که یک مول از الکترولیت درون یک حلال، حل میشود، میزان قدرت رسانایی محلول با نام رسانایی مولی آن شناخته میشود.
طبیعت الکترولیت
طبیعت الکترولیتها با توجه به میزان رسانایی مواد یونی تشکیل دهنده آنها میتواند متفاوت باشد. هرچه تفکیک این مواد به یونهای سازنده شان بیشتر باشد، تعداد یونهای موجود در محلول افزایش یافته و رسانایی یونی محلول افزایش مییابد.
تمامی ترکیباتی که با درصد خیلی پایینی تفکیک میشوند، جزء دسته الکترولیتهای ضعیف قرار میگیرند. در واقع هرچه ضریب تفکیک یک ماده کمتر باشد، میزان رسانایی آن در محلولها کمتر میشود. محلولهایی که از ترکیب مواد یونی با ضریب تفکیک بالا تشکیل شده اند، الکترولیتهای قوی یا محلولهای یونی خوب خوانده میشوند. این الکترولیتها در قسمت بعد معرفی خواهند شد.
دما
دمای محلول یکی از مهمترین عوامل تاثیرگذار بر به وجود آمدن محلولهای یونی است. بر اساس مشاهدات انجام شده، افزایش دمای یک محلول باعث انحلال بیشتر ترکیبات یونی در حلال شده و هرچه انحلال افزایش پیدا کند به دنبال آن میزان غلظت یونها در حلال و میزان رسانایی محلول افزایش پیدا میکند.
الکترولیتهای قوی و ضعیف
الکترولیتها ترکیباتی هستند که در صورت انحلال در آب به یونهای مثبت «کاتیون» و یونهای منفی «آنیون» تقسیم میشوند. به این فرایند یونش یا یونیزه شدن نیز گفته میشود. الکترولیت ای قوی به میزان بالایی (حدود ۱۰۰ درصد) در آب تفکیک میشوند. الکترولیتهای ضعیف با درصد خیلی پایینی (بین ۱ تا ۱۰ درصد) دچار تفکیک میشوند. عامل رسانایی بالای الکترولیتهای قوی یونهای بسیار زیاد موجود در محلول آنهاست و در محلول الکترولیتهای ضعیف، درصد بالای ماده تفکیک نشده عامل رسانایی پایین آنها است.
الکترولیتهای قوی به سه دسته اسیدهای قوی، بازهای قوی و نمکها تقسیم میشوند. الکترولیتهای ضعیف در دو دسته بازها و اسیدهای ضعیف جای میگیرند. در ادامه این مطلب از مجله فرادرس در جدولی چند مثال از الکترولیتهای قوی و ضعیف را مشخص کردهایم.
| الکترولیتهای قوی | الکترولیتهای ضعیف |
| اسیدهای قوی مانند اسید کلریدریک، هیدروژن برومید، هیدروژن یدید، پرکلریک اسید و سولفوریک اسید | اسیدهای ضعیف مانند هیدروژن فلوئورید، استیک اسید، کربنیک اسید، فسفریک اسید و ... |
| بازهای قوی مانند سدیم هیدروکسید، پتاسیم هیدروکسید، باریم هیدروکسید، کلسیم هیدروکسید | بازهای ضعیف مانند آمونیاک، پیریدین و بسیاری از بازهای ضعیف نیتروژندار دیگر |
| نمکهای یونی مانند سدیم کلرید، پتاسیم برومید، منیزیم کلرید و ... | --- |
اسیدها و بازها با انحلال در آب میتوانند تفکیک شوند. اسیدها از کاتیون هیدروژن و بازها از آنیون هیدروکسید تشکیل شدهاند. میزان تفکیک این مواد در آب با عبارتی به نام ثابت تفکیک اسید و باز تعریف میشود که به آن ثابت یونش نیز گفته میشود. هرچه میزان یونش اسیدها و بازها در آب بیشتر باشد میزان حضور یونها در آب و میزان رسانایی آنها بیشتر میشود.
اصول کار رسانای یونی
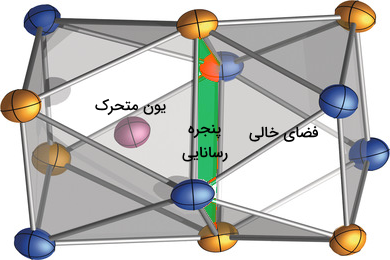
شرایط اصلی که باید در راستای انجام رسانش یونی وجود داشته باشد با ساختار به هم ریخته یونهای درحرکت و یا وجود کانالهایی برای عبور آنها در ساختار رسانا مربوط است. اولین و مهمترین نیازمندی رسانایی یونی، وجود موقعیتهای در دسترس برای حرکت یونها است. این یونها در حرکت از یک موقعیت به موقعیت دیگر به اصطلاح میپرند. در نتیجه این فواصل حرکت نباید فاصله زیادی با یکدیگر داشته باشند.
به فاصله مورد نظر برای حرکت یونها، پنجرهی رسانایی گفته میشود. برای مثال در مورد مواد جامد نارسانا، در یک بلور با حالت ایده آل، تمامی این فواصل از قبل باید به وسیله یونها یا اتمهای خنثی پر شده باشند یا کاملا خالی باشند که این پدیده باعث میشود جامد رسانایی یونی نداشته باشد. در مورد رساناهای یونی این موقعیتها تا حدودی با یونها پر شدهاند و موقعیتهای خالی نیز برای حرکت آنها وجود دارد در نتیجه این یونها میتوانند آزادانه بین آنها حرکت کنند و باعث انتقال جریان الکتریکی شوند.
اندازه گیری میزان رسانایی محلولهای یونی
برای اندازه گیری میزان هدایت الکتریکی محلولهای یونی باید از پل وتستون بهره گرفت. سلول رسانش این پل از دو الکترود پلانیتی تشکیل شده است که با یک لایه پلاتین سیاه پوشانده شده اند.
رسانای یونی مانند رساناهای الکترونیکی میتواند به سه عامل وابسته باشد. این عوامل میزان بار q، میزان غلظت n (تعداد ذرات در یک حجم مشخص) و میزان تحرک b (جریان میانگینی که یک حمل کننده جریان در میدان الکتریکی اعمال شده منتقل میکند) هستند. در نتیجه یک معادله برای توضیح میزان رسانایی ویژه نوشته میشود که به شکل زیر است.
میزان رسانایی محلولها با وسیلهای به نام هدایتسنج اندازهگیری میشود. هدایتسنجها میزان توانایی محلولها یا مواد جامد یا گاز را در عبور جریان الکتریکی اندازهگیری میکنند. اندازهگیری میزان هدایت الکتریکی در بسیاری از موارد مانند صنایع تصفیه اب و فاضلاب ، بررسی آبهای سطحی و زیر زمینی برای مصارف کشاورزی و ... کاربرد دارد.
هدایتسنجها با اعمال یک میدان الکتریکی مناسب، باعث انتقال یونهای مثبت به آند و یونهای منفی به کاتد، میزان جریان الکتریکی محلولرا اندازهگیری میکنند. این جریان با واحدهایی مانند زیمنس، میلی زیمنس و میکروزیمنس بر واحد سطح مانند متر یا سانتی متر اندازهگیری میشوند.

رسانایی یونی در جامدات
در بسیاری از جامدات، یونها به محکمی کنار یکدیگر قرار گرفتهاند و حرکت نمیکنند اما در برخی از این ترکیبات جامد برخی از یونها در حرکت هستند که این پدیده باعث افزایش رسانایی یونی در این جامدات میشود. یکی از مهمترین این مواد بتا- آلومینا است که یک فرم از آلومیونیوم اکسید است. این ماده دارای حفرههایی است که از طریق آنها کاتیونهای سدیم میتوانند عبور کنند. از این جامدات بیشتر در تولید باتریها استفاده میشود. وقتی سرامیک با مادهای که دارای یونهای در حرکت است مانند سدیم مثبت ترکیب میشود، ترکیبی را به وجود میاورد که نام رسانای یونی سریع شناخته میشود.
این رسانایی یونی در جامدات در قوانین الکترولیز در موادی مانند سرب فلوراید، سولفات مقره مشاهده شده است. شناخت رسانایی جامدات یونی یکی از مهمترین اتفاقاتی بود که در صنعت باتریسازی افتاد. برای مثال شرکت ماشینسازی فورد، بتا-آلومینا را در تحقیقی برای خازن مناسبی برای تولید ماشینهای برقی تولید کرد.
میزان رسانایی یک محلول الکترولیت از مهاجرت یونهای سازنده آن به سمت الکترودها به وجود میآید. تصویری که ممکن است از این فرایند در ذهن به وجود بیاید حرکت به ترتیب یونها و مسقیم به سمت الکترودها است. در واقع این تصور نادرست است. حرکت این یونها به سمت الکترونها به شکل بدون الگو و اتفاقی صورت میگیرد. حرکت یونها به این شکل میتواند با اعمال یک نیروی خارجی نیز اتفاق بیافتد. محلولهای یونی از حداقل دو یون آنیون و کاتیون تشکیل شدهاند که در درون محلول حرکت میکنند.
رسانای یونی سریع
رسانای یونی سریع به رساناهای یونی جامدی گفته میشود که یونها در آنها تحرکات زیادی دارند. این مواد به نام الکترولیت جامد و یا رساناهای ابریونی نیز شناخته میشوند. از این مواد در فرایندهای ساخت باتریها استفاده فراوان میشود. در این جامدات انتقال جریان از طریق پرش یونها بین حفرههای ساختار جامد انجام میشود.
رسانای پروتونی
رسانای پروتونی در واقع یک نوع رسانای یونی سریع است که یونهای انتقال دهنده جریان در آن، یونهای هیدروژن مثبت هستند.

رسانایی یونی در مایعات
بسیاری از ترکیبات یونی میتوانند در آب و برخی دیگر از حلالها مانند اتانول و آمونیاک حل شوند. این انحلال با جدا شدن یونهای سازنده این ترکیبات انجام میشود. اگر یونها بتوانند درون محلول ایجاد شده حرکت کنند، آن محلول تبدیل به یک رسانا میشود. به این مواد رساناهای یونی گفته میشود. موادی که با انحلال در آب، یون آزاد میکنند الکترولیت نام دارند. یونهای ایجاد شده میتوانند بار الکترونی مثبت یا منفی داشته باشند. به یونهای مثبت ایجاد شده کاتیون و به یونهای منفی ایجاد شده آنیون گفته میشود. الکترولیتهای قوی به طور کامل در آب حل میشوند. برای مثال سدیم کلراید، اسید نیتریک، پرکلریک اسید و کلسیم کلراید در آب محلولهای الکترولیت قوی ایجاد میکنند.
فرایند جداسازی یونها که یونش نیز نام دارد در معادله واکنش زیر برای ترکیب سدیم کلراید نشان داده شده است.
همانطور که مشاهده میکنید با انحلال نمک در آب، بلورهای آن به دو یون کاتیون سدیم و آنیون کلر شکسته شده است. در نتیجه فرایند انحلال الکترولیتهای قوی، دیگر هیچ ترکیب خنثیای در محلول باقی نمیماند. این بدان معناست که با انحلال سدیم کلراید در آب تمامی مولکولها به یونها تبدیل شدهاند و سدیم کلراید به صورت خنثی در محلول باقی نمیماند. برخی دیگر از جامدات یونی ، ، ، و هستند.
از طرفی دیگر الکترولیتهای ضعیف را داریم که ترکیبات یونی هستند که در صورت انحلال به صورت کامل شکسته نمیشوند و مقادیری از ماده به صورت خنثی در محلول باقی میماند. این موارد به خوبی جریان الکتریکی را انتقال نمیدهند. از این مواد میتوان به آمونیاک، کربنیک اسید و استیک اسید اشاره کرد. میزان یونهای جدا شده موجود در محلول در این مواد به کمک ثابت تعادل و ثابت یونش به دست میآید که نسبتی از غلظت یونهای موجود و ماده اولیه را مشخص میکند. برای مثال در ترکیب کربنیک اسید معادله یونش و ثابت یونش به شکل زیر هستند.
رسانای یونی مایع در باتری
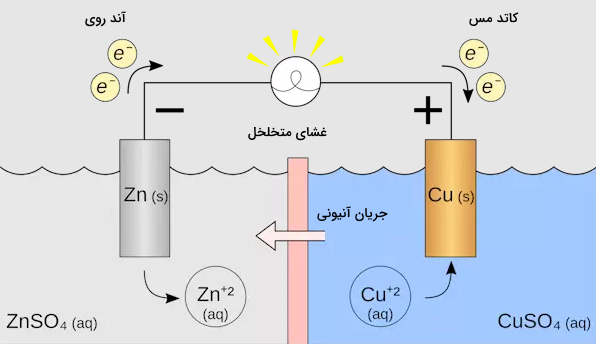
از الکترولیتها در سیستم تولید باتریها استفاده میشود. ساده ترین باتریها از دو الکترولیت تشکیل شدهاند. در ادامه یک باتری با دو الکترود مس و روی بررسی شده است. اتمهای روی تمایل دارند که به یون تبدیل شده و الکترون تولید کنند. این فرایند در معادله زیر نشان داده شده است.
با حرکت یونهای روی در محلول، کاتیونهای مس به سمت الکترود روی حرکت میکنند تا بار الکترونی آن را دریافت کنند.
در باتریهای خشک بجای استفاده از حلال مایع، از یک خمیر الکترولیت استفاده میشود تا از باتری نشت نکند. به این سیستم سلول گالوانی نیز گفته میشود.
رسانای یونی در باتریهای لیتیومی
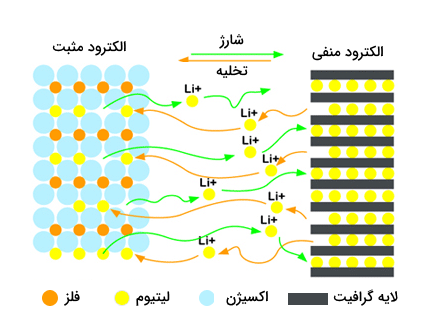
حتما تا به حال نام باتریهای لیتیومی (لیتیوم-یونی) را شنیده اید. از این نوع باتری که بر اساس رسانایی یونی کار میکند در بسیاری از وسایل مانند گوشیها و دیگر وسایل الکترونیکی استفاده میشود. این باتریها قابل شارژ هستند و در نتیجه چرخه بازیافتی مناسب و طولانی دارند. در این باتریها بجای وجود الکترولیت آبی، از یک الکترولیت غیر آبی استفاده میشود. این الکترولیت از مواد آلی و نمکهای لیتیوم استفاده میشود. ترکیب این دومورد باعث به وجود آمدن یک راسانایی یونی میشود. این باتریها ولتاز نسبتا بالایی دارند. در این باتریها الکترود مثبت از هیدروژن و الکترود منفی از گرافیت تشکیل شده است و یونهای لیتیوم ۱ بار مثبت وظیفه انتقال جریان را بر عهده دارند. در تصویر زیر نمایی کلی از باتریهای لیتیومی را مشاهده میکنید.
رسانایی گرافیت
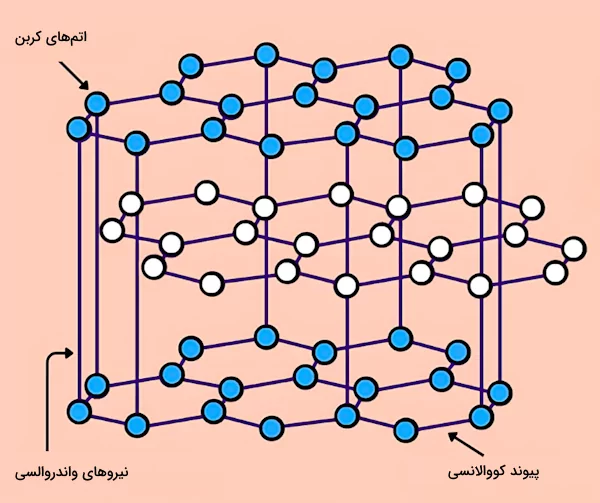
گرافیت استفاده شده در الکترود منفی باتریها یک انتخاب خوب برای رسانایی و کار بسیاری از سلولهای الکتریکی و یونی است. به این دلیل که گرافیت خاصیت رسانایی خوبی برای الکتریسیته و گرما را دارد. این خاصیت رسانایی گرافیت به دلیل ساختار خاص مولکولی آن است که به یونها و الکترونها اجازه میدهد آزادانه بین لایههای رویهم قرار گرفته ساختار آن حرکت کنند. در واقع گرافیت به دلیل ساختار لایهای که دارد، تنها نافلز رسانای مورد استفاده در بسایری از موارد است. ساختار گرافیت از لایههای کربنی رویهم قرار گرفتهای تشکیل شده که به وسیله نیروهای واندروالسی به یکدیگر متصل هستند. در تصویر زیر ساختار گرافیت را مشاهده میکنید.
کاربردهای رسانای یونی
از مواد رسانای یونی در فرایندهای الکتروشیمیایی بسیار حائز اهمیت هستند. این مواد در تکنولوژی ساخت باتریها، سلولهای سوختی و ... کاربرد دارند. از طرف دیگر از رساناهای الکتریکی که جریان الکتریسیته را در پاسخ به میدان الکتریکی اعمال شده عبور میدهند، در ساخت ترانزیستورها، دیودها و مقاومتها استفاده میشوند.
الکترولیتها که نوعی رسانای یونی مایع هستند، از مهمترین مواد برای انجام فرایندهای بیولوژیک هستند. این محلولها مسئولیت انتقال مواد معدنی را در طول سیستم بدن به عهده دارند. از این مواد میتوان به کاتیونهای کلسیم، پتاسیم، سدیم و منیزیم اشاره کرد.
جمعبندی
در این مطلب از مجله فرادرس آموختیم رسانای یونی به موادی گفته میشود که با عبور یونهای آنها توانایی عبور جریان الکتریکی را دارند. میزان رسانایی یونی این ترکیبات به غلظت یونها، دما و ساختار مواد بستگی دارد. محلولهای الکترولیت و برخی از جامدهای یونی کریستالی قابلیت هدایت جریان الکتریکی از طریق حرکت یونها را دارند. در الکترولیتها هرچه الکترولیت و تفکیک آن بیشتر باشد، رسانایی بیشتر میشود. در جامدات یونی، وجود حفرهها با موقعیتهای مناسب برای عبور جریان، به خاصیت رسانایی آنها کمک میکند. از خاصیت رسانایی یونی در تولید باتریها و بررسیهای مربوط به کیفیت آب در صنایع آب و فاضلاب و کشاورزی کاربرد دارد.