سلول الکترولیتی – به زبان ساده
یک سلول الکترولیتی از انرژی الکتریکی برای انجام واکنش اکسایش و کاهش غیر خودبهخودی استفاده میکند. سلول الکترولیتی نوعی از سلول الکتروشیمیایی به شمار میآید و به طور معمول برای تجزیه ترکیبات شیمیایی در فرآیندی موسوم به الکترولیز مورد استفاده قرار میگیرد. از نمونههای مهم در الکترولیز میتوان به تجزیه آب به هیدروژن و اکسیژن و تجزیه بوکسیت به آلومینیوم و مواد دیگر اشاره کرد. لازم به ذکر است که فرآیند آبکاری نیز با استفاده از یک سلول الکترولیتی انجام میگیرد. در این آموزش قصد داریم تا به بررسی سلول الکترولیتی و مقایسه آن با سایر سلولهای الکتروشیمیایی بپردازیم.

اجزای اصلی سلول الکترولیتی
یک سلول الکترولیتی از سه جزء اصلی (یک الکترولیت و دو الکترود) تشکیل شده است. الکترولیت به طور معمول، محلولی از آب و سایر حلالها است که یونهایی در آن حل شدهاند. همچنین، نمکهای مذاب همچون سدیم کلرید نیز نوعی الکترولیت به شمار میآیند. زمانیکه یک اختلاف پتانسیل خارجی به الکترودها اعمال شود، یونهای الکترولیت به الکترودهای کاتد و آند با بار مخالف جذب میشوند و در اینجاست که واکنشهای ردوکس انجام میگیرند.
لازم به ذکر است که در صورت اعمال یک پتانسیل الکتریکی خارجی با قطبیت (جهت) و مقدار مناسب، یک سلول الکترولیتی میتواند ترکیب شیمیایی پایدار و خنثی را تجزیه کند.
توصیف دقیق سلول الکترولیتی
شکل کلی یک واکنش را میتوان به صورت زیر نوشت:

میتوان سلولی ساخت که با عبور یک جریان الکتریکی از یک سیستم شیمیایی، بر روی آن کار انجام دهد. به این سلولها، سلول الکترولیتی میگویند. سلولهای الکترولیتی همچون سلولهای گالوانی از دو نیمسلول به نامهای نیمسلول اکسایش و نیمسلول کاهش تشکیل شدهاند.
جهت جریان الکترونها در یک سلول الکترولیتی ممکن است عکس جهت خودبهخودی جریان آنها در یک سلول گالوانی باشد، اما تعریف کاتد و آند در هر دو یکسان است یعنی در محل کاتد، کاهش صورت میگیرد و در محل آند، اکسایش. از آنجایی که جهت هر دو نیمواکنش، تغییر کرده است، علامت - و نه مقدار - پتانسیل سلول نیز معکوس میشود.
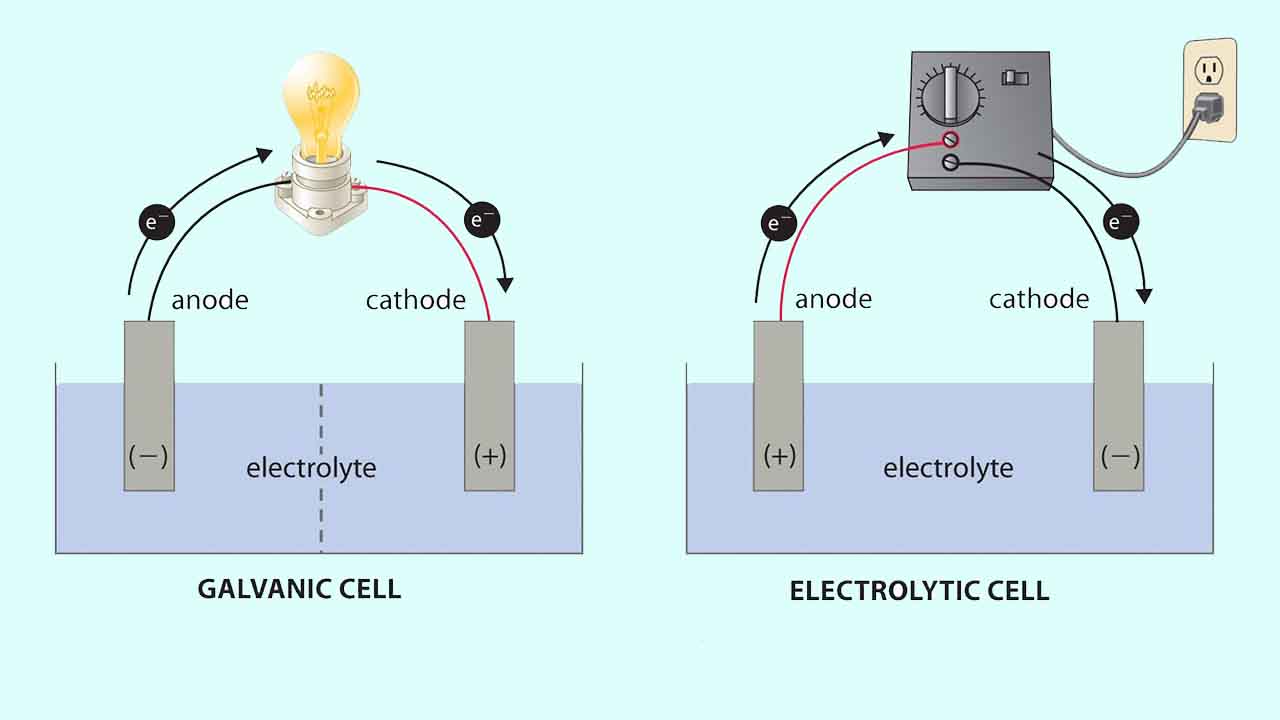
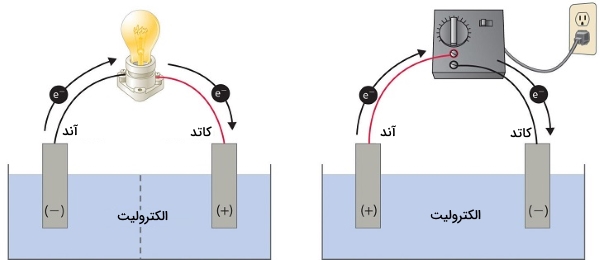
سلولهای الکترولیتی بسیار شبیه به سلولهای ولتاییک (گالوانی) هستند چراکه هردو به یک پل نمکی نیاز دارند و هر دو شامل الکترودهای کاتد و آند هستند. همچنین، شار پیوسته الکترون از آند به کاتد در هر دو سلول وجود دارد. با این وجود، در این دو سلول، تفاوتهایی نیز وجود دیده میشود که اصلیترین تفاوتهای این دو نوع سلول، در تصویر زیر نشان داده شده است.
در این تصویر، سلول گالوانی در سمت چپ و سلول الکترولیتی در سمت راست قرار دارد. سلول گالوانی، انرژی آزاد شده از واکنش خودبهخودی را به انرژی الکتریک تبدیل میکند که برای انجام کار، مورد استفاده قرار میگیرد. نیمواکنشهای اکسایش و کاهش به طور معمول در بخشهایی مجزا انجام میگیرند که از طریق یک مدار الکتریکی خارجی به یکدیگر متصل شدهاند. علاوه بر این، اتصال دومی هم وجود دارد که به یونها اجازه میدهد بین دو قسمت حرکت کنند. این اتصال توسط خطچینهایی در تصویر نشان داده شده که بیانگر غشای متخلخل است.
وجود غشای متخلخل برای حفظ حالت الکتریکی خنثی از جمله موارد ضروری در سلولهای گالوانی به شمار میآید. اختلاف پتانسیل موجود بین الکترودها سبب جریان الکترونها از طرف بخش کاهنده به اکسنده در مدار خارجی و تولید جریان الکتریکی میشود.
در سمت راست تصویر، یک سلول الکترولیتی قرار دارد. در این سلول، بمنظور تولید اختلاف پتانسیل بین الکترودها و اعمال نیرو برای حرکت الکترونها، از یک منبع انرژی الکتریکی خارجی بهره میگیرند. در اثر این اتفاق، واکنش اکسایش کاهشی صورت میگیرد که به طور خودبهخودی قابل انجام نیست. در هردو این سلولها، آند به الکترودی میگویند که در آن، نیمواکنش اکسایش رخ داده است و کاتد نیز الکترودی خواهد بود که در آن، نیمواکنش کاهش انجام میگیرد.
علاوه بر این، در جدول زیر، نیمواکنشها و واکنش کلی سلول آورده شده است.
| سلول الکترولیتی | سلول گالوانی |
| از انرژی الکتریکی بمنظور انجام واکنشهای اکسایش کاهش غیر خودبهخودی استفاده میشود. | بر اثر انجام واکنشهای خودبهخودی ردوکس، انرژی آزاد خواهد شد که به انرژی الکتریکی تبدیل میشود. |
| واکنش نیمسلول اکسایش | واکنش نیمسلول اکسایش |
| واکنش نیمسلول کاهش | واکنش نیمسلول کاهش |
| واکنش کلی در سلول | واکنش کلی در سلول |
توصیف واکنش در سلول الکترولیتی
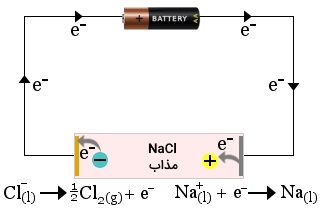
برای اینکه توضیح دهیم چه اتفاقی در یک سلول الکترولیتی رخ میدهد بهتر است تجزیه سدیم کلرید مذاب به فلز سدیم و گاز کلر را در نظر بگیریم. این واکنش زیر زیر آورده شده است. واکنش زیر، در جهت برگشت، خودبهخودی است اما در جهت رفت، چنین امکانی وجود ندارد.
اگر سدیم کلرید مذاب (طرف چپ معادله واکنش) را در یک ظرف قرار دهیم و الکترودهای کربن را نیز به قطبهای مثبت و منفی یک باتری متصل کنیم، یک واکنش الکترولیتی خواهیم داشت.
الکترونها از قطب منفی به به طرف کاتد حرکت میکنند و سبب کاهش یونهای سدیم به اتمهای سدیم میشوند. تشکیل اتم سدیم، بر روی کاتد صورت میگیرد و یونهای سدیم نیز حرکتی به سمت کاتد دارند.
یونهای منفی کلر به طرف آند حرکت میکنند و به هنگام اکسید شدن و تشکیل اتمهای کلر، الکترون آزاد خواهد شد. در ادامه، اتمهای کلر با یکدیگر ترکیب میشوند تا گاز کلر به صورت حباب تشکیل شود.
توجه داشته باشید که همچنان محل اکسایش در آند و محل کاهش در کاتد است اما بار روی الکترودها در این دو الکترود، به صورت معکوس خواهد بود. در اینجا، آند، مثبت و کاتد دارای بار منفی است.
شرایط عملیاتی سلول الکترولیتی، اهمیت بسیار زیادی دارد. مادهای که قویترین عامل کاهنده باشد، دچار اکسایش خواهد شد و همچنین، قویترین عامل اکسنده نیز کاهش مییابد. اگر به جای سدیم کلرید مذاب، از محلول آبی سدیم کلرید استفاده میشد، هیدروژن به جای سدیم کاهش پیدا میکرد زیرا عامل اکسنده قویتری از سدیم به شمار میآید.
سلول الکترولیتی مس نقره
در ادامه به طور کوتاه، واکنشها در سلول الکترولیتی مس نقره را مورد بررسی قرار میدهیم. این واکنشها برای سلول الکترولیتی مس نقره به صورت زیر نوشته میشوند.
اکسایش در آند:
کاهش در کاتد:
خواص سلول الکترولیتی و گالوانی
در جدول زیر، خواص سلولهای الکترولیتی و گالوانی آورده شده است.
| سلول گالوانی | سلول الکترولیتی |
| یک سلول گالوانی، انرژی شیمیایی را به انرژی الکتریکی تبدیل میکند. | یک سلول الکترولیتی سبب تبدیل انرژی الکتریکی به انرژی شیمیایی میشود. |
| واکنشهای ردوکس به طور خودبهخودی انجام میگیرند و به همین دلیل، انرژی الکتریکی تولید میشود. | واکنشهای اکسایش کاهش به صورت خودبهخودی رخ نمیدهند و برای انجام این واکنشها به انرژی الکتریکی نیاز داریم. |
| دو نیمسلول در دو بخش مجزا قرار دارند و از طریق پل نمکی یا غشای متخلخل به یکدیگر متصل شدهاند. | هر دو الکترود در یک محفظه در محلول الکترولیت مذاب قرار دارند. (در مواردی نیز به کمک پل نمکی، دو محفظه با یکدیگر مرتبط میشوند.) |
| الکترونها از طریق ذرات اکسید شده تامین میشوند و از آند به کاتد در مدار خارجی حرکت میکنند. | از یک باتری خارجی برای تامین الکترونها استفاده میشود که این الکترونها از کاتد وارد و از آند خارج میشوند. |
| در سلول گالوانی، آند، الکترود منفی و کاتد، الکترود مثبت است. واکنش در آند، اکسایش و در کاتد، کاهش خواهد بود. | آند، الکترود مثبت و کاتد، الکترود منفی است. واکنش در آند، اکسایشی و در کاتد، کاهشی خواهد بود. |
کاربرد سلول الکترولیتی
در ادامه، به کاربرد سلولهای الکترولیتی میپردازیم. از جمله کاربردهای این سلولها میتوان به تولید سدیم، شارژ باتریهای قابل شارژ و الکترولیز آب اشاره کرد.
تولید سدیم
از الکترولیز بمنظور تولید فلز سدیم از سدیم کلرید مذاب استفاده میشود. در این فرآیند به طور معمول، برای کاهش نقطه ذوب سدیم کلرید به زیر 700 درجه سانتیگراد، آنرا با کلسیم کلرید مخلوط میکنند. از آنجایی که الکترونگاتیوی کلسیم بیشتر از سدیم است، هیچ کلسیمی بر روی کاتد تشکیل نخواهد شد.
شارژ باتری
از فرآیند الکترولیز بمنظور شارژ باتریهای قابل شارژ استفاده میشود. باتریهای قابل شارژ به هنگام استفاده در دستگاههای مختلف، همچون یک سلول ولتائی عمل میکنند اما به هنگام شارژ شدن، نقش یک سلول الکترولیتی را ایفا میکنند.
به طور مثال، باتری ادیسون، یک سلول قابل شارژ ساده است که توسط «توماس ادیسون» (Thomas Edison) اختراع شد. این سلول از دو الکترود فلزی، یکی از جنس آهن و دیگری از جنس نیکل تشکیل شده است. به هنگام شارژ اولیه، لایهای از اکسید نیکل بر روی الکترود نیکل تشکیل میشود. الکترولیت در اینجا، محلول آبی پتاسیم هیدروکسید است. به هنگام دشارژ شدن، سلول ادیسون همچون یک سلول ولتائی عمل میکند و به هنگام شارژ، نقش سلول الکترولیتی دارد. در تصویر زیر، شکل کلی این سلول نشان داده شده است.
معادله شیمیایی واکنش در الکترودها به صورت زیر است:
به هنگام تخلیه و تولید انرژی الکتریکی، واکنش بالا از چپ به راست انجام میگیرد. به هنگام شارژ و زمانیکه سلول، نقش الکترولیتی دارد، واکنشهای بالا از راست به چپ انجام میگیرند.
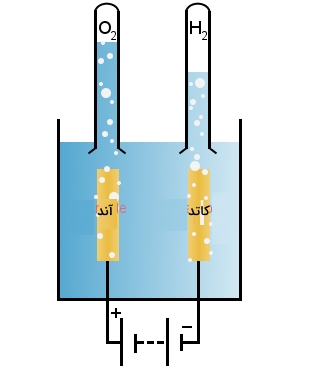
الکترولیز آب
الکترولیز آب از جمله راههای تولید سوخت پاک به شمار میآید. همانطور که در تصویر زیر نشان داده شده است، از جریان برق مستقیم (DC) میتوان برای تجزیه آب به هیدروژن و اکسیژن استفاده کرد. در کاتد، یونهای هیدروژن، الکترون جذب میکنند:
در آند، آب، الکترون از دست میدهد و یونهای اکسیژن و هیدروژن تشکیل میشوند.
پیش بینی واکنش الکترولیز
چهار عامل اصلی وجود دارد که امکان انجام یک الکترولیز را حتی با وجود ولتاژ زیاد، تعیین میکند.
- در برخی موارد نیاز به اعمال ولتاژ بیش از حد (اضافی) داریم تا بتوانیم با برهمکنشهای سطح الکترود مقابله کنیم. این حالت، بیشتر در خصوص گازها اتفاق میافتد. به طور مثال، به ۱/5 ولت «اضافه ولتاژ» (Over-potential) نیاز دارد درحالیکه این مقدار برای پلاتین، صفر است.
- ممکن است از بیش از یک واکنش در الکترود داشته باشیم به این معنی که با داشتن چند نیمواکنش، احتمال خروجیهای مختلفی از واکنش در سلول وجود خواهد داشت.
- احتمال دارد که واکنشدهندهها در حالت استاندارد خود قرار نداشته باشند یعنی ممکن است ولتاژ نیمسلولها، کمتر یا بیشتر از مقدار حالت استاندارد باشد.
- توانایی یک الکترود خنثی برای الکترولیز، به واکنشدهندهها در محلول الکترولیت وابسته است درحالیکه یک الکترود فعال (اکتیو) به خودی خود میتواند نیمواکنشهای اکسایش یا کاهش را انجام دهد.
اگر تمامی موارد بالا را در نظر بگیریم، به خوبی میتوان نیمواکنشها در الکترود و واکنش کلی در الکترولیز را پیشبینی کرد.
جنبههای کمی الکترولیز
«مایکل فارادی» (Micheal Faraday) در سال ۱۸۳۳ دریافت که به هنگام الکترولیز، همواره یک رابطه ساده بین مقدار ماده تولیدی یا مصرفی در یک الکترود و مقدار بار الکتریکی (Q) عبوری از درون سلول وجود دارد. به طور مثال، نیمواکنش زیر را در نظر بگیرید:
با توجه به ضرایب استوکیومتری در بالا، درمییابیم که زمانیکه ۱ مول یون نقره داشته باشیم،برای تبدیل شدن به ۱ مول فلز نقره، باید ۱ مول الکترون از کاتد تامین شود. از آنجایی که بار منفی بر روی یک الکترون را برابر با کولن میدانیم، با ضرب این عدد در ثابت آووگادرو، مقدار بار به ازای هر مول الکترون را بدست میآوریم. به این کمیت، «ثابت فارادی» (Faraday Constant) میگویند و آنرا با نماد F نشان میدهند.
بنابراین، با توجه به معادلهای که در خصوص یون نقره بیان کردیم، باید میزان 96490 کولن بار از میان کاتد عبور کند تا ۱ مول نقره رسوب کند. برای هر الکترولیز، بار الکتریکی (Q) گذرنده از میان الکترود، طبق رابطه زیر به مقدار الکترونها وابسته است:
به طور معمول، به جای اندازهگیری مقدار بار الکتریکی، جریان الکتریکی را در یک آزمایش الکترولیز، اندازهگیری میکنند. از آنجایی که کولن به صورت «مقدار بار گذرنده از یک نقطه مشخص در مدار الکتریکی به هنگام شار یک آمپر به مدت یک ثانیه» تعریف میشود، مقدار بار بر حسب کولن را میتوان از طریق حاصلضرب جریان اندازهگیری شده (آمپر) در زمان (ثانیه) به هنگام شارش آن محاسبه کرد.
در رابطه بالا، I و t به ترتیب بیانگر جریان و زمان هستند. با توجه به رابطه بالا در مییابیم که با تنظیم واحد زمان، به نتایج مورد نظر خود دست پیدا میکنیم. حال میتوانیم نیمواکنش در الکترود و واکنش کلی در الکترولیز را پیشبینی کنیم. علاوه بر این، محاسبه مقادیر واکنشدهندههای مصرفی و فرآوردههای تولیدی، اهمیت بسیاری دارد. برای این محاسبات از ثابت فارادی استفاده میکنیم.
مثال پیش بینی واکنش الکترولیز
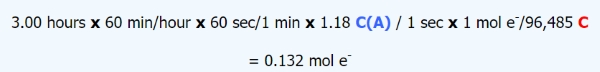
برای تعیین مقدار برم در یک نمونه، از الکترولیز نمونه برم استفاده میشود. در کاتد، نیمواکنش به صورت زیر نوشته میشود:
چه مقدار برم در طول ۳ ساعت و با شدت جریان ۱/18 آمپر، رسوب میکند.
با توجه به موارد مطرح شده، از ضرایب تبدیل زیر برای حل اینگونه سوالات استفاده کنید.
کولن 96485 = یک مول الکترون
(s) زمان × (C/s) جریان = (C) بار الکتریکی
(A) یک آمپر = یک کولن بار در ثانیه = (C/s)
با توجه به ضرایب تبدیل مطرح شده، به حل سوال بالا خواهیم پرداخت:
پیشنهاد می کنیم برای آشنایی بیشتر با این دسته سوالات، مطلب خود را بیازمایید شیمی دوازدهم با جواب را مطالعه کنید.












