سلول الکتروشیمیایی – به زبان ساده
سلول الکتروشیمیایی به دستگاهی میگویند که از طریق واکنشهای شیمیایی درون آن، انرژی الکتریکی تولید میکند. در هر فرآیند الکتروشیمیایی، الکترونها از یک ماده شیمیایی به دیگری از طریق واکنش اکسایش کاهش، جریان پیدا میکنند. واکنش اکسایش کاهش (ردوکس) زمانی بوجود میآید که الکترونها از مادهای اکسید شده به ماده در حال کاهش، منتقل شوند. در این نوع از فرآیندها، «کاهنده» (Reductant) به مادهای میگویند که الکترون از دست میدهد و اکسید میشود. «اکسنده» (Oxidant) نیز به ذراتی گفته میشود که در طول فرآیند، با پذیرش الکترون، کاهش مییابند.

از نمونههای معمول سلولهای الکتروشیمیایی میتوان به باتری ۱/۵ ولتی اشاره کرد که در بسیاری از دستگاههای الکترونیکی کاربرد دارد. چنین سلولهایی که توانایی تولید جریان الکتریکی را به کمک واکنشهای شیمیایی دارند، موسوم به «سلول گالوانی» (Galvanic Cell) یا سلول ولتاییک هستند. به عکس، سلول الکتروشیمیایی که در آنها، انجام واکنشهای شیمیایی به کمک اعمال یک جریان الکتریکی انجام میشود، در دسته سلولهای الکترولیتی جای میگیرند. در تصویر زیر، شکل کلی اجزای یک سلول الکتروشیمیایی نشان داده شده است.
توجه داشته باشید که به هنگام نمایش یک سلول الکتروشیمیایی، کاتد در سمت راست و آند در سمت چپ نمایش داده میشود.
نیم واکنش ها در سلول الکتروشیمیایی
واکنشهای اکسایش و کاهش را میتوان به صورت دو «نیمواکنش» (Half-reaction) نمایش داد. یکی از این نیمواکنشها نشان دهنده فرآیند کاهش و دیگری بیانگر فرآیند اکسایش هستند. به طور مثال، واکنش روی با برم را به صورت زیر نشان میدهند:
این واکنش را میتوان به صورت دو نیم واکنش نشان داد:
نیمواکنش کاهش:
نیمواکنش اکسایش:
هر یک از این نیمواکنش برای درک بهتر فرآیند نوشته میشوند. در این واکنش، روی، کاهنده و اکسنده است. با جمع کردن دو معادله بالا، به واکنش کلی میرسیم. در بسیاری از واکنشهای شیمیایی، فرض میکنیم که واکنشدهندهها به صورت فیزیکی با یکدیگر در تماس هستند. به عنوان مثال، در واکنشهای اسید و باز، هر دو ماده در یک فاز پراکنده شدهاند. اما در خصوص واکنشهای اکسایش کاهش (ردوکس) میتوان به طور فیزیکی، نیمواکنشها را از یکدیگر جدا کرد. البته برای جداسازی این نیمواکنشها، به یک مدار کامل نیاز داریم.
جهت تکمیل مدار و اتصال دو نیمواکنش، از یک سیم خارجی کمک میگیریم. با پیشرفت واکنش، الکترونها از کاهنده به اکسنده و به کمک سیم الکتریکی، جریان پیدا میکنند. در اثر این فرآیند، انرژی الکتریکی ایجاد میشود که میتوان به کمک آن، کار انجام داد. به دستگاهی که بمنظور تولید انرژی الکتریکی از یک واکنش خودبهخودی اکسایش کاهش استفاده میشود، سلول الکتروشیمیایی میگویند. البته نوع دیگری از سلولهای الکتروشیمیایی نیز وجود دارد که برای انجام واکنش غیر خودبهخودی اکسایش کاهش، از انرژی الکتریکی بهره میگیرد.
انواع سلول الکتروشیمیایی
۲ نوع مختلف از سلول الکتروشیمیایی وجود دارد. این سلولها موسوم به «سلولهای گالوانی» و سلولهای الکترولیتی هستند. سلولهای گالوانی را به افتخار فیزیکدان ایتالیایی، «لوییجی گالوانی» (Luigi Galvani) نامگذاری کردهاند.
این دانشمند به هنگام کالبدشکافی یک قورباغه مشاهده کرد که به هنگام اعمال یک شوک الکتریکی، پای این قورباغه تکان میخورد و بیانگر طبیعت الکتریکی پیامهای عصبی بود.
سلول گالوانی
یک سلول گالوانی، با استفاده از از انرژی آزاد شده به هنگام انجام واکنش خودبهخودی اکسایش کاهش، انرژی الکتریکی تولید می کند. این نوع از سلول الکتروشیمیایی را همچنین با نام سلولهای ولتاییک میشناسند که به افتخار مخترع آن «آلساندرو ولتا» (Alessandro Volta) نامگذاری شده است.

سلول الکترولیتی
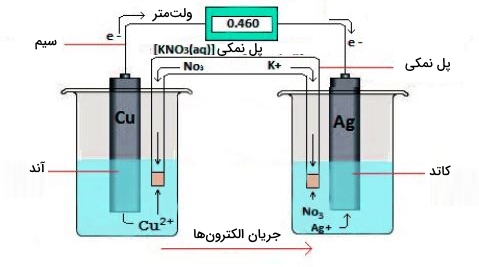
درمقابل، یک سلول الکترولیتی، با مصرف انرژی الکتریکی تامین شده از منبعی خارجی، سبب انجام واکنشهای غیر خودبهخودی اکسایش کاهش میشود. هر کدام از این دو نوع سلول، شامل دو الکترود هستند. این الکترودها فلزات جامدی را تشکیل میدهند که به یک مدار خارجی متصل شدهاند و این مدار، وظیفه اتصال دو بخش از سلول را به عهده دارد.
نیمواکنش اکسایش در یک الکترود (آند) و نیمواکنش کاهش در دیگری (کاتد) روی میدهد. با تکمیل (بسته) شدن مدار، الکترونها از آند به طرف کاتد جریان پیدا میکنند. این الکترونها همچنین بوسیله ماده یا محلولی یونی به یکدیگر متصل میشوند. این ماده یا محلول یونی سبب انتقال الکترونها از یک بخش الکترود به بخش دیگر میشود و موسوم به الکترولیت است.
سلول گالوانی
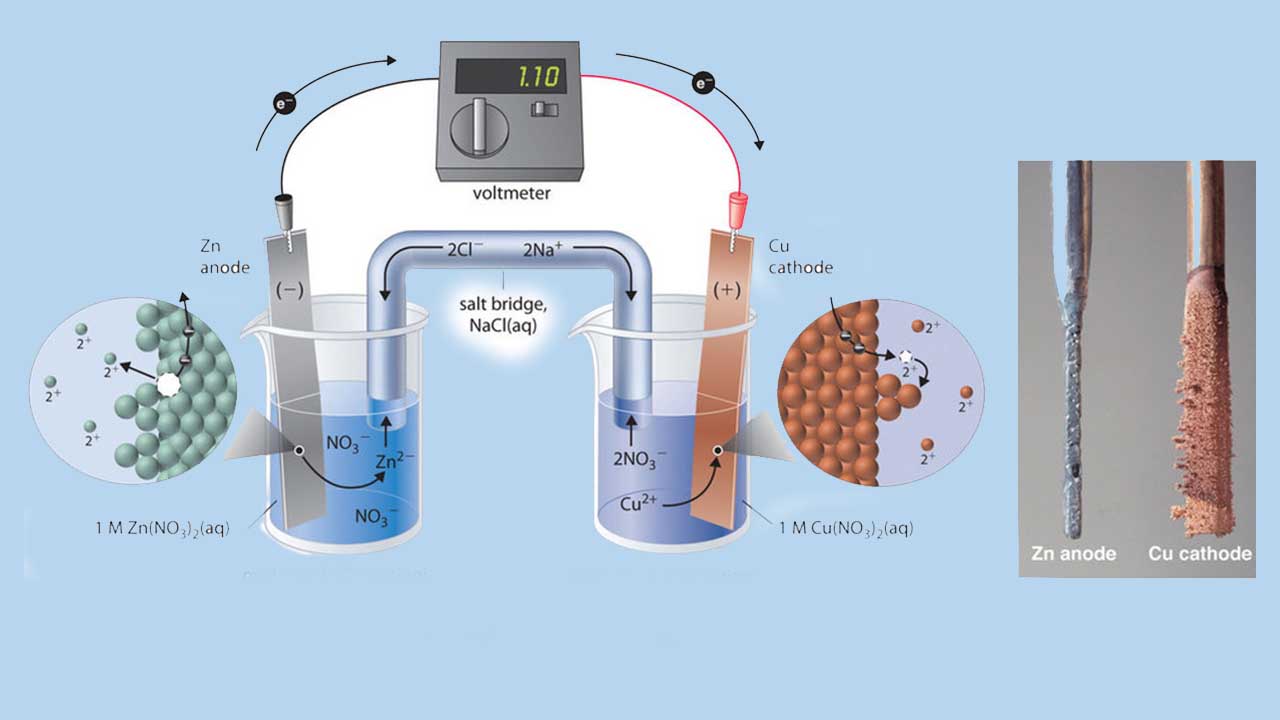
در ادامه، اصول سلولهای گالوانی (ولتاییک) و واکنشهای آنرا مورد بررسی قرار میدهیم. به همین منظور، سلول الکتروشیمیایی روی مس (واکنش فلز روی با یون مس) را در نظر میگیریم که در نهایت به تولید رسوب مس و یون روی منجر میشود. واکنش موازنه شده آن در زیر آورده شده است.
برای انجام چنین واکنشی، میتوانیم قطعهای از یک شمش روی را در داخل محلول آبی مس (II) سولفات قرار دهیم. با پیشرفت واکنش، شمش روی حل و تودهای از مس تشکیل میشود. این تغییرات به طور خودبهخودی انجام میگیرند اما کل انرژی آزاد شده به شکل گرما آزاد میشود و نمیتوان از آن برای انجام کار بهره گرفت.
چنین واکنشی را میتوان در یک سلول گالوانی هم انجام داد. برای تهیه این سلول، نواری از مس را در داخل یک بِشر حاوی محلول ۱ مولار یونهای و نواری از فلز روی را درون بشری حاولی محلول ا مولار یونهای قرار میدهند. دو نوار فلزی، نقش الکترود را دارند و بوسیله یک سیم به یکدیگر متصل شدهاند. ظرفهای حاوی محلولها نیز به کمک یک پل نمکی، به یکدیگر متصل شدهاند. در حقیقت، این پل نمکی، لولهای U شکل است که داخل بشرها قرار میگیرد.
یونهای پل نمکی به گونهای انتخاب میشوند که در واکنشهای الکتروشیمیایی شرکت نکنند و دچار اکسایش یا کاهش نشوند و رسوبات و ترکیبات پیچیده (کمپلکس) تشکیل ندهند. کاتیونها و آنیونهای معمولی که در پل نمکی مورد استفاده قرار میگیرند به ترتیب عبارتند از یونهای سدیم یا پتاسیم و یا . زمانیکه مدار بسته شود، واکنشی خودبهخودی روی میدهد. در آند (الکترود روی)، فلز روی به اکسید میشود و در کاتد (الکترود مس)، یونهای به فلز مس کاهش مییابند.
با پیشرفت واکنش، نوار روی حل خواهد شد و غلظت یونهای در محلول حاوی افزایش مییاد. به طور همزمان، جرم نوار مسی افزایش پیدا میکند و غلظت یونهای در محلول حاوی این یونها کاهش مییابد. به این ترتیب، همان واکنشی را که در بالا، در یک بشر تنها انجام شد را با جدا کردن نیمواکنشهای اکسایش و کاهش، به طور مجدد انجام دادیم. الکترونهایی که در آند آزاد میشوند، در طول سیم جریان پیدا میکنند و سبب تولید یک جریان الکتریکی خواهند شد. در نتیجه، سلولهای گالوانی، انرژی شیمیایی را به انرژی الکتریکی تبدیل میکنند که میتوان برای انجام کار، از آن بهره گرفت.
ماده الکترولیتی که در داخل پل نمکی وجود دارد، دو خاصیت عمده دارد که در ادامه به آن خواهیم پرداخت.
با حمل بارهای الکتریکی و حفظ حالت الکتریکی خنثی در هر دو محلول، مدار را کامل میکند که این کار از طریق مهاجرت یونها از میان این پل نمکی رخ میدهد. تا زمانی که تحت شرایط عملیاتی سلول، یونهای پل نمکی در واکنشهای اکسایش کاهش شرکت نکنند، ماهیت شیمیایی آنها در پل نمکی، اهمیتی ندارد. بدون چنین اتصالی، بار مثبت کلی در محلول ، با حل شدن فلز روی، افزایش پیدا میکرد و بار مثبت کلی در محلول کاهش مییافت.
پل نمکی از طریق جریان آنیونها به محلول و کاتیونها به محلول ، سبب خنثی شدن بارها میشود. در غیاب پل نمکی یا چنین اتصالات مشابهی، به دلیل عدم حفظ حالت الکتریکی خنثی، واکنش به سرعت متوفق میشد.
برای اندازهگیری اختلاف پتانسیل بین دو بشر، میتوان از یک ولتمتر بهره گرفت. اگر در مسیر سیم، یک کلید قرار دهیم، با قطع شدن کلید (قطع شدن مسیر اتصال آند به کاتد)، عبور جریان متوقف خواهد شد و در نتیجه، هیچ واکنش شیمیایی نخواهیم داشت. با وصل کلید، مدار خارجی تکمیل و جریان از آند به کاتد میسر میشود.
پتانسیل سلول
پتانسیل سلول که بر اساس ولت بیان میشود، به اختلاف پتانسیل الکتریکی بین دو نیمواکنش میگویند که به انرژی مورد نیاز برای حرکت یک ذره باردار در میدانی الکتریکی مرتبط است. در سلولی که به توضیح آن پرداختیم، ولتمتر، اختلاف پتانسیلی برابر با 1/10 ولت را نشان میدهد. از آنجایی که الکترونهای نیمواکنش اکسایش، در آند آزاد میشوند، آند در سلول گالوانی، دارای بار منفی خواهد بود و کاتد - که الکترونها را جذب میکند - بار مثبت خواهد داشت.
توجه داشته باشید که تمامی الکترودها در طول یک واکنش ردوکس، دچار تبدیلات شیمیایی نمیشوند. الکترود را میتون از فلزی خنثی و به شدت رسانا همچون پلاتین تهیه کرد تا بتوان از واکنش آن در فرآیند اکسایش کاهش، جلوگیری کرد. چنین پدیدهای را در مثال زیر مورد بررسی قرار دادهایم.
مثال سلول گالوانی
یک شیمیدان، سلولی گالوانی شامل دو الکترود تهیه کرده است. یک بشر شامل نواری از قلع و غوطهور شده در محلول آبی سولفوریک اسید و دیگری، دارای الکترود پلاتین در محلول نیتریک اسید است. هر دو محلول از طریق یک پل نمکی به یکدیگر متصل شدهاند و اتصال الکترودها نیز به کمک یک سیم الکتریکی انجام شده است. با وصل مدار، حبابهای گاز در الکترود پلاتین پدیدار میشوند. معادله موازنه شده زیر، نشاندهنده واکنش اکسایش کاهش خودبهخودی در این سلول الکتروشیمیایی است.
موارد زیر را برای این سلول گالوانی در نظر بگیرید:
- نیمواکنش هر الکترود را بنویسید.
- نشان دهید که کدام الکترود، کاتد و کدامیک آند است.
- نشان دهید که کدام الکترود مثبت و کدامیک منفی است.
برای حل این سوال، بعد از مشخص کردن نیمواکنشهای اکسایش و کاهش در هر الکترود، به کمک جهت جریان الکترونها، علامت کاتد و آند را مشخص میکنیم.
در نیمسلول کاهش، نیترات طی واکنش کاهشی به نیتریک اکسید تبدیل میشود. در ادامه، این نیتریک اکسید با اکسیژن هوا واکنش و را تشکیل میدهد که از مشخصههای آن، رنگ قرمز - قهوهای است. در نیمواکنش اکسایش، فلز قلع، اکسید میشود. نیمواکنشهای متناظر با فرآیندهای توضیح داده شده، در زیر آورده شده است:
نیمواکنش کاهش:
نیمواکنش اکسایش:
بنابراین، نیترات به کاهش پیدا میکند و قلع به اکسایش مییابد. از آنجایی که کاهش در الکترود پلاتین رخ میدهد، بنابراین کاتد ما در این سلول، پلاتین است. به طور مشابه نیز به دلیل وقوع اکسایش در الکترود قلع، آند، الکترود قلع در این سلول الکتروشیمیایی خواهد بود.
الکترونها از الکترود قلع به الکترود پلاتین، از طریق یک سیم الکتریکی جریان پیدا میکنند و در الکترود پلاتین، به نیترات منتقل میشوند. مدار الکتریکی به کمک یک پل نمکی تکمیل میشود. این پل، عامل عبور کاتیونها به طرف کاتد و آنیونها به طرف آند به شمار میآید. از آنجایی که الکترونها از الکترود قلع جریان پیدا میکنند در نتیجه، این الکترود، الکترود منفی ما خواهد بود. در مقابل، به دلیل جریان الکترونها به طرف الکترود پلاتین، الکترود پلاتین را به عنوان الکترود مثبت در نظر میگیریم.

مثال دوم سلول گالوانی
سلول گالوانی سادهای را در نظر بگیرید که در آن،۲ بشر به کمک یک پل نمکی به یکدیگر متصل شده باشند. یک بشر حاوی محلول در سولفوریک اسید رقیق به همراه الکترود پلاتین است. در بشر دیگر، محلولی از در سولفوریک اسید رقیق داریم. الکترود این نیمسلول نیز، پلاتین در نظر گرفته شده است. زمانیکه دو الکترود را با یک سیم به یکدیگر متصل کنیم، واکنش زیر انجام میشود.
همانند مثال قبل، نیمواکنشهای هر الکترود را بنویسید و کاتد و آند را به همراه علامتهای آنها مشخص کنید.
نیمواکنشها به صورت زیر خواهند بود:
الکترود پلاتین در محلول پرمنگنات، کاتد و الکترود قلع نیز آند است. به توجه به جهت جریان، کاتد، مثبت و آند منفی خواهد بود.
دیاگرام سلول الکتروشیمیایی
اگر این مطلب را به طور کامل مطالعه کرده باشید، میبینید که هر بار برای توصیف یک سلول الکتروشیمیایی باید توضیحاتی طولانی را برای بیان نیمسلولها، الکترودها و الکترولیت ارائه کنیم. برای جلوگیری از توضیحات اضافی، میتوانیم از یک نمایش خطی موسوم به «دیاگرام سلول» (Cell Diagram) برای نمایش سلول الکتروشیمیایی استفاده کنیم. در این نوع از نمایش، ماهیت شیمیایی الکترودها و بخشهای سلول را به کمک فرمول شیمیایی نشان میدهیم و آند در سمت چپ و کاتد در سمت راست قرار میگیرد.
مرز بین فازها، به کمک خطوط عمودی (یک خط عمودی) نمایش داده میشوند. پل نمکی را نیز از طریق دو خط عمودی نمایش میدهیم. بنابراین، دیاگرام سلول برای سلول الکتروشیمیایی روی مس را میتوانیم همچون تصویر زیر نمایش دهیم:

سلولهای گالوانی میتوانند آرایشی به غیر از نمونههایی داشته باشند که تا الان بررسی کردهایم. به طور مثال، ولتاژ حاصل از واکنش اکسایش کاهش را میتوان با قرار دادن دو الکترود در یک بشر حاولی الکترولیت، با دقت بیشتری اندازهگیری کرد. این نوع آرایش، خطاهای ناشی از مقاومت مرز فازها برای جریان بارها را کاهش میدهد که به آن «پتانسیل پیوند» (Junction Potential) یا پتانسیل اتصال میگویند. در دیاگرام زیر، نمونهای از این سلول گالوانی، نمایش داده شده است.
با کمی توجه در مییابید که این دیاگرام سلول الکتروشیمیایی فاقد خطوط عمودی است یعنی در این سلول، پل نمکی نداریم به همین دلیل، دو خط عمودی را در دیاگرام لحاظ نکردهایم. نیمواکنشها و واکنش کلی به شکل زیر هستند:
واکنش در کاتد:
واکنش در آند:
واکنش کلی:
یک سلول گالوانی تکبخشی، همان ولتاژی را تولید میکند که در سلول دو بخشی داشتیم اما تخلیه آن سریعتر انجام میگیرد. علت این تخلیه سریع، واکنش مستقیم واکنشدهندهها در آند است. به همین دلیل، چنین سلولی، کاربرد مناسبی برای تولید الکتریسیته ندارد.
مثال رسم دیاگرام سلول الکتروشیمیایی
دیاگرام سلول را برای سلول گالوانی مثال قبل رسم کنید. معادله موازنه شده آن به صورت زیر است:
آند این سلول، نواری از جنس قلع و کاتد آن پلاتین است. با شروع از سمت چپ، برای نشان دادن مرز فازی بین الکترود و محلول حاوی قلع، از خط عمودی کمک میگیریم. بنابراین، بخش آند را به صورت زیر خواهیم نوشت:
در این نوع از نمایش میتوانستیم عبارت در بخش کاتد استفاده کنیم اما از آنجایی که این ترکیب، در واکنش کلی شرکت نمیکند، بنابراین نیازی به نمایش آن نیست. بخش کاتد حاوی محلول نیتریک اسید است و به همراه فراورده واکنش و پلاتین، در واکنش شرکت میکند. این بخش را نیز به صورت زیر مینویسیم که خطوط عمودی در آن، بیانگر مرز فازها است.
با ترکیب این دو بخش در سلول الکتروشیمیایی، به دیاگرام زیر میرسیم:
با توجه به اینکه غلظتهای محلول در سوال داده نشده است، آنها را در دیاگرام نمایش نمیدهیم. در مثال بعد، دیاگرام سلول را به همراه غلظت محلولها نمایش میدهیم.
مثال دوم رسم دیاگرام سلول الکتروشیمیایی
دیاگرام سلول را برای واکنش زیر نشان دهید. فرض کنید که در این سلول، غلظت یون نقره و منیزیم برابر با ۱ مولار است.
در نهایت، با توجه به مثال قبل و همچنین، غلظتهای داده شده، دیاگرام آن به صورت زیر رسم میشود:













