درصد فراوانی ایزوتوپ چیست؟ – به زبان ساده + فرمول و نمونه سوال
اتمهایی که در هسته خود تعداد پروتون یکسان و تعداد نوترون متفاوتی دارند ایزوتوپ نامیده میشوند. این ایزوتوپها میتوانند به صورت مصنوعی یا طبیعی ایجاد شوند. ایزوتوپهای یک عنصر به میزان یکسانی در طبیعت وجود ندارند. احتمال وجود برخی از آنها بیشتر و برخی کمتر است. بر همین اساس برای ایزوتوپهای مختلف یک عنصر درصد فراوانی ایزوتوپ مشخص میکنند. در ادامه این مطلب از مجله فرادرس، ایزوتوپ و نحوه اندازهگیری درصد فراوانی ایزوتوپ توضیح داده میشود.
- فرق ایزوتوپها با هم و علت متفاوت بودن درصد فراوانی آنها را یاد خواهید گرفت.
- میآموزید چگونه ساختار اتم، عدد اتمی و عدد جرمی را شناسایی کنید.
- تأثیر نسبت نوترون به پروتون در پایداری هسته و ایزوتوپهای رادیواکتیو را درک میکنید.
- فرمول محاسبه جرم اتمی میانگین عناصر با درصد فراوانی ایزوتوپها را یاد خواهید گرفت.
- عملکرد دستگاه طیفسنج جرمی برای تعیین فراوانی ایزوتوپها را یاد میگیرید.
- یاد میگیرید مسائل درصد فراوانی ایزوتوپ را با روشهای عددی و طیف جرمی حل کنید.

درصد فراوانی ایزوتوپ چیست ؟
درصد فراوانی ایزوتوپ به درصدی از اتم با میزان مشخصی از جرم اتمی گفته میشود که در طبیعت وجود دارند. ایزوتوپهای یک عنصر به میزان یکسان وجود ندارند. برای مثال جیوه ۷ ایزوتوپ دارد که ایزوتوپ Hg-۲۰۲ بیشترین (۲۹٫۸۰٪) و ایزوتوپ Hg-۱۹۶ کمترین درصد فراوانی ایزوتوپ (۰٫۱۴۶٪) را در میان این هفت ایزوتوپ دارند.
ایزوتوپ چیست ؟
ایزوتوپ از واژه یونانی «Iso» به معنی یکسان و Tope به معنی محل گرفته شده است. به اتمهایی که تعداد پروتون یکسان و تعداد نوترون متفاوتی دارند، ایزوتوپ گفته میشود که دو زیر گروه دارد.
- ایزوتوپ پایدار
- ایزوتوپ ناپایدار
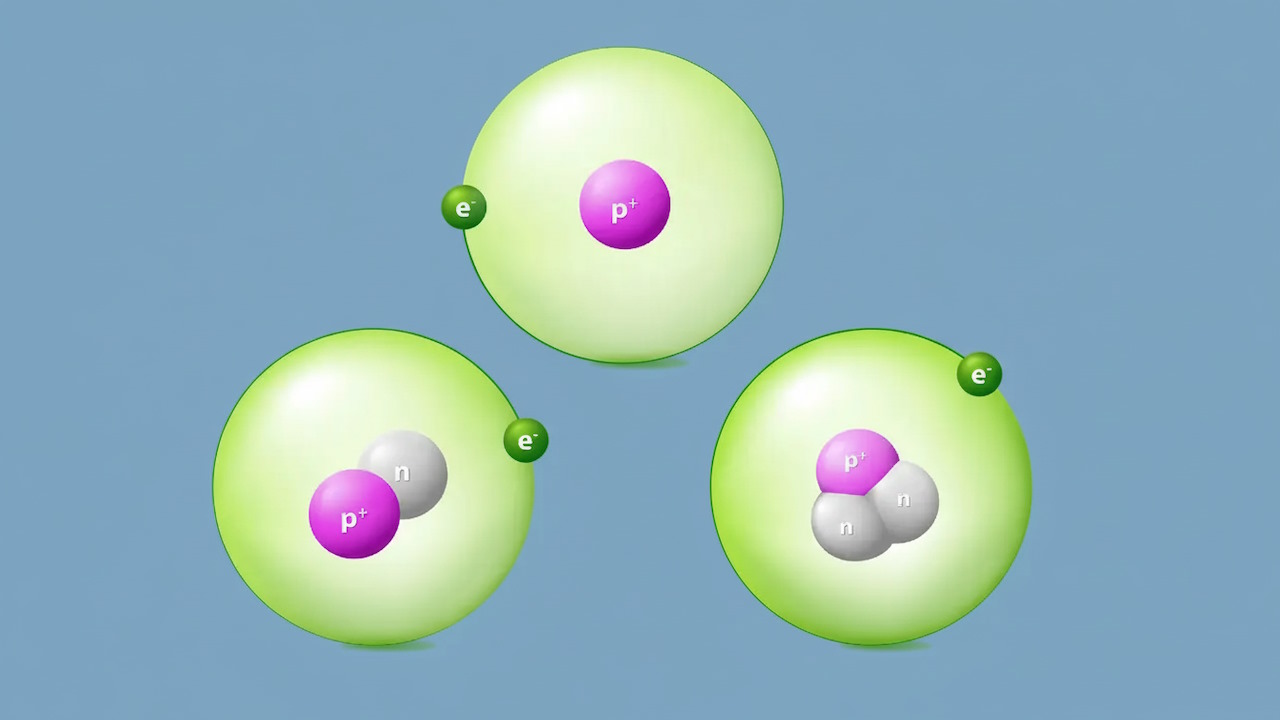
همه چیز از اتم تشکیل شده است و اتم از سه ذره زیراتمی نوترون (خنثی)، الکترون (بار منفی) و پروتون (بار مثبت) تشکیل شده است. پروتون و نوترون در هسته اتم قرار دارند و الکترون در اوربیتالها پیرامون هسته اتم هستند. شکل زیر اتم هلیوم را نشان میدهد.
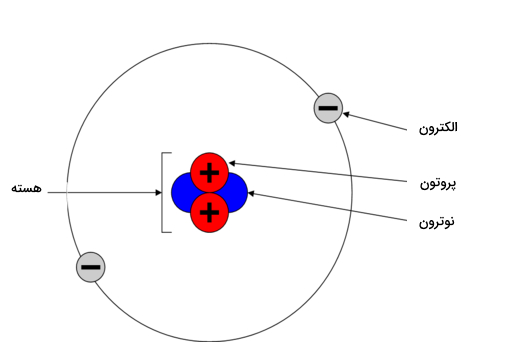
همانطور که در تصویر مشاهده میکنید هلیوم دارای دو پروتون، دو نوترون و دو الکترون است. عدد اتمی هلیوم ۲ است (بر اساس تعداد پروتون) برای اینکه این اتم خنثی باشد دو الکترون نیز در آن با بار مخالف وجود دارد. اگر عدد اتمی یعنی تعداد پروتونهای اتم تغییر کند به اتمی دیگر تبدیل میشود. تعداد الکترون برابر با پروتون نیز برای پایداری اتم اهمیت دارد. با این حال اتم میتواند تعداد نوترون متفاوتی داشته باشد و ایزوتوپهایی با جرم اتمی متفاوت ایجاد کند.
از میان عنصرهای جدول تناوبی تنها ۲۱ عنصر «مونوتوپیک» (Monotopic) هستند و یک ایزوتوپ طبیعی دارند و سایر عنصرها دارای ایزوتوپهای متعدد هستند.
نقش نوترون در اتم چیست ؟
پروتونها در هسته اتم قرار گرفتهاند و همگی بار مثبت دارند به همین دلیل، نیروی الکترواستاتیک موجود، آنها را از یکدیگر دور میکند. برای این که انسجام هسته اتم حفظ شود نیروی قویتری نسبت به نیروی الکترواستاتیک در هسته وجود دارد که پروتونها را در کنار یکدیگر قرار میدهد. این نیروی قوی به دلیل وجود نوترون در هسته به وجود میآید.
در اتمهایی که جرم اتمی آنها کمتر از ۲۰ است، نسبت نوترون به پروتون برابر با یک نشاندهنده پایداری هسته است و در صورتی که اگر این نسبت بیشتر از ۱ باشد هسته رادیواکتیو و ناپایدار ایجاد میشود. برای مثال در اتم هلیوم میزان نوترون ۲ و پروتون نیز ۲ عدد است. بر همین اساس نسبت نوترون به پروتون در اتم ۱ در نظر گرفته میشود که نشاندهنده پایداری هسته آن است. در حالی که اتم C-۱۴ دارای ۸ نوترون و ۶ پروتون است که نسبت آن بیشتر از یک است. این اتم هسته ناپایدار و رادیواکتیو دارد که به طور خودبخودی متلاشی میشود. به این هستهها بهاصطلاح ایزوتوپ ناپایدار گفته میشود.
عدد جرمی و نماد ایزوتوپی
عدد جرمی یک اتم برابر با تعداد پروتون به علاوه تعداد نوترونهای موجود در هسته اتم است. در شیمی برای نشان دادن میزان پروتونها و نوترونهای یک عنصر از نماد ایزوتوپی استفاده میکنند. در نماد ایزوتوپی عدد جرمی در سمت چپ و بالای نام اتم و عدد اتمی (تعداد پروتونهای یک اتم) در پایین و سمت چپ اتم نوشته میشود. با کم کردن میزان عدد جرمی از عدد اتمی میتوان میزان نوترونها را محاسبه کرد. اگر عنصر مورد نظر بار الکتریکی هم داشته باشد، بار نیز در سمت راست و بالای نام عنصر نوشته میشود.

فراوانی نسبی ایزوتوپ و جرم اتمی میانگین
عنصر کلر دو ایزوتوپ کلر-۳۵ و کلر-۳۷ دارد (کلر-۳۶ به طور مصنوعی تولید میشود.). جرم اتمی کلر-۳۵ برابر با ۳۴٫۹۷ uو جرم اتمی کلر-۳۷ برابر با ۳۶٫۹۷ u است. اگر به جدول تناوبی عناصر توجه کنید جرم اتمی عنصر کلر برابر با ۳۵٫۴۵ u نوشته شده است. این میزان برابر با میانگین جرمهای اتمی ایزوتوپهای عنصر کلر در طبیعت است. به این جرم اتمی میانگین گفته میشود. یکای جرم اتمی میانگین به صورت amu یا u نوشته میشود.
اما با محاسبه جرم اتمی میانگین دو ایزوتوپ کلر این سوال پیش میآید که چرا جرم اتمی میانگین کلر (۳۵٫۴۵ u) با جرم اتمی میانگین ایزوتوپهای آن (۳۵٫۹۷) یکسان نمیشود؟ یعنی وقتی اعداد ۳۴٫۹۷ و ۳۶٫۹۷ را با هم جمع میکنیم و تقسیم بر ۲ میکنیم عدد ۳۵٫۹۷ بدست میآید که با ۳۵٫۴۵ نوشته شده در جدول تناوبی متفاوت است.

این تفاوت به دلیل اختلاف فراوانی نسبی این دو ایزوتوپ در طبیعت است. به این معنی که برخی از ایزوتوپها بیشتر و برخی کمتر در طبیعت وجود دارند. برای مثال در عنصر کلر، ایزوتوپ کلر-۳۵ فراوانی نسبی ۷۵٫۷۶٪ و در ایزوتوپ کلر-۳۷ فراوانی نسبی ۲۴٫۲۴٪ است. به همین علت نمیتوان جرم اتمی میانگین آنها را تنها با جمع کردن جرم اتمی ایزوتوپها و سپس تقسیم کردن بر تعداد ایزوتوپها بدست آورد و باید درصد فراوانی ایزوتوپها را نیز در نظر گرفت.
فراوانی نسبی معمولا به صورت درصد گزارش میشود. برای درک نحوه اندازهگیری جرم اتمی میانگین به مثال ارائه شده در بخش بعد مراجعه کنید.
نحوه محاسبه جرم اتمی میانگین به وسیله درصد فراوانی ایزوتوپ
توجه داشته باشید که «جرم اتمی میانگین» (Average Atomic Mass) یک عنصر یک میانگین وزنی است و برای محاسبه آن میزان «جرم اتمی» (Atomic Mass) هر ایزوتوپ در فراوانی نسبی (Relative Abundance) آن ضرب میشود سپس نتایج هر یک از ایزوتوپها با یکدیگر جمع میشود. فرمول زیر برای محاسبه آن طراحی شده است.
برای مثال محاسبه جرم اتمی میانگین کلر به صورت زیر عمل میکنیم.
اندازه گیری درصد فراوانی ایزوتوپ چگونه انجام میشود ؟
تا به این قسمت از متن متوجه شدیم که چگونه جرم اتمی میانگین را با استفاده از جرم اتمی ایزوتوپها و فراوانی نسبی آنها محاسبه کنیم. ولی سوال این است که میزان فراوانی نسبی ایزوتوپها چگونه بدست میآید؟ برای مثال چگونه متوجه میشویم که ۷۵٫۷۶٪ از اتم کلر موجود در طبیعت را کلر-۳۵ تشکیل میدهد؟
میزان فراوانی نسبی از طریق روشی به نام «طیف سنجی جرمی» (Mass Spectrometry) محاسبه می شود. در این روش نمونهای که دارای اتمهای مورد نظر است وارد دستگاه میشود. نمونه که معمولا در محلول آلی و آبی قرار دارد به سرعت توسط دمای بالا تبخیر می شود و نمونه تبخیر شده توسط الکترونهای توان بالا بمباران میشوند.
این الکترونها انرژی کافی برای جدا کردن الکترونها از اتمهای نمونه را دارند و در حین انجام این فرایند یونهای با بار مثبت ایجاد میشود. این یونها سپس از طریق صفحات الکتریکی شتاب میگیرند و توسط یک میدان مغناطیسی منحرف میشوند (به تصویر زیر دقت کنید).
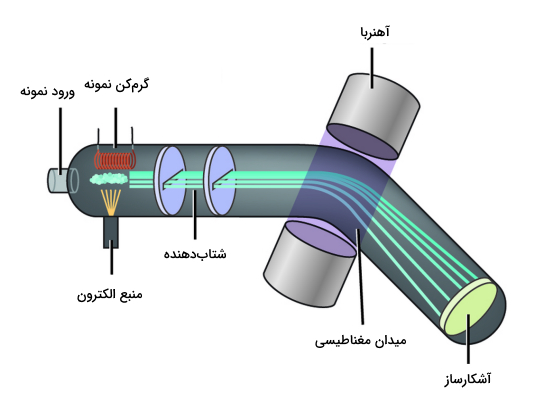
مقدار انحراف هر یون در میدان مغناطیسی به سرعت و بار آن بستگی دارد. یونهایی که کندتر حرکت میکنند (یعنی یونهای سنگینتر) کمتر منحرف میشوند، در حالی که یونهایی که سریعتر حرکت میکنند (یعنی یونهای سبکتر) بیشتر منحرف میشوند. برای فهم بهتر این موضوع به نیرویی که برای شتاب دادن به «آجر» نیاز دارید در مقابل نیروی لازم برای شتاب دادن «شن» فکر کنید. نیروی لازم برای شتاب دادن به «شن» بسیار کمتر است. علاوه بر این، میدان مغناطیسی یونهای با بارهای بالاتر را بیشتر از یونهایی با بار کمتر منحرف میکند.
مقداری که هر یون منحرف می شود با نسبت جرم به بار آن (m/z)، رابطه عکس دارد. یونها پس از انحراف به یک آشکارساز میرسند که دو چیز را اندازهگیری میکند.
- نسبت جرم به بار هر یون
- تعداد یونهایی که نسبت جرم به بار یکسان دارند.
فراوانی نسبی یک یون خاص در نمونه را میتوان با تقسیم کردن تعداد یونها با نسبت جرم به بار یکسان بر تعداد کل یونهای شناسایی شده، محاسبه کرد. در پایان آزمایش، دستگاه طیفسنج جرمی یک طیف جرمی برای نمونه تولید میکند که فراوانی نسبی را در نسبت جرم به بار ترسیم کرده است.
در بعضی از نمونهها تمام یونهایی که در دستگاه طیف سنج جرمی ایجاد میشوند یک بار مثبت میگیرند. در این حالت، نسبت جرم به بار هر یون با جرم یون یا همان جرم اتمی برابر میشود. به همین جهت نموداری که برای آنها ارائه میشود به جای اینکه در محور X نسبت جرم به بار را نشان دهد، تنها جرم اتمی را نشان میدهد.
بررسی طیف جرمی عنصر زیرکونیوم
فرض کنید که نمونهای خالص از عنصر زیرکونیوم با عدد اتمی ۴۰ را در دستگاه طیفسنج جرمی قرار دادهایم. نمودار زیر نتیجه طیفسنجی این عنصر را به ما نشان می دهد.
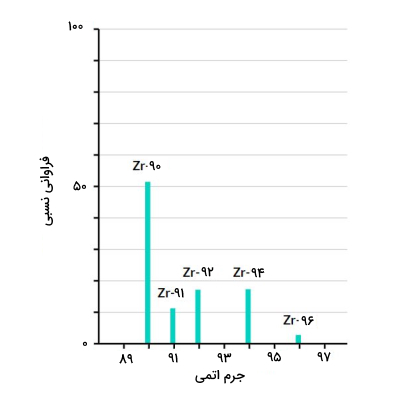
پنج پیک در این نمودار دیده می شود که نشاندهنده پنج ایزوتوپ طبیعی عنصر زیرکونیوم هستند. میزان بلندی هر پیک نشاندهنده میزان فراوانی آن ایزوتوپ به نسبت سایر ایزوتوپهای عنصر زیرکونیوم است. در مورد عنصر زیرکونیوم ایزوتوپ Zr-۹۰ بیشترین فراوانی را دارد.
پیشنهاد میکنیم برای آشنایی بیشتر با این روش اندازهگیری درصد فراوانی ایزوتوپ، فیلم آموزش طیف سنجی جرمی فرادرس که لینک آن در ادامه آورده شده است را مشاهده کنید.
نحوه محاسبه درصد فراوانی ایزوتوپ
برای درک بهتر نحوه اندازهگیری درصد فراوانی ایزوتوپها در ادامه چند مثال برای عناصر مس، سیلیکون و سرب آورده شده است.
مثال اول: محاسبه درصد فراوانی ایزوتوپهای عنصر مس
جرم اتمی مس ۶۳٫۵۴۶ ± ۰٫۰۰۳ amu است. Cu-۶۳ و Cu-۶۵ ایزوتوپهای مس هستند. جرم اتمی Cu-۶۳ برابر با ۶۲٫۹۲۹۶ amu و جرم اتمی Cu-۶۵ برابر با ۶۴٫۹۲۷۸ amu است. درصد فراوانی ایزوتوپهای آن را حساب کنید.
برای بدست آوردن درصد فراوانی ایزوتوپها از معادله زیر استفاده میکنیم.
با جایگزین کردن مقادیر گزارش شده در سوال به معادله زیر میرسیم.
این را میدانیم که میزان درصد فراوانی Cu-۶۸ + Cu-۶۳ برابر با ۱۰۰ است. از این رو این معادله را بر اساس درصد فراوانی یکی از ایزوتوپها (Cu-۶۳) مینویسیم. همچنین برای سادهتر شدن محاسبات دو طرف نمودار را بر ۱۰۰ تقسیم میکنیم. در این حالت مجموع درصد فراواتنی ایزوتوپها برابر با ۱ میشود.
این عبارت را در معادله اصلی اضافه میکنیم.
با کم کردن مقدار درصد فراوانی ایزوتوپ Cu-۶۳ از عدد ۱۰۰ میتوان مقدار درصد فراوانی ایزوتوپ Cu-۶۵ را بدست آورد.
مثال دوم: محاسبه درصد فراوانی ایزوتوپهای عنصر سیلیکون
عنصر سیلیکون سه ایزوتوپ طبیعی با جرمهای اتمی زیر را دارد. اگر جرم اتمی میانگین عنصر سیلیکون ۲۸٫۰۸۵۵ amu باشد و درصد فراوانی Si-۲۹ برابر با ۴٫۶٪ باشد، درصد فراوانی ایزوتوپهای Si-۲۹ و Si-۲۹ را محاسبه کنید.
- جرم اتمی ایزوتوپ Si-۲۸ برابر با ۲۷.۹۷۶۹ amu
- جرم اتمی ایزوتوپ Si-۲۹ برابر با ۲۸٫۹۷۶۵ amu
- جرم اتمی ایزوتوپ Si-۳۰ برابر با ۲۹٫۹۷۳۸ amu
برای حل این مسئله ایزوتوپ Si-۲۸ را x و ایزوتوپ Si-۳۰ را y در نظر میگیریم. میدانیم که جرم اتمی میانگین از فرمول زیر محاسبه میشود.
جرم اتمی میانگین عنصر سیلیکون= (درصد فراوانی Si-۲۸ × جرم اتمی Si-۲۸) + (درصد فراوانی Si-۲۹ × جرم اتمی Si-۲۹) + (درصد فراوانی Si-۳۰ × جرم اتمی Si-۳۰)
همچنین میدانیم که مجموع درصد فراوانی ایزوتوپهای یک عنصر برابر با ۱۰۰ است. برای این که معادله ساده شود این معادله را به ۱۰۰ تقسیم میکنیم که در این صورت مجموع درصد فراوانیهای یک ایزوتوپ برابر با ۱ میشود.
معادله را بر اساس یکی از ایزوتوپها مینویسیم.
حال به جای y در معادله اول از نتیجه بدست آمده استفاده میکنیم.
مقدار بدست امده از x را در ۱۰۰ ضرب میکنیم تا درصد فراوانی ایزوتوپ Si-۲۸ بدست آید.
سپس مقدار بدست آمده از x را در فرمول زیر جایگزاری میکنیم تا مقدار ایزوتوپ Si-۳۰ بدست آید.
مثال سوم: محاسبه درصد فراوانی ایزوتوپهای عنصر سرب
جرم اتمی میانگین عنصر سرب برابر با ۲۰۷٫۱۹ amu است. این عنصر دارای سه ایزوتوپ است که جرم اتمی آنها در بخش زیر نوشته شده است. اگر درصد فراوانی نسبی ایزوتوپهای Pb-۲۰۷ و Pb-۲۰۸ برابر باشد، درصد فراوانی هر سه ایزوتوپ را بدست آورید.
- جرم اتمی ایزوتوپ Pb-۲۰۶ برابر با ۲۰۵.۹۸ amu
- جرم اتمی ایزوتوپ Pb-۲۰۷ برابر با ۲۰۶.۹۸ amu
- جرم اتمی ایزوتوپ Pb-۲۰۸ برابر با ۲۰۷.۹۸ amu
طبق صورت مسئله درصد فراوانی ایزوتوپهای Pb-۲۰۷ و Pb-۲۰۸ برابر است پس هر دو را x در نظر میگیریم. ایزوتوپ Pb-۲۰۶ را نیز y در نظر میگیریم. میدانیم که مجموع درصد فراوانی ایزوتوپهای یک عنصر برابر با ۱۰۰ است. برای راحتی آن را ۱ در نظر میگیریم و در آخر اعداد بدست امده را در ۱۰۰ ضرب میکنیم. بر همین اساس میتوانیم فرمول زیر را بنویسیم.
y را بر اساس x در فرمول مینویسیم.
درصد فراوانی ایزوتوپهای Pb-۲۰۷ و Pb-۲۰۸ برابر با ۲۶٫۳٪ بدست آمد و درصد فراوانی y دو برابر x است که میزان آن ۴۷٫۴٪ میشود.
جمعبندی
ایزوتوپهای یک عنصر در تعداد نوترون با یکدیگر تفاوت دارند به همین جهت جرم اتمی متفاوت برای عنصر به وجود میآورند. این ایزوتوپها به طور یکسان در طبیعت وجود ندارند. بعضی بیشتر و بعضی کمتر هستند. به درصدی از این ایزوتوپها که در طبیعت وجود دارند، درصد فراوانی ایزوتوپ گفته میشود. برای اندازهگیری درصد فراوانی ایزوتوپها از دستگاه طیفسنجی جرمی استفاده میشود. درصد فراوانی ایزوتوپها برای محاسبه جرم اتمی میانگین اتم اهمیت دارد و در فرمول محاسبه آن به کار میرود.
آزمون درصد فراوانی ایزوتوپ
۱. در اتمهای یک عنصر، تفاوت اساسی میان ایزوتوپها چیست و این تفاوت چه اثری بر ویژگیهای هسته دارد؟
ایزوتوپها ساختار هسته متفاوتی از نظر شکل هندسی دارند.
ایزوتوپها متفاوت در تعداد الکترونها هستند و رفتار شیمیایی آنها تفاوت دارد.
ایزوتوپها تعداد پروتونهای مختلف دارند و این موجب بار هسته متفاوت میشود.
ایزوتوپها تعداد نوترونهای مختلف دارند که باعث تغییر جرم هسته میشود.
ایزوتوپهای یک عنصر دارای تعداد پروتون یکسان هستند اما تعداد نوترونهای متفاوت دارند. این تفاوت در نوترون باعث اختلاف در جرم هسته و پایداری هسته اتم میشود.
۲. در عناصر سبک، چه نسبتی بین نوترون و پروتون باعث پایداری ایزوتوپ میشود و اگر این نسبت بیشتر شود، چه اتفاقی رخ میدهد؟
نسبت برابر نوترون و پروتون باعث پایداری است و افزایش آن موجب ناپایداری ایزوتوپ میشود.
برتری تعداد پروتون نسبت به نوترون موجب پایداری و افزایش نوترون پایداری را زیاد میکند.
هرچه تعداد نوترون کمتر از پروتون باشد ایزوتوپ پایدارتر خواهد بود.
تعداد برابر الکترون با پروتون عامل اصلی پایداری و افزایش نوترون هیچ تاثیری ندارد.
وقتی تعداد نوترون و پروتون در عناصر سبک برابر باشد، ایزوتوپ پایدار میماند. اگر تعداد نوترون از پروتون بیشتر شود، ایزوتوپ ناپایدار و رادیواکتیو میشود. بنابراین رابطه مستقیم بین نسبت نوترون به پروتون و پایداری وجود دارد و تنها «برابری تعداد نوترون و پروتون» است که پایداری را تضمین میکند، نه افزایش آن.
۳. اگر یک عنصر دو ایزوتوپ با فراوانیهای متفاوت داشته باشد، چه چیزی تعیین میکند که جرم اتمی میانگین به جرم کدام ایزوتوپ نزدیکتر شود؟
ایزوتوپی که عدد جرمی کوچکتری دارد.
ایزوتوپی که بار مثبت بیشتری دارد.
هر ایزوتوپی که فراوانی بیشتری داشته باشد.
ایزوتوپی که نوترون کمتری دارد.
جرم اتمی میانگین براساس میانگین وزنی بین جرم و درصد (فراوانی) هر ایزوتوپ محاسبه میشود. بنابراین فراوانی بیشتر یک ایزوتوپ باعث میشود که جرم اتمی میانگین به جرم همان ایزوتوپ نزدیکتر باشد.
۴. در صورت داشتن فراوانی نسبی و جرم دو ایزوتوپ یک عنصر، کدام روش برای بهدست آوردن جرم اتمی میانگین این عنصر صحیح است؟
فراوانی نسبی هر ایزوتوپ را با جرم آن جمع کنیم.
جرم هر ایزوتوپ را در فراوانی نسبی خودش ضرب و مجموع حاصل را جمع کنیم.
جرم بزرگتر را به دلیل تاثیر بیشتر بهعنوان جرم اتمی میانگین انتخاب کنیم.
هر دو جرم را با هم جمع و بر تعداد ایزوتوپ تقسیم کنیم.
در روش درست باید جرم هر ایزوتوپ را در فراوانی نسبی مربوط به خودش ضرب کنیم و مجموع این مقادیر را بهعنوان میانگین وزنی به دست آوریم. این روش باعث میشود تاثیر هر ایزوتوپ باتوجه به درصد وجودش محاسبه شود. جمع ساده جرمها یا انتخاب تنها ایزوتوپ غالب نتیجه دقیقی نمیدهد و جمع فراوانی با جرم نیز معنای علمی ندارد.
۵. در طی فرآیند تعیین درصد فراوانی ایزوتوپهای یک عنصر با دستگاه طیف سنج جرمی، چه اصلی برای جداسازی یونهای ایزوتوپ به کار میرود؟
همه یونها بدون جداسازی وارد آشکارساز میشوند.
یونها براساس نسبت جرم به بار (m/z) در میدان مغناطیسی منحرف میشوند.
یونها فقط براساس رنگ طیف منتشر شده شناسایی میشوند.
جداسازی فقط با توجه به جرم مطلق یونها انجام میشود.
در طیف سنج جرمی، یونها براساس نسبت جرم به بار (m/z) توسط میدان مغناطیسی منحرف میشوند. به این صورت، هر ایزوتوپ به دلیل داشتن m/z متفاوت، مسیر جداگانهای پیدا میکند و میتوان آنها را شناسایی و درصد فراوانی هرکدام را تعیین کرد.
۶. در تفسیر طیف جرمی یک عنصر، اگر چند پیک با ارتفاعهای مختلف مشاهده شود، برای شناسایی فراوانترین ایزوتوپ کدام معیار را باید در نظر گرفت؟
شمارش تعداد کل پیکها و یافتن میانه آنها.
انتخاب ایزوتوپی که بلندترین پیک را در طیف دارد.
انتخاب ایزوتوپی که کوچکترین مقدار m/z را دارد.
انتخاب ایزوتوپی که مقدار m/z آن از همه بزرگتر باشد.
در طیف جرمی عنصر، بلندی هر پیک معیاری از فراوانی ایزوتوپ مربوط به آن است. ایزوتوپی که بلندترین پیک را دارد، بیشترین تعداد یونها و در نتیجه بالاترین فراوانی نسبی را در نمونه نشان میدهد. انتخاب ایزوتوپ با کوچکترین یا بزرگترین مقدار m/z، یا قرار دادن پیک در موقعیت میانه، دلیلی برای تشخیص فراوانترین ایزوتوپ ارائه نمیکند و با مفهوم نسبت فراوانی نسبی مطابقت ندارد.












