ترکیبات کوئوردیناسی – از صفر تا صد
ترکیبات کوئوردیناسی یا کمپلکسهای کوئوردیناسی، دستهای از ترکیبات شیمیایی شامل یک اتم یا یون مرکزی هستند که این اتم یا یون مرکزی معمولا فلزی و موسوم به مرکز کوئوردیناسیون است. همچنین، اطراف این مرکز، مولکولهای پیوندی موسوم به «لیگاند» (Ligand) قرار دارند. بسیاری از ترکیبات شامل فلز، مخصوصا فلزات واسطه، در دسته ترکیبات کوئوردیناسی قرار میگیرند. یک ترکیب کوئوردیناسی که مرکز آن، اتمی فلزی باشد را کمپلکس فلزی مینامند.

به طور معمول، تغییر رنگی که در ترکیبات کوئوردینانسی رخ میدهند، حاصل واکنشهای ردوکس نیستند بلکه این تغییرات، حاصل تغییر در لیگاندهای متصل به مرکز فلزی هستند. در این شرایط حتی ممکن است عدد اکسایش فلز، تغییری نداشته باشد. در این آموزش قصد داریم تا در خصوص ترکیبات کوئوردیناسی و نحوه نامگذاری آنها صحبت کنیم.
نظریه ترکیبات کوئوردیناسی ورنر
ترکیب شیمیایی «نیل فرنگی» (Prussian Blue) به طور تصادفی در اویل قرن هجدهم کشف شد و شاید آنرا بتوان به عنوان اولین ترکیب کوئوردیناسی به شمار آورد. در سال ۱۷۹۸، شیمیدانی فرانسوی به نام «تاسر» (B. M. Tassaert)، بلورهایی زردرنگ از ترکیبی با فرمول را از مخلوط و بدست آورد.
آنچه که در این خصوص عجیب به نظر میآمد، آن بود که هر دو ترکیب و ، ترکیبات پایداری بودند که با ترکیب با یکدیگر، مواد پایداری را تولید میکردند. چنین ترکیباتی را که از دو ترکیب سادهتر تشکیل شده بودند، ترکیبات کوئوردیناسی نامیدند. پیشنهاد میکنیم برای آشنایی بیشتر با ترکیبات کوئوردیناسی و کاربردهای آنها در شیمی، فیلم آموزش فرادرس که در ادامه آورده شده است را مشاهده کنید.
در سال ۱۸۵۱، ترکیب کوئوردیناسی دیگری از این دو ماده کشف شد. این ماده که فرمول آن به صورت بود، بلورهایی به رنگ بنفش داشت. دو ترکیب مورد اشاره را در تصویر زیر میبینید:

هرقدر این نوع از ترکیبات، بیشتر مورد مطالعه قرار گرفتند، معنای عمیقتری نیز پیدا کردند. به طور مثال، در واکنش با ، ترکیب زردرنگ، ۳ مول را مطابق انتظار تولید میکند اما در ترکیب بنفش، تنها ۲ مول به تولید میرسد. در نیمه دوم قرن نوزدهم، شیمی ترکیبات معدنی از جمله شاخههای بسیار پرطرفدار در علم شیمی محسوب میشد که در این میان، کارهای شیمیدان سوییسی، «آلفرد ورنر» (Alfred Werner) اهمیت بسیاری پیدا کرد. نظریه ترکیبات کوئوردیناسی ورنر، واکنش بلورهای زرد و بنفش را با نقره نیترات اینگونه توصیف کرد که در محلولهای آبی، این دو ترکیب در اثر واکنشهای زیر، یونیزه میشوند. واکنش a مربوط به یونش ترکیب زردرنگ و واکنش b مربوط به ترکیب بنفش است.
بنابراین، ترکیب a سه مول از یون کلر را برای تشکیل رسوب سه مول فراهم میکند درحالیکه ترکیب b، تنها دو مول یون کلر بدست میدهد. این نوع از یونش که توسط ورنر ارائه شد، پایهای برای مطالعات بیشتر در خصوص هدایت الکتریکی ترکیبات کوئوردینانسی شد.
از آنجایی که ترکیب a در نهایت، چهار یون تولید میکند، نسبت به ترکیب دیگر، رسانایی بهتری دارد. نظریه ورنر در سال ۱۸۹۳ بیان میکرد که برخی اتمهای فلزی، خاصه فلزات واسطه، دو نوع ظرفیت والانس یا پیوندی دارند. نوع اول بر اساس تعداد الکترون از دست رفته به هنگام تشکیل یون فلزی توصیف میشود. نوع دوم، دلیل پیوندهای سایر لیگاندها، به فلز مرکزی است.
در تعاریف امروزی، یک کمپلکس، به هر ذرهای شامل لیگاندهای متصل به فلز مرکزی میگویند. فلز مرکزی میتواند یک اتم یا یون و کمپلکس میتواند یک آنیون یا مولکول خنثی باشد. در یک فرمول شیمیایی، فلز مرکزی و لیگاندهای متصل به آنرا با علامت کروشه نشان میدهند. ترکیبات کمپلکس یا شامل یونهای کمپلکس را با نام ترکیبات کوئوردیناسی میشناسند. کمپلکس کاتیونی، آنیونی، خنثی و یک ترکیب کوئوردیناسی به ترتیب از راست به چپ در زیر آورده شده است:
، ، ،
عدد کوئوردیناسیون
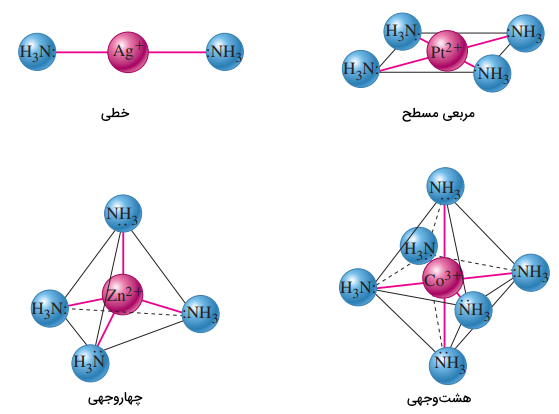
«عدد کوئوردیناسیون» (Coordination Number) یک کمپلکس، تعداد نقاط اطراف یک فلز مرکزی است که پیوندهای متصل به لیگاند در آن شکل میگیرند.
این عدد در بین ترکیبات کوئوردیناسی، از ۲ تا ۱۲ ذکر میشود. عدد کوئوردیناسیون به عوامل مختلفی بستگی دارد که از آنجمله میتوان به نسبت شعاع اتم فلز مرکزی (یا یون مرکزی) به شعاع لیگاندهای متصل اشاره کرد. در جدول زیر، این عدد برای یونهای معمول آورده شده است.
| نام یون | عدد کوئوردیناسیون |
| ۲، ۴ | |
| ۲ | |
| ۲، ۴ | |
| ۶ | |
| 4، ۶ | |
| 4، ۶ | |
| 4، ۶ | |
| 4 | |
| 4 | |
| 4، ۶ | |
| 6 | |
| 6 | |
| 6 | |
| 6 | |
| 4 | |
| 6 |
چهار شکل معمول در کمپلکسهای یونی، در تصویر زیر آورده شدهاند. از کاربردهای عملی عدد کوردیناسیون، نوشتن و تفسیر فرمول شیمیایی کمپلکسها است.
مثال
عدد کوئوردیناسیون و عدد اکسایش در کمپلکس یونی چیست؟
در تعیین عدد اکسایش یک یون فلزی در یک کمپلکس، باید توجه کنیم که کدامیک از لیگاندها باردار و کدامیک خنثی هستند. این کمپلکس یونی، یک یون کلر، یک یون و چهار مولکول آمونیاک دارد. بنابراین، عدد کوئودیناسیون این کمپلکس برابر با ۶ است. از این ۶ لیگاند، ۲ لیگاند بار دارند و چهار لیگاند (مولکول آمونیاک) نیز خنثی هستند. سهم کل آنیونها از بار خالص، برابر با است. با توجه به بار خالص کمپلکس یونی برابر با ، عدد اکسایش کبالت مرکزی را میتوان ذکر کرد.

در نتیجه، عدد اکسایش یک فلز را میتوان از طریق رابطه زیر محاسبه کرد:
مجموع بارهای لیگاند + عدد اکسایش فلز = بار کمپلکس یونی
در خصوص این مساله:
عدد اکسایش فلز =
= عدد اکسایش فلز
لیگاندها
ویژگی مشترک بین لیگاندها در ترکیبات کوئوردیناسی، توانایی آنها برای دادن جفتالکترونها به اتمهای فلزی یا یونهایی است که به عنوان اسید لوییس عمل میکنند.
لیگاندی که از یک جفتالکترون برای تشکیل یک نقطه اتصال به اتم فلز مرکزی یا یون مرکزی استفاده میکند را «لیگاند تکدندانه» (Monodenate Ligand) میگویند. از نمونههای لیگاندهای تکدندانه میتوان به موارد زیر اشاره کرد:
- آنیونهای تکاتمی هچون یونهای هالید،
- آنیونهای چنداتمی همچون یون هیدروکسید
- مولکولهای ساده همچون آمونیاک
- مولکولهای پیچیدهتر مانند، متانامین با فرمول
توجه داشته باشید که پیوند کووالانسی که در واکنش اسید-باز رخ میدهد از نوع کووالانسی کوئوردینانسی است. بنابراین، عدد کوئوردیناسیون یک یون فلز واسطه در کمپلکس را میتوان به عنوان تعداد پیوندهای کووالانسی کوئوردینانسی در یک کمپلکس در نظر گرفت.
برخی از لیگاندها میتوانند دهنده بیش از یک جفتالکترون از اتمهای مختلف باشند. همچنین این قابلیت را دارند تا الکترونها را به محلهای مختلفی از ساختار هندسی یک کمپلکس اختصاص دهند. به این نوع از لیگاندها، «لیگاندهای چنددندانه» (Polydentate Ligand) میگویند. به طور مثال، مولکول اتیلن دیآمین میتواند به عنوان دهنده ۲ جفتالکترون عمل کند به گونهای که هر جفت به یک اتم نیتروژن اختصاص پیدا میکند. از آنجایی که این مولکول از دو نقطه به فلز مرکزی اتصال دارد، به آن لیگاند «دودندانه» (Bidentate) میگویند.
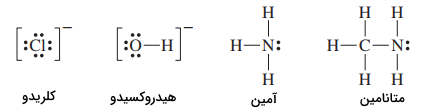
سه نوع معمول لیگاند چنددندانه در تصویر زیر آورده شده است.
به تصویر زیر نگاه کنید. در این تصویر، اتصال دو لیگاند اتیلن دیآمین (en) به یک یون نشان داده شده است. در ادامه، نحوه اتصال هر لیگاند را در مختصات کروی اطراف این یون بررسی خواهیم کرد.
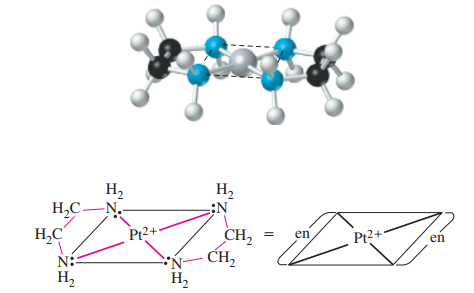
- از آنجایی که یون ، عدد کوئوردیناسیون ۴ با لیگاند تکدندانه دارد و به دلیل اینکه کمپلکس نمیتواند لیگاند دیگری همچون ، یا را اتصال دهد، نتیجه میگیریم که هر گروه en باید از دو نقطه اتصال پیدا کند.
- لیگاندهای en در کمپلکس یونی، دیگر خواص بازی ندارند و نمیتوانند با دریافت پروتون از آب، تولید کنند. بنابراین، هر دو گروه در هر مولکول en باید به کمکپلکس یونی متصل شوند.
دو حلقه پنجضلعی که در تصویر بالا آمده است را در نظر بگیرید. این حلقهها شامل اتمهای پلاتین، نیتروژن و کربن هستند. زمانی که پیوند لیگاند چنددندانه به یک یون فلزی، حلقهای (به طور معمول با ۵ یا ۶ عضو) تولید کند، به این کمپلکس، «کیلیت» (Chelate) یا کلات میگویند. همچنین، لیگاند چنددندانهای مذکور را هم «عامل کیلیتساز» (Chelating Agent) یا عامل کلاتهکننده مینامند. به این فرآیند نیز «کیلیتسازی» (Chelation) میگویند.
نامگذاری ترکیبات کوئوردیناسی
کمپلکسهای کوئوردیناسی، خواص مغناطیسی، رنگ و ایزومرهای مخصوص به خود را دارند و کاربردهایی از عکاسی تا درمان سرطان برای آنها در نظر گرفتهاند. در نتیجه، روشی خاص برای نامگذاری آنها نیز باید وجود داشته باشد.
بر اساس نظریه باز لوییس، لیگاندها، بازهای لوویس محسوب میشوند چراکه به عنوان دهنده الکترون به اتم فلز مرکزی عمل میکنند. فلزها نیز در حقیقت، اسید لوییس و پذیرنده الکترون هستند. ترکیبات کوئوردیناسی، یک لیگاند و یک کاتیون فلز مرکزی را شامل میشوند. بار کلی در این ترکیبات میتواند خنثی، مثبت یا منفی باشد. ترکیبات کوئوردیناسی به صورت کمپلکس یا شامل کپملکسهای یونی هستند که نمونههایی از آنها در ادامه آورده شدهاند:
- کمپلکس کاتیونی:
- کمپلکس آنیونی:
- کمپلکس خنثی:
- ترکیب کوئوردیناسی:
همانطور که در بالا نیز توضیح داده شد، تعداد لیگاندهایی که به یک فلز متصل میشوند، بسته به نوع دندانهای بودن آن است. برای نامگذاری ترکیبات کوئوردیناسی، موارد زیر را باید به یاد داشته باشیم:
- لیگاندها در ابتدا و به ترتیب الفبا نامگذاری میشوند.
- در ادامه، نام فلز آورده میشود.
- در مرحله بعد، عدد اکسایش فلز به همراه عدد رومی (داخل پرانتز) ذکر خواهد شد.
قانون اول: لیگاندهای آنیونی
لیگاندهای آنیونی که در انتها، به صورت «-ید» وجود داشته باشند، با «-و» جایگزین میشوند. به طور مثال، کلرید به کلرو تبدیل خواهد شد. آنیونهای شامل «-یت» و «-ات» با «-یتو» و «اتو» جایگزین میشوند. به طور مثال، نیتریت به نیتریتو و نیترات به نیتراتو تبدیل خواهند شد. در جدول زیر، لیگاندهای تکدندانهای آنیونی را با نام مخصوص به خود مشاهده میکنید.
| فرمول مولکولی | نام لیگاند | فرمول مولکولی | نام لیگاند |
| فلوئورو | هیدروکسو | ||
| کلرو | سولفاتو | ||
| برومو | تیوسولفاتو | ||
| یدو | نیترو، نیتریتو-ان | ||
| اوکسو | نیتریتو، نیتریتو-او | ||
| سیانو | تیوسیاناتو، تیوسیاناتو-اس | ||
| ایزوسیانو | ایزوتیوسیاناتو، تیوساناتو-ان |
قانون دوم: لیگاندهای خنثی
بیشتر مولکولهای خنثی که به صورت لیگاند هستند، نام عادی خود را به همراه دارند. در جدول زیر، این نوع از لیگاندها به همراه نام آنها آورده شده است.
| فرمول مولکولی لیگاند | نام لیگاند |
| «آمین» (Ammine) | |
| آکوا | |
| کربونیل | |
| نیتروسیل | |
| متیلآمین | |
| پیریدین |
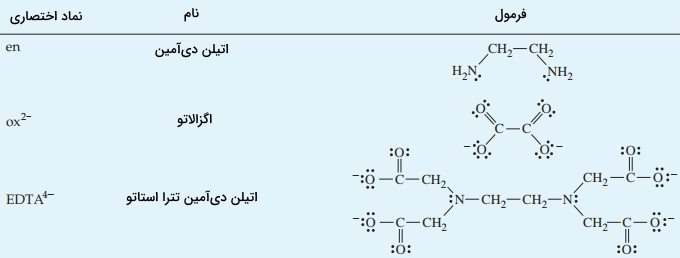
لیگاندهای چنددندانه از همان قانون آنیونها و مولکولهای خنثی پیروی میکنند. این لیگاندها را در زیر مشاهده میکنید:
| نام کوتاه | نام بلند |
| اتیلن دیآمین | |
| اگزالاتو | |
| اتیلن دیآمین تترا استاتو |
قانون سوم: تعدد لیگاند
تعداد لیگاند موجود در یک کمپلکس را با پیشوندهای دی، تری، تترا و ... نشان میدهند. لیگاندهای چنددندانهای که در نام خود، پیشوند داشته باشند - مانند en و EDTA - از این قانون تبعیت نمیکنند. برای نشان دادن تعداد این لیگاندها در ترکیبات کوئوردیناسی باید نام لیگاند را داخل پرانتز بیاورید و از عبارات «بیس» (bis)، «تریس» (tris) و «تتراکیس» (tetrakis) استفاده کنید. در جدول زیر، پیشوندهای مرتبط با تعداد لیگاندها در یک کمپلکس، آورده شده است:
| تعداد لیگاند | لیگاند تکدندانه | لیگاند چنددندانه |
| 1 | مونو | - |
| 2 | دی | بیس |
| 3 | تری | تریس |
| 4 | تترا | تتراکیس |
| 5 | پنتا | - |
| 6 | هگزا | - |
پیشوندها همواره قبل از نام لیگاند آورده میشوند و در زمان قرار دادن لیگاند به ترتیب الفبا، به حساب نمیآیند. توجه داشته باشید که به طور معمول از عبارت مونو استفاده نمیشود. به طور مثال، را به صورت تریآمین کلرودیکربونیل آهن (III) نامگذاری میکنند. توجه داشته باشید که لیگاند، همواره در ابتدا قرار میگیرد.
مثال 1
کمپلکس یونی زیر را نامگذاری کنید:
$$\left[C r C l_{2}\left(H_{2} Oright)_{4}\right]^{+}$$
برای حل این مساله ابتدا باید لیگاندها را شناسایی کنیم. لیگاندها در این مثال، و هستند. بنابراین، از نامهای لیگاند تکدندانه کلرو و آکوا استفاده خواهیم کرد. بر اساس الفبا نیز عبارت آکوا قبل از کلرو میآید. ۴ آکوا و ۲ کلرو داریم و در نتیجه، قبل از نام آنها، پیشوند به کار میبریم. از آنجایی که هردو، لیگاند تکدندانه هستند، نامگذاری لیگاندها را به شکل زیر انجام میدهیم:
تترا آکوا دی کلرو
حال که لیگاندها نامگذاری شدند، به نامگذاری فلز میپردازیم. فلز مورد نظر، کروم (کرومیوم) است. بنابراین، نام این کمپلکس را به صورت زیر، یادداشت میکنیم:
یون تترا آکوا دیکلرو کروم (III)
در ادامه این آموزش، دلیل استفاده از عبارت (III) توضیح داده میشود.
مثال ۲
کمپلکس یونی زیر را نامگذاری کنید:
برای نامگذاری این ترکیب، از همان روش قبل بهره میگیریم. در این مثال، یک لیگاند کلرو و یک لیگاند اتیلن دیآمین داریم. فلز مرکزی، اتم کبالت است. در استفاده از روش قبلی باید توجه داشته باشیم که در این مثال، en یک لیگاند چنددندانه و شامل پیشوند «دی» در نام خود است. در نتیجه، از عبارت بیس استفاده میکنیم. در نهایت، نام این ترکیب کوئوردیناسی عبارتست از:
یون دیکلرو بیس (اتیلندیآمین) کبالت (III)
قانون چهارم: فلزات
به هنگام نامگذاری فلز مرکزی، نام قراردادی و عدد اکسایش آنرا باید بدانید. برای نمایش عدد اکسایش هم از اعداد رومی در داخل پرانتز بهره میگیریم. به طور مثال، در سوال بالا، کروم و کبالت، عدد اکسایش دارند. به همین دلیل، بعد از نام آنها از عبارت (III) استفاده کردیم. مس با عدد اکسایش را به صورت مس (II) نشان میدهند. اگر کمپلکس کوئوردیناسی به صورت یک آنیون باشد، به انتهای فلز مرکزی، «-ات» اضافه خواهد شد. علاوه بر این، نام برخی از فلزات به شکل یونانی آنها تغییر پیدا خواهد کرد. به طور مثال، مس (II) را با نام کوپرات (II) نیز نامگذاری میکنند. در جدول زیر، نام لاتین برخی از فلزات، آورده شده است. البته استفاده از نام لاتین در نامگذاری فارسی، کاربرد کمتری دارد:
| فلزات واسطه | نام لاتین |
| آهن | فِرات |
| مس | کوپرات |
| قلع | استانات |
| نقره | آرجنتات |
| سرب | پلمبات |
در خصوص سایر فلزات، عبارت «-ات» را به انتهای نام آنها اضافه خواهیم کرد مانند کبالتات، نیکلات، پلاتینات و ... . در نهایت، زمانی که کمپلکس یونی، بار کلی داشته باشد، از عبارت یون استفاده میکنیم. در صورتیکه کمپلکس، خنثی یا بخشی از ترکیبات کوئوردیناسی باشد، نیازی به استفاده از این عبارت نیست.
مثال
کمپلکس را نامگذاری کنید:
با نگاه به فرمول این کمپلکس، به سرعت در مییابیم که یک کمپلکس آنیونی داریم. در این مثال، چهار لیگاند تکدندانه، یعنی هیدروکسید دیده میشود. بنابراین، از نام تتراهیدروکسو استفاده خواهیم کرد. فلزی که در این مثال داریم، کروم است و با توجه به آنیون بودن کمپلکس، از عبارت «-ات» در پایان نام آن بهره میگیریم. این فلز، عدد اکسایشی برابر با دارد. در نهایت، نام این کمپلکس به صورت زیر خواهد بود:
یون تترا هیدروکسوکرومات (III)

نکته مهم در نامگذاری ترکیبات کوئوردیناسی
به عنوان نکته آخر باید اشاره کنیم که به هنگام نامگذاری کمپلکسهای شیمیایی، در ابتدا نام کاتیون و پس از آن، آنیون ذکر شود. این مورد را میتوان با در نظر گرفتن NaCl بیان کرد. یون سدیم (کاتیون) را در ابتدا و سپس آنیون کلر را میآوریم.
مثال 1
کمپلکس زیر را نامگذاری کنید.
$$\left.left[\mathrm{Pt}\left(\mathrm{NH}_{3}\right)_{4}\right)\right]\left[\mathrm{Pt}(\mathrm{Cl})_{4}\right]$$
با توجه به اینکه خنثی است، کمپلکس اول، به طور کلی بار مثبت دارد. کلر، دارای بار است و به این ترتیب، کمپلکس دوم، آنیون خواهد بود. در نتیجه، کمپلکسی را در ابتدا مینویسیم که شامل باشد و در ادامه، کلر را ذکر میکنیم. در نهایت، نام این ترکیب پیچیده (کمپلکس) به صورت زیر نوشته خواهد شد:
تترا آمین پلاتین (II) تترا کلروپلاتینات (II)
مثال ۲
کمپلکس زیر را نامگذاری کنید:
این کمپلکس را با نام تترا آمین کلرو نیتریتو-ان-کبالت (III) میشناسند. حرف «ان» (N) که قبل از نیتریتو آمده، نمادی برای نشان دادن لیگاند نیتریت با نام نیتریتو-ان است. اگر ترکیب، به صورت بود، لیگاند را به صورت نیتریتو-او نامگذاری میکردیم. در حقیقت، نام ترکیب مورد نظر به اینصورت خواهد بود:
تترا آمین کلرونیتریتو-او-کبالت (III)
از عبارات نیترو (برای ) و نیتریتو (برای ) میتوان بمنظور توصیف لیگاند نیتریت، بهره برد. در اینصورت، نام دو ترکیب، به ترتیب به صورت زیر نوشته خواهد شد:
- تترا آمین کلرونیترو کبالت (III)
- تترا آمین کلرونیتریتو کبالت (III)
نوشتن فرمول ترکیبات کوئوردیناسی
نوشتن فرمول کمپلکس کوئوردیناسی با ترتیبی متفاوت از نام آن نوشته میشود. نماد شیمیایی فلز را در ابتدا مینویسیم. در ادامه، لیگاندها آورده میشوند.
در این خصوص باید توجه کنیم که لیگاندهای آنیونی، قبل از لیگاندهای خنثی قرار میگیرند. اگر بیش از یک آنیون یا لیگاند خنثی داشتیم، نوشتن آنها بر اساس الفبا صورت میگیرد.
در نامگذاری این ترکیبات کوئوردیناسی زمانی که یکی از یونها، تنها یک عنصر باشد، تعداد اتمها را با پیشوند نشان نمیدهیم؛ اما از آنجایی که باید نام آن در فرمول ذکر شود، از طریق موازنه بار کلی ترکیب، آنرا نشان میدهیم. به طور مثال، تترا فلوئورو کروم (VI) کلرید را به صورت نشان میدهیم.
مثال
فرمول ترکیبات زیر را به ترتیب بنویسید:
- آمین تترا آکوا کروم (II)
- آمین سولفاتو کروم (II)
- آمین تترا آکوا کرومیوم (II) سولفات
- پتاسیم هگزا سیانوفرات (III)
حل
- ترکیب اول: فرمول ترکیب اول به صورت زیر است:
هر دو لیگاند، خنثی هستند و بنابراین، با در نظر گرفتن ترتیب الفبایی، ابتدا و سپس آورده میشود. با دقت در نام ترکیب، در مییابیم که ترتیب نوشتار این ترکیب در فرمول، متفاوت از خود ترکیب است زیرا یکی از آنها بر اساس نماد شیمیایی و دیگری بر اساس نام لیگاند نوشته میشوند.
- ترکیب دوم: این ترکیب به صورت زیر نوشته خواهد شد. با توجه به اینکه یک آنیون است، قبل از آورده میشود:
- ترکیب سوم: فرمول ترکیب سوم به صورت زیر است:
- ترکیب چهارم: فرمول این ترکیب را به شکل زیر خواهیم نوشت. در این ترکیب به محل قرارگیری K توجه کنید:
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش نظریه اتمها در مولکولها با نرمافزار محاسباتی AIM2000
- اوربیتال مولکولی — به زبان ساده
- شیمی فضایی — به زبان ساده
^^













دانشجوی شیمی کاربردی علوم تحقیقاتم و متشکرم بابت اطلاعات مفید و عالییتون
روش فهمیدن تتراگونال و تریگونال؟
خیلی عالی و جامع بود.
ممنونم از جناب استاد سهیل بحر کاظمی
خیلی عالی بود.
با سلام؛
خوشحالیم که مطالعه مطلب برای شما مفید بوده است و از ارائه بازخورد شما نیز بسیار سپاسگزاریم.
با تشکر از همراهی شما با مجله فرادرس
عالی ممنونم
سلام وقت بخیر، خسته نباشید
چگونه میتوان تشخیص داد یک کمپلکس دیا مغناطیس یا پارا مغناطیس می باشد؟
خیلی ممنونم توضیحات عالی
سلام ممنون بابت توضیحات خوبتون?
یه سوال دارم بین کلرو و دی کربونیل کدوم مقدمه و چرا؟ ممنون میشم لطف کنید و جواب بدید?
با سلام؛
همانطور که در داخل متن ذکر شده است، برای نامگذاری ترکیبات کوئوردیناسی باید موارد زیر را در نظر داشته باشیم.
نامگذاری لیگاندها در ابتدا و به ترتیب الفبا
آوردن نام فلز در ادامه
ذکر عدد اکسایش فلز به همراه عدد رومی (داخل پرانتز)
با تشکر از همراهی شما با مجله فرادرس
با سلام خیلی عالی توضیح داده اید واقعا ممنونم از این همه لطف شما
از روی آرایش الکترونی اگر اخرین الکترون در اربیتال d جفت بودند میشه دیامغناطیس اگر تک بودند میشه پارامغناطیس