خارج قسمت واکنش – به زبان ساده
خارج قسمت واکنش (Q)، معیاری برای سنجش مقادیر نسبی فرآوردهها و واکنشدهندههای واکنش، در زمانی مشخص است. خارج قسمت واکنش به ما کمک میکند تا میزان پیشرفت یا جهت واکنش را به کمک دادههایی همچون فشار و غلظت واکنشدهندهها و فرآوردهها مشخص کنیم. به کمک مقایسه ثابت تعادل (K) و خارج قسمت واکنش، میتوان جهت واکنشِ در حال انجام را مشخص کرد.

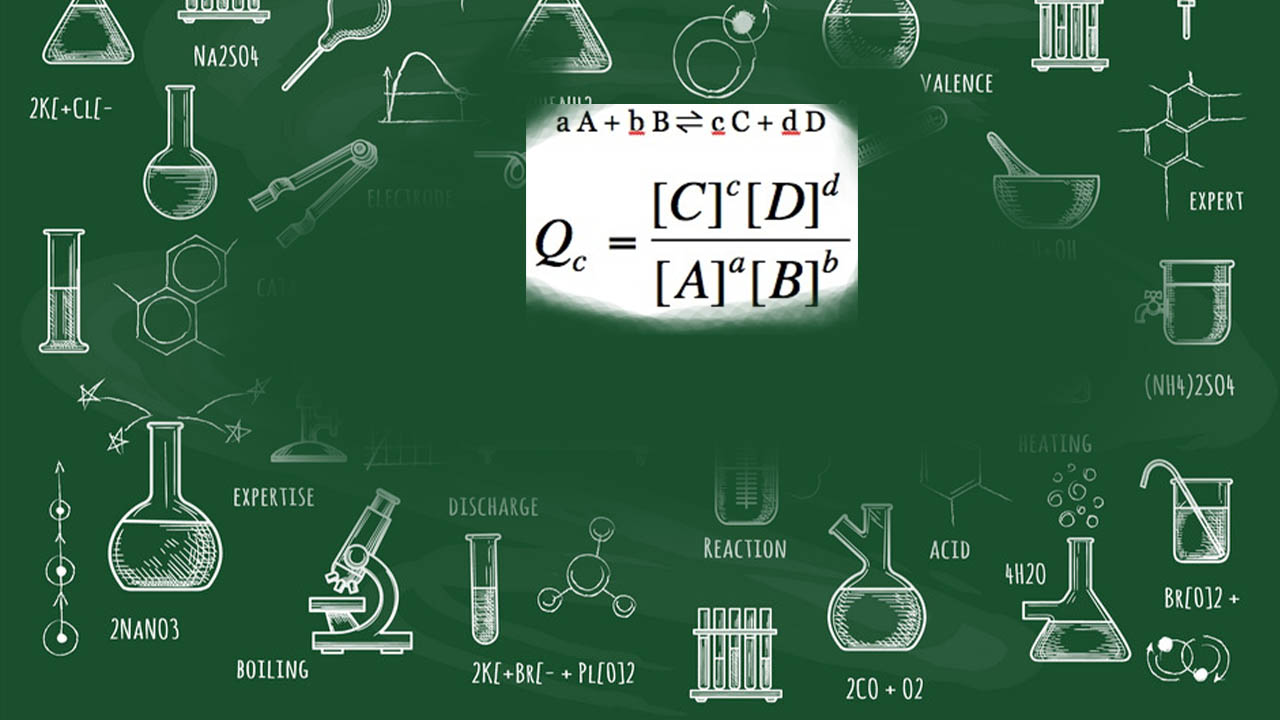
خارج قسمت واکنش و ثابت تعادل
تفاوت اصلی خارج قسمت واکنش و ثابت تعادل در این است که ثابت تعادل، یک واکنش را در حالت تعادل توصیف میکند اما خارج قسمت واکنش بمنظور توصیف واکنش در حالت غیر تعادلی بکار میرود.
برای تعیین خارج قسمت واکنش باید غلظتهای واکنشدهنده و فرآورده مشخص باشند. واکنش شیمیایی زیر را در نظر بگیرید:
به طور کلی، رابطه خارج قسمت واکنش از طریق حاصلضرب فعالیت (اکتیویته) اجزای فرآورده تقسیم بر حاصلضرب اکتیویته اجزای واکنشدهنده بیان میشود که اکتیویته در اینجا با مقادیر غلظت، برابری میکند. اگر در معادله موازنه شده، هرکدام از اجزای واکنش، دارای ضرایب استوکیومتری باشند، این ضرایب نیز در فرمول خارج قسمت واکنش لحاظ میشوند. در نهایت، رابطه خارج قسمت واکنش به صورت زیر خواهد بود:
توجه داشته باشید که رابطه بالا، اجزا را تنها در حالتهای گاز یا محلول در آب نشان میدهد. در حقیقت، هر مایع یا جامد خالص، اکتیویته برابر با ۱ دارد و در نتیجه، از رابطه بالا حذف میشود.
تعیین جهت پیشرفت واکنش
مقایسه بین خارج قسمت واکنش و ثابت تعادل، به ما در تعیین جهت پیشرفت واکنش به صورت زیر کمک میکند.
- اگر ، جهت پیشرفت واکنش به سمت واکنشدهندهها خواهد بود. در حقیقت، در رابطه Q، نسبت صورت کسر به مخرج کسر، بزرگتر از مقدار آن برای K است و نشان میدهد که در آن لحظه، نسبت به حالت تعادل، فرآورده بیشتری داریم. با توجه به اصل لوشاتلیه و از آنجایی که واکنش همواره به سمت تعادل پیش میرود، این واکنش، به کمک مقادیر اضافی فرآورده، به سمت تولید واکنشدهنده پیش خواهد رفت و در نتیجه، واکنش به سمت چپ پیشروی خواهد کرد. در نهایت، در اثر این فرآیندها، سیستم به تعادل میرسد.
- اگر ، جهت پیشرفت واکنش به سمت فرآوردهها خواهد بود. در این حالت، نسبت فرآورده به واکنشدهنده، کمتر از این نسبت برای یک سیستم در حال تعادل است. به عبارت دیگر، در چنین شرایطی، غلظت یا فشار واکنشدهندهها بیشتر از غلظت یا فشار فرآوردهها ذکر میشود. همانند قبل و با توجه به اینکه پیشرفت واکنش در جهت رسیدن به تعادل خواهد بود، پیشروی واکنش به طرف راست و تولید فرآورده بیشتر است.
- اگر ، سیستم در حال تعادل است و واکنش، هیچ تمایلی برای تولید واکنشدهنده یا فرآورده ندارد و جابجایی جهت پیشروی دیده نمیشود. البته همواره توجه داشته باشید زمانی که واکنش در حال تعادل باشد، به این معنی نیست که هیچ واکنشی صورت نمیگیرد، بلکه در این حالت، به طور مداوم واکنشهای رفت و برگشت در حال انجام هستند.
بحث در خصوص فعالیت (اکتیویته)
مفهوم با اهمیت دیگری که در محاسبات خارج قسمت واکنش مطرح میشود، «فعالیت» (Activity) است. به طور مثال، رابطه خارج قسمت واکنش را برای واکنش اسید باز زیر در نظر بگیرید:
همانطور که گفته شد، در مایعات و جامدات خالص، مقدار اکتیویته برابر با ۱ خواهد بود و در نتیجه، رابطه خارج قسمت واکنش با حذف آب، به صورت زیر نوشته خواهد شد:
مثال 1
با توجه به دادههای مساله، خارج قسمت واکنش و جهت پیشرفت آنرا تعیین کنید.
معادله واکنش:
برای حل این سوال، رابطه خارج قسمت را مینویسیم:
با جایگذاری مقادیر داده شده برای غلظت، خواهیم داشت:
با توجه به اینکه در سوال بالا، مقدار خارج قسمت واکنش بیش از ثابت تعادل است ، جهت پیشرفت واکنش به سمت واکنشدهندهها خواهد بود.

مثال ۲
خارج قسمت واکنش و جهت پیشرفت آن را با فرض محاسبه کنید:
برای نوشتن رابطه خارج قسمت باید توجه کنیم که میزان اکتیویته آب خالص برابر با ۱ است و در نتیجه، از رابطه حذف میشود:
با جایگذاری دادههای مساله در رابطه بالا خواهیم داشت:
با مقایسه مقادیر خارج قسمت واکنش و ثابت تعادل، در مییابیم که و در نتیجه، واکنش در حال تعادل نیست. به همین دلیل، برای رسیدن به تعادل دینامیک (پویا)، واکنش به سمت راست (تولید فرآورده) پیشروی میکند.
مثال ۳
برای واکنش زیر، خارج قسمت واکنش و جهت پیشرفت آنرا محاسبه کنید. مقدار ثابت تعادل برابر با ۴ است.
رابطه خارج قسمت واکنش به صورت زیر خواهد بود:
توجه داشته باشید که در صورت سوال، اطلاعاتی برای غلظت آمونیاک نداریم. به همین دلیل مقدار صفر را برای آن در نظر میگیریم (فرض میکنیم). بنابراین خواهیم داشت:
در این شرایط، مقدار ثابت تعادل بیشتر از خارج قسمت واکنش است. بنابراین، جهت پیشرفت واکنش به طرف راست خواهد بود.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:












