تیتراسیون برگشتی چیست؟ – از صفر تا صد
«تیتراسیون برگشتی» (Back Titration) یکی از روشهای تیتراسیون است. در این روش غلظت آنالیت به طور غیرمستقیم و در دو مرحله تعیین میشود. در مواردی که تیتراسیون مستقیم ممکن نیست و نقطه اکیوالان یا همارزی نامشخص است، تیتراسیون برگشتی بهکار میرود. با مطالعه این مطلب همراه با چند مثال، بیشتر با این روش آشنا خواهید شد.


تیتراسیون برگشتی چیست ؟
تیتراسیون برگشتی از تکنیکهای تحلیلی برای تعیین مقدار آنالیت است که در دو مرحله انجام میشود. در این روش برخلاف انواع تیتراسیون معمولی که در آن غلظت نامشخصِ آنالیت، مستقیم محاسبه میشود، مشخص کردن غلظت آنالیت به روش غیرمستقیم صورت میگیرد. این روش همچنین با نامهای «تیتراسیون غیرمستقیم» (Indirect Titration)، «تیتراسیون باقیمانده» (Residual Titration) یا «تیتراسیون وارونه» (Inverse Titration) نیز شناخته میشود.
تیتراسیونها به روشهای گوناگونی طبقهبندی میشوند که عبارتند از:
- بر اساس واکنش شیمیایی: مانند تیتراسیون اسید-باز یا تیتراسیون اکسایش و کاهش
- نحوه دریافت اطلاعات: مانند تیتراسیون پتانسیومتری یا تیتراسیون فتومتریک
- بر اساس روش انجام:تیتراسیون مستقیم یا تیتراسیون غیرمستقیم
کاربردهای تیتراسیون برگشتی
با توجه به استفاده محصولات ساخته شده از مواد شیمیاییِ محلول مانند انواع محصولات بهداشتی و شوینده، غلظتهای بالای این مواد میتواند برای پوست و سلامتی انسان مضر باشد. با استفاده از روشهای تجزیه حجمی غلظت مناسب این مواد شیمیایی کنترل و بررسی میشود. روشهای تیتراسیون برای بهدست آوردن اطلاعات کمی مانند غلظت محلول یا تعیین استوکیومتری واکنشهای شیمیایی کاربرد دارد.
تئوری تیتراسیون برگشتی
در تیتراسیون معکوس، حجم مشخصی از شناساگر B به آنالیت A افزوده میشود. مقداری از شناساگر B پس از واکنش با آنالیت A باقی میماند. مقدار باقیمانده با تیترانت T تیتر میشود. مقدار آنالیت A از تفاوت شناساگر B واکنش داده در مرحله اول و واکنش مقدار باقیمانده آن و نسبتهای استوکیومتری بهدست میآید.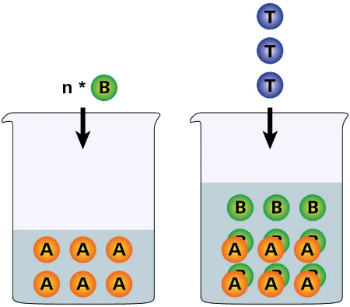
تیتراسیون برگشتی برای واکنشهایی با شرایط زیر استفاده میشود.
- جامدهای نامحلول، وقتی آنالیتها نمک نامحلولی مانند کلسیم کربنات هستند.
- هنگامی که تعیین نقطه پایانی تیتراسیون به روش مستقیم دشوار است، مثلا تیتراسیون اسید و باز ضعیف.
- وقتی واکنش بسیار کند پیش میرود.
- واکنش شامل ترکیباتی فرار مانند آمونیاک و ید باشد. در چنین شرایطی به دلیل از دست ماده، دقت لازم اعمال نمیشود.
مراحل انجام تیتراسیون غیرمستقیم
- شناساگر B بیش از اندازه به آنالیت A افزوده میشود.
- شناساگر زمانی مشخصی به واکنش بین شناساگر B و آنالیت A اختصاص داده میشود.
- مقدار باقیمانده معرف B با تیترانت T، تیتر میشود.
- حجم اضافه شده و مقدار مولی شناساگر B در مرحله اول باید مشخص شود.
محاسبات تیتراسیون برگشتی
محاسبات تیتراسیون برگشتی نیز مانند تیتراسیون مستقیم به غلظت و حجم گونههای درگیر و همچنین واکنشهای استوکیومتری بین آنها نیاز دارد.

مثال تیتراسیون برگشتی
در زیر برای آشنایی بیشتر دو مثال متفاوت برای تعیین غلظت ماده فرار و نمکهای محلول و محاسبات استوکیومتری در محلول آورده شده است.
تیتراسیون برگشتی برای تعیین غلظت ماده فرار
در آزمایشگاه شیمی از دانشآموزی خواسته شد تا غلظت آمونیاک که مادهای فرار است را در محلول سفیدهکننده بهدست آورد. او ۲۵٫۰۰ میلیلیتر از محلول سفید کننده را در ارلن ۲۵۰ میلیلیتری ریخت. سپس آن را با هیدروکلریک اسید با غلظت ۰٫۱۰۰ مولار تیتر کرد. پس از مصرف ۵۰٫۰۰ میلیلیتر اسید، واکنش کامل شد.
سپس اسید باقی مانده در بورت (مصرف نشده) با سدیم کربنات با غلظت ۰٫۰۵۰ مولار تیتر شد. پس از مصرف ۲۱٫۵۰ میلیلیتر سدیم کربنات، واکنش کامل شد. غلظت آمونیاک موجود در محلول سفیدکننده را محاسبه کنید.
پاسخ:
مرحله ۱: محاسبه مقدار HCl اضافی
- نوشتن معادله موازنه شده واکنش تیتراسیون
- بهدست آوردن مقدار مول (n) سدیم کربنات واکنش داده در تیتراسیون. باید به این نکته توجه داشته باشید که واحد حجم، لیتر و غلظت بر حسب مول بر لیتر است.
حجم (V) غلظت (c) مول (n)
- بهدست آوردن مقدار مول (n) هیدروکلریک اسید با استفاده از نسبت استوکیومتری واکنش شیمیایی موازنه شده؛ با توجه به معادله تعادلی واکنش ۱ مول با ۲ مول واکنش میدهد؛ بنابراین مول سدیم کربنات با مول هیدروکلریک اسید واکنش میدهد.
- مقدار HCl اضافی (مصرف نشده)
مرحله ۲: محاسبه مقدار آمونیاک موجود در سفیدکننده
- بهدست آوردن مقدار مول کل اضافه شده به محلول سفید کننده
- محاسبه مقدار مول واکنش داده شده با محلول سفید کننده
مول اضافی مول کل مول واکنش داده شده
- نوشتن معادله تعادلی بین آمونیاک در سفید کننده و هیدروکلریک اسید
- بهدست آوردن مقدار مول از نسبت استوکیومتری معادله. با توجه به معادله، ۱ مول با ۱ مول در سفیدکننده واکنش میدهد.
- محاسبه غلظت در محلول سفید کننده
غلظت آمونیاک موجود در محلول سفیدکننده برابر با ۰٫۱۱۴ مول بر لیتر است.
تیتراسیون برگشتی کلسیم کربنات
تیتراسیون برگشتی کلسیم کربنات مثالی از تعیین مقدار نمک نامحلول است. از یک دانشآموز خواسته شد تا جرم کلسیم کربنات موجود در یک نمونه ۰٫۱۲۵ گرمی گچ را تعیین کند. او گچ را در ارلن ۲۵۰ میلیلیتری حل کرد. سپس آن را با هیدروکلریک اسید با غلظت ۰٫۲۰۰ مولار تیتر کرد. پس از مصرف ۵۰٫۰۰ میلیلیتر اسید، واکنش کامل شد.
سپس اسید باقی مانده در بورت (مصرف نشده) با سدیم هیدروکسید با غلظت ۰٫۲۵۰ مولار تیتر شد. پس از مصرف ۳۲٫۱۲ میلیلیتر سدیم هیدروکسید، واکنش کامل شد. درصد کلسیم کربنات موجود در گچ را محاسبه کنید.
پاسخ:
مرحله ۱: محاسبه مقدار HCl اضافی
- نوشتن معادله موازنه شده واکنش تیتراسیون
- بهدست آوردن مقدار مول (n) سدیم هیدروکسید
- بهدست آوردن مقدار مول (n) هیدروکلریک اسید با استفاده از نسبت استوکیومتری واکنش شیمیایی موازنه شده؛ با توجه به معادله تعادلی واکنش ۱ مول با ۱ مول واکنش میدهد؛ بنابراین مول سدیم هیدروکسید با مول هیدروکلریک اسید واکنش میدهد.
- مقدار HCl اضافی (مصرف نشده)
مرحله ۲: محاسبه مقدار کلسیم کربنات موجود در گچ
- بهدست آوردن مقدار مول کل HCl اضافه شده به محلول گچ
- محاسبه مقدار مول HCl واکنش داده با محلول گچ
مول اضافی مول کل مول واکنش داده شده
- نوشتن معادله تعادلی بین کلسیم کربنات در گچ و هیدروکلریک اسید
- بهدست آوردن مقدار مول از نسبت استوکیومتری معادله؛ با توجه به معادله، ۲ مول با ۱ مول در محلول گچ واکنش میدهد. پس مول کلسیم کربنات نصف است.
- محاسبه جرم کلسیم کربنات موجود در گچ
جرم مولی مول = جرم
- محاسبه درصد کلسیم کربنات در ۰٫۱۲۵ گرم از نمونه گچ
جرم کلسیم کربنات موجود در گچ برابر با ۰٫۰۹۹ گرم است که ۷۹٫۲ درصد جرم گچ را شامل میشود.