بار قراردادی چیست؟ – به زبان ساده
در علم شیمی، بار قراردادی (FC) باری است که به یک اتم در یک مولکول اختصاص داده میشود با این فرض که الکترونها در تمام پیوندهای شیمیایی به طور مساوی بین اتمها، جدا از الکترونگاتیوی نسبی آنها به اشتراک گذاشته شدهاند. در زمان رسم ساختار لوویس یا رسم ساختار رزونانس برای مولکول، ساختار مورد نظر به گونهای انتخاب میشود که بار قراردادلی هر اتم به مقدار صفر نزدیک باشد.


فرمول بار قراردادی
بار قراردادی هر اتم در یک مولکول را میتوان از طریق رابطه زیر محاسبه کرد:
- : تعداد الکترون ظرفیت اتم منفرد خنثی
- : تعداد الکترونهای ناپیوندی
- : تعداد کل الکترونهای به اشتراک گذاشته شده در پیوند با سایر اتمها در مولکول (تعداد الکترونهای پیوندی)
برای توصیف بهتر این رابطه، بار قراردادی اتمها در آمونیاک را محاسبه میکنیم. ساختار لوویس آمونیاک به شکل زیر است:
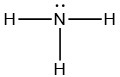
اتم نیتروژن خنثی در گروه 15 از جدول تناوبی، ۵ الکترون ظرفیت دارد. به کمک ساختار لوویس در مییابیم که اتم نیتروژن در آمونیاک، یک جفتالکترون ناپیوندی و سه پیوند با اتم هیدروژن دارد. با جایگذاری این اعداد در رابطه بالا خواهیم دید که بار قرارداری برای اتم نیتروژن صفر خواهد بود:
اتم هیدروژن خنثی نیز یک الکترون ظرفیت دارد. هر اتم هیدروژن در مولکول، هیچ الکترون ناپیوندی ندارد و تنها شامل یک پیوند است. با محاسبه بار قراردادی به کمک فرمول بالا، بار قراردادی برای این اتم در مولکول هیدروژن هم صفر خواهد بود:
توجه داشته باشید که مجموع بارهای قرادادی هر اتم باید با بار کلی مولکول یا یون، برابر باشد. در این مثال، نیتروژن و هر اتم هیدروژن، بار قراردادی برابر با صفر داشتند و در نتیجه، مجموع آنها نیز صفر خواهد بود که با بار خنثی مولکول آمونیاک، برابری میکند. به طور معمول، ساختار لوویسی که بار قرادادی اتمهای آن برابر با صفر باشند، پایداری بیشتری دارد. در صورتیکه بار قرادادی در اتمهای مختلف، مثبت یا منفی باشد، پایدارترین ساختار، در اتم الکترونگاتیوتر، بار قراردادی منفی و در اتم با الکترونگاتیوی کمتر، بار قراردادی مثبت خواهد داشت.
بار قراردادی یونهای چند اتمی
در مثال زیر، نحوه محاسبه بار قراردادی در یونهای چند اتمی را یاد میگیریم.
مثال محاسبه بار قراردادی یون آمونیم
بار قراردادی برای یون آمونیوم محاسبه کنید.
برای حل این سوال باید تعداد الکترونهای ظرفیت هر اتم را در یون آمونیوم مشخص کنیم. از ساختار لوویس برای تعیین تعداد الکترونهای پیوندی و ناپیوندی در هر اتم استفاده کنید. در نهایت، به کمک فرمول بالا، بار قراردادی محاسبه خواهد شد. ساختار لوویس برای آمونیوم به صورت زیر است:

اتم نیتروژن در آمونیوم، ۴ پیوند دارد و الکترون ناپیوندی در آن دیده نمیشود. با استفاده از فرمول بالا، بار قراردادی در اتم نیتروژن، برابر با خواهد بود:
هر اتم هیدروژن نیز یک پیوند با نیتروژن دارد و فاقد الکترون ناپیوندی است. در نتیجه، بار قراردادی در هر اتم هیدروژن برابر با صفر خواهد بود:
بنابراین، بار قراردادی هر اتم در یون آمونیوم به شکل است:

الگوهای پیوندی معمول در ساختارهای آلی
روشی که در بالا برای تعیین بار قراردادی مطرح شد، نقطه آغازی برای شیمی آلی است و در ساختارهای کوچک، به خوبی میتوان از آن بهره گرفت. اما چنین روشی در ساختارهای بزرگتر، سبب صرف زمان بسیار زیادی خواهد شد.
به طور مثال، در تعیین بار قراردادی هر اتم در مولکول 2-دئوکسی سیتیدین که از بخشهای تشکیلدهنده مولکول DNA محسوب میشود، فرآیندی بسیار زمانبر و کسلکننده را خواهیم داشت.

در هر صورت، شیمیدانها بویژه اشخاصی که با مولکولهای زیستی سروکار دارند، باید بتوانند ساختار این مولکولها را بر یک مبنای مشخص رسم کنند. به طور واضح این اشخاص باید توانایی خود را در رسم این ساختارها برای تعیین بار قراردادی تقویت کنند. این کار مستلزم تمرین و آشنایی با الگوهای پیوندی معمول است.
کربن
کربن، عنصر بسیار مهمی برای شیمیدانها به شمار میآید. در ساختارهای متان، اتانول، متانول، اتان، اتن و اتین، چهار پیوند را در اتم کربن مشاهده میکنیم. همچنین، هر اتم کربن، بار قراردادی صفر دارد. به عبارت دیگر، کربن، عنصری چهار ظرفیتی است یعنی به طور معمول، چهار پیوند تشکیل میدهد.
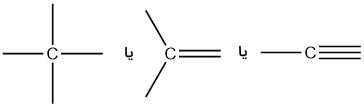
همانطور که گفته شد، کربن در بسیاری از مولکولها به صورت چهار ظرفیتی است اما موارد استثنا نیز وجود دارند. در کربوکاتیونها و کربانیونها، یک اتم کربن، به ترتیب بار قراردادی مثبت یا منفی دارد. با کربوکاتیونها زمانی مواجه میشویم که یک اتم کربن، سه پیوند بدون جفتالکترون ناپیوندی داشته باشد. کربوکاتیونها، 6 الکترون ظرفیت و بار قراردادی برابر با دارند. کربانیونها در مواقعی وجود دارند که اتم کربن، سه پیوند به همراه یک جفتالکترون ناپیوندی داشته باشد. کربانیونها ۸ الکترون ظرفیت و بار قراردادی دارند.
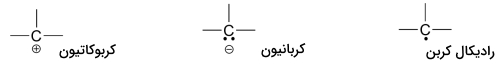
دو ساختار محتمل دیگر مربوط به رادیکال کربن و «کاربن» (Carbene) است که هر دو، بار قراردادی برابر با صفر دارند. رادیکال کربن، سه پیوند و یک الکترون جفتنشده (ناپیوندی) دارد. در رادیکالهای کربن، ۷ الکترون ظرفیت داریم و بار قراردادی، صفر است. کاربنها، ذرات بسیار فعالی هستند که در آنها اتم کربن دو پیوند و یک جفتالکترون ناپیوندی دارد که سبب بوجود آمدن بار قراردادی صفر میشود.
بهتر است که از روشهای آموزش داده شده، صحت بارهای قراردادی گفته شده را بررسی کنید. مهمتر اینکه قبل از پیشروی در علم شیمی آلی بهتر است با این ساختارها آشنا شوید تا بتوانید به راحتی آنها را تشخیص دهید. به این ترتیب، قادر خواهید بود تا با نگاهی کوتاه به اتمهای کربن، بار قراردادی مثبت و منفی بین آنها را تشخیص دهید.
هیدروژن
الگوی پیوند معمول در هیدروژن، بسیار ساده است. به طور معمول، اتمهای هیدروژن در مولکولهای آلی، تنها دارای یک پیوند هستند و هیچ الکترون جفتنشدهای ندارند. بنابراین، بار قراردادی اتم هیدروژن برابر صفر خواهد بود. البته پروتون ، یون هیدرید و رادیکال هیدروژن، از این قانون تبعیت نمیکنند. پروتون، هیدروژنی بدون پیوند و جفتالکترون ناپیوندی با بار قراردادی است. یون هیدرید را نیز به صورت اتم هیدروژن بدون پیوند و با یک جفتالکترون ناپیوندی ذکر میکنند که بار قراردادی برابر با دارد.
رادیکال هیدروژن، اتم هیدروژنی بدون پیوند و با یک الکترون جفت نشده با بار قراردادی صفر است. البته، رادیکال هیدروژن و یون هیدرید بسیار واکنشپذیر هستند و در طبیعت، به این شکل حضور ندارند. با این وجود، بحث در خصوص پروتونها در متون اسید و باز، اهمیت بسیاری دارد. همچنین، در واکنشهای اکسایش کاهش (ردوکس)، یون هیدرید به طور ویژه مورد بررسی قرار میگیرد. به عنوان یک قانون کلی، تمامی اتمهای هیدروژن در مولکولهای آلی، بدون پیوند و با بار قراردادی صفر هستند.
اکسیژن
آرایش معمول اتم اکسیژن با بار قراردادی صفر، زمانی است که ۲ پیوند و دو جفتالکترون ناپیوندی داشته باشد. آرایشهای دیگر به صورت ۱ پیوند و ۳ جفت الکترون با بار قراردادی و ۳ پیوند و یک جفتالکترون با بار قراردادی هستند. تمامی این الگوها در اکسیژن، از قاعده اکتت تبعیت میکنند. البته آرایشهای دیگری نیز در خصوص رادیکالهای اکسیژن مطرح میشوند اما در این آموزش، تمرکز ما بیشتر بر روی سه شکل اصلی غیر رادیکالی است.
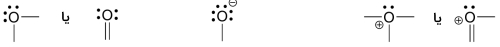
نیتروژن
نیتروژن دارای دو الگوی پیوندی اصلی است که هرکدام از قانون اکتت پیروی میکنند.
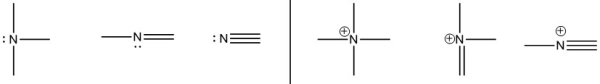
اگر یک اتم نیتروژن، سه پیوند و یک جفتالکترون ناپیوندی داشته باشد، بار قراردادی آن برابر با صفر خواهد بود. اگر با چهار پیوند و بدون جفتالکترون ناپیوندی وجود داشته باشد، بار قراردادی آن برابر با خواهد بود. در برخی موارد نادر، نیتروژن با بار ، دو پیوند و دو جفتالکترون ناپیوندی خواهد داشت.
فسفر و گوگرد
فسفر و گوگرد بیشتر در مولکولهای زیستی حضور دارند. با وجود اینکه این عناصر، الگوهای متفاتی در آزمایشگاه شیمی دارند اما در متون بیولوژی، گوگرد از الگوی پیوندی همانند اکسیژن پیروی میکند. فسفر نیز در بیشتر موارد به شکل یون فسفات ، با ۵ پیوند به اکسیژن و بدون الکترون ناپیوندی است. بار قراردادی فسفر در این شرایط، صفر خواهد بود.

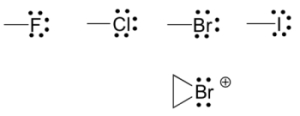
هالوژنها
هالوژنها اهمیت بسیاری در آزمایشگاه و علم پزشکی دارند اما در مولکولهای آلی کمتر دیده میشوند. هالوژنها در ترکیبات آلی، یک پیوند و سه جفتالکترون ناپیوندی با بار قراردادی صفر دارند. در برخی موارد، به خصوص در برم، هالوژنها را به صورت دو پیوند (به صورت یک حلقه سهعضوی) با دو جفت الکترون ناپیوندی و بار بررسی میکنیم.
اگر الگوهای مختلفی که گفته شد را به خوبی یاد بگیرید، ساختارهای آلی بزرگ را به راحتی رسم خواهید کرد.
استفاده از بار قراردادی در بین ساختارهای لوویس
برای اینکه به کمک بار قراردادی، ساختار لوویس پایدار را در مواد بررسی کنیم، خوب است مقایسهای بین دو ساختار مختلف مولکول داشته باشیم. برای دیاکسید کربن، دو ساختار وجود دارد که هردو از ساختارهای لوییس پیروی میکنند. برای رسم ساختار، موارد زیر را در نظر میگیریم:
- با مقایسه الکترونگاتیوی مشاهده میکنیم کربن، الکترونگاتیوی کمتری نسبت به اکسیژن دارد و در نتیجه، به عنوان اتم مرکزی در نظر گرفته میشود.
- اتمهای کربن و اکسیژن به ترتیب دارای 4 و ۶ الکترون ظرفیت هستند. مجموع الکترونهای ظرفیت، برابر با 16 خواهد بود.
- اگر اتم کربن را با پیوندهای یگانه، بین اتمهای اکسیژن به شکل قرار دهیم، 12 الکترون باقی خواهد ماند.
- تقسیم الکترونهای باقیمانده بین اتمهای اکسیژن، ساختار زیر را بدست میدهد. این ساختار، در اطراف هر اتم اکسیژن، قاعده اکتت را تکمیل میکند که در آن، سه جفتالکترون ناپیوندی داریم.
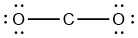
- هیچ الکترونی برای اتم مرکزی باقی نمیماند.
- برای اینکه قاعده اکتت در خصوص اتم کربن نیز رعایت شود، میتوانیم دو جفتالکترون ناپیوندی در اکسیژن را به جفتهای پیوندی تبدیل کنیم. برای اینکار، ۲ راه وجود دارد. میتوان یک جفت الکترون از هر اتم اکسیژن گرفت تا ساختاری متقارن ایجاد کرد یا اینکه هر دو جفتالکترون را از یک اتم اکسیژن گرفت و ساختاری نامتقارن بوجود آورد. این دو ساختار محتمل را در تصویر زیر، مشاهده میکنید.

- هر دو ساختار لوییس رسم شده، از قاعده اکتت پیروی میکنند. بارهای قراردادی در این دو ساختار، در تصویر زیر آورده شدهاند.
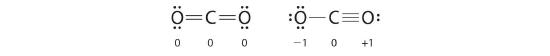
مشاهده میکنید که در هر دو ساختار، بار قراردادی خالص برای مولکول، برابر با صفر در نظر گرفته میشود اما ساختار سمت راست دارای بار روی اتم الکترونگاتیوتر اکسیژن است به همین دلیل، پیشبینی میشود که ساختار لوییس سمت راست، پایداری بیشتری داشته باشد. به یاد داشته باشید که بار قراردادی، بار حقیقی مولکولها یا یونها را نشان نمیدهد. از این روش برای نمایش ساختار پایدار لوییس بهره میگیرند اما برای مطالعه مباحث تکمیلی، میتوانید به مطالب رزونانس و رسم ساختار رزونانس رجوع کنید.
مثالی جهت نمایش ساختار لوویس پایدار
از یون تیوسیانات با فرمول در صنعت چاپ و همچنین مواد ضدخوردگی در برابر گازهای اسیدی استفاده میشود. این یون، حداقل دارای دو ساختار محتمل است. هر دو ساختار را رسم و بار قراردادی اتمهای آنها را مشخص کنید و بگویید کدامیک از ساختارها، پایداری بیشتری دارند.
برای حل این سوال، به روش زیر عمل میکنیم:
- گام به گام روشهای گفته شده را عمل کنید تا دو ساختار لوییس برای یون تیوسانات رسم شود.
- با استفاده از فرمولِ ابتدای آموزش، بار قراردادی روی هر اتم را محاسبه کنید.
- بر اساس بار قراردادی هر اتم، پیشبینی کنید که کدامیک از ساختارها، پایداری بیشتری دارند. در این خصوص، الکترونگاتیوی نسبی هر اتم نسبت به دیگری را نیز در نظر بگیرید.
در تصویر زیر، ساختارهای لوویس محتمل را برای یون تیوسیانات مشاهده میکنید.

برای تعیین ساختار لوویس مناسب، بار قراردادی روی هر اتم را باید محاسبه کنیم. اگر با کربن شروع کنیم، متوجه خواهیم شد که اتم کربن در هر کدام از این ساختارها، چهار پیوند را به اشتراک میگذارد. بنابراین، بار قراردادی روی اتم کربن، برابر با صفر است. در ادامه، با بررسی اتم گوگرد درمییابیم که در ساختار اول، اتم گوگرد، یک پیوند و سه جفتالکترون ناپیوندی دارد، بنابراین، با توجه به فرمول، بار قراردادی برابر با خواهد بود. در ساختار دوم، اتم گوگرد، بار قراردادی صفر دارد. در ساختار سوم، بار قراردادی اتم گوگرد، ذکر میشود.
با بررسی اتم نیتروژن، متوجه میشویم که در ساختار اول، اتم نیتروژن، ۳ پیوند (۳ جفتالکترون پیوندی) و همچنین یک جفتالکترون ناپیوندی دارد. به همین دلیل و با توجه به فرمول، بار قراردادی برای نیتروژن در ساختار اول با داشتن تعداد کل پنج الکترون ظرفیت، صفر ذکر میشود. در ساختار دوم، بار قراردادی اتم نیتروژن، برابر با است. در سومین ساختار، اتم نیتروژن، بار قراردادی برابر با خواهد داشت.
با انجام مراحل فوق، باید به این سوال پاسخ دهیم که کدامیک از ساختارهای فوق، پایداری بیشتری دارند. باید گفت ساختار دوم، ساختار محتملتری است زیرا بار منفی بر روی اتم الکترونگاتیوتر نیتروژن قرار دارد و بارهای قراردادی کمتری بر روی هر اتم در مقایسه با ساختار سوم دارد.
روش تصویری برای محاسبه بار قراردادی
از روش ساده زیر نیز میتوانیم برای محاسبه بار قراردادی استفاده کنیم. برای توصیف این روش نیز به طور مجدد از مولکول دیاکسید کربن کمک میگیریم.
همانند تصویر زیر، دایرهای در اطراف اتم مورد نظر رسم کنید.

تعداد الکترونهای داخل دایره را حساب کنید. از آنجایی که این دایره، نیمی از پیوند کووالانسی را قطع میکند، بنابراین، هر خط در پیوند را به عنوان یک الکترون در نظر میگیریم.
تعداد الکترونهای داخل دایره را از شماره (عدد رومی) گروه اتم در جدول تناوبی کم کنید تا بار قراردادی محاسبه شود.
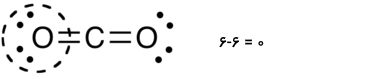
مقایسه بار قراردادی با عدد اکسایش
بار قراردادی ابزاری است که به کمک آن میتوان توریع بار الکتریکی در یک مولکول را تخمین زد. مفهوم عدد اکسایش نیز روشی برای بررسی توزیع الکترونها در یک مولکول است. اگر بارهای قراردادی و اعداد اکسایش اتمها در مولکول دیاکسید کربن را با یکدیگر مقایسه کنیم، به مقادیر زیر میرسیم:
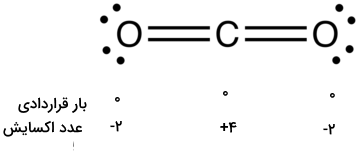
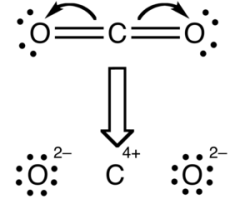
دلیل تفاوت بین مقادیر محاسبه شده، این است که بارهای قراردادی و اعداد اکسایش، روشهای مختلفی را برای بررسی توزیع الکترونها بین اتمها در مولکول در نظر میگیرند. از نگاه بار قراردادی، فرض میشود که الکترونها در هر پیوند کووالانسی دقیقا به طور مساوی بین دو اتم در یک پیوند تقسیم شدهاند. این دیدگاه به شکل تصویر در زیر آورده شده است:
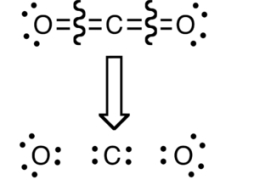
اینکه الکترونها به طور مساوی بین دو اتم توزیع شده باشند، فرض صحیحی نیست چراکه چگالی الکترونی، به دلیل الکترونگاتیوی بیشتر اتم اکسیژن نسبت به کربن، در اطراف اتم اکسیژن بیشتر است. این تاثیر را به خوبی میتوان در نقشههای پتانسیل الکترواستاتیک مشاهده کرد. از نگاه عدد اکسایش، الکترونهای یک پیوند، به اتمی اختصاص دارند که الکترونگاتیوی بیشتری داشته باشد. این دیدگاه نیز در تصویر زیر آورده شده است:
این دیدگاه نیز به طور کامل صحیح نیست چراکه تفاوت الکترونگاتیوی بین اتم کربن و اکسیژن به اندازهای نیست که پیوندها را به شکل پیوند یونی در نظر بگیریم. در واقعیت، توزیع الکترونها در مولکول، چیزی بین این دو دیدگاه است. دیدگاه ساختار لوویس سبب توسعه دقیقتر نظریه پیوندهای والانس شد که نتیجه آن، معرفی نظریه اوربیتال مولکولی بود.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی عمومی ۱ و ۲ (مرور و حل مساله)
- پیوند هیدروژنی — از صفر تا صد
- نیروهای بین مولکولی در شیمی — به زبان ساده
^^













سلام واقعا عالی بود
فقط یه سوال توی فرمول بار قراردادی چرا به جای Bتقسیم بر دو ، ۱٫۲ رو ضربدر یه عدده دیگه شده که نمیدونم این عدد چیه (شاید تعداد الکترون های ظرفیت باشه )
میشه قسمت آخر فرمول بار قراردادی رو توضیح بدید Bتقسیم بر دو رو
خیلی ممنون میشم 🙏
سلام و وقت شما بهخیر؛
B نشاندهنده تعداد الکترونهای موجود در ساختار است که درگیر پیوند باشند. توجه داشته باشید که در ریاضی، چه عددی ضرب در ۱٫۲ شود، چه تقسیم بر عدد ۲، نتیجه یکسان خواهد بود.
با تشکر از همراهی شما دوست عزیز با مجله فرادرس.
سلام چطور میشه همه حالات مختلف رسم لوویس یک ترکیب رو دونست؟
با سلام؛
پیشنهاد میکنیم مطلب «ساختار لوویس و نحوه رسم آن — به زبان ساده (+ دانلود فیلم آموزش گام به گام)» را برای این موضوع مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس