الکترون خواهی در شیمی | به زبان ساده
الکترون خواهی یک اتم یا مولکول، به مقدار انرژی آزاد شده در زمان اضافه شدن یک الکترون به اتم خنثی (یا مولکول) در فاز گازی و ایجاد یک یون منفی میگویند. به عبارت سادهتر، به تمایل یک اتم برای جذب یک الکترون، الکترون خواهی گفته میشود.

مقدمه
زمانی که یک اتم در اثر واکنشی شیمیایی، الکترون بگیرد یا از دست بدهد، میتوان به تعریف انرژی اتم پرداخت. واکنش شیمیایی که در آن، انرژی آزاد شود، واکنش گرماده و واکنشی که انرژی جذب کند، موسوم به واکنش گرماگیر است. انرژی یک واکنش گرماده، منفی و انرژی یک واکنش گرماگیر، مثبت خواهد بود. اگر بخواهیم در مثالی ساده این موضوع را بررسی کنیم، میتوان به افتادن یک کتاب از دست شخص اشاره کرد.
زمانی که شخص، کتاب را از روی زمین بر میدارد، به کتاب انرژی پتانسیل میدهد یا به عبارت دیگر، کتاب، انرژی پتانسیل خواهد داشت. با این وجود، زمانی که کتاب از دست شخص به زمین بیافتد، انرژی پتانسیل به انرژی جنبشی تبدیل میشود و به هنگام برخورد به زمین، صدایی میشنویم که نتیجه آزاد شدن انرژی است.
به طور مشابه، زمانی که الکترونی به یک اتم خنثی اضافه شود، انرژی آزاد میشود که به آن، الکترون خواهی اول میگوییم. در نتیجه، الکترون خواهی اول، منفی خواهد بود. با این وجود، انرژی بیشتری برای اضافه کردن یک الکترون دیگر به یون منفی نیاز داریم که موسوم به الکترون خواهی دوم است. این انرژی، بر انرژی آزاد شده به هنگام اضافه کردن الکترون غلبه میکند و به عبارت دیگر، انرژی مورد نیاز، بیش از انرژی دریافت شده است. بنابراین، الکترون خواهی دوم، مثبت خواهد بود.
الکترون خواهی اول: انرژی منفی
الکترون خواهی دوم: انرژی مثبت
الکترون خواهی اول
انرژیهای یونش، همواره پیرامون تشکیل یونهای مثبت مورد بحث قرار میگیرند اما الکترون خواهی را میتوان معادل آن و برای یونهای منفی در نظر گرفت. بهرهگیری از الکترون خواهی در بیشتر موارد،محدود به گروههای ۱۶ و ۱۷ جدول تناوبی است. به انرژی آزاد شدهای که در اثر آن، ۱ مول اتم گازی، هرکدام یک الکترون بگیرند و ۱ مول یون گازی با بار ایجاد کنند، الکترون خواهی اول گویند که مقداری منفی دارد. به طور مثال، الکترون خواهی اول اتم کلر برابر با است. به طور معمول، علامت منفی نشاندهنده آزاد شدن انرژی است.
زمانیکه نافلزات، الکترون جذب کنند، تغییرات انرژی آنها به طور معمول، منفی خواهد بود زیرا برای تشکیل یون، در فرآیندی گرماده، انرژی از دست میدهند. بنابراین، الکترون خواهی در آنها منفی خواهد بود. الکترون خواهی در نافلزات، بیشتر از فلزات است که دلیل آنرا باید در ساختار اتمی آنها جستجو کرد. ابتدا باید به این نکته اشاره کنیم که نافلزات، الکترون لایه ظرفیت بیشتری نسبت به فلزات دارند و در نتیجه، برای نافلزات، دریافت الکترون و رسیدن به آرایش پایدار، سادهتر خواهد بود.
نکته بعدی این است که در نافلزات، لایه ظرفیت به هسته نزدیکتر است و بنابراین، جدا کردن الکترون، سختتر و جذب آن از طریق عناصر دیگر، به خصوص فلزات، سادهتر خواهد بود. بنابراین، نافلزات، الکترون خواهی بیشتری نسبت به فلزات دارند. به عبارت دیگر، تمایل آنها برای دریافت الکترون از اتمهای دیگر، بیش تر است.
مثال برای الکترون خواهی گروه ۱۷
نافلزاتی همچون هالوژنها در گروه ۱۷ جدول تناوبی، الکترون خواهی بیشتری نسبت به فلزات دارند. این روند را در زیر مشاهده میکنید. به علامت منفی توجه کنید که بیانگر انرژی آزاد شده است.
- فلوئور:
- کلر:
- برم:
- ید:
همانطور که از نام آن پیداست، الکترون خواهی به توانایی یک اتم به دریافت یک الکترون میگویند. بر خلاف الکترونگاتیوی، الکترون خواهی معیاری کمی برای اندازهگیری تغییرات انرژی در زمان اضافه شدن یک الکترون به اتم گازی خنثی به شمار میرود. با مقایسه الکترونگاتیوی میفهمیم هرقدر میزان الکترون خواهی یک اتم، منفیتر باشد، تمایل اتم برای جذب الکترون، بیشتر خواهد بود.
بررسی الکترون خواهی فلزات در برابر نافلزات
در این بخش به صور خلاصه، تفاوتهای الکترون خواهی فلزات در برابر نافلزات را بررسی خواهیم کرد.
فلزات
فلزات تمایل دارند تا برای رسیدن به آرایش گاز نجیب و تشکیل کاتیون، الکترون از دست بدهند و برای از دست دادن الکترون، انرژی جذب کنند. الکترون خواهی فلزات، کمتر از نافلزات ذکر میشود. در واقع فلزات خصلت فلزی دارند و تمایل دارند الکترون از دست بدهند.
نافلزات
نافلزات تمایل به دریافت الکترون برای تشکیل آنیون و رسیدن به آرایش گاز نجیب دارند و برای دریافت الکترون، انرژی آزاد میکنند. بنابراین، الکترون خواهی در نافلزات، بیشتر از فلزات است. در تصویر زیر، تغییرات تناوبی الکترون خواهی با عدد اتمی برای ۶ ردیف جدول تناوبی ذکر شده است. توجه داشته باشید که الکترون خواهی میتواند مثبت یا منفی باشد. نافلزات خصلت نافلزی داشته و تمایل دارند الکترون دریافت کنند.
الگوهای مشخص در الکترون خواهی
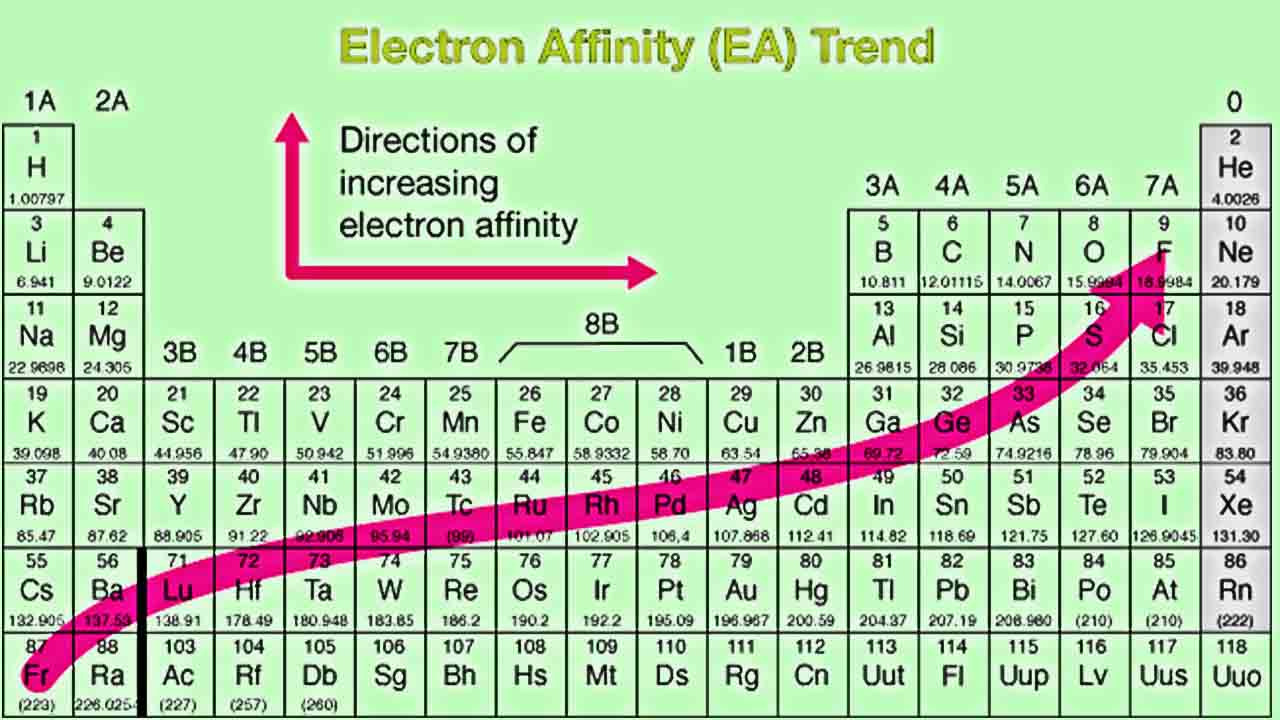
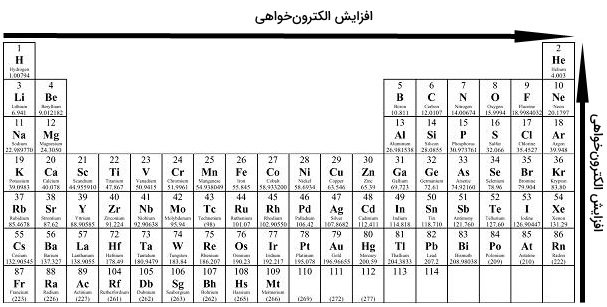
در بررسی روندهای تناوبی الکترونخواهی، در هر تناوب از چپ به راست، میزان الکترون خواهی افزایش و در هر گروه جدول تناوبی از بالا به پایین، الکترون خواهی کاهش پیدا میکند. افزایش الکترون خواهی در هر تناوب به این دلیل است که الکترونهای اضافه شده به سطوح انرژی (لایه ظرفیت)، رفته رفته به هسته نزدیکتر میشوند. بنابراین، جاذبه بیشتری بین هسته و الکترونها خواهیم داشت.
به یاد دارید که هرقدر فاصله بیشتر باشد، جاذبه کمتری داریم. بنابراین، زمانی که یک الکترون به اوربیتال خارجی اضافه شود، انرژی آزاد میشود. علاوه بر این، هرقدر تعداد الکترونهای لایه ظرفیت یک اتم بیشتر باشد، تمایل بیشتری برای جذب الکترون و تکمیل کردن آرایش گاز نجیب دارد. هر قدر تعداد الکترونهای لایه ظرفیت یک اتم، کمتر باشند، تمایل اتم برای از دست دادن آنها کمتر خواهد بود.
الکترون خواهی در هر گروه از بالا به پایین و در هر تناوب از راست به چپ کاهش پیدا میکند زیرا الکترونهای اضافه شده، در سطوح بالاتری از انرژی و دورتر از هسته قرار میگیرند و کشش هسته را به میزان کمتری احساس میکنند. با این وجود ممکن است این نگاه پیش بیاید که با توجه به افزایش تعداد الکترونهای لایه ظرفیت در هر گروه از بالا به پایین، اتم مورد نظر باید پایدارتر و الکترون خواهی بیشتری داشته باشد. اما باید «اثر پوششی الکترونها» (Shielding Effect) را نیز در نظر بگیریم.
با حرکت از بالا به پایین در یک گروه، اثر پوششی افزایش مییابد و دافعه بین الکترونها بیشتر میشود. به همین دلیل، جاذبه بین الکترونها و هسته در هر گروه از بالا به پایین کاهش مییابد.
با حرکت در هر گروه از بالا به پایین، الکترون خواهی اول کاهش پیدا میکند به این معنی که برای تشکیل یونهای منفی، انرژی کمتری دخیل میشود. اما اتم فلوئور از این الگو پیروی نمیکند و باید آنرا به طور جداگانهای در نظر گرفت. به عبارت دیگر، الکترون خواهی را میتوان معیاری برای سنجش جاذبه بین الکترونهای ورودی و هسته دانست. هر قدر این جاذبه بیشتر باشد، انرژی بیشتری آزاد میشود.
عوامل موثر بر الکترون خواهی به طور دقیق با عوامل موثر بر انرژی یونش منطبق هستند که شامل بار هسته، فاصله و اثر پوششی الکترونها بود. افزایش بار هسته در هر گروه از بالا به پایین با اثر پوششی الکترونها خنثی میشود. صرف نظر از نوع اتم مورد بحث، هر الکترون، کشش بار را از مرکز اتم احساس میکند.
بررسی الکترون خواهی فلوئور و کلر
آرایش الکترونی اتم فلوئور به صورت زیر است:
این اتم در هسته خود، ۹ پروتون دارد. الکترون ورودی، به سطح دوم انرژی وارد میشود و الکترونهای ، پوششی در مقابل هسته برای آن ایجاد میکنند. در نهایت، این الکترون، جاذبهای بار را از طرف هسته احساس میکند. در حقیقت، دو الکترون پوششی، جاذبه ۹ پروتون را کاهش دادهاند.
در مقابل، آرایش الکترونی اتم کلر به صورت زیر است:
این اتم در هسته خود ۱۷ پروتون دارد اما الکترون ورودی، جاذبه باری به صورت حس میکند چراکه الکترونهای لایه اول و دوم، جاذبه ۱۷ پروتون را کاهش دادهاند.
با بررسی موارد بالا در مییابیم که در هر گروه از بالا به پایین، هرقدر فاصله الکترون ورودی از هسته بیشتر باشد، جاذبه کمتر و به دنبال آن، انرژی آزاد شده کمتری (الکترون خواهی کمتر) خواهیم داشت.
مثال پیشبینی الکترونخواهی عناصر
بر اساس محل عناصر Sb، Se و Te، پیشبینی کنید که کدامیک از این عناصر، بیشترین مقدار منفی الکترونگاتیوی را دارند.
برای حل این سوال، به صورت زیر عمل کنید:
عناصر را در جدول تناوبی پیدا کنید. از روندهای الکترون خواهی در هر گروه و تناوب استفاده کنید تا روند کلی الکترون خواهی عناصر همگروه و عناصر مشترک در یک تناوب به راحتی مشخص شوند.
میدانیم که در هر گروه از بالا به پایین، مقدارِ منفی الکترون خواهی کاهش پیدا میکند. در نتیجه میتوان پیشبینی کرد که الکترونخواهی Se، منفیتر از Te خواهد بود. همچنین میدانیم که مقدار الکترونخواهی در هر تناوب از چپ به راست، منفیتر میشود و مقدار منفی در عناصر گروه ۱۵، کمتر از حالت مورد انتظار است. از آنجایی که Sb در سمت چپ Te و به گروه ۱۵ تعلق دارد، پیشبینی میکنیم که الکترونخواهی Te منفیتر از Sb باشد. در نتیجه، ترتیب الکترونخواهی عناصر به صورت زیر خواهد بود:
بنابراین، Se، منفیترین مقدار الکترونخواهی را در میان این ۳ عنصر دارد.
علت رفتار متفاوت فلوئور در روند الکترون خواهی
الکترون ورودی، نسبت به عناصر دیگر، به هسته نزدیکتر خواهد بود و انتظار الکترون خواهی بالایی داریم. با این وجود، از آنجایی که فلوئور، اتم کوچکی به شمار میآید، در حقیقت، الکترون ورودی، به منطقهای مملو از الکترون و به همراه دافعههای زیاد وارد میشود. چنین دافعههایی، جاذبه دریافتی توسط الکترون و همینطور میزان الکترون خواهی را کاهش میدهند. چنین روند معکوسی را بین اکسیژن و گوگرد در گروه 16 نیز میتوان مشاهده کرد. الکترون خواهی اول در اکسیژن برابر با و کمتر از الکترون خواهی گوگرد با مقدار است.
مقایسه مقادیر الکترون خواهی گروه ۱۶ و ۱۷ جدول تناوبی
همانطور که مشاهده کردید، الکترون خواهی اول در اکسیژن ()، کمتر از فلوئور () است. به طور مشابه نیز این مقدار برای گوگرد () کمتر از کلر () است. اما دلیل این امر چیست؟ این سوال، جواب سادهای دارد. در حقیقت، دلیل این اتفاق، وجود ۱ پروتون کمتر در گروه ۱۶ نسبت به هسته اتمهای گروه ۱۷ جدول تناوبی است. مقدار پوشش الکترونهای داخلی، به یک میزان و ثابت خواهد بود یعنی کشش خالص از طرف هسته در گروه ۱۶ کمتر از گروه ۱۷ است و بنابراین، الکترون خواهی کمتری داریم.
واکنشپذیری عناصر در گروه ۱۷ از بالا به پایین کاهش پیدا میکند و در نتیجه، فلوئور، بیشترین واکنشپذیری و ید، کمترین واکنشپذیری را خواهد داشت. در برخی موارد، به هنگام واکنش، این عناصر، یونهای منفی ایجاد میکنند. اولین تاثیر را اینگونه میتوان بیان کرد که کاهش واکنشپذیری از بالا به پایین به دلیل جاذبه کمتر الکترون ورودی توسط هسته، سبب میشود احتمال تشکیل یون منفی، کاهش پیدا کند. این توصیف، تا زمانی که اتم فلوئور را دخیل نکرده باشیم، منطقی به نظر میرسد.
یک واکنش کلی شامل مراحل مختلف به همراه تغییرات انرژی است و نمیتوان یک روند را تنها با توصیف یکی از مراحل توجیه کرد. فلوئور، عنصری بسیار واکنشپذیرتر از کلر به شمار میآید زیرا انرژی آزاد شده در سایر مراحل واکنشِ آن، بیشتر از انرزی الکترون خواهی در این اتم است.
الکترون خواهی دوم
الکترون خواهی دوم را تنها در گروه ۱۶ و اتمهای اکسیژن و گوگرد میتوان پیدا کرد که هر دو، یونهای با بار تشکیل میدهند. الکترونخواهی دوم، به انرژی مورد نیاز برای اضافه کردن یک الکترون به ۱ مول از یونهای گازی و تولید ۱ مول یون با بار گازی میگویند. البته برای تعریف سادهتر، بهتر است معادله شیمیایی زیر را در نظر بگیرید:
به عبارت دیگر، الکترونخواهی دوم به انرژی مورد نیاز برای اعمال تغییرات بالا در یک مول است. در حقیقت، با این کار، یک الکترون را به یونی منفی اضافه میکنیم و به همین دلیل، الکترون خواهی دوم مقداری مثبت خواهد داشت.
کاربردهای الکترون خواهی
از این خاصیت برای سنجش اتمها و مولکولها در فاز گاز بهره میگیرند چراکه در حالات جامد و مایع، سطوح انرژی این مواد، در تماس با سایر اتمها و مولکولها تغییر میکنند.
از مقادیر الکترونخواهی برای توسعه مقیاسی از الکترونگاتیوی برای اتمها و پتانسیل یونش استفاده شد. مفاهیم نظری دیگری که از الکترونخواهی استفاده میکنند شامل پتانسیل شیمیایی الکترونی و «سختی شیمیایی» (Chemical Hardness) است.
در مثالی دیگر، مولکول یا اتمی که مقدار مثبتتری از الکترونخواهی نسبت به دیگری داشته باشد موسوم به «الکترونگیرنده» (Electron Acceptor) و اگر این میزان، منفیتر باشد، اتم یا مولکول موسوم به «الکتروندهنده» (Electron Donor) است.

جمعبندی
الکترون خواهی یک اتم، به تغییرات انرژی به هنگام اضافه کردن یک الکترون به اتم گازی و تبدیل آن به یک آنیون میگویند. به طور کلی، عناصری که بیشترین مقدار منفی الکترون خواهی را دارند، اتمهایی با کوچکترین اندازه و بالاترین انرژی یونش هستند و در بخش بالا و راست جدول تناوبی قرار دارند.














سلام استاد خسته نباشید
چرا وقتی از کلر به برم میریم الکترون خواهی افزایش پیدا میکنه؟
با سلام
همانطور که در داخل متن ذکر شده است، از کلر به برم، الکترونخواهی کاهش پیدا میکند و افزایش پیدا نمیکند.
با تشکر از همراهی شما با مجله فرادرس
سلام ممنون بابت مطلب بسیار مفیدتون.
لطفا اگر میشه بیشتر توضیح بدیین که چرا الکترون خواهی رو فقط در فاز گاز استفاده می کنند؟
با سلام؛
همانطور که در داخل متن توضیح داده شده، از الکترونخواهی برای سنجش اتمها و مولکولها در فاز گاز بهره میگیرند زیرا در حالتهای جامد و مایع، سطوح انرژی این مواد، در تماس با سایر اتمها و مولکولها تغییر میکنند.
با تشکر از همراهی شما با مجله فرادرس
علت بیشتربودن الکترون خواهی کربن از نیتروژن چیست لطفا راهنماییم کنید
سلام
میشه این عناصر را بر اساس الکترون خواهی مرتب کنین؟ و توضیحش بدین؟
Na Al Si Mg
با سلام؛
از آنجایی که زیرلایه p در نیتروژن به صورت نیمهپر وجود دارد و پایدارتر است. از اینرو، الکترونخواهی بیشتری در کربن نسبت به نیتروژن دیده میشود.
با تشکر از همراهی شما با مجله فرادرس
ممنون خیلی کمک کرد
سلام استاد
چگونه میتوانم یک الکترون را به ۱۰ یا ۲۰ یا بی نهایت الکترون تبدیل کنم ؟ ممنون میشم راهنمایی کنید .
سلام
جواب این سوال چی میشه??
چرا بعضی از عناصر توانایی نقل و انتقال الکترون ندارند؟ و بعضی دیگر عناصر این توانایی را دارند؟
چه خاصیتی در این عناصر باعث این توانایی میشود؟؟
با سلام؛
پیشنهاد میکنیم برای آشنایی با الکترونهای آزاد و نحوه نقل و انتقال آنها مطلب «پیوند فلزی — به زبان ساده» را مطالعه کنید.
با تشکر از همراهی شما با مجله فرادرس
سلام ممنون ،چون کلر الکترون خواهی کمتری نسبت به فلئور داره باعث میشه تو دمای اتاق زودتر یونیده بشه؟ و اینکه اگه هیدروکلریک اسید به طور کامل یونیده میشه پس ثابت یونشش با هیدروبرمیک اسید و هیدرویدیک اسید باهمون غلظت باید برابر بشه درسته؟
با سلام؛
در رابطه با سوال اول باید گفت که تنها یک دلیل را نمیتوان برای یونش کلر ذکر کرد و در داخل متن نیز به آن پرداخته شده است اما برای مطالعه بیشتر نیز میتوانید مطلب «انرژی یونش — به زبان ساده» را مطالعه کنید. در رابطه یونش اسید نیز مطالعه مطالب زیر بویژه مطلب مربوط به «اکتیویته» پیشنهاد میشود تا با مفهوم غلظت موثر نیز آشنا شوید:
«قدرت اسید و ثابت تفکیک اسید — از صفر تا صد»
«اسید قوی چیست؟ — به زبان ساده»
«عوامل موثر بر قدرت اسید و باز — به زبان ساده»
«اکتیویته در شیمی — از صفر تا صد»
با تشکر از همراهی شما با مجله فرادرس