آرایش الکترونی فشرده – به زبان ساده + مثال
آرایش الکترونی اتمها چه به صورت خنثی یا و چه یونی به ما این امکان را میدهد که انرژی و توزیع الکترونها در اوربیتالها را دریابیم و بتوانیم درک بهتری از توانایی پیوند، مغناطیس و سایر خواص شیمیایی آن داشته باشیم. نوشتن آرایش الکترونی اتمها برای اتمهایی با عدد اتمی پایین کار سادهای است اما هر چه اتم بزرگتر میشود الکترونهای بیشتری خواهد داشت که اوربیتالهای بیشتری را پر میکنند. در نتیجه نوشتن آرایش الکترونی تمام این اوربیتالها زمانبر و مشکل خواهد بود. برای حل این مشکل از آرایش الکترونی فشرده استفاده میشود. در آرایش الکترونی فشرده با استفاده از نماد گاز نجیب از نوشتن بخشی از الکترونها فاکتور میگیریم و آرایش الکترونی کوتاهتری مینویسیم. در این مطلب نحوه نوشتن آرایش الکترونی فشرده توضیح داده شده است اما قبل از آن کمی در رابطه با اصول کلی نوشتن آرایش الکترونی صحبت میکنیم.
- میآموزید چگونه آرایش الکترونی فشرده عناصر را به روشی ساده بنویسید.
- یاد میگیرید نقش گاز نجیب را در کوتاهسازی آرایش الکترونی تشخیص دهید.
- نحوه استفاده از جدول تناوبی برای تعیین آرایش فشرده را یاد خواهید گرفت.
- استثناهای آرایش الکترونی و علتهای آن را خواهید شناخت.
- تغییر آرایش الکترونی اتمها هنگام تبدیل شدن به یون را میآموزید.

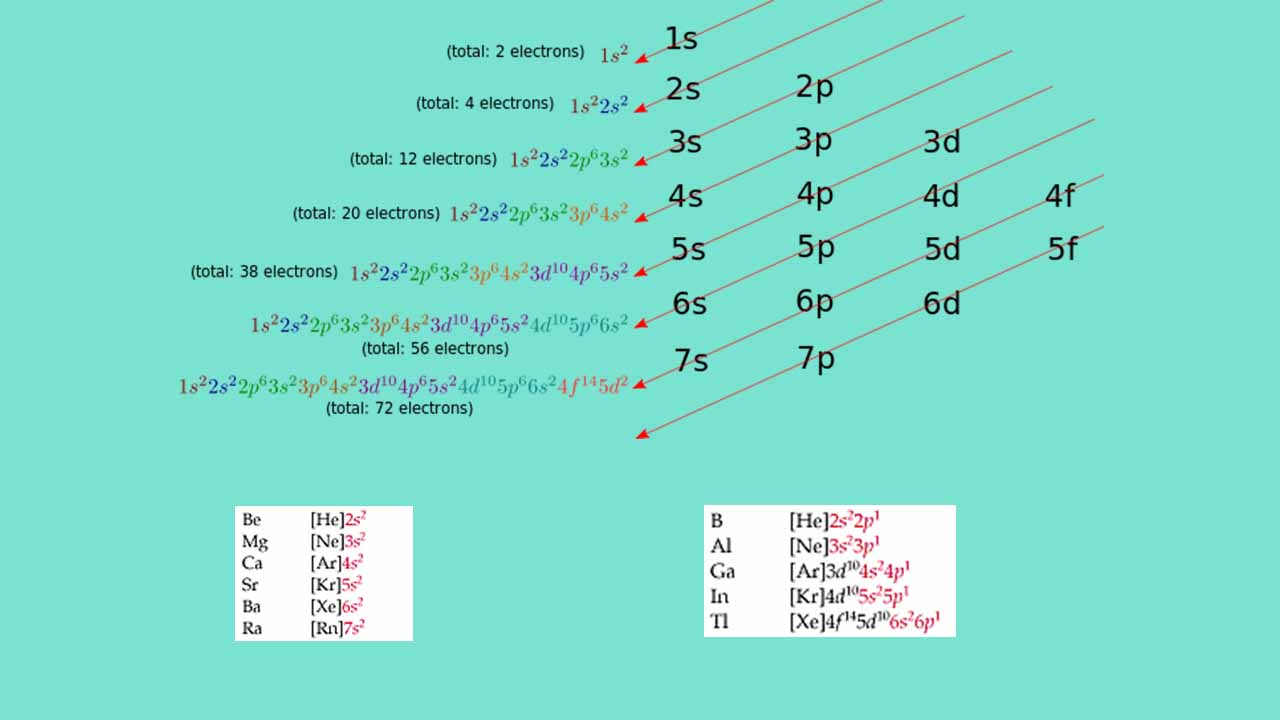
آرایش الکترونی فشرده چیست ؟
نوشتن آرایش الکترونی اتمها زمان لازم برای نوشتن آرایش الکترونی را کاهش میدهد و کار محققان را برای نوشتن آرایش الکترونی اتمهای سنگین راحت میکند. در واقع برای نوشتن این مدل آرایش الکترونی از گاز نجیب ماقبل اتم استفاده میشود. میدانیم که اوربیتال لایه ظرفیت (اوربیتال لایه آخر) گازهای نجیب کاملا پر از الکترون است و جایی برای اضافه کردن الکترون ندارد. به همین خاطر از نماد این گاز نجیب به جای نوشتن بخشی از آرایش الکترونی عنصر مورد نظر استفاده میکنیم و مابقی آرایش الکترونی عنصر را در جلوی نماد گاز نجیب مینویسیم.

به عنوان مثال اگر بخواهیم آرایش الکترونی آلومینیم با عدد اتمی 13 را به طور کامل بنویسیم باید به شیوه زیر عمل کنیم.
نوشتن این آرایش الکترونی برای 13 الکترون شاید کار راحتی باشد ولی برای عناصر سنگین با عدد اتمی بالا دشوار است. برای مثال اگر بخواهیم آرایش الکترونی کامل اتم ایتریوم با عدد اتمی 39 را بنویسیم باید 39 الکترون را به صورت زیر در اوربیتالها قرار دهیم که کار مشکلی است.
برای حل این مشکل میتوانیم از بخشی از این اوربیتالها فاکتور بگیریم. حفظ کردن آرایش الکترونی تمامی عنصرهای جدول تناوبی کار دشواری است اما میتوان نحوه آرایش اوربیتالهای گازهای نجیب را حفظ کرد و از نماد آن به جای نوشتن کامل آرایش الکترونی استفاده کرد. برای مثال در خصوص عنصر ایتریوم، گاز نجیبی که میتواند بخشی از آرایش الکترونی آن را در بر بگیرد، گاز نجیب ماقبل آن یعنی کریپتون با عدد اتمی 36 است. آرایش الکترونی این گاز نجیب به صورت زیر نوشته میشود.
این آرایش الکترونی کریپتون در آرایش الکترونی ایتریوم نیز وجود دارد. میتوان به جای آن نماد کریپتون یعنی [Kr] را استفاده کرد و سایر اوربیتالها را در جلوی آن نوشت که نتیجه آن به صورت میشود. به این نوع نوشتن آرایش الکترونی، آرایش الکترونی فشرده گفته میشود که برای عناصر سنگین بسیار کارامد است.
چگونه آرایش الکترونی فشرده را بنویسیم ؟
برای نوشتن آرایش الکترونی فشرده مراحل زیر را انجام دهید.
- از روی جدول تناوبی عنصرها نماد شیمیایی عنصر مورد نظر را پیدا کنید. مثلا برای نوشتن آرایش الکترونی فشرده عنصر روی، Zn در جدول تناوبی پیدا میکنیم که عدد اتمی آن 30 است.
- گاز نجیب ماقبل عنصر مورد نظر را پیدا کنید و نماد آن را در کروشه بنویسید. برای اتم روی، نزدیکترین گاز نجیب کوچک به آن آرگون است که آن را به صورت [Ar] مینویسیم.
- آرایش الکترونی گاز نجیب ماقبل به عنصر مورد نظر را پیدا کنید و روی کاغذ بنویسید. در مثال ما آرایش الکترونی آرگون را به صورت 4s 3d 4p نوشته میشود.
- عدد اتمی عنصر مورد نظر را از عدد اتمی گاز نجیب کم کنید. عدد اتمی عنصر روی 30 است و عدد اتمی آرگون 18 است که تفریق آنها از یکدیگر عدد 12 میشود.
- زیرلایههای باقیمانده را طبق عدد بدست آمده پر کنید. برای اتم روی الکترونهای 19 و 20 زیرلایه اوربیتال چهارم s را پر میکند که آن را به صورت جلوی کروشه مینویسیم. الکترونهای 21 تا 30 نیز زیرلایه d سوم را پر میکند که آن را به صورت مینویسیم. هر 12 الکترون باقیمانده در اوربیتالها قرار داده شد و آرایش الکترونی فشرده برای اتم روی به صورت نوشته میشود.
برای راحتتر نوشتن آرایش الکترونی فشرده لازم است که آرایش الکترونی گاز نجیب قبل از آن عنصر را بدانیم به همین جهت آرایش الکترونی گازهای نجیب در جدول زیر نوشته شدهاند.
| عنصر | نماد | عدد اتمی | آرایش الکترونی |
| هلیوم | He | 2 | |
| نئون | Ne | 10 | |
| آرگون | Ar | 18 | |
| کریپتون | Kr | 36 | |
| زنون | Xe | 54 | |
| رادون | Rn | 86 |
آرایش الکترونی اتم چیست ؟
آرایش الکترونی اتم به ما کمک میکند نحوه قرار گرفتن الکترونها در اوربیتالها را متوجه شویم و میزان انرژی نسبی آنها را دریابیم. برای درک بهتر اهمیت آرایش الکترونی به چند مثال بعد توجه کنید. آرایش الکترونی اتم هلیوم با عدد اتمی 2، به صورت زیر نوشته میشود.
عدد 1 میزان تراز انرژی اصلی، s زیرلایه اوربیتال و توان 2 تعداد الکترونهای موجود در اوربیتال را نشان میدهد. بر اساس آرایش الکترونی اتم هلیوم متوجه میشویم که الکترونهای آن در پایینترین سطح انرژی قرار گرفتهاند. همچنین زیرلایه اوربیتالی s کاملا از الکترون پر شده و دیگر جایی برای افزودن الکترون ندارد. اگر الکترونی به آن اضافه شود باید آن را در اوربیتال بعدی جای دهد. برای مثال آرایش الکترونی اتم لیتیوم با 3 الکترون به صورت زیر است.
دو الکترون اتم لیتیوم اوربیتال اول s را پر میکنند و 1 الکترون باقیمانده زیرلایه s اوربیتال بعدی یعنی شماره 2 را پر میکند. اعداد کوانتومی که در نوشتن آرایش الکترونی اتمها استفاده میشود و نحوه نوشتن آن در ادامه توضیح داده میشود.
عدد کوانتومی
مدل اتمی بور که قبلا در مجله فرادرس توضیح داده شده مدلی یکبعدی است که فقط یک عدد کوانتومی به نام n برای توصیف اندازه مدار الکترون میدهد. بعد از مدتی شرودینگر با ارائه مدلی سهبعدی مدل بور را کامل کرد. مدل شرودینگر سه عدد کوانتومی برای توصیف فضای سهبعدی که الکترون اشغال کرده به ما میدهد.
این اعداد از معادله موجی شرودینگر بدست آمده است که شامل:
- عدد کوانتومی اصلی (n): عدد کوانتومی اصلی اندازه اوربیتال را نشان میدهد. اوربیتالی که n آن برابر با 2 است از اوربیتال با n برابر با یک بزرگتر است. الکترونها به دلیل بار مخالفی که با هسته اتم دارند در نزدیک آن قرار می گیرند. برای اینکه الکترون بتواند در لایههای اوربیتالی بالاتر قرار بگیرد باید انرژی بیشتری داشته باشد تا از هسته اتم فاصله بگیرد. بنابراین با افزایش n میزان انرژی اوربیتال نیز افزایش مییابد. الکترونهایی که n یکسانی دارند همگی در یک اوربیتال قرار گرفتهاند.
- عدد کوانتومی فرعی (l): شکل اوربیتال را نشان میدهد. اوربیتالها شکلهای متنوعی دارند. برای مثال اوربیتال با l برابر با 0 به صورت کروی و اوربیتال با l برابر با 1 به شکل دمبل است. شکل اوربیتالها را با نمادهای d ،p ،s و ... نشان میدهند.
در چهار نماد اول (d ،p ،s و f) الگویی وجود ندارد اما نمادهای بعد از g به ترتیب حروف الفبای انگلیسی هستند.
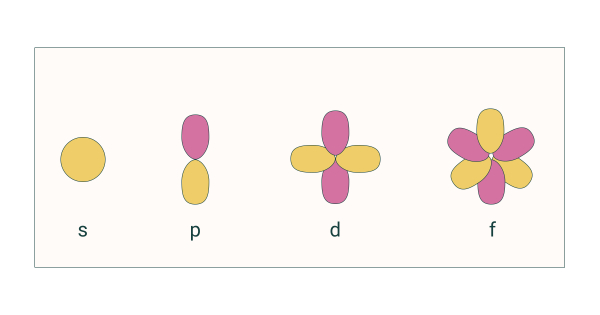
- عدد کوانتومی مغناطیسی (m): جهتگیری اوربیتال در فضای سهبعدی را نشان میدهد. اگر به شکل اوربیتالها در تصویر بالا دقت کنید اوربیتال s کروی است و تنها به یک شکل در فضای سهبعدی قرار میگیرد. اما اوربیتالهای بعدی جهتگیری متفاوتی در فضا دارند. عدد کوانتومی مغناطیسی این جهتگیری را مشخص میکنند. این عدد بین l+ و l- است. یعنی اوربیتال s که l آن برابر با صفر است، m برابر با صفر دارد اما اوربیتال p با l برابر با 1 دارای اعداد کوانتومی مغناطیسی 1+، 0, 1- است.
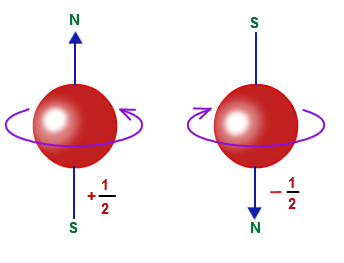
علاوه بر این سه عدد الکترون هم به صورت ساعتگرد (s=-1/2) و پادساعتگرد (s=+1/2) به دور خود میچرخد که آن را با عدد کوانتومی اسپینی یا مشخص میکنند.
انرژی اوربیتالها
هر اوربیتال انرژی مخصوص به خود را دارد و با افزایش عدد کوانتومی (n) انرژی آن نیز افزایش مییابد. تصویر زیر سطوح مختلف انرژی اوربیتالهای مختلف را با یکدیگر مقایسه میکند. همانطور که مشاهده میکنید اوربیتال 1s الکترونهای دارای کمترین انرژی را در بر میگیرد و همانطور که به سمت اوربیتالهای 2p، 2s و 3s پیش میرویم انرژی الکترونهای موجود در آن بالاتر میرود.
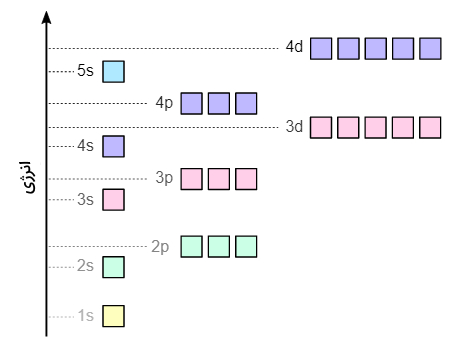
با این حال این الگو در تمامی اوربیتالها صدق نمیکند و استثناهایی نیز وجود دارد. برای مثال اوربیتال 3d دیرتر از اوربیتال 4s از الکترون پر میشود و انرژی بیشتری دارد. این موارد استثنا در سایر نقاط نیز وجود دارد که در ادامه توضیح داده میشوند.
آرایش الکترونی اتمها چگونه نوشته میشود ؟
آرایش الکترونی اتمها روشی استاندارد برای نشان دادن میزان انرژی لایه و زیرلایه اشغال شده توسط الکترون است. قبل از اینکه نحوه نوشتن آرایش الکترونی اتمها را توضیح دهیم باید بدانیم که اوربیتالهایی که عدد کوانتومی اصلی یکسانی دارند یک لایه را تشکیل میدهند که آن را با عدد کوانتومی اصلی نشان میدهیم. زیرلایههای موجود در این اوربیتال نیز ممکن است اشکال مختلفی داشته باشند که آن را با عدد کوانتومی فرعی نشان میدهیم.
برای مثال 2p زیر لایه دمبلی لایه اصلی دوم را نشان میدهد. تعداد زیرلایههای موجود در یک لایه با عدد کوانتومی اصلی مرتبط است یعنی لایه n برابر با 1 تنها یک زیرلایه دارد که شامل s میشود ولی لایه n برابر با 4، چهار زیرلایه d ،p ،s و f را میتواند داشته باشد. با دانستن این موضوع میتوانیم آرایش الکترونی اتمها را رسم کنیم.
برای نوشتن آرایش الکترونی به صورت زیر عمل میکنیم.
- ابتدا باید تعداد الکترونهای موجود در اتم را بدست آوریم. اگر اتم ما بار نداشته باشد تعداد الکترونهای آن برابر با تعداد پروتون یا همان عدداتمی است.
- سپس طبق اصل آفبا الکترونها را به ترتیب در زیرلایههایی با کمترین انرژی قرار میدهیم. برای مثال اتم هیدروژن عدداتمی برابر با 1 دارد که تعداد پروتونهای آن را نشان میدهد. چون اتم هیدروژن خنثی است و باری ندارد، تعداد الکترون برابر با پروتون است یعنی یک الکترون داریم. این الکترون در زیرلایهای با کمترین انرژی یعنی زیرلایه s لایه اول قرار میگیرد و آرایش الکترونی آن به صورت زیر نوشته میشود.
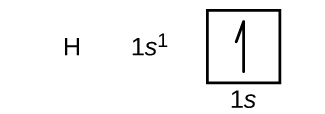
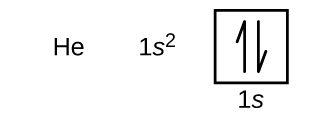
بعد از اتم هیدروژن، اتم هلیوم با عدد اتمی 2 را در جدول تناوبی داریم. این اتم 2 الکترون دارد. طبق اصل طرد پائولی هیچ دو الکترونی نمیتوانند اعداد کوانتومی یکسانی داشته باشند. به همین جهت این دو الکترون در زیرلایه اول (s) در لایه اول (n=1) قرار میگیرند اما اسپین متفاوتی خواهند داشت.
بعد از اتم هلیوم به اتم لیتیوم در جدول تناوبی میرسیم که عدد اتمی 3 دارد. دو الکترون از اتم هلیوم مشابه اتم هلیوم در زیرلایه اول لایه اول قرار میگیرند. اما n=1 تنها یک زیرلایه (s) دارد که توسط دو الکترون با اسپین مخالف پر شده است. زیرلایه s عدد کوانتومی مغناطیسی 0 تنها برای دو الکترون جای دارد. به همین جهت یک الکترون باقیمانده، زیرلایه اول (s) لایه دوم (n=2) را پر خواهد کرد که آرایش الکترونی آن به صورت زیر خواهد بود.
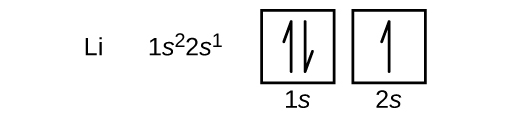
بعد از اتم لیتیوم به برلیم با عدد اتمی 4 میرسیم. 2 الکترون اول آن زیرلایه اول لایه اول را پر میکنند و دو الکترون دوم آن زیرلایه اول (s) لایه دوم (n=2) را پر خواهند کرد که آرایش آن به صورت زیر است. در این حالت نیز اصل طرد پائولی رعایت شده است و اعداد کوانتومی آنها حداقل در یک عدد تفاوت دارند.
- اعداد کوانتومی الکترون اول: عدد کوانتومی اصلی برابر با 1 (n=1)، عدد کوانتومی فرعی برابر با 0 که یعنی اوربیتال s، عدد کوانتومی مغناطیسی 0 با اسپین 1/2+.
- اعداد کوانتومی الکترون دوم: عدد کوانتومی اصلی برابر با 1 (n=1)، عدد کوانتومی فرعی برابر با 0 که یعنی اوربیتال s، عدد کوانتومی مغناطیسی 0 با اسپین 1/2-.
- اعداد کوانتومی الکترون سوم: عدد کوانتومی اصلی برابر با 2 (n=2)، عدد کوانتومی فرعی برابر با 0 که یعنی اوربیتال s، عدد کوانتومی مغناطیسی 0 با اسپین 1/2+.
- اعداد کوانتومی الکترون سوم: عدد کوانتومی اصلی برابر با 2 (n=2)، عدد کوانتومی فرعی برابر با 0 که یعنی اوربیتال s، عدد کوانتومی مغناطیسی 0 با اسپین 1/2-.
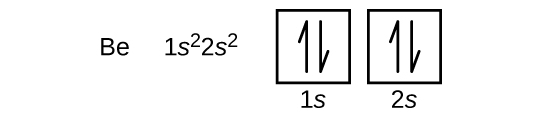
اتم بعدی بور است که عدد اتمی 5 دارد. آرایش الکترونی 4 الکترون آن مانند برلیم است اما برای الکترون پنجم جایی در اوربیتال s وجود ندارد. این بار چون در لایه دوم هستیم میتوانیم 2 زیرلایه داشته باشیم. زیرلایه دوم در لایه دوم اوربیتال p است و الکترون با اسپین مثبت در آن قرار میگیرد. عدد کوانتومی مغناطیسی در اوربیتال p برابر با 1+، 0 و 1- است که الکترون میتواند در یکی از آنها قرار بگیرد. آرایش الکترونی اتم بور به صورت زیر نوشته میشود.
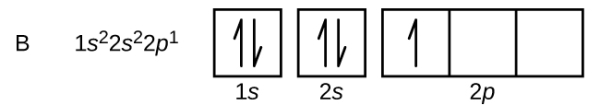
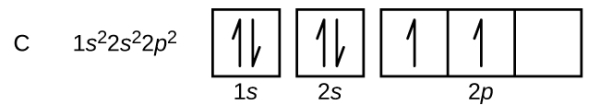
عنصر بعدی کربن با عدداتمی ۶ است که 6 الکترون دارد. 4 الکترون آن اوربیتالهای 1s و 2s را پر میکند ولی برای جای دادن دو الکترون بعدی در اوربیتال 2p باید از قانون هاند استفاده کنیم. طبق این قانون برای اینکه اتم در پایدارترین حالت خود باشد، الکترونها ابتدا به صورت جفت نشده در اوربیتال قرار میگیرند بعد یکی یکی جفت میشوند. همچنین این الکترونهای جفت نشده باید اسپین یکسان داشته باشند.
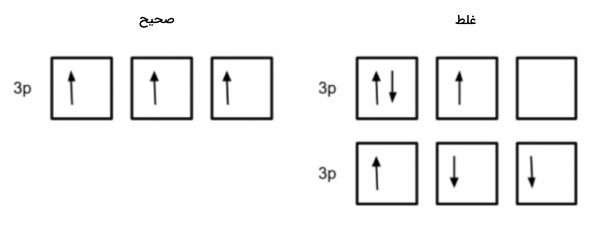
به همین جهت آرایش الکترونی اتم کربن به صورت زیر نوشته می شود.
استفاده از جدول تناوبی عناصر برای نوشتن آرایش الکترونی اتم ها
همانطور که در مطالب قبلی مجله فرادرس توضیح داده شد، جدول تناوبی، اتمها را بر اساس افزایش عدد اتمی مرتب میکند تا عناصر با خواص شیمیایی یکسان به صورت دورهای تکرار شوند. هنگامی که آرایش الکترونی فشرده اتمها به جدول اضافه شود، آرایش اتمی مشابهی در لایه خارجی اتمهای موجود در یک گروه یا ستون خواهیم دید. از آنجایی که الکترونهای لایه ظرفیت در لایه بیرونی اتم قرار گرفتهاند، نقش مهمی در واکنشهای شیمیایی ایفا میکنند. الکترونهای لایه ظرفیت بیشترین انرژی را در میان الکترونهای اتم دارند و راحتتر از الکترونهای دیگر به اشتراک گذاشته میشوند. این الکترونها همچنین عامل تعیین کننده در برخی از ویژگیهای فیزیکی عناصر هستند.
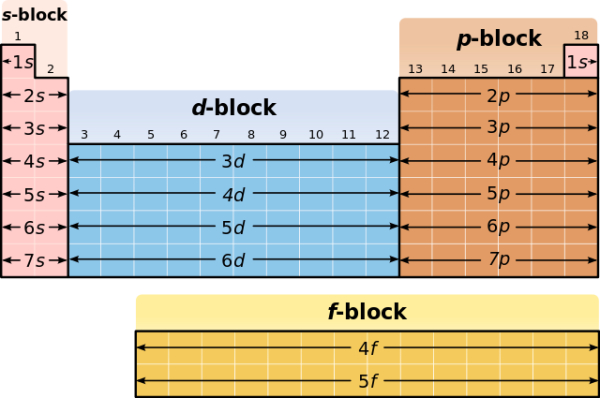
از این ویژگی جدول تناوبی عناطر میتوان استفاده کرد و آرایش الکترونی اتمها را بر اساس نوشت. جدول تناوبی را از نظر آرایش اتمها میتوان به سه گروه زیر طبقهبندی کرد.
- عناصر گروه اصلی (بلوک s و p): عناصری هستند که آخرین الکترون آنها به اوربیتال s یا p وارد میشود. این اتمها شامل تمام عناصر غیرفلزی و همچنین بسیاری از فلزات و شبهفلزات میشود. الکترونهای ظرفیت برای عناصر گروه اصلی آنهایی هستند که بالاترین سطح n را دارند. به عنوان مثال، «عنصر گالیم» (Ga) با عدد اتمی 31، دارای آرایش الکترونی زیر است.
این عنصر سه الکترون در لایه ظرفیت خود دارد که شامل الکترونهای موجود در اوربیتال 4s و 4p است. - فلزات واسطه (بلوک d): عناصر فلزی هستند که آخرین الکترون اضافه شده در آنها وارد اوربیتال d میشود. الکترونهای ظرفیت (آنهایی که پس از آخرین پیکربندی گاز نجیب اضافه شدهاند) در این عناصر شامل الکترونهای ns و (n-1) d هستند. البته استثناهایی در این گروه برای رسم آرایش الکترونی فشرده اتم وجود دارد.
- عناصر واسطه داخلی (بلوک f): عناصر فلزی هستند که آخرین الکترون اضافه شده در آنها اوربیتال f را پر میکند. لایه ظرفیت عناصر واسطه داخلی از اوربیتال (n – 2)f ،اوربیتال (n – 1)d و ns تشکیل شده است. دو نوع عناصر واسطه داخلی وجود دارد.
- ردیف لانتانید: از عنصر »لانتانیم» (La) تا «لوتتیوم» (Lu)
- ردیف اکتینید: از عنصر «اکتینیم» (Ac) تا «لاورنسیم» (Lr)
لانتانیم و اکتینیم در لایه ظرفیت خود اوربیتال f ندارند.
برای نوشتن آرایش الکترونی فشرده از روی جدول تناوبی عناصر از عدد کوانتومی اصلی موجود در هر ردیف استفاده میکنیم. میدانیم که لایه ظرفیت گاز نجیب ماقبل اتم مورد نظر کاملا از الکترون پر شده است. نام گاز نجیب را مینویسیم و در جلوی آن با توجه به این که چند عنصر از گاز نجیب به جلوتر آمدهایم الکترونهای لایه ظرفیت را پر میکنیم.
استثناهای آرایش الکترونی اتمها
در برخی موارد، حالت پایه برای قرار گرفتن الکترونها در اوربیتال با قانون آفبا همخوانی ندارد. به طور کلی وقتی اوربیتالها به طور کامل یا نصفه پر باشند، اتم پایداری بیشتری دارد. برای مثال اتم کروم 24 الکترون دارد که آرایش 18 الکترون آن مانند گاز نجیب آرگون است.
آرایش الکترونی گاز نجیب آرگون:
6 الکترون دیگر باقی میماند که باید در اوربیتالها جای بگیرند. طبق اصل آفبا، بعد از پر شدن اوربیتال 3p اوربیتال 4s و پس از آن اوربیتال 3d پر میشود. در مورد اتم کروم اگر اوربیتال 4s با دو الکترون پر شود 4 الکترون بعدی باید در اوربیتال 3d قرار بگیرند که شکل زیر حاصل میشود.
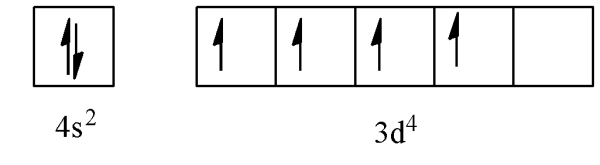
اما برای اینکه اتم پایدارتر شود ترجیح میدهد که اوربیتال 3d خود را نصفه پر کند. یعنی 5 الکترون در آن قرار دهد و یک الکترون را در اوربیتال 4s بگذارد. در این صورت آرایش الکترونی زیر حاصل میشود که پایداری بیشتری نسبت به حالت نشان داده شده در تصویر بالا دارد.
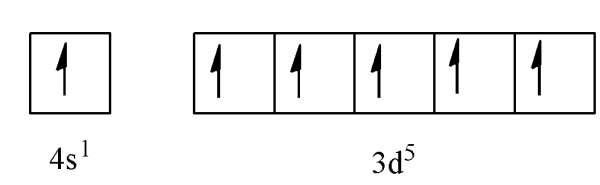
مثال بعدی اتم مس است که 29 الکترون دارد. آرایش 18 الکترون از 29 الکترون این اتم نیز مانند گاز نجیب آرگون است. اگر بر اساس قانون آفبا آرایش الکترونی 11 اتم باقیمانده را رسم کنیم دو الکترون در اوربیتال 4s و 9 الکترون در اوربیتال ۳d قرار میگیرد. اتم ترجیح میدهد برای پایداری بیشتر اوربیتالهای خود را نصفه یا به طور کامل پر کند.
بر همین اساس یک الکترون از اوربیتال 4s وارد اوربیتال 3d میشود و اوربیتال 3d به طور کامل پر میشود. از طرفی اوربیتال 4s هم نصفه باقی میماند که باز هم به پایداری اتم کمک میکند. آرایش الکترونی فشرده سایر اتمهایی که آرایش الکترونی استثنا دارند در جدول زیر گردآوری شدهاند.
| عنصر | نماد | آرایش الکترونی فشره استثنا |
| کروم | Cr | |
| مس | Cu | |
| نیوبیم | Nb | |
| مولیبدن | Mo | |
| روتنیم | Ru | |
| رودیم | Rh | |
| پالادیم | Pd | |
| نقره | Ag | |
| لونتیم | Lu | |
| سریم | Ce | |
| گادولینیم | Gd | |
| پلاتین | Pt | |
| طلا | Au | |
| اکتینیم | Ac | |
| توریم | Th | |
| پروتاکتینیوم | Pa | |
| اورانیم | U | |
| نپتونیم | Np | |
| کوریم | Cm |
آرایش الکترونی فشرده در یون ها
وقتی اتمی الکترون از دست میدهد و یا بدست میآورد تبدیل به یون میشود. در صورت از دست دادن الکترون بار مثبت میگیرد مه به آن کاتیون میگویند و در صورت بدست اوردن الکترون بار منفی میگیرد که به آن آنیون میگویند. اتمهای گروه 1 و 2 و عناصر غیرفلزی الکترونهای خود را از دست میدهند یا به دست میآورند تا به آرایش الکترونی گازهای نجیب برسند. یعنی آرایش الکترونهای لایه ظرفیت آنها به تبدیل شود.
عناصر گروه 1 یک الکترون و عناصر گروه 2 جدول تناوبی دو الکترون از دست میدهند تا به آرایش الکترونی گاز نجیب ماقبل خود برسند. برای مثال اتم خنثی سدیم برای رسیدن به ساختار گاز نجیب نئون باید یک الکترونی که در اوربیتال 3s خود دارد از دست بدهد (تصویر زیر).
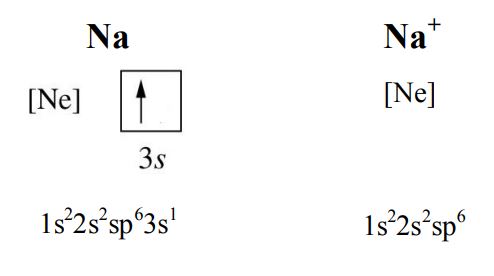
عناصر غیرفلزی گروه 15 تا 17 نیز الکترون بدست میآورند تا به ساختار گاز نجیب بعد از خود برسند. برای مثال فسفر در لایه ظرفیت خود 2 الکترون در اوربیتال 3s و 3 اوربیتال در اوربیتال 3p دارد. برای اینکه به ساختار گاز نجیب بعد از خود برسد 3 الکترون دریافت میکند و آرایش الکترونی زیر حاصل میشود.
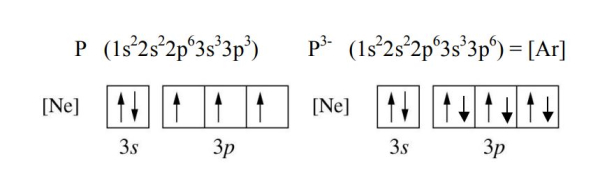
آرایش الکترونی یونهای فلزات واسطه الزاما به گاز نجیب بعد یا قبل از خود تبدیل نمیشود و بسته به باری که دارند میتوان آرایش الکترونی انها را بدست آورد. معمولا وقتی فلزات واسطه یونیزه میشوند ابتدا الکترونهای اوربیتال s لایه ظرفیت خود را از دست میدهند. برای مثال عنصر اسکاندیم وقتی سه الکترون لایه ظرفیت خود را از دست میدهد، آرایش الکترونی آن به شکل زیر تبدیل میشود.
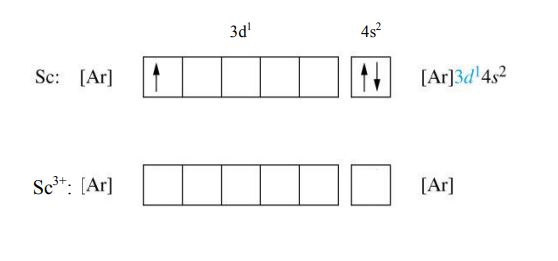
مثالی دیگر از این فلزات، یون کروم است. این یون 3 الکترون از دست میدهد. الکترون اول از اوربیتال 4s و دو الکترون دیگر از اوربیتال 3d گرفته میشود. آرایش الکترونی فشرده یون کروم به صورت زیر است.
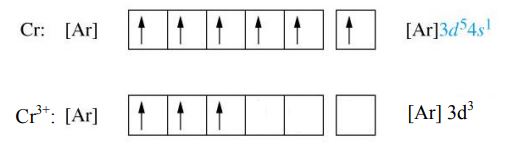
جمعبندی
آرایش الکترونی اتمها انژی و جهتگیری الکترونها در اوربیتال را به ما نشان میدهند اما نوشتن آن برای عناصری با عدد اتمی بالا مشکل است. به همین جهت از آرایش الکترونی فشرده استفاده میشود. در این روش به جای بخشی از آرایش الکترونی از نماد گاز نجیب ماقبل عنصر استفاده میشود و سایر الکترونهای باقیمانده در جلوی نماد نوشته میشود.
آزمون آرایش الکترونی فشرده
۱. آرایش الکترونی چه نوع اطلاعاتی درباره اتمها به ما میدهد؟
چگونگی توزیع الکترونها و ظرفیت پیوندی اتم
تعداد پروتونهای هسته و جرم اتمی
ویژگیهای فیزیکی مانند نقطه ذوب و جوش
شکل هندسی مولکول و رنگ آن
آرایش الکترونی اتم مشخص میکند الکترونها چگونه در اوربیتالها قرار گرفتهاند و این موضوع نقش مهمی در فهم رفتار شیمیایی و ظرفیت پیوندی اتم دارد. خواصی مانند شمار پروتونها، هندسه مولکول، یا ویژگیهای فیزیکی صرفا با آرایش الکترونی توصیف نمیشوند و نیازمند اطلاعات اضافی یا جنبههای دیگری از شیمی هستند.
۲. ویژگی اصلی روش آرایش الکترونی فشرده نسبت به آرایش کامل چیست؟
نمایش انرژی دقیق هر تراز
توضیح کامل ویژگیهای مغناطیسی اتم
تعیین نوع اوربیتال هر الکترون
کاهش زمان و حجم نوشتن آرایش الکترونی
ویژگی اصلی روش آرایش الکترونی فشرده، کاهش زمان و حجم نوشتن آرایش است، زیرا با جایگزینی بخش بزرگ آرایش با نماد گاز نجیب، فقط قسمت باقیمانده نوشته میشود.
۳. عدد کوانتومی اصلی (n) چه اثری بر انرژی اوربیتالها دارد؟
تغییر n بر میزان چرخش (spin) الکترون تاثیر دارد.
تغییر n فقط جهتگیری فضایی اوربیتال را تعیین میکند.
افزایش n فقط نوع اوربیتال (s، p، d، f) را مشخص میکند.
افزایش n باعث زیاد شدن انرژی اوربیتال میشود.
افزایش عدد کوانتومی اصلی (n) سبب بالا رفتن انرژی اوربیتال میشود و این رابطه در سطوح انرژی مشهود است. هر چه n بزرگتر شود، انرژی اوربیتال بالاتر میرود.
۴. برای نگارش آرایش الکترونی فشرده یک عنصر، چه گامهایی باید به ترتیب برداشته شود؟
ابتدا همه اوربیتالها را کامل مینویسیم، سپس بخش s را حذف میکنیم تا آرایش خلاصه به دست آید.
اول عدد اتمی عنصر را یافته، نزدیکترین گاز نجیب پیشین را مشخص و نمادش را در کروشه مینویسیم، سپس الکترونهای باقیمانده را طبق ترتیب انرژی توزیع میکنیم.
عدد اتمی و نماد شیمیایی را با هم قرار میدهیم و سپس همه اوربیتالها را به ترتیب انرژی بدون اشاره به گاز نجیب پر میکنیم.
ابتدا نماد گاز نجیب بعد از عنصر را در کروشه مینویسیم، عدد اتمی را تقسیم بر دو کرده و اوربیتالها را پر میکنیم.
برای نوشتن آرایش الکترونی فشرده، لازم است ابتدا عدد اتمی عنصر را مشخص کنیم. سپس نزدیکترین گاز نجیب که عدد اتمی کمتری دارد را پیدا کرده و نماد آن را در کروشه قرار دهیم. تعداد الکترونهای باقیمانده با کم کردن عدد اتمی گاز نجیب از عدد اتمی عنصر به دست میآید و این الکترونها باید طبق توالی انرژی اوربیتالها اضافه شوند.
۵. برای نوشتن آرایش الکترونی فشرده یک عنصر، چرا شناسایی گاز نجیب ماقبل اهمیت دارد و این کار چگونه انجام میشود؟
شناسایی گاز نجیب ماقبل ترتیب پر شدن اوربیتالهای p و d را تغییر میدهد.
با تعیین گاز نجیب ماقبل میتوان تنها لایه ظرفیت عنصر را نشان داد.
با انتخاب گاز نجیب ماقبل، بخش تکراری آرایش حذف و فقط آرایش مربوط به الکترونهای جدید نوشته میشود.
گاز نجیب ماقبل امکان محاسبه عدد کوانتومی اصلی (n) را فراهم میکند.
استفاده از روش گاز نجیب ماقبل باعث میشود آرایش الکترونی فشرده تنها قسمت اضافی پس از آخرین گاز نجیب را نمایش دهد و محاسبه زمانبر اوربیتالهای قبلی را حذف کند. این کار با یافتن نماد گاز نجیب قبل عنصر در جدول تناوبی و نوشتن آن در کروشه انجام میشود.
۶. چه عاملی باعث میشود جدول تناوبی ابزار مناسبی برای نوشتن آرایش الکترونی فشرده عناصر باشد؟
جدول تناوبی مسیر ورود گازهای نجیب را برای تمامی عناصر نشان میدهد.
جدول تناوبی محل قرارگیری عنصر و نوع بلوک آن را برای تعیین زیرلایه پایانی مشخص میکند.
جدول تناوبی فقط عدد اتمی عنصر را ارائه میدهد و بر نوع آرایش تاثیری ندارد.
جدول تناوبی تنها آرایش عناصر سبک را تسهیل میکند و برای سنگینها کاربردی ندارد.
هنگام نگارش آرایش الکترونی فشرده، محل عنصر در جدول تناوبی و نوع بلوک (s, p, d, f) به ما کمک میکند تا بدانیم کدام زیرلایه آخرین بار الکترون میگیرد. این مسیر علاوه بر شناسایی سریع گروه، امکان استفاده از نماد گاز نجیب و تشخیص بخش پایانی آرایش را فراهم میکند.
۷. در آرایش الکترونی فشرده یون یک فلز واسطه، کدام ترتیب برای حذف الکترونها رعایت میشود؟
ابتدا الکترونها از زیرلایه s لایه ظرفیت و سپس از d حذف میشوند.
تمام الکترونهای فرعی همزمان حذف میشوند و ترتیب اهمیتی ندارد.
الکترونها به ترتیب از بالاترین اوربیتال انرژی گرفته تا پایینترین حذف میشوند.
ابتدا الکترونها از زیرلایه 3d و سپس 4s حذف میشوند.
در فلزات واسطه، آرایش الکترونی فشرده یون طبق این است که نخست الکترونها از زیرلایه s لایه ظرفیت حذف میشوند و پس از آن نوبت به d میرسد. این برخلاف ظاهر آرایش کامل است که شاید حذف d را مقدم بداند. اما حذف تدریجی الکترون از s به پایداری و تطابق با رفتار واقعی یونها منجر میشود.
۸. اگر در عنصری مانند کروم (Cr) آرایش الکترونی از اصل آفبا پیروی نکند، این تغییر چه تاثیری بر پایداری ساختار الکترونی آن خواهد داشت؟
ساختار الکترونی بسیار ناپایدار و واکنشپذیرتر میشود.
آرایش الکترونی کاملا بیتاثیر بر پایداری خواهد بود.
پایداری ساختار به طور محسوسی افزایش مییابد.
پایداری ساختار کاهش یافته و میل به تغییر بیشتر میشود.
در عناصر با آرایش استثنایی مانند کروم، پیروی نکردن کامل از اصل آفبا باعث میشود پایداری ساختار کمتر شود، چون این آرایش ویژه برای رسیدن به حالت پایدار نیمهپر یا پرشدگی کامل اوربیتالها انتخاب میشود.
۹. کدام عامل باعث میشود تعیین آرایش الکترونی عناصر بلوک d دشوار باشد؟
تفاوت مقدار اسپین (spin) الکترونها در اوربیتالهای d
همارز شدن انرژی زیرلایههای s و d و وقوع جابهجایی الکترون
تغییر تعداد ترازهای الکترونی با افزایش عدد اتمی
تغییر ناگهانی انرژی اوربیتالها در لایههای مختلف
در عناصر بلوک d، انرژی زیرلایههای s و d به هم نزدیک میشود و این امر میتواند منجر به جابهجایی الکترون بین این زیرلایهها شود. بنابراین، در برخی موارد برای کسب پایداری بیشتر، یک الکترون از زیرلایه s به d منتقل میشود و آرایش الکترونی غیرمنتظرهای ایجاد میکند.












