کربانیون چیست؟ – به زبان ساده
یک کربانیون در شیمی به آنیونی میگویند که در آن، اتم کربن به صورت سه ظرفیتی باشد - یعنی سه پیوند را تشکیل دهد - و بار الکتریکی منفی را اختیار کند. زمانی که کربانیون به گروههای جانشین سه، دو و یک استخلافی متصل شود، به ترتیب، شکلی به صورت سهضلعی مسطح، خمیده و خطی خواهد داشت. یک کربانیون به طور کلی، باز مزدوج یک «کربن اسید» (Carbon Acid) است.

واکنش این ترکیب را در زیر مشاهده میکنید که در این واکنش، B یک باز را نشان میدهد.
کربانیونها چگالی الکترونی منفی در اتم کربن دارند و در بیشتر موارد، به خوبی با بسیاری از الکتروندوستها با قدرتهای متفاوت همچون گروههای عاملی کربونیل، واکنشگرهای هالوژناسیون و پروتوندهندهها وارد واکنش میشوند. کربانیونها به عنوان یکی از مواد واسط واکنشپذیر در شیمی آلی شناخته میشوند. در سنتزهای آلی، واکنشگرهای اورگانولیتیومی (آلی لیتیومی) و همچنین واکنشگر گرینیارد را به عنوان کربانیون میشناسند.
روندها در کربانیون
کربانیونها به طور معمول، «هستهدوست» (Nucleophilic) و بازی هستند. خاصیت بازی و هستهدوستی کربانیون به کمک گروههای متصل به کربن مشخص میشود که شامل موارد زیر است:
- اثر القایی. اتمهای الکترونگاتیو مجاور بار الکتریکی، موجب پایداری این بار میشوند.
- مقدار «مزدوج شدگی» (Conjugation) آنیون. اثر رزونانس موجب پایداری آنیون خواهد شد. این مورد، به خصوص زمانی اهمیت دارد که آنیون در نتیجه آروماتیستیه (خاصیت آروماتیکی) به پایداری رسیده باشد.
لازم به ذکر است که هندسه مولکولی نیز بر هیبرید شدن کربانیونها تاثیر دارد. هرقدر خاصیت s در اتم جاذب بار الکتریکی، بیشتر باشد، آنیون پایداری بیشتری دارد. واکنشگرهای آلیفلزی همچون بوتیلیتیوم یا متیل منیزیم برمید را به طور معمول، به عنوان نوعی از کربانیون میشناسند. البته این مواد معمولا کمپلکسهایی با پیوندهای کووالانسی قطبی هستند. در حقیقت، کربانیونهای حقیقی که فاقد گروههای جانشین پایدارکننده باشند را نمیتوان در فاز متراکم بررسی کرد و مطالعه آنها باید در فاز گاز صورت بگیرد.
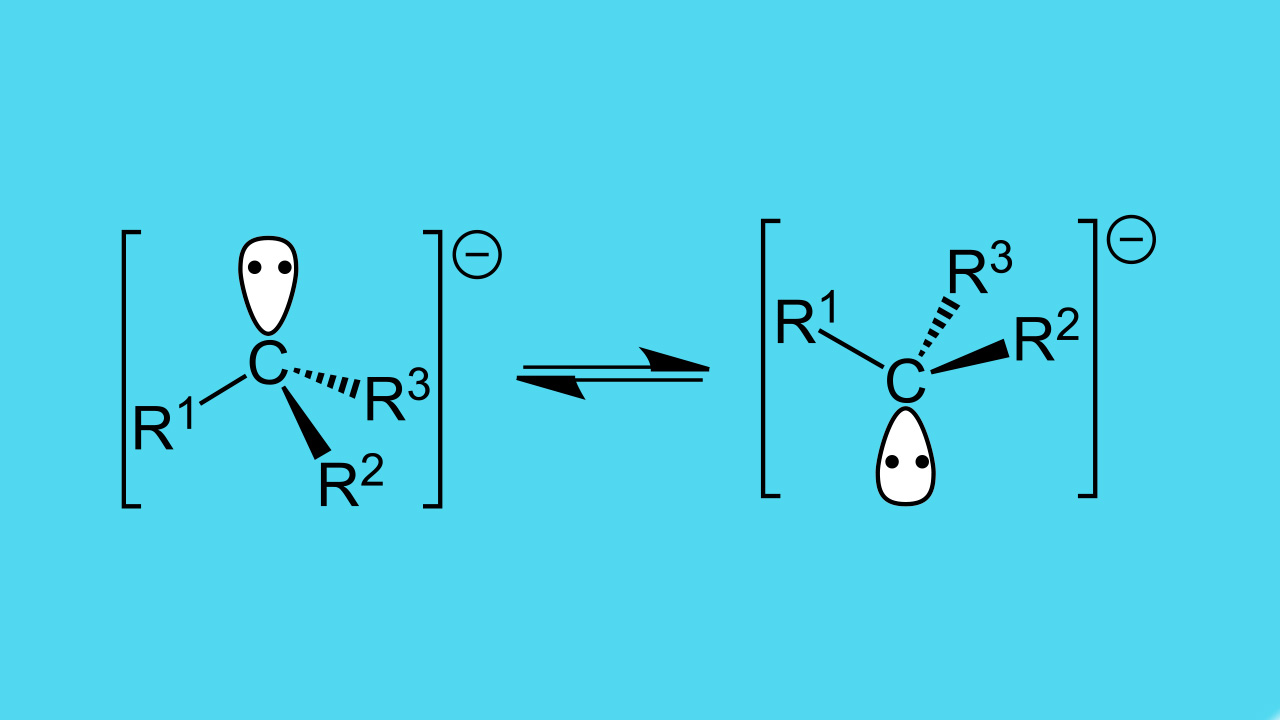
در گذشته این مورد شناسایی نشده بود که آیا آلکیل آنیونهای ساده به صورت ذرهای آزاد وجود دارند یا خیر. بسیاری از مطالعات نظری پیشبینی کرده بودند که آنیون متانایید با فرمول باید ذرهای غیر پیوندی باشد و این امر بدان معنی بود که مقدار «الکترونخواهی» (Electron Affinity) در خصوص منفی خواهد بود. چنین ذراتی به سرعت تجزیه میشوند و این تجزیه به شکل خود به خودی و از طریق خروج الکترون بوقوع میپیوندد. چنین رفتاری، زمان بسیار کوتاهی دارد و به طور مستقیم توسط طیفسنجی جرمی قابل مشاهده نیست. با این وجود، در سال 1978، متیل آنیون با قرار دادن «کتن» (Ketene) در برابر تخلیه بار الکتریکی، به تولید رسید. در نتیجه این کار، به کمک طیفسنجی فوتوالکترونی، مقدار الکترونخواهی برابر با اندازهگیری شد.
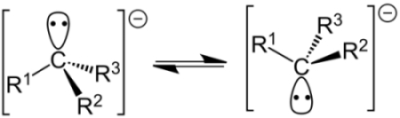
ساختار به صورت هرمی با مقدار «ممانعت وارونگی» (Inversion Barrier) برابر با ذکر میشود درحالیکه ، شکلی مسطح دارد. در ادامه، بیشتر کربانیونهای نوع اول و دوم و سوم به شکل ، به صورت ذراتی غیر پیوندی مشخص شدند. این امر نشان میداد که این ذرات، حالت ناپایداری دارند و به کمک برخی تاثیرات پایدار کننده، به صورت ذرات پیوندی تبدیل میشدند.
در فاز متراکم، تنها کربانیونهایی به صورت ذرات یونی در نظر گرفته میشوند که به طور مناسبی از طریق پخش شدن الکترونها به پایداری رسیده باشند. به طور مثال، دانشمندان در سال 1984، نمکی از کربانیون تریفنیل متانید را که حاصل سه ماده دیگر بود، معرفی کردند.
کربن اسیدها
هر مولکولی که شامل یک پیوند باشد، با از دست دادن پروتون، تشکیل کربانیون میدهد. بنابراین، هر هیدروکربنی که چنین پیوندی داشته باشد را میتوان یک اسید با مقدار مشخص در نظر گرفت. در تعریف کلی و کلاسیک برای متان، این ماده را یک اسید در نظر نمیگیرند اما مقدار آن برابر با 56 ذکر میشود. این عدد را با استیک اسید در جدول زیر مقایسه کنید. تمامی عواملی که در پایداری کربانیون دخیل هستند را میتوان در مقدار کربن اسیدها نیز پیدا کرد. این مقادیر برای ترکیبات در آب تعیین میشوند که به کمک آنها، کربن اسیدها را بتوان با اسیدهای معمول مقایسه کرد.
همانطور که در بالا نیز به آن اشاره شد، کربن اسیدها در مقایسه با اسیدهای معمول، بسیار ضعیفتر هستند. البته موارد استثنا هم بین آنها دیده میشود. به طور مثال، بنزن در تعریف آرنیوس، یک اسید محسوب نمیشود. با این وجود، در تعریف اسید برونستد، با مقدار برابر با 49، یک اسید ضعیف به شمار میآید. جدول زیر، قدرت اسید برای برخی از کربن اسیدها را در دیمتیل سولفوکسید (DMSO) نشان میدهد.
| نام | فرمول | فرمول ساختاری | |
| متان |  | 56 | |
| اتان |  | 50 | |
| آنیسول | 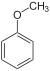 | 49 | |
| آنیلین | 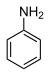 | 30/6 | |
| تریفنیل متان | 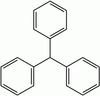 | 30/6 | |
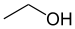
| اتانول | 29/8 | ||
| استون | 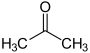 | 26/5 | |
| استیک اسید | 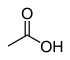 | 4/76 | |
| ترینیترو متان |  | 0/17 |
با نگاهی به جدول در مییابیم که خاصیت اسیدی از بالا به پایین، تحت شرایط زیر افزایش پیدا میکند:
- زمانی که آنیون، به صورت آروماتیک ذکر شود. این آروماتیسیته میتواند نتیجه الکترون اضافه شده یا نتیجه پخش شدن بار منفی کربن بر روی حلقههای آروماتیکی باشد.
- زمانی که کربانیون با گروههای شدیدا الکترونگاتیو احاطه شده باشد.
- زمانی که کربانیون در مجاورت یک گروه عاملی کربونیل قرار داشته باشد. پروتونهای آلفا در گروه کربونیل، خاصیت اسیدی دارند زیرا بار منفی در «انولات» (Enolate) میتواند به طور جزئی در اتم اکسیژن توزیع شود.
کربانیون کایرال
با توجه به اینکه شکل یک کربانیون به صورت هرم سه ضلعی توصیف شده است، سوالی که مطرح میشود این است که آیا کربانیونها خاصیت کایرال دارند یا خیر زیرا اگر «ممانعت فعالسازی» (Activation Barrier) برای وارونگی این شکل مولکول، مقدار پایینی باشد، هر عملی که بخواهد کایرالیته را نشان دهد، در نهایت به «راسمیک شدن» (Racemization) منجر میشود. البته شواهدی وجود دارند که نشان میدهد کربانیونها به خصوص در ترکیبات اورگانولیتیومی میتوانند خاصیت کایرال داشته باشند.
اولین مدرک برای وجود ترکیبات کایرال اوگانولیتیومی در 1950 نشان داده شد. واکنش ۲-یدواکتان با سک-بوتیلیتیوم در اتر و دمای درجه سانتیگراد، به همراه واکنش با یخ خشک، ۲-متیل بوتیریک اسید را بدست داد که مخلوطی راسمیک بود. البته ماده دیگری به نام ۲-متیل اوکتانوییک اسید هم در این واکنش به تولید میرسد که فعالیت نوری دارد.
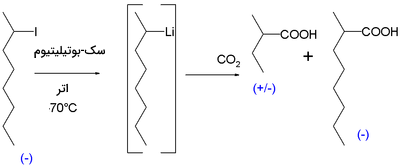
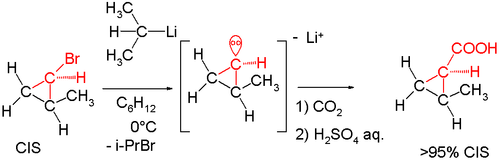
اگر واکنش به دمای صفر درجه سانتیگراد برسد، فعالیت نوری از دست میرود. شواهد دیگری نیز در دهه 1960 بیان شدند. واکنش ایزومر سیس-۲-متیلسیکلوپروپیل برمید با سک-بوتیلیتیوم به همراه یخ خشک، ماده سیس-۲-متیل سیکلو پروپیل کربوکسیلیک اسید را تولید کرد. بیش از 95 درصد ترکیبات حاصل، ایزومر سیس را تشکیل میدهند. تشکیل ایزومر ترانس، نشان میدهد که کربانیون واسط، مادهای غیر پایدار بوده است.
ساختار و پایداری رادیکالهای کربن، کربوکاتیونها و کربانیون
مواد واسطی که از طریق گسست پیوندهای کربن تولید میشوند، ترکیبات کربنی واکنشپذیر با سه پیوند شامل کربوکاتیونها، رادیکالهای کربن و کربانیونها هستند. چنین ترکیبات سهظرفیتی، به شدت واکنشپذیرند و برای تشکیل کربن چهار ظرفیتی و پایدار، به سرعت وارد واکنش میشوند.
پایداری در کربوکاتیونها
اتم کربن با بار مثبت در کربوکاتیون، تنها شش الکترون در لایه ظرفیت خود دارد. اگرچه، بار قراردادی روی کربوکاتیون با اتمهای متصل به آن به اشتراک گذاشته میشود. این توزیع بار بین چندین اتم، نتیجه اثر القایی خواهد بود که در آن، چگالی الکترونی از طریق شبکه پیوند سیگما، همانند یک سیم، جریان پیدا میکند. در برخی موارد، بار مثبت مرکز کاتیونی به دلیل اثر رزونانس، بر روی دو اتم یا بیشتر پخش میشود. پایداری القایی یک کربوکاتیون زمانی اتفاق میافتد که اتم کربن با بار مثبت، دانسیته الکترونی را از گروههای متصل، به طرف خود جذب کند. بنابراین، یک کربن هیبرید شده، همچون گروه متیل یا سایر گروههای آلکیل، توانایی توزیع چگالی الکترونی از طریق پیوند سیگما به اتم کربن با بار مثبت را دارند.
ترکیبات واسط واکنشپذیر بر اساس تعداد اتم کربن متصل به کربن سهظرفیتی، طبقهبندی میشوند. اتم کربنی که به یک، دو یا سه اتم کربن متصل باشد، به ترتیب به صورت کربن نوع اول ، دوم و سوم طبقهبندی خواهد شد. پایداری کربوکاتیون با افزایش تعداد اتمهای کربن متصل به مرکز مثبت، افزایش مییابد. این روند به صورت زیر نشان داده میشود:
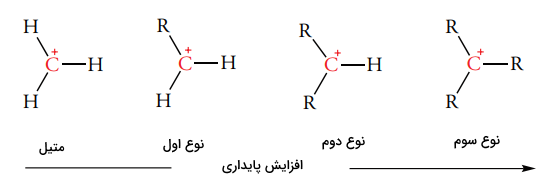
اتم کربن مثبت در کربوکاتیون، به صورت سهضلعی مسطح و هیبرید شده است. این اتم، یک اوربیتال خالی به صورت عمود بر صفحه دارد و در تصویر زیر نشان داده شده است. این اوربیتال خالی، به صورت بالقوه پذیرنده الکترون خواهد بود و این نوع از کربوکاتیونها، اسیدهای قوی لوویس به شمار میآیند.
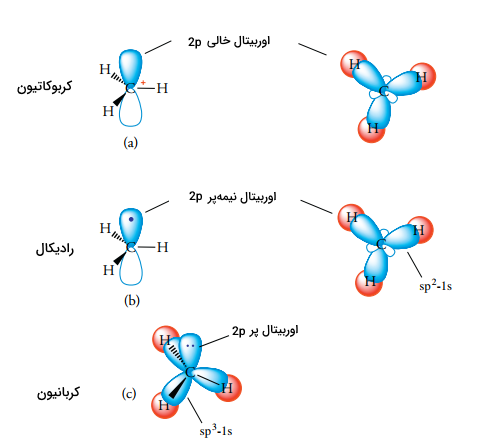
پایداری در رادیکالهای کربن
همانند کربوکاتیونها، رادیکالهای کربن نیز ذراتی با تعداد کم از الکترون هستند. در مقایسه با کربوکاتیونها که در لایه ظرفیت خود، شش الکترون داشتند، رادیکالهای کربن در لایه ظرفیت خود هفت الکترون دارند. بار دیگر همچون کربوکاتیونها، رادیکالهای کربن نیز از طریق اثر القایی گروههای متصل به رادیکال مرکزی، به پایداری میرسند. از آنجایی که رادیکالها، الکترون بیشتری نسبت به کربوکاتیونها دارند، تفاوت پایداری در رادیکالها، کوچکتر از کربوکاتیونها است. ترتیب پایداری رادیکالها نیز همانند پایداری در کربوکاتیونها ذکر میشود. رادیکال کربن دارای یک اتم کربن هیبرید شده است. رادیکال متیل، ساختاری مسطح و زاویه پیوندی 120 درجه در دارد.

پایداری در کربانیون
یک کربانیون دارای یک اتم کربن با بار منفی و سه ظرفیتی است که در لایه ظرفیت خود، هشت الکترون دارد. بنابراین، کربانیون، کمبود الکترون ندارد. کربانیونها، از جمله بازهای قوی لوویس به شمار میآیند که ساختار الکترونی همچون آمینها دارند. برخلاف کربوکاتیونها و رادیکالهای کربن، یک کربانیون به دلیل گروههای الکتروندهنده متصل به مرکز آنیونی، ناپایدار است، به همین دلیل، ترتیب پایداری کربانیونها، روندی عکس نسبت به کربوکاتیون و رادیکال کربن دارد.
با توجه به اینکه مشاهده کردیم که گروههای آلکیل، با توجه به هیدروژن، به عنوان آزاد کننده الکترون رفتار میکنند، میتوان به طور کلی به این نتیجه رسید که گروههای آزاد کننده الکترون، کربوکاتیونها و رادیکالها را پایدار میکنند و موجب ناپایداری کربانیونها میشوند.
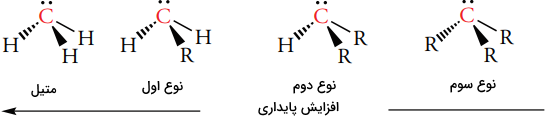
اتم کربن با بار منفی در یک کربانیون به صورت هیبرید شده است. همانند سایز ذرات هیبرید شده، جهت چهار اوربیتال هیبرید به طرف گوشههای چهاروجهی خواهد بود. یکی از اوربیتالهای هیبرید، یک جفتالکترون ناپیوندی دارد. در نتیجه، سه گروه متصل به مرکز کربانیونی، یک شکل هرمی را تشکیل میدهند.
کربوکاتیونها، رادیکالها و کربانیونها از طریق رزونانس به پایداری میرسند. به طور مثال، اگر یک اتم کربن با یک پیوند پای، به یک اتم کربن سه ظرفیتی متصل شده باشد، اوربیتال خالی آن اتم کربن با اوربیتال پیوند پای، برهمکنش انجام میدهد. نتیجه، یک ماده واسط خواهد بود که از طریق رزونانس به پایداری رسیده است.
جمع بندی و تاریخچه کربانیون
ساختار کربانیون در ابتدا با مکانیم واکنش «تراکم بنزوئین» (Benzoin Condensation) ظهور کرد که به خوبی توسط «کلارک» (Clarke) و «لاپورث» (Lapworth) در سال 1907 معرفی و اصطلاح کربانیون توسط «والیس» (Wallis) و «آدامز» (Adams) در سال 1933 معرفی شد. در این آموزش نیز سعی کردیم تا مفهوم کربانیون را به زبانی ساده بیان کنیم. علاوه بر این، روندهای مختلف در کربانیون و عوامل موثر در خاصیت بازی و هستهدوستی کربانیونها را مورد بررسی قرار دادیم. در این مطلب، کربن اسیدها نیز معرفی شدند و به کمک ارائه یک جدول، قدرت اسیدی برخی از آنها را بیان کردیم. همچنین، ساختارها و روند پایداری را در کربوکاتیونها، رادیکالهای کربن و کربانیون بررسی شدند. در انتها نیز به طور مختصر، کایرالیته و فعالیت نوری در کربانیون توضیح داده شدند.
اگر این مطلب برای شما مفید بوده است، آموزشها و مطالب زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای نرمافزارهای مهندسی شیمی
- آموزش شیمی عمومی
- اصل لوشاتلیه — به زبان ساده
- شرایط STP در شیمی — به زبان ساده
- جدول تناوبی — از صفر تا صد
^^