نظریه برخورد – به زبان ساده
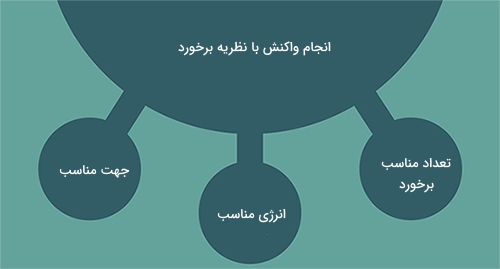
نظریه برخورد به ما توضیح میدهد که چرا واکنشهای شیمیایی مختلف با سرعتهای متفاوتی انجام میشوند. همچنین این نظریه، راههایی را برای تغییر در سرعت واکنش پیشنهاد میدهد. «نظریه برخورد» (Collision Theory) بیان میکند که برای انجام یک واکنش شیمیایی، اجزای آن باید با یکدیگر برخورد داشته باشند. به عبارت دیگر بر اساس این نظریه، سرعت واکنش به تعداد برخورد وابسته است. نظریه برخورد همچنین بیان میکند که اجزای واکنشدهنده ممکن است در برخورد با هم واکنش ندهند. برای یک برخورد موثر باید اجزا با انرژی و جهت مناسب با یکدیگر برخورد داشته باشند.

شرط انجام واکنش در نظریه برخورد
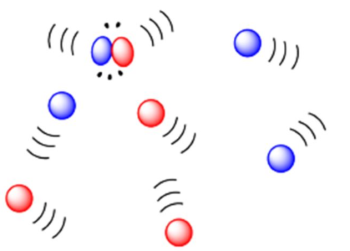
مولکولها برای انجام واکنش باید با هم برخورد داشته باشند. این قانون در نظریه برخورد به عنوان زیربنایی برای بررسی مکانیسم یک واکنشِ معمول است و توضیح میدهد که چرا انجام واکنشهای «سه مولکولی» (Termolecular) بسیار کم انجام میشوند. واکنش زیر را در نظر بگیرید:
فرآوردهها
بر اساس نظریه برخورد، اگر قرار باشد که دو مولکول و با یکدیگر واکنش دهند، باید به اندازهای به یکدیگر نزدیک شوند که برخی از پیوندهای مولکولی آنها شکسته و پیوندهای جدید برای تولید فرآورده تشکیل شوند. به این فرآیند برخورد میگویند.
تعداد برخوردها بین مولکولهای و در یک گاز، با غلظت هر کدام از مولکولها متناسب است. اگر غلظت دو برابر شود، تعداد برخوردهای این دو مولکول هم دو برابر میشوند. همانطور که در بحث سرعت واکنش مطرح شد، مرتبه این نوع از واکنش از نوع مرتبه دوم است و سرعت آن از رابطه زیر بدست میآید:
ارتباط سرعت واکنش و نظریه برخورد
برای یک گاز در دمای اتاق و فشار اتمسفری، در یک سانتیمتر مکعب از فضا، تعداد برخوردها در هر ثانیه برابر با برخورد است. نظریه برخورد بیان میکند که اگر تمامی برخوردها بین دو واکنشدهنده از نوع برخورد موثر بودند، تمامی واکنشها در کسری از ثانیه انجام میشدند. به طور مثال به هنگام برخورد دو توپ بیلیارد با هم، این دو توپ یکدیگر را از مسیر خود منحرف میکنند. همین فرآیند نیز به هنگام برخورد دو مولکول و اتفاق میافتد، به گونهای که این برخورد باید موجب شکستن پیوندها و آرایش مجدد پیوندهای جدید باشد. به عبارت دیگر، برای انجام چنین برخوردی باید انرژی آن تامین شود.
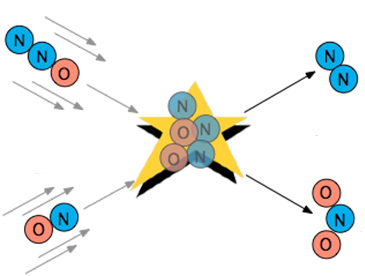
جهتگیری مولکولها
به شرط بالا باید یک مورد دیگر نیز اضافه کنیم. این شرط بیشتر در خصوص مولکولهای پیچیده به چشم میخورد و در حقیقت بیان میکند که مولکولها باید به هنگام برخورد، جهتی مناسب برای انجام فرآیند داشته باشند. به طور مثال، در واکنش گاز «دینیتروژن اکسید» با «نیتریک اکسید» ، اکسیژن باید با نیتروژن برخورد کند و در غیر اینصورت واکنشی انجام نخواهد شد. با توجه به اینکه جهتگیری و چرخش مولکولها در فاز گاز به صورت تصادفی انجام میشود، همواره مولکولهایی با چرخش مناسب وجود دارند که این واکنشها بتوانند انجام شوند. هر قدر این چرخش شکل پیچیدهتری داشته باشد، برخوردهای موثر کمتر خواهند بود.
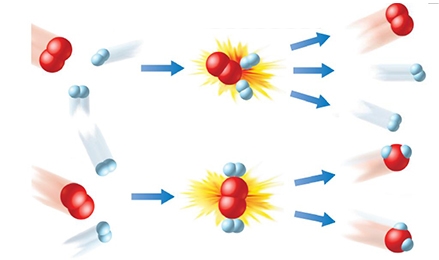
برخورد و قدرت پیوند
برخوردهای بین مولکولها سبب میشود تا پیوندهای بین اتمی در آنها دچار کشش و خمش شوند. در نتیجه، این پیوندها به طور موقتی تضعیف خواهند شد. این ضعیف شدن پیوندها، آنها را در معرض تخریب و آشفتگی قرار خواهد داد. آشفتگی حاصل از این برخوردها موجب میشود تا ابرهای الکترونی هر اتم با سایر اتمها برهمکنش داشته باشند که این امر در مواردی ممکن است به تشکیل پیوندهای جدید بیانجامد.
پیوندهای شیمیایی خاصیتی شبیه به فنر دارند. به عبارت دیگر، انرژی پتانسیل آنها با میزان فشردگی یا کشیدگی پیوند متناسب است. هر پیوند اتم با اتم را میتوان به صورت نمودار انرژی پتانسیل نشان داد. این نمودار بیان میکند که چگونه انرژی با تغییرات طول پیوند تغییر خواهد کرد. زمانی که پیوندها بر اثر برخورد یا حرارت، انرژی جذب میکنند، به سطح انرژی بالاتری میرسند و سبب تضعیف قدرت پیوندی میشوند چراکه طول این پیوند در حالت جدید، بسته به نوع انرژی شروع به نوسان میکند.
یک برخورد، تعدادی از پیوندها را با این روش تحریک میکند. تنها در زمان ثانیه، این تحریک در طول سایر پیوندهای مولکول توزیع میشود که این توزیع انرژی در حالتی پیچیده و غیر قابل پیشبینی انجام خواهد شد. در نهایت، انرژی به حد مشخصی میرسد و موجب میشود تا پیوندی که از این انرژی تاثیر گرفته است کشیدگی بیشتری پیدا کند و در کنار ابرهای الکترونی سایر واکنشدهندهها قرار گیرد. حاصل این برهمکنشها سرانجام موجب پیشرفت یک واکنش میشود.
افزایش سرعت یک واکنش
به طور خلاصه، عواملی که سرعت یک واکنش را زیاد میکنند باید بر یکی از موارد زیر تاثیر داشته باشند:
- زمان برخورد: هر قدر در یک فاصله زمانی معین، برخورد بیشتری داشته باشیم، سرعت واکنش نیز بیشتر خواهد بود.
- نوع برخورد: برخوردهای موثری که انرژی مناسبی داشته باشند، بر انجام شدن سریعتر یک واکنش تاثیرگذار هستند.
- جهت برخورد: افزایش برخوردها با جهت مناسب، سرعت واکنش را افزایش میدهند.
فرآیندهای تک مولکولی
فرآیندهای تکمولکولی نیز با برخورد آغاز میشوند. تا سال ۱۹۲۱ دانشمندان موفق به درک نقش برخورد در فرآیندهای «تکمولکولی» (Uni-molecular) نشدند. در حقیقت این نوع از واکنشها مکانیسم پیچیدهای دارند و در فشارهای خیلی کم از سینتیک مرتبه دوم تبعیت میکنند.
این نوع از واکنشها را با نام «شبه تکمولکولی» (Pseudounimolecular) توصیف میکنند. به طور مثال، ایزومریزاسیون (ایزومری شدن) سیکلو پروپان که در پایین آورده شده، نمونهای از واکنشهای تجزیه است که از سینتیک مرتبه اول تبعیت میکند و شامل فرآیندی تک مولکولی میشود:
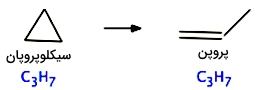
تبدیل سیکلوپروپان به پروپن را میتوان به صورت زیر نشان داد. لازم به ذکر است که در این تصویر، برای سادگی به تصویر کشیدن فرآیند، از نشان دادن اتمهای هیدروژن صرفنظر شده است. این کار البته فرض غلطی نیست چراکه پیوندهای کربن-کربن ضعیفتر از پیوندهای کربن با هیدروژن هستند و در نتیجه تاثیرپذیری پیوندهای کربن-کربن در برخورد، بیشتر است.

اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی عمومی
- ثابت تعادل — از صفر تا صد
- کلوئید — به زبان ساده
^^












من سه مقاله ری سرچ جدید در رابطه با نظریه برخورد در سینتیک میخوام میشه لطفا بم پیشنهاد بدید چندتا مقاله؟