طیف سنجی مولکولی – به زبان ساده
طیفسنجی دانشی است که در خصوص جذب، گسیل و پراکندگی تابشهای الکترومغناطیس اتمها و مولکولهایی بحث میکند که میتوانند به حالت مایع، جامد یا گاز باشند. تابش مرئی الکترومغناطیس را به عنوان «نور» (Light)، میشناسیم. البته در بعضی موارد، واژههای نور، «تابش» (Radiation) و «تابش الکترومغناطیس» (Electromagnetic Radiation) به جای یکدیگر بکار میروند. «طیفسنجی» (Spectroscopy)، نقش مهمی را در توسعه مکانیک کوانتوم ایفا کرد و به منظور فهم خواص مولکولی و انجام آزمایشهای طیفسنجی، بسیار مهم است. این علم را به عنوان پله اول در مطالعه مکانیک کوانتوم و خواص مولکولی ذکر میکنند. در این آموزش قصد داریم تا با مفاهیم اولیه و ساده یکی از انواع طیف سنجی به نام طیف سنجی مولکولی آشنا شویم؛ در همین راستا در ابتدا مفاهیم اولیه را مطرح میکنیم و سپس به جنبههای مختلف بحث میپردازیم.
مفاهیم اولیه در طیف سنجی مولکولی
برهمکنشهای تابشی با ماده، میتواند موجب تغییر جهت پرتوها یا تغییر حالت انرژی بین سطوح مختلف در اتم یا مولکول شود. در طیف سنجی مولکولی گذار از یک سطح پایینتر به سطح بالاتر که با انتقال انرژی از میدانهای تابشی به اتم یا مولکول همراه است را «جذب» (Absorption) مینامند. همچنین، گذار از سطح انرژی بالاتر به سطح انرژی پایینتر موسوم به «گسیل» (Emission) است.
تغییر جهت نور به سبب برهمکنش با ماده را با نام «پراکندگی» (Scattering) میشناسند که میتواند با انتقال انرژی نیز همراه باشد که این یعنی تابش پراکنده ممکن است طول موج یکسان یا متفاوتی داشته باشد. برای آشنایی بیشتر با طیف سنجی مولکولی نیاز به درک یک سری مفاهیم پایه در خصوص پدیدههای ذکر شده داریم که در ادامه به آنها خواهیم پرداخت.
جذب
زمانی که یک اتم یا مولکول، نوری جذب میکند، این نور، یک ساختار کوانتیزه را به حالت برانگیخته با سطح انرژی بیشتر میرساند. نوع برانگیختگی، به طول موج نور بستگی دارد. الکترونها در اثر تابش فرابنفش یا نور مرئی به اوربیتالهای بالاتر میرسند، نور مادون قرمز سبب ارتعاش میشود و چرخش مولکولها توسط برانگیختگی با مایکروویو قابل انجام است.
یک طیف جذبی، شامل جذب نور به عنوان تابعی از طول موج است و طیف یک اتم یا مولکول به ساختار سطح انرژی آن بستگی دارد. از جمله کاربردهای طیف جذبی میتوان به تشخیص ترکیبات شیمیایی اشاره کرد.
گسیل
اتمها یا مولکولهایی که به سطوح انرژی بالاتری برانگیخته شدهاند، از طریق گسیل پرتوهایی میتوانند به سطوح پایینتر برسند. برای اتمهایی که بوسیله منبع انرژی با دمای بالا برانگیخته شدهاند، این نوع از گسیل، موسوم به گسیل اتمی یا اپتیکی است. همچنین، برانگیختگی اتم به کمک نور را با نام «فلورسانس اتمی» (Atomic Florescence) میشناسند. در خصوص مولکولها ذکر این نکته ضروری است که در صورتیکه حالت گذار در برانگیختگی مربوط به یک اسپین باشد، به آن فلورسانس و اگر برانگیختگی بین دو اسپین مختلف اتفاق بیافتد به آن فسفرسانس میگویند. خوب است بدانید که قدرت گسیل یک ماده در غلظتهای پایین، به طور خطی با غلظت آنالیت تناسب دارد و از این ویژگی برای اندازهگیری ذرات گسیلکننده بهره میگیرند.
پراکندگی
در طیف سنجی مولکولی زمانی که یک تابش الکترومغناطیس از یک ماده گذر کند، بیشتر پرتوها به مسیر خود ادامه میدهند اما کسر کوچکی از آنها در جهات دیگر پراکنده خواهند شد. به نوری که با همان طول موج وارد شده، پراکنده شود، «پراکندگی رایلی» (Rayleigh Scattering) میگویند. نور پراکندهشده در جامدات شفاف به سبب ارتعاش را «پراکندگی بریلوئن» (Brillouin Scattering) مینامند. همچنین، نوری که به دلیل ارتعاش مولکولها در جامدات پراکنده میشود را با نام «پراکندگی رامان» (Raman Scattering) میشناسند.
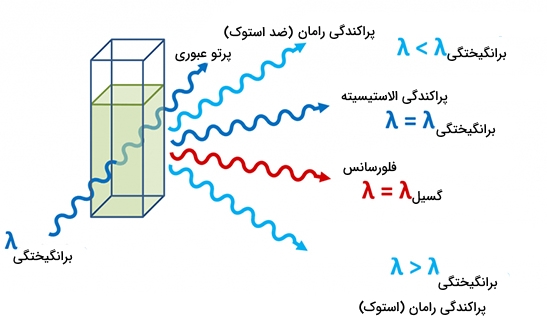
طیف الکترومغناطیس
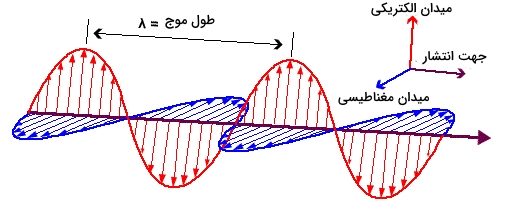
تابش الکترومغناطیس، از موجهای الکتریکی و مغناطیسی تشکیل شده است که در صفحات عمود بر هم نوسان میکنند و نور مرئی، نوعی از همین تابشهای الکترومغناطیس است. به همین شکل، پرتوهای گامای متساعد شده از سوخت هستهای، اشعههای ایکس در دستگاههای تصویربرداری، نور فرابنفشی که موجب آفتابسوختگی میشود، نور مادون قرمزی که در عینکهای دید در شب بکار میرود، امواج مایکروویو در پختوپز و امواج رادیویی، همگی شامل طیف الکترومغناطیس میشوند.
امواج الکترومغناطیس، همچون موج دریاها در مسیری مشخص حرکت میکنند. سرعت این امواج در حدود 300 میلیون متر بر ثانیه است. فرقی نمیکند که در مورد اشعه گاما صحبت میکنیم یا نور مرئی، هردو سرعت یکسانی دارند. گرچه به طور واضح میتوان حس کرد که این دو موج با یکدیگر تفاوت دارند، اما ما بیشتر با نور خورشید احاطه شدهایم و بهتر است که در معرض تابش اشعه گاما نباشیم. خواص متنوع تابشهای مختلف الکترومغناطیس به دلیل تفاوت در طول موج آن و انرژی متناظر هر کدام است. هر قدر طول موج کوتاهتری داشته باشیم، انرژی بیشتر خواهد بود.
پرتوهای با انرژی بالا همچون گاما و ایکس، از طول موجهای بسیار کوتاهی تشکیل شدهاند. انرژی طول موجهای بلند، بسیار کم هستند و بنابراین برای موجودات زنده خطر کمتری دارند. طول موج نور مرئی، بازهای بین 400-700 نانومتر را تشکیل میدهد درحالیکه امواج رادیویی، طول موجی بیش از صدها متر دارند.
فهم این نکته که تابشهای الکترومغناطیس حاوی مقادیر انرژی قابل سنجش هستند سادهتر خواهد بود اگر ما، به جای اینکه نور را نوعی موج در نظر بگیریم، آن را به عنوان جریانی از ذرات موسوم به «فوتون» (Photon) بیان کنیم. بر اساس مفهوم «دوگانگی موج-ذره» (Wave-Particle Duality)، در سطح کوانتوم، رفتار موجی و ذرهای از یکدیگر قابل تشخیص نیستند و ذرات بسیار ریز، طول موجی قابل مشاهده دارند. اگر نور را به عنوان جریانی از فوتونها در نظر بگیریم، انرژی طول موجی خاص را میتوان به صورت رابطه زیر بیان کرد:
در رابطه بالا:
- E: انرژی
- : طول موج بر حسب متر
- : سرعت نور
- : ثابت پلانک با مقدار
از آنجایی که پرتوهای الکترومغناطیس با سرعت ثابتی حرکت میکنند، هر طول موج، فرکانس مشخصی خواهد داشت که این مقدار، برابر با تعداد دفعاتی است که قله موج در هر ثانیه از یک نقطه عبور میکند. طول موجهای بلندتر، فرکانسهای پایینتری نیز دارند و برعکس. فرکانس را معمولا با هرتز بیان میکنند که به معنای دور در ثانیه است. زمانی که در خصوص الکترومغناطیس صحبت میکنیم، در حقیقت در رابطه با دو مفهوم طول موج و فرکانس به بحث میپردازیم که این دو مقدار را میتوان با رابطه زیر به یکدیگر مرتبط کرد که در این رابطه، فرکانس و واحد آن است:
دامنه کامل طیفهای الکترومغناطیس را با عنوان «طیف الکترومغنطیس» (Electromagnetic Spectrum)، میشناسند که در تصویر زیر آورده شده است.
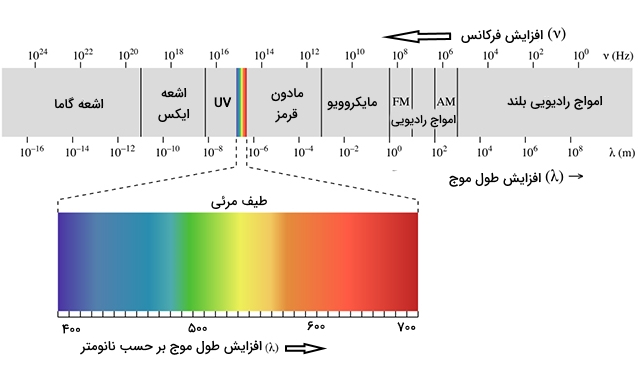
توجه کنید که نور مرئی تنها بخش کوچک از این طیف را در بر میگیرد. نور سفید که از خورشید یا لامپ به ما میرسد، ترکیبی از تمامی طول موجهای مرئی است. به این نکته توجه کنید که هر بار با دیدن رنگین کمان، طیف مرئی امواج الکترومغناطیسی را میبینید که در آن، نور بنفش کوتاهترین طول موج و نور قرمز، بلندترین طول موج را دارد.
مروری کلی بر آزمایش طیف سنجی مولکولی
در آزمایشهای طیف سنجی مولکولی، پرتو الکترومغناطیس با طول موجهای مشخص را از داخل یک نمونه حاوی ترکیب مورد بررسی عبور میدهند. مولکولهای نمونه، انرژی را از برخی طول موجها جذب میکنند که در نتیجه این کار، مولکول از «حالت پایه» (Ground State) به انرژی بیشتری موسوم به «حالت برانگیخته» (Excited State) میرسد. طول موجهای دیگری که توسط مولکول جذب نشدهاند، از آن گذر خواهند کرد. یک «آشکارساز» (Detector)، در بخش دیگر نمونه نصب شده است که طول موجهای جذب شده و مقدار جذب را ثبت میکند.
اساس طیف سنجی مولکولی به این صورت است که یک مولکول به طور مشخص، طول موجهایی را جذب میکند که انرژی برابر با اختلاف انرژی حالت برانگیخته و پایه داشته باشد. بنابراین، اگر این اختلاف انرژی را بنامیم، مولکول خاص، تابشی را جذب میکند که متناظر با باشد و اجازه میدهد تا طول موجهای دیگر گذر کنند.
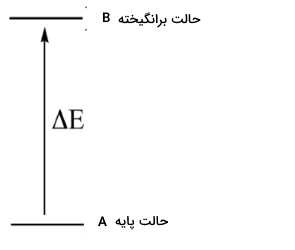
در طیف سنجی مولکولی با مشاهده اینکه یک مولکول، چه میزان از یک طول موج را جذب میکند، میتوان اطلاعات مهمی در خصوص طبیعتِ گذار یک مولکول از حالتهای مختلف انرژی را بدست آورد که در نهایت، این اطلاعات، ما را به ساختار مولکول نزدیکتر میکند.
علاوه بر این، ترکیب اتمها و تشکیل مولکول، سبب بوجود آمدن نوع مشخصی از حالات انرژی و به تبع آن طیف منحصر به فرد گذار بین این حالات میشود. «طیف مولکولی» (Molecular Spectra) را میتوان از طریق حالات اسپین الکترون، چرخش مولکولی، ارتعاش مولکولی و حالات الکترونی بدست آورد.
طیفسنجی چرخشی و مایکروویو به یک معنی هستند. ارتعاشات، حرکات نسبی هستههای اتم است که به کمک طیفسنجی مادون قرمز و «طیفسنجی رامان» مورد بررسی قرار میگیرد. برانگیختگی الکترونی را نیز به کمک طیفسنجی نور مرئی، فرابنفش و فلورسانس مطالعه میکنند. مطالعات طیفسنجی مولکولی سبب توسعه اولین «میزرها» (Masers) و همچنین پیشرفت لیزرها شد.

نظریه طیف مولکولی
بر خلاف اتمها که در آنها کوانتیزه شدن، تنها حاصل برهمکنش الکترونها با هسته و سایر الکترونها است، کوانتیزه شدن سطوح مولکولی و در نتیجه جذب و گسیل پرتوهای شامل این نوع از سطوح انرژی، مکانیسمهای مختلفی را شامل میشوند. در ظاهر، فرق چندانی بین مکانیسمهای مختلف وجود ندارد اما در عمل، اختلاف مقادیر این مکانیسمها سبب میشود تا بتوان آنها را به طور مستقل از یکدیگر بررسی کرد.
حالات انرژی چرخشی
در فاز گازی، مولکولها از یکدیگر دور هستند و به طور آزادانه میتوانند حول محورهای خود چرخش داشته باشند. در طیف سنجی مولکولی اگر یک مولکول دواتمی را به صورت دو گوی سخت در نظر بگیریم - یعنی از ارتعاشات داخلی آنها صرفنظر کنیم - و این مولکول از دو جرم و تشکیل شده و در فاصله از هم قرار داشته باشند، میتوان «ممان اینرسی» (Moment of Inertia) را برای آنها به صورت زیر تعریف کرد:
در رابطه بالا، «جرمِ کاهشیافته» (Reduced Mass) است و از رابطه زیر بدست میآید:
استفاده از قانون مکانیک کوانتوم در خصوص حرکت چرخشی مولکول دواتمی نشان میدهد که انرژی چرخشی، حالتی کوانتیزه (کوانتیده) دارد و از رابطه زیر بدست میآید:
در رابطه بالا، ثابت پلانک است و ، که به ، عدد چرخشی کوانتومی میگویند. طیف چرخشی مولکولی زمانی بوجود میآید که یک مولکول از یک سطح چرخشی به سطح دیگری منتقل شود. برای اینکه این انتقال حالت در مولکول دو اتمی صورت بگیرد، باید یک ممان دوقطبی دائمی داشته باشیم و این امر بدان معنی است که نیاز به دو اتم مجزا داریم. در نهایت، برای انتقال از یک سطح انرژی به سطح انرژی ، تغییرات انرژی برابر با رابطه زیر خواهد بود:
در رابطه بالا، ثابت چرخشی مولکول است.
حالات انرژی ارتعاشی
مولکولهای حقیقی، گویهایی سخت نیستند. در یک مولکول دواتمی، دو هسته نسبت به یکدیگر دارای ارتعاش هستند. در طیف سنجی مولکولی برای چنین سیستمی، اگر حرکت ارتعاشی به صورت هارمونیک باشد، انرژی ارتعاشی که با نشان میدهیم از رابطه زیر بدست میآید:
در رابطه بالا، عدد کوانتومی ارتعاشی و ثابت نیروی پیوند است. شرایط لازم برای مشاهده طیف ارتعاشی یک مولکول دو اتمی را وجود یک تغییر در ممان دو قطبی مولکول در حال ارتعاش ذکر میکنند. در نتیجه، مولکولهای جورهسته دواتمی در این حالت فعال نیستند.
حالات انرژی الکترونی
در طیف سنجی مولکولی روابط انرژی بین هسته و الکترونها در یک مولکول دواتمی، بسیار پیچیده و توصیف آن قدری دشوار است. یکی از روشهای معمول برای در نظر گرفتن حالات انرژی یک مولکول دو اتمی، کمک گرفتن از نظریه مولکولی در مورد اوربیتال خواهد بود. در این تعریف، توابع موج الکترونی یک اتم سازنده مولکول، که به اوربیتال اتمی موسوم هستند، متناسب با مکانیک کوانتومی و تقارن، با یکدیگر ترکیب میشوند تا دستهای از اوربیتالهای مولکولی را بسازند که دامنه آن نه تنها یک اتم، بلکه کل هسته مولکول را شامل میشود.
در نتیجه، حالت گذار مولکولی و به تبع آن طیف مولکولی را میتوان بر اساس انتقال الکترون بین دو اوربیتال مولکولی توصیف کرد.
حالات انرژی یک مولکول دو اتمی حقیقی
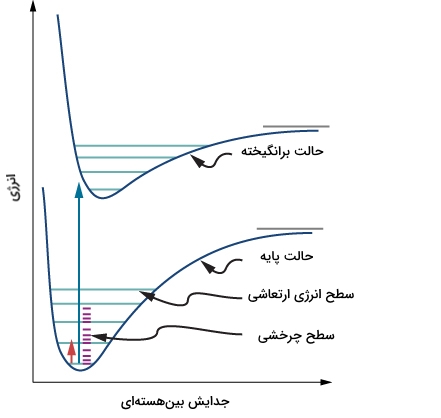
در هر مولکول حقیقی، حرکات مختلف مولکول به صورت جدا اتفاق نمیافتند چراکه مولکولها به طور همزمان تحت چرخش و ارتعاش قرار دارند. پیوندهای شیمیایی هیچکدام به حالت سخت و بدون ارتعاش نیستند و نوسان این پیوندها نیز همیشه حالت هارمونیک ندارد. همچنین، به هنگام بررسی مولکولها، هیچکدام چرخش، ارتعاش و انرژیهای الکترونی یکسانی ندارند اما این انرژیها در میان حالات انرژی در دسترس، بر اساس اصل «توزیع بولتسمان» (Boltzmann Distribution)، توزیع میشوند.
زمانی که یک مولکول تحت عمل ارتعاش قرار میگیرد، طول پیوند آن به اندازه متوسط جدایش بینهستهای (Internuclear Separation) نوسان میکند. اگر این نوسان، هارمونیک باشد، این مقدار متوسط با تغییر حالت ارتعاش مولکول عوض نخواهد شد اما برای یک مولکول حقیقی، این ارتعاشات هارمونیک نیست.
فیلم آموزش ویدیویی طیف سنجی مولکولی
آنچه که گفته شد، بررسی اجمالی از طیف سنجی مولکولی بود. این مبحث، یکی از ضروریترین دروس در رشته شیمی به شمار میآید. در همین راستا، فرادرس اقدام به انتشار دوره آموزش طیف سنجی مولکولی در قالب یک آموزش ۹ ساعته ویدیویی کرده است. سرفصلهای دوره آموزش ویدیویی طیف سنجی مولکولی عبارت هستند از:
- درس یکم: تابش الکترومغناطیس و برهمکنش آنها با اتمها و مولکولها
- عوامل پهنشدگی خطوط طیفی و روشهای حذف پهنشدگی
- درس دوم: طیف سنجی چرخشی
- درس سوم: طیف سنجی ارتعاشی
- درس چهارم: طیف سنجی الکترونی اتمها و مولکولها
درس طیف سنجی مولکولی نیازمند فهم دقیق مکانیک کوانتوم و شامل فرمولهای پیچیده ریاضی و محاسباتی است. در درس یکم این مجموعه، در خصوص تابش الکترومغناطیس و برهمکنش آنها با اتمها و مولکولها صحبت میشود و اگر دانشجویی در فهم مباحث پایه در کوانتوم و تابش الکترومغناطیس مشکلی داشته باشد، این مشکلات، به خوبی در این فصل برطرف خواهند شد. علاوه بر این، واژههای مهم در طیفسنجی مورد بررسی قرار میگیرند و مباحثی همچون پهنشدگی خطوط طیفی و لیزرها توضیح داده خواهند شد.
بعد از آشنایی با مباحث پایه در فصل اول، طیفسنجی چرخشی و ریزموج در فصل دوم مورد بحث قرار میگیرد. از مهمترین مباحث این فصل میتوان به قواعد انتخاب چرخشی، طبقهبندی مولکولها از نظر چرخشی، شدت جهش و طیف چرخشی رامان اشاره کرد. طیفسنجی ارتعاشی مولکولها یا طیفسنجی مادون قرمز در بخش سوم مورد بررسی قرار میگیرد که در ابتدا برای سیستم تکذرهای (جسم و فنر) و سپس در خصوص سیستمهای دوذرهای و مولکولهای چنداتمی بررسی میشود.
در فصل چهارم، به مباحث پیشرفته در طیفسنجی اتمها و مولکولها پرداخته خواهد شد که از آنجمله میتوان به حل معادله شرودینگر برای اتم هیدروژن و اتمهای چندالکترونی اشاره کرد. مباحثی همچون جفتشدن اندازهحرکت زاویهای و همچنین روشهای جفتشدن راسل-ساندرز و JJ نیز از جمله مباحث ارائه شده در این فصل است. در نهایت، نظریه اختلال به عنوان یک روش تقریبی در مکانیک کوانتوم مورد بررسی قرار میگیرد.
لازم به ذکر است که فهم دقیق طیف سنجی مولکولی خاصه برای کسانی که قصد شرکت در آزمون کارشناسی ارشد را دارند بسیار مهم است چراکه سوالات بسیاری از بحث طیفسنجی مطرح میشوند.
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای مهندسی شیمی
- مجموعه آموزشهای نرم افزارهای مهندسی شیمی
- آموزش آنالیز تابع موج (Wave Function) با نرم افزار Multiwfn
- کوانتوم — به زبان ساده
- دوگانگی موج و ذره — به زبان ساده
^^













سلام وقت شما بخیر باشه؛ ببخشید یه سوال: این درس سخته؟
بهنسبت شیمی کوانتوم چقدر سخته؟