سرطان چیست؟ – به زبان ساده
سرطان در اصل بیماری تقسیم کنترل نشده سلولها است. پیشرفت و گسترش آن معمولاً با یک سری تغییرات در فعالیت تنظیم کنندههای چرخه سلولی مرتبط است. به عنوان مثال، مهارکنندههای چرخه سلولی، هنگامی که شرایط مناسب نیست، از تقسیم سلولها جلوگیری میکنند، بنابراین فعالیت بسیار کم این مهارکنندهها میتواند باعث سرطان شود.
به همین ترتیب، تنظیم کنندههای مثبت تقسیم سلولی در صورت فعال بودن، میتوانند منجر به سرطان شوند. در بیشتر موارد، این تغییرات در فعالیت، به دلیل جهش در ژنهایی است که پروتئینهای تنظیم کننده چرخه سلولی را رمزگذاری میکنند.
در اینجا، ما به جزئیات بیشتری خواهیم پرداخت که چه تغییراتی در سلولهای سرطانی به وجود میآید. همچنین خواهیم دید که چگونه تنظیم کنندههای چرخه سلولی میتوانند به ایجاد سرطان کمک کنند.
چه اتفاقاتی در سلولهای سرطانی رخ میدهد؟
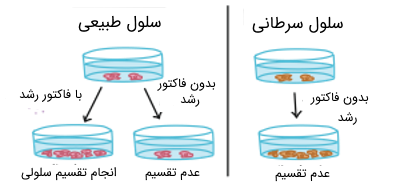
سلولهای سرطانی متفاوت از سلولهای طبیعی بدن رفتار میکنند. بسیاری از این تفاوتها مربوط به رفتار تقسیم سلولی در آنها است. به عنوان مثال، سلولهای سرطانی میتوانند در محیط کشت در آزمایشگاه بدون هیچ فاکتور رشد یا سیگنالهای پروتئینی محرک، رشد فزایندهای داشته باشند.
در حالی که سلولهای عادی برای رشد در محیط کشت نیاز به فاکتورهای رشد دارند. سلولهای سرطانی ممکن است فاکتورهای رشد را بتوانند خودشان ایجاد کنند و فرایندهایی برای افزایش فاکتور رشد داشته باشند. این سلولها میتواند هم در محیط کشت هم در محیط بدن این فاکتورها را تولید کنند و حتی سلولهای مجاور خود را نیز به تولید این فاکتورهای رشد، تحریک کنند.
سلولهای سرطانی همچنین سیگنالهایی را که باید باعث شود آنها تقسیم خود را متوقف کنند را نادیده میگیرند. به عنوان مثال، وقتی سلولهای عادی که در یک محیط کشت رشد میکنند، از هر طرف توسط سلولهای مجاور خود احاطه شدهاند، دیگر تقسیم نمیشوند (مهار تماسی). در مقابل، سلولهای سرطانی در لایههایی به شکل تودهای تقسیم میشوند و بر روی یکدیگر قرار میگیرند و مهار تماسی از رشد آنها جلوگیری نمیکند.
محیط موجود در یک محیط کشت با محیط موجود در بدن انسان متفاوت است، اما دانشمندان فکر میکنند که از بین رفتن مهار تماسی در سلولهای سرطانی رشده کرده در محیط کشت، نشان دهنده از بین رفتن مکانیسمی است که به طور معمول تعادل بافت را در بدن حفظ میکند.
یکی دیگر از ویژگیهای بارز سلولهای سرطانی «نامیرایی» آنها است. در واقع نامیرایی اصطلاحی مناسب برای این واقعیت است که آنها میتوانند چندین برابر بیشتر از یک سلول طبیعی بدن تقسیم سلولی انجام دهند. به طور کلی، سلولهای انسانی میتوانند قبل از، از دست رفتن ظرفیت تقسیم و پیر شدن، فقط حدود 40-60 دور چرخه تقسیم را طی کنند و در نهایت بمیرند.
سلولهای سرطانی میتوانند بارها و بارها بیشتر از سلولهای عادی تقسیم شوند، این امر تا حد زیادی به این دلیل است که آنزیمی به نام «تلومراز» (Telomerase) را بیان میکنند، که باعث از بین رفتن ساییدگی کروموزوم میشود؛ این امر به طور معمول در طی هر تقسیم سلولی اتفاق میافتد.
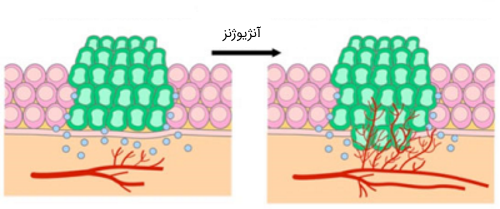
سلولهای سرطانی از جهات دیگری که مستقیماً مربوط به چرخه سلولی نیستند با سلولهای طبیعی تفاوت دارند. این تفاوتها به رشد، تقسیم و شکل گیری تومور کمک میکند. به عنوان مثال، سلولهای سرطانی توانایی مهاجرت به سایر قسمتهای بدن (فرآیندی متاستاز) و تولید و رشد رگهای خونی جدید را دارند. به فرایندی که طی آن سلولهای سرطانی قادر به تولید و رشد رگهای خونی یا به اصطلاح رگزایی میشوند، «آنژیوژنز» (angiogenesis) میگویند. آنژیوژنز فرایندی است که به منظور تامین منبع اکسیژن و مواد مغذی برای سلولهای توموری انجام میشود.
سلولهای سرطانی همچنین در شرایطی (مثلاً به دلیل آسیب DNA) که سلولهای طبیعی دچار مرگ برنامهریزی شده سلول یا آپوپتوز میشوند میتوانند زنده بمانند و فعالیت کنند. علاوه بر این، تحقیقات جدید نشان می دهد که سلولهای سرطانی ممکن است دچار تغییرات متابولیکی شوند که از افزایش رشد و تقسیم سلولی پشتیبانی میکند.
سرطان چگونه پیشرفت میکند؟
سلولها مکانیسمهای مختلف زیادی برای محدود کردن تقسیم سلولی، ترمیم آسیب DNA و جلوگیری از پیشرفت سرطان دارند. به همین دلیل تصور میشود که سرطان در یک فرآیند چند مرحلهای توسعه مییابد، که در آن مکانیسمهای مختلف باید از کار بیوفتند تا یک توده بزرگ از سلولها سرطانی ایجاد شوند. به طور خاص، بیشتر سرطانها زمانی به وجود میآیند که سلولها دچار یک سری جهش (تغییرات در DNA) شده که این جهشها باعث میشوند، سلولها سریعتر تقسیم سلولی انجام دهند، از کنترلهای داخلی و خارجی بر روی تقسیم فرار کنند و از مرگ برنامهریزی شده سلول جلوگیری به عمل آورند.
این روند چگونه ممکن است کار کند؟ در یک مثال فرضی، یک سلول ممکن است ابتدا فعالیت یکی از مهار کنندههای چرخه سلولی خود را از دست بدهد، این امر باعث شود سلولهای تولید شده از آن کمی سریعتر از حالت عادی تقسیم شوند. اما بعید به نظر میرسد که این سلولها سرطانی باشند. این سلولها در نهایت ممکن است که تبدیل به یک «تومور خوش خیم» (Benign Tumor) شوند که در واقع تودهای از سلولهایی به حساب میایند که قادر هستند بیش از حد تقسیم شوند، اما امکان حمله به بافتهای دیگر (متاستاز کردن) را ندارند.
با گذشت زمان، ممکن است یک جهش در یکی از سلولها از نسل جدید فرزندان سلول اولیه رخ دهد و باعث افزایش فعالیت یک تنظیم کننده چرخه سلولی شود. جهش ممکن است به خودی خود سرطان ایجاد نکند، اما فرزندان این سلول حتی سریعتر از حالت اولیه تقسیم میشوند و یک توده بزرگتر از توده سلولهای اولیه را ایجاد میکنند که در آن یک جهش سوم ایجاد میشود. سرانجام، ممکن است یک سلول جهش کافی داشته باشد تا خصوصیات سلول سرطانی را بدست آورد و «تومور بدخیم» (Malignant tumor) ایجاد کند. تومور بدخیم در واقع، گروهی از سلولها هستند که بیش از حد تقسیم میشوند و میتوانند به بافتهای دیگر حمله کنند.
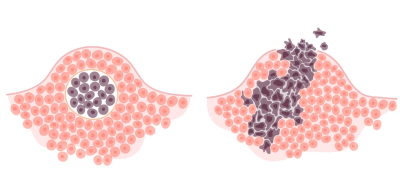
با گسترش تومور، سلولهای آن اغلب در هر مرحله تقسیم، جهشهای بیشتری در ژنهای خود بدست میآورند. سرطانهای مرحله پیشرفته ممکن است تغییرات عمدهای در ژنوم خود داشته باشند، از جمله این جهشها میتوان به جهشهای در مقیاس بزرگ مانند از بین رفتن یا دو برابر شدن تمام کروموزومها اشاره کرد.
این تغییرات چگونه بوجود میآیند؟ حداقل در برخی موارد، به نظر میرسد این تغییرات به دلیل جهش و غیر فعال کردن ژنهایی به وجود میآیند که باعث کنترل و ثابت نگه داشتن ژنوم میشوند (یعنی ژنهایی که مانع از بروز جهش یا انتقال آنها هستند). این ژنها، پروتئینهایی را رمزگذاری میکنند که آسیب DNA را تشخیص داده و آنها را ترمیم میکنند و مواد شیمیایی متصل شونده به DNA را از آن جدا نگه میدارند، سرهای تلومر را در انتهای کروموزومها حفظ میکنند و سایر نقشهای اصلی نگهدارنده را بر عهده دارند.
اگر یکی از این ژنها جهش یافته و غیر عملکردی باشد، جهشهای دیگر میتوانند به سرعت در پی هم ایجاد شوند. بنابراین، اگر یک سلول دچار چنین جهشهایی در ژنهای حفظ پایداری و عملکرد خود شود، سلولهای حاصل از تقسیم آن نیز ممکن است خیلی سریعتر از سلولهای طبیعی به میزان جهشهای مورد نیاز برای تبدیل شدن به یک توده سرطانی برسند.
تنظیم کنندههای چرخه سلولی و سرطان
انواع جهشهای مختلف باعث ایجاد انواع مختلفی از سرطان میشوند و هر تومور دارای مجموعهای منحصر به فرد از تغییرات ژنتیکی است. اما، به طور کلی، جهش دو نوع تنظیم کننده چرخه سلولی، ممکن است باعث پیشرفت و گسترش سرطان شوند:
- تنظیم کنندههای مثبت: زمانی که این تنظیم کننده بیش از حد فعال شوند، خاصیت سرطان زایی یا انکوژنیک (Oncogenic) پیدا می کنند.
- تنظیم کنندههای منفی: به این تنظیم کنندهها «سرکوبگرها تومور» (Tumor Suppressors) نیز میگویند و در زمان سرطان این تنظیم کنندهها غیر فعال میشوند.
عوامل ایجاد کننده سرطان یا سرطانزاها
تنظیم کنندههای مثبت چرخه سلولی ممکن است در سرطان بیش از حد فعال باشند. به عنوان مثال، یک گیرنده فاکتور رشد حتی اگر فاکتورهای رشدی وجود نداشته باشد، ممکن است سیگنالهایی برای رشد و تقسیم ارسال کند، یا یک پروتئین سیکلین (سیکلینها خانوادهای از پروتئینها هستند که در طول چرخه سلولی با فعال کردن آنزیمهایی، مرحله سنتز در چرخه سلولی را فعال می کنند) ممکن است در سطوح غیر طبیعی و بالا بیان شود.
اشکال بیش فعال (تحریک کننده سرطان) این ژنها انکوژن یا سرطانزا نامیده میشوند، در حالی که اشکال طبیعی آنها که هنوز جهش پیدا نکردهاند را «پیش-سرطانزا» (Proto-Oncogenes) میگویند. این سیستم نامگذاری نشانگر این است که پروتئین اولیه طبیعی پیش سرطانزا اگر به شکلی جهش یابد که فعالیت آن بیش از حد عادی افزایش یابد، میتواند به یک آنکوژن تبدیل شود.
جهشهایی که پروتئینهای پیش-سرطانزا را به سرطانزا تبدیل میکنند، میتوانند اشکال مختلفی داشته باشند. برخی از جهشها توالی اسیدآمینه پروتئین را تغییر میدهند، در نتیجه شکل پروتئین را تغییر میدهند و آن را در حالت «همیشه روشن» به دام میاندازند.
برخی از جهشها باعث افزایش در تعداد ژنها یا تقویت ژن (Amplification) میشوند، در این حالت سلولها کپیهای زیادی از یک ژن را به دست میآورند و در نتیجه تولید پروتئینهای حاصل از این ژن نیز بسیار افزایش مییابد. در موارد دیگر، یک خطا در ترمیم DNA ممکن است یک پیش-سرطانزا را به بخشی از یک ژن متفاوت متصل کند، و یک پروتئین ترکیبی را با فعالیت تنظیم نشده بسازد.
بسیاری از پروتئینهایی که سیگنالهای فاکتور رشد را منتقل میکنند، توسط پروتئینهای پیش-سرطانزا رمزگذاری میشوند. به طور معمول، این پروتئینها پیشرفت چرخه سلولی را فقط در صورت وجود فاکتورهای رشد هدایت میکنند. اگر یکی از پروتئینها به دلیل جهش، بیش از حد فعال شود، حتی اگر هیچ فاکتور رشدی وجود نداشته باشند، سیگنالهایی را برای رشد و تقسیم به سایر سلولها انتقال میدهد. در شکل زیر، گیرنده فاکتور رشد، پروتئین Ras و آنزیم سیگنالینگ Raf همه توسط پروتئینهای پیش - سرطانزا رمزگذاری شدهاند.
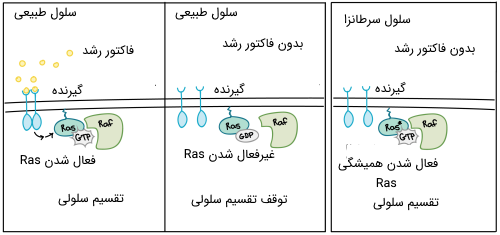
اشکال بیش فعال این پروتئینها اغلب در سلولهای سرطانی یافت میشوند. به عنوان مثال، جهشهای سرطانزای Ras در حدود 90٪ از مبتلایان به سرطانهای لوزالمعده مشاهده میشود. Ras یک پروتئین G است، به این معنی که بین یک فرم غیرفعال (که به مولکولهای کوچک GDP متصل میشود) و یک فرم فعال (که به مولکول بزرگتر GTP متصل است) تغییر میکند. جهشهای ایجاد کننده سرطان اغلب ساختار پروتئین Ras را تغییر میدهند به طوری که دیگر نمیتواند به فرم غیرفعال خود تغییر پیدا کند و یا این کار را بسیار آهسته میتواند انجام دهد و در واقع پروتئین در حالت فعال گیر میکند.
سرکوبگرهای تومور
تنظیم کنندههای منفی چرخه سلولی ممکن است در سلولهای سرطانی، کمتر فعال (یا حتی غیر عملکردی) باشند. به عنوان مثال، پروتئینی که پیشرفت چرخه سلولی را در پاسخ به آسیب DNA متوقف میکند ممکن است دیگر نتواند آسیب در DNA را تشخیص دهد یا باعث ایجاد پاسخ شود.
ژنهایی که به طور معمول پیشرفت چرخه سلولی را مسدود میکنند، به عنوان سرکوب کننده تومور شناخته میشوند. زمانی که سرکوب کنندههای تومور به درستی به فعالیت خود میپردازند، از ایجاد تومورهای سرطانی جلوگیری میکنند اما هنگامی که سلول در ژنهای کد کننده این تنظیم کنندهها دچار جهش شود، ممکن است این ژنها و پروتئینهای آنها به درستی کار نکرده و تومور ایجاد شود.
یکی از مهمترین سرکوب کنندههای تومور پروتئین تومور p53 است که نقش مهمی در پاسخ سلولی به آسیب DNA ایفا میکند. p53 در درجه اول در نقطه کنترلی G1 وارد عمل میشود. این پروتئین در نقطه کنترل G1 میتواند در پاسخ به آسیب در DNA و شرایط نامساعد، از پیشرفت چرخه سلولی جلوگیری کند و در همین مرحله چرخه سلولی را مسدود کرده و نگه دارد.
هنگامیکه DNA سلول آسیب میبیند، یک پروتئین حسگر میتواند p53 را فعال کند که این پروتئین چرخه سلولی را در نقطه کنترل G1 متوقف کرده و باعث تولید مهار کننده چرخه سلولی میشود. این مکث میتواند زمان لازم برای ترمیم DNA را تامین کند. این کار نیز وابسته به پروتئین p53 است، زیرا این پروتئین میتواند آنزیمهای ترمیم کننده DNA را فعال کند.
زمانی که سلول بتواند DNA خود را ترمیم کند، پروتئین p53 از سلول جدا شده و مراحل چرخه سلولی ادامه پیدا میکند و منجر به تقسیم سلولی میشود.
اگر ترمیم DNA به درستی انجام نشود، پروتئین p53 عملکرد سوم خود را انجام میدهد و سلول را وارد مرحله «آپتوزیس» (Apoptosis) یامرگ برنامهریزی شده سلولی میکند تا با از بین بردن سلول از انتقال DNA آسیب دیده به سلولهای جدید جلوگیری به عمل آورد.
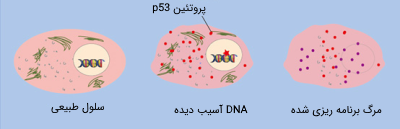
در سلولهای سرطانی، پروتئین p53 اغلب وجود ندارد یا عملکردی نداشته و یا فعالیتی بسیار کمتر از حد طبیعی دارد. به عنوان مثال، بسیاری از تومورهای سرطانی یک شکل جهش یافته از پروتئین p53 دارند که دیگر نمیتواند به DNA متصل شود. از آنجا که p53 با اتصال به ژنهای هدف و فعال کردن رونویسی آنها عمل میکند، بنابراین زمانی که نتواند به DNA متصل شود دیگر نمیتواند وظایف خود را انجام دهد.
هنگامیکه پروتئین p53 بدون عملکرد باشد، سلول حتی با DNA آسیب دیده ممکن است مراحل چرخه سلولی را تا تقسیم سلولی ادامه دهد. سلولهای حاصل از چنین تقسیمهای سلولی به احتمال زیاد به دلیل دریافت DNA ترمیم نشده از سلول مادر دچار جهش در ژنوم خود هستند.
با گذشت نسلها و تقسیمهای سلولی متوالی، سلولهای دارای p53 معیوب، میتوانند جهشهایی را در DNA خود انباشته کنند که برخی از آنها ممکن است پروتئینهای پروتوانکوژن را به انکوژنها تبدیل کرده و یا سایر سرکوب کنندههای تومور را غیرفعال کنند.
p53 ژن جهش یافته متداول در سرطانهای انسانی است. سلولهای سرطانی که در ژن پروتئین p53 خود جهش نداشته باشند، احتمالا پروتئین p53 آنها طی مکانیسمهای دیگری غیر فعال شده است، به عنوان مثال، ممکن است در این سرطانها پروتئینهای تجزیه کننده p53 بیش از حد فعال شوند و با سرعت بیشتری آنها را تجزیه کنند.
اگر مطلب بالا برای شما مفید بود، آموزشهای زیر به شما پیشنهاد می شود:
- مجموعه آموزشهای علوم پزشکی
- آموزش زیستشناسی سلولی
- مجموعه آموزشهای زیستشناسی
- با انواع پروتئین آشنا شوید
- پلاکت چیست؟ -- به زبان ساده
- سیستم ایمنی بدن -- از صفر تا صد
^^












سلام چگونه می شه با ایشون در ارتباط بود برای اینکه من رو در زمینه نانو راهنمایی کنند؟ من دانشجوی ارشد فیزیک هستم
خیلی خوب نوشته شده بود. قابل فهم و جذاب?