تقطیر و هر آنچه باید درباره آن بدانید – مفهوم، انواع و کاربردها
«تقطیر» (Distillation) روشی است برای جداسازی مواد شیمیایی که بر پایهی تفاوت در «فراریت» (volatility) آنها انجام میشود. این فرایند عموما بخشی از یک فرایند شیمیایی در واحدهای صنعتی است. چنین روشی در دستهی «عملیات واحد» (unit operation) قرار میگیرد.


از تقطیر برای رسیدن به اهداف مختلفی استفاده میشود. برای نمونه میتوان به جداسازی آب شیرین از آبنمک اشاره کرد. هوا همچنین طی این فرایند میتواند به بخشهای مجزایی مانند اکسیژن و هلیوم تقریبا خالص تبدیل شود. اکسیژن در فرایندهای پزشکی و هلیوم در بادکنکهای شادی مورد استفاده قرار میگیرد (البته این یکی از استفادههای آن است). تقطیر نفت خام منجر به تولید محصولات مناسبی برای حوزهی حملونقل، تولید برق و گرمایش میشود. برای بالا بردن درصد خلوص الکل جهت کاربردهای پزشکی نیز از تقطیر استفاده میگردد.
بهتر است در این بخش کمی در مورد فراریت توضیح دهیم. فراریت به تمایل یک ماده برای تبدیل شدن به فاز بخار گفته میشود که رابطه مستقیمی با فشار بخار ماده دارد. هر قدر فشار بخار ماده در دمای مشخص بالاتر باشد، تمایل آن ماده برای تبدیل شدن به بخار و در نتیجه فراریت ماده بالاتر است. فراریت رابطهی معکوسی با دمای جوش دارد. یعنی هرچه ماده فرارتر باشد، در دمای پایینتری به جوش میآید. برای مثال بنزین از آب فرارتر است.
پیشینه
تقطیر به شیوهی امروزی با اختراع «انبیق» (alembic) توسط دانشمند مسلمان «جابر بن حیان» - ۸۰۰ سال پس از میلاد - به دنیا آمد. این دانشمند البته اختراعات مختلفی در زمینهی شیمی دارد که هنوز مورد استفاده قرار میگیرند. برای مثال استفاده از بالن آزمایشگاهی به همراه تجهیزات دیگر برای تقطیر، نوع تکامل یافتهی انبیق است. تصویر یک انبیق را در شکل زیر مشاهده میکنید.

بعد از دورهی «کیمیاگری» (alchemy) و شروع علم شیمی، از «قرع» (retort) برای تقطیر استفاده شد. انبیق و قرع هر دو ظروفی شیشهای با گردن دراز و متمایل به یک سو هستند که به عنوان «چگالنده» (condenser) برای میعان مقطر، مورد استفاده قرار میگیرند. انتهای خروجی هر دو ظرف برای جمعآوری مقطر رو به پایین است. تصویر یک قرع را در شکل زیر مشاهده میکنید.

پیشنهاد میکنیم برای درک بهتر دو فرآیند تقطیر و میعان و تفاوت آنها مطلب فرق تقطیر و میعان را مطالعه کنید.
کاربرد تقطیر
کاربردهای این فرایند به چهار دستهی مقیاس آزمایشگاهی، تقطیر صنعتی، تقطیر برای به دست آوردن داروها و عطریات و در نهایت صنایع غذایی تقسیم میگردد. البته دو دستهی آخر با دو دستهی اول از این جهت متفاوت هستند که در این گروه، تقطیر برای خالصسازی انجام نمیپذیرد. بلکه این فرایند با هدف به دست آوردن محصول مقطر نهایی انجام میگردد.
تفاوت اصلی مقیاس صنعتی و آزمایشگاهی این است که در مقیاس آزمایشگاهی، فرایند مورد نظر به صورت «ناپیوسته» (batch-wise) انجام میشود؛ در حالی که در گروه صنعتی، عموما فرایند به صورت «پیوسته» (continuously) است.
در فرایند ناپیوسته، ترکیب مادهی اصلی، بخارات حاصل و مقطر به دست آمده در طول عملیات و به نسبت زمان متغیر است. در این نوع عملیات، ابتدا مقداری ماده شیمیایی وارد دستگاه میشود. تقطیر شروع و هر کدام از مواد به نسبت فراریت خود از محلول جدا میشود. ماده با فراریت بالا در مراحل اولیه و ماده با فراریت پایین در مراحل نهایی جدا میگردند. بعد از اتمام عملیات به صورت کامل، دوباره محلول جدید وارد میشود. یک دستگاه تقطیر ناپیوسته در شکل زیر با جزئیات نشان داده شده است.
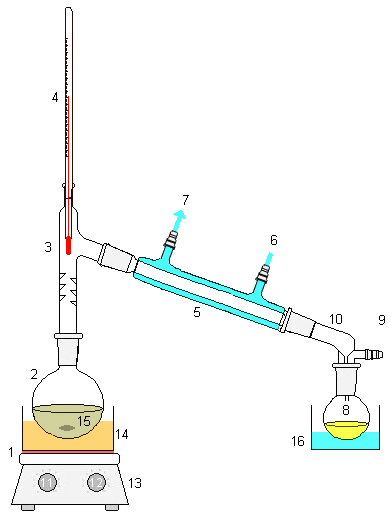
| ۱. منبع گرما | ۲. ظرف محلول | ۳. درپوش | ۴. دماسنج |
| ۵. چگالنده | ۶. ورود آب خنک کننده | ۷. خروج آب خنک کننده | ۸. ظرف دریافت مقطر |
| ۹. ورودی گاز | ۱۰. دریافتکننده | ۱۱. کنترل گرما | ۱۲. تنظیم سرعت هم زن |
| ۱۳. همزن | ۱۴. حمام آب گرم | ۱۵. دانههای همزن | ۱۶. حمام آب سرد |
برای نمونه گلابگیری به این روش انجام میشود. محلولی شامل آب و گل معطر وارد یک دیگ میگردد. مادهی شیمیایی تشکیل دهندهی بوی خوش به علت فراریت بیشتر، سهم بیشتری از بخار در شروع فرایند را دارد. به همین دلیل بخار میعان شده در ابتدای فرایند، درصد خلوص بالاتری از خود نشان میدهد. چنین فرایندی برای خالصسازی الکل نیز صادق است. الکل نسبت به آب فرارتر است.
حال در فرایند پیوسته، سعی میشود ترکیب مادهی اصلی، بخارات حاصل و برشهای تقطیر ثابت نگاه داشته شود. به طور مداوم محلول خوراک وارد «برج تقطیر» (distillation column) میشود و محصولات خارج میگردند.
مدل تقطیر ایدهآل
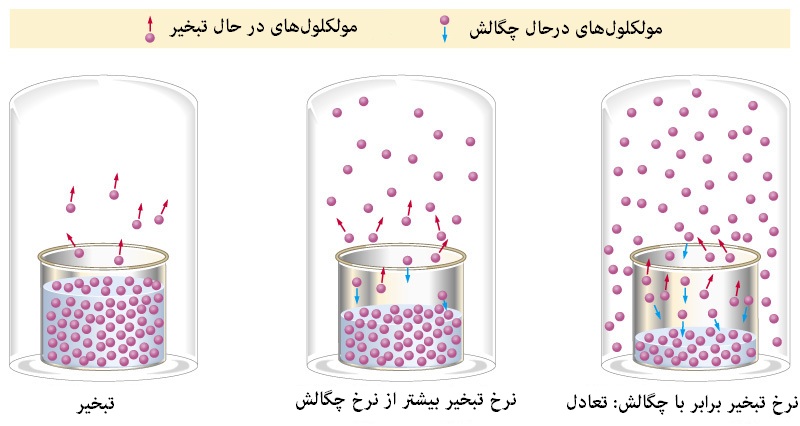
این که تصور کنیم هر جزء از محلول در دمای جوش مخصوص به خود میجوشد، ما را به خطا میاندازد. چرا که در یک محلول، در هر دمایی تمام اجزاء تبخیر میشوند. اما در دماهای پایینتر، جزء با فراریت بیشتر، سهم بیشتری از تبخیر به خود اختصاص میدهد. به همین دلیل است که با این فرایند امکان جداسازی خالص هر کدام از اجزاء وجود ندارد. با این حال مدل تقطیر ایدهآل از «قانون رائولت» (Raoult's law) و «قانون دالتون» (Dalton's law) پیروی میکند.
قانون رائولت میگوید درصد حضور یک جزء در بخار حاصل از یک محلول برابر است با ترکیب درصد آن در فاز مایع ضرب در «فشار بخار» (vapor pressure) آن زمانی که ماده خالص است. به سهمی از فشار کل در بالای سطح مایع که توسط مولکولهای بخار مایع تأمین میگردد، فشار بخار مایع گفته میشود. برای مایعی معین، هر چه دما بالاتر باشد، فشار بخار مایع بیشتر خواهد بود. توجه کنید اگر فشار بخار جزئی از محلول تحت تاثیر جزء دیگر تغییر کند یا فراریت آن وابسته به درصد حضور آن در محلول باشد، این قانون دیگر صادق نیست.
قانون دالتون میگوید کل فشار بخار محلول با جمع فشار بخار تکتک اعضا در دمای مشخص برابر است. هنگامی که یک سیستم چندجزیی را گرم میکنیم، فشار بخار هر جزء بالا میرود که منجر به افزایش فشار بخار کل محلول میگردد. هنگامی که فشار بخار به فشار محیط برسد، محلول به جوش میآید و مولکولها شروع به کندن از فاز مایع و پیوستن به فاز بخار میکنند. دقت کنید که در این حالت جزء فرارتر، سهم بیشتری از فاز بخار را از خود میکند و درصد آن در فاز مایع با سرعت بیشتری کم میگردد.
چنین مدلی عموما برای مواد مشابه از نظر شیمیایی مانند «بنزن» (benzene) و «تولوئن» (toluene) صادق است. در موارد دیگر میزانی از انحراف از قانون رائولت و دالتون مشاهده میشود. مثال معروف این دسته از مواد، ترکیب اتانول و آب است. این ترکیب هنگام گرم شدن «آزئوتروپ» (azeotrope) میسازد. آزئوتروپ محلولی است که دمای جوش ترکیب آن از دمای جوش هر کدام از اجزاء به صورت مجزا پایینتر است. به همین دلیل در این نقطه، تبخیر یا جوشش منجر به تغییر نسبت درصد هیچ کدام از اجزا نمیگردد.
يک آزئوتروپ مخلوطي از 2 يا چند مايع با ترکيب درصد معين است که تقطير معمولي هيچ تاثيري روي آن ندارد. اين بدان معنا است که وقتي يک آزئوتروپ را تبخير میکنیم ترکيب درصد مواد تشکيل دهندهی آن در فاز بخار و مايع هيچ فرقي با هم ندارند. با این که میتوان از مدلهای محاسباتی برای تعیین این نقاط استفاده کرد، آزمایشهای تجربی نتایج بهتری را به دست میدهند.
تقطیر ناپیوسته
برای این کار باید ظرفی حاوی دو مادهی فرار «آ» و «ب» را گرم کنیم. فرض میکنیم مادهی آ فرارتر از مادهی ب است به این معنا که نقطهی جوش پایینتری دارد. هنگامی که محلول به جوش میآید، ترکیب درصد بخار به وجود آمده متفاوت از ترکیب درصد محلول است. مطابق قانون رائولت، ترکیب درصد جزء فرارتر در بخار بیشتر از جزء دیگر است. در این مرحله بخار از یک چگالنده عبور میکند و میعان میشود. دقت کنید به دلیل تبخیر بیشتر جزء آ، ترکیب درصد آن در محلول مایع به تدریج کمتر میشود.
به همین ترتیب ترکیب درصد جزء ب به تدریج شروع به افزایش میکند. به همین دلیل نقطهی جوش محلول باقیمانده بالا میرود. با ادامهی فرایند، به دلیل کم شدن جزء فرارتر در محلول و بالاتر رفتن دمای سیستم، ترکیب درصد جزء ب نیز در بخار افزایش مییابد. به همین دلیل اولین بخارات حاصله، حاوی بزرگترین ترکیب درصد از جزء فرارتر است.
اگر فشار بخار این دو جزء با یکدیگر تفاوت زیادی داشته باشد، بخارات اولیه ممکن است تا حد زیادی تنها از جزء آ تشکیل گردند. با خروج بخار از سیستم، کمکم بخارات، حاوی میزان بیشتری از جزء ب خواهند بود.
تقطیر پیوسته
در این فرایند، به طور پیوسته از هرکدام از دو ماده به اندازهای به سیستم تزریق میشود تا همیشه ترکیب درصدها، دماها و دیگر عوامل عملیاتی ثابت بماند. به همین منوال میزان بخارات و محلول خارج شده همیشه ثابت نگاه داشته میشود. یعنی در این عملیات دو خروجی با ترکیب درصد یکسان، یکی غنی از جزء آ و یکی غنی از جزء ب خواهیم داشت. عموما در صنایع پالایشگاهی از فرایندهای پیوسته استفاده میگردد.
توسعهی فناوری تقطیر
هر دو فرایند پیوسته و ناپیوسته را میتوان با استفاده از یک «ستون جداسازی» (fractionating column) روی ظرف تبخیر، بهبود بخشید. این ستون با افزایش سطح تماس بین فاز بخار و مایع به تقطیر کمک میکند. طی زمان تماس، این دو فاز در تعادل با یکدیگر قرار میگیرند. چنین ستونی غالبا شامل تعدادی «سینی» (tray) است. هر کدام از این سینیها نیز در یک دما و فشار خاص، شامل یک محلول در حال تبخیر و در تعادل با فاز بخار هستند. گرچه تفاوتهایی بین ستونهای تقطیر آزمایشگاهی و صنعتی وجود دارد اما اساس کار آنها مشابه است.
روشهای تقطیر
در ادامه به مرور انواع روشهای تقطیر پرداختهایم و مواردی مانند «تقطیر ساده»، «تقطیر جز به جز»، «تقطیر با بخار»، «تقطیر در خلا» و... را توضیح دادهایم.
مقیاس آزمایشگاهی
در این مقیاس در اکثر موارد از روش غیرپیوسته استفاده میگردد. دستگاه تقطیر آزمایشگاهی شامل یک «تبخیر کننده» (re-boiler)، یک چگالنده و یک ظرف جمعآوری محصول مقطر است. محلول خوراک در تبخیر کننده گرم میشود، بخار در چگالنده میعان و در نهایت محصول مورد نظر در ظرف جمعآوری میگردد. البته روشهای مختلفی برای تقطیر در این مقیاس وجود دارد.
تقطیر ساده
در تقطیر ساده تمام بخار تولید شده مستقیما وارد چگالنده میشود و چگالنده آن را به صورت کامل میعان میکند. به همین دلیل محصول مقطر خالص نیست و ترکیب درصد آن دقیقا برابر با بخار تولیدی است. این ترکیب درصد البته با قانون رائولت قابل محاسبه است.
از این رو از این روش تنها برای جداسازی موادی استفاده میگردد که تفاوت زیادی در میزان فراریت یا نقطهی جوش (حداقل ۲۵ درجهی سانتیگراد) داشته باشند. از کاربردهای دیگر این روش به جداسازی مایعات از نفت یا مواد جامد میتوان اشاره کرد. به دلیل تفاوت زیاد فراریت، عموما محصول به دست آمده از جزء فرار غنی است.
تقطیر جزء به جزء
در بسیاری از موارد، نقطهی جوش اجزاء یک محلول بسیار به یکدیگر نزدیک و تقریبا تابع قانون رائولت است. در چنین مواردی باید از «تقطیر جزء به جزء» (fractional distillation) استفاده کرد. در این روش تقطیر ساده به دفعات انجام میشود. این فرایند در یک ستون تقطیر صورت میپذیرد و هر کدام از سینیها نمایندهی یک مرحلهی تقطیر ساده است؛ به این معنا که در مراحل مختلف، عمل تبخیر و چگالش تا رسیدن به محصول مورد نظر انجام میگیرد.
هنگامی که محلول گرم میشود، بخار شروع به بالا رفتن از ستون تقطیر مینماید. در همین حین در هر کدام از سینیها روی قسمت «پرشده» (packing) میعان میشود و به پایین میآید. حال این میعان با بخار در حال بالا آمدن تماس پیدا میکند و دوباره قسمتی از آن تبخیر میگردد. در همین حین نیز باعث میعان بخشی از بخار میشود.
حال تصور کنید که بخار مرحلهی اول از جزء آ غنیتر شده است. این بخار را میعان میکنیم و دوباره عمل تبخیر را انجام میدهیم. بخار در مرحلهی دوم باز هم غنیتر میگردد. با تکرار این مراحل، در مراحل نهایی میتوان ترکیب درصد تقریبا خالصی را به دست آورد. هرچه این مراحل افزایش یابد، جداسازی بهتر صورت میگیرد.
تقطیر با بخار
این روش برای محلولهایی که به گرما حساساند به کار گرفته میشود. این مواد مانند ترکیبات «آروماتیک» (aromatic) ممکن است در تماس با حرارت بالا تخریب یا تجزیه گردند. در «تقطیر با بخار» (steam distillation) از حبابهای بخار برای حمل بخشی از محلول استفاده میگردد. این مواد همراه با بخار وارد چگالنده میشوند. از آنجا که ترکیبات آروماتیک در آب حل نمیشوند، بعد از میعان از آب به صورت یک لایهی مجزا جدا میگردند.
بدون استفاده از این روش باید ترکیبات آروماتیک را تا دمای بسیار بالاتری جوشاند که منجر به تخریب آنها میشود. با این حال با اختراع روش «تقطیر در خلأ» (Vacuum distillation) این مشکل تا حد زیادی حل شده است.
تقطیر در خلأ

برخی از ترکیبات شیمیایی دمای جوش بسیار بالایی دارند. با کاهش فشار میتوان دمای جوش را پایین آورد. چرا که در دماهای بالا امکان تخریب این مواد وجود دارد. یا این که از نظر عملیاتی دسترسی به دماهای بسیار بالا بسیار هزینهبر و مشکل است. هنگامی که فشار پایین میآید و به فشار بخار محلول در دمای پایین میرسد، تبخیر شروع میشود. برای درک بهتر در نظر بگیرید که آب در نقاطی با ارتفاع بیشتر و فشار کمتر، زودتر یا در دماهای پایینتری به جوش میآید. از این روش در تقطیر برشهای سنگین نفت خام استفاده میگردد.
تقطیر آزوئوتروپیک
در برخی از شرایط، ترکیب مواد با یکدیگر خواص آنها را از یک محلول ایدهآل دور میکند. در این حالت قانون رائولت دیگر صادق نیست. همانطور که اشاره شد در صورت ایجاد محلول آزئوتروپ، ترکیب بدون تغییر در ترکیب درصد میجوشد و تبخیر میشود. برای نمونه «اتیل الکل» (ethyl alcohol) و آب در دمای ۷۸.۲ درجه سانتیگراد یک آزئوتروپ ۹۵ درصد را تشکیل میدهند.
حال اگر نیاز به خلوص بیشتری از الکل داشته باشیم، فنونی برای شکستن این ترکیب وجود دارد. به این روشها تقطیر آزئوتروپیک گفته میشود. اساس برخی از این روشها پرش از نقطهی آزئوتروپ با وارد کردن یک مادهی سوم یا تغییر فشار است. همچنین میتوان با روشهای دیگر شیمیایی و فیزیکی، ناخالصی را جدا کرد.
برای نمونه به منظور خالصسازی بیشتر اتانول (رسیدن به خلوص بالای ۹۵ درصد)، میتوان از «عوامل خشک کننده» (drying agent) مانند «پتاسیم کربنات» (potassium carbonate) برای آبگیری بهره برد.
تقطیر واکنشی
در این روش از رآکتور به عنوان تبخیر کننده استفاده میگردد. در «تقطیر واکنشی» (reactive distillation)، دمای جوش محصول واکنش از دمای جوش واکنش دهندهها بسیار پایینتر است. هنگامی که واکنش در دمایی انجام میشود که واکنش دهندهها هنوز در فاز مایع قرار دارند و محصول تولید میشود، این محصول شروع به تبخیر میکند. بخار حاصله مانند تقطیر ساده با ورود به چگالنده، میعان و جدا میگردد.
تقطیر تخریبی
این تکنیک شامل گرمایش شدید مواد جامد (عموما مواد آلی) در غیاب اکسیژن (با هدف ممانعت از سوختن) است. در «تقطیر تخریبی» (Destructive distillation) با گرمایش شدید، مواد با نقطهی جوش بالا به صورت گاز متصاعد و سپس میعان میشوند. دلیل شناخته شدن متانول به عنوان الکل چوب، حرارتدهی زیاد به چوب و استحصال آن است.
تبخیر ناگهانی
«تبخیر ناگهانی» (Flash evaporation) نوعی روش تقطیر است که طی آن مخلوط مایع با عبور از یک شیر فشارشکن به داخل یک محفظه پاشیده میشود. در طی این فرایند، جزء فرارتر به صورت بخار در میآيد و از بالای برج خارج میشود. جزء سنگینتر به صورت مایع از پایین برج خارج میشود. فرایند یاد شده تک مرحلهای است و میتواند به صورت پیوسته یا ناپیوسته انجام شود.
تقطیر صنعتی
این دسته از عملیات واحد در مهندسی شیمی شامل تقطیر جزئی، در خلأ، آزئوتروپیک و ... هم به صورت پیوسته و هم به صورت ناپیوسته است. البته بیشترین کاربرد تقطیر حزء به جزء پیوسته در پالایشگاهها، صنایع شیمیایی و پتروشیمیها دیده میشود.
تقطیر صنعتی عموما در ستونهای بزرگ عمودی با نام «برج تقطیر» (distillation towers) صورت میگیرد. قطر این تجهیزات به بیش از شش متر و طول آنها به بیش از ۶۰ متر نیز میرسد. هنگامی که خوراک فرایند، مانند نفت شامل ترکیبات گوناگونی باشد، با خارج کردن بخشی از محصول از قسمتهای مختلف برج میتوان به محصولی با ترکیب مورد نظر دست پیدا کرد. به هر کدام از این محصولات یک «برش» (cut) میگویند.
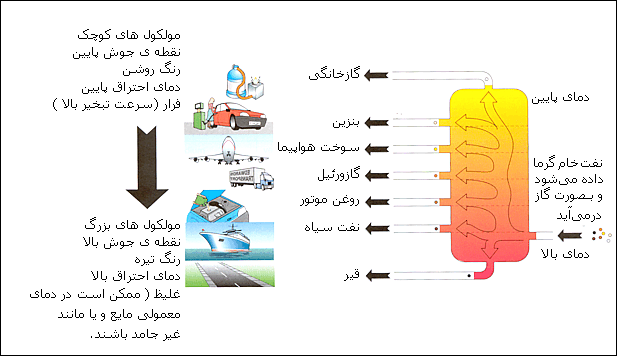
سبکترین محصولات، یا موادی با نقطهجوش پایین، از بالای برج خارج میشوند و سنگینترین آنها که بالاترین نقطهی جوش را دارند، از پایین برج به دست میآیند.
در چنین فرایندی از «جریان بازگشتی» (Reflux) در بالای برج برای پیشرفت در جداسازی استفاده میگردد. این جریان بخشی از جریان خروجی بالای برج است که پس از میعان به داخل ستون باز میگردد. جریان بازگشتی با ورود به برج شروع به خنک و میعان کردن بخار در حال بالا رفتن میکند و در نتیجه بازده تقطیر افزایش مییابد. هرچه در تعداد سینی ثابت، میزان این جریان افزایش یابد، بازده نیز بیشتر میگردد.
از چنین فناوری در جداسازی هوا برای تولید اکسیژن مایع، نیتروژن مایع و آرگون بسیار خالص استفاده میگردد. به ترکیب مایع شده این اجزا، هوای مایع گفته میشود. با تقطیر «کلروسیلانها» (chlorosilanes) میتوان سیلیکون خالص را برای استفاده در مواد «شبه رسانا» (semiconductor) استخراج کرد.
طراحی و بهرهبرداری از یک برج به ترکیب خوراک و محصول مورد نیاز بستگی دارد. برای ترکیبات دوتایی و ساده میتوان از روشهای «مککیب - تیل» (McCabe-Thiele) یا «معادلهی فنسک» (Fenske) استفاده کرد. البته روشهای شبیهسازی پیچیده برای ترکیبات چندجزیی مورد استفاده قرار میگیرد. دقت کنید که در مدلسازیها همیشه هر مرحله را یک تعادل کامل بین فاز مایع و گاز در نظر میگیرند. به همین دلیل همیشه در واقعیت تعداد سینیها بیشتر از تعداد مورد محاسبه در مدلسازی است.
البته گاهی در برجها به جای سینی از قسمتهای پرشده (مانند پوشال در کولر) استفاده میشود که البته انواع مختلفی دارد. یکی از دلایل استفاده از این ابزار، نیاز به کاهش افت فشار در طول برج است؛ برای مثال در فرایند تقطیر در خلأ چنین نیازی وجود دارد. فاز مایع سطح مواد پرکننده را خیس میکند و بخار از کنار سطوح خیس عبور مینماید. در همین تماس «انتقال جرم» (mass transfer) مطلوب صورت میگیرد. نوعی از مواد پرکننده را در شکل زیر مشاهده میکنید.

اگر مطلب بالا برای شما مفید بوده است، احتمالاً آموزشها و مقالاتی که در ادامه آمده نیز برایتان کاربردی خواهند بود.
- آموزش مقدمه ای بر مهندسی زیست سوخت ها
- مجموعه آموزشهای مهندسی مکانیک
- مجموعه آموزشهای مهندسی شیمی
- آشنایی با برج خنک کننده و انواع آن -- از صفر تا صد
- اعداد اکتان و ستان چه تفاوتی با یکدیگر دارند؟ --- به زبان ساده
- معرفی بیوانرژی و کاربردهای آن -- به زبان ساده
- بنزین و گازوئیل چه تفاوتهایی دارند؟ --- به زبان ساده
- نیروگاههای برقآبی چگونه کار میکنند؟
^^












واقعا مطالب عالی و جدید بودند، سپاس فراوان از شما
خیلی عالی و خیلی ممنونم🙏
با سلام و تشکر از اطلاعاتی که دادید.دستگاه جهت روغن و اسانس گیری از گیاه رو کجا میشه تهیه کرد
خیلی خیلی عالی بود