اپی ژنتیک چیست؟ – به زبان ساده
در گذشته تصور بر این بود که تنها ژنوم است که به ارث میرسد یا فنوتیپ افراد را تعیین میکند. اما امروزه میدانیم که محیط بر چگونگی بروز ژنها اثر میگذارد و ممکن است از طریق سلولهای زایا به گامت و نهایتا فرزندان نیز منتقل شود. به اثر محیط بر ژن طوری که بر نحوه بیان آن اثر بگذارد اپی ژنتیک میگوییم. در این مطلب به تعریف این علم و انواع مکانیسمهای مؤثر بر اپی ژنتیک پرداختهایم.


اپی ژنتیک چیست؟
در زیستشناسی، «اپی ژنتیک» (Epigenetics) مطالعه تغییرات فنوتیپ وراثتی است که هیچ تغییری در توالی DNA ایجاد نمیکند. پیشوند یونانی epi - در اپی ژنتیک بیانگر ویژگیهایی است که در بالای یا علاوه بر مبنای ژنتیک سنتی باعث ایجاد تغییرات فوتیپی میشوند. اپی ژنتیک شامل تغییراتی است که بر فعالیت و بیان ژن تأثیر میگذارند اما این اصطلاح را میتوان برای توصیف هرگونه تغییر فنوتیپی وراثتی نیز به کار برد. چنین تأثیراتی بر فنوتیپ سلول و فیزیولوژی ممکن است در اثر عوامل خارجی یا محیطی ایجاد شوند یا بخشی از رشد طبیعی ارگانیسم باشند.
یک نمونه از تغییرات اپی ژنتیکی، روند تمایز سلولی است. طی مورفوژنز، سلولهای بنیادی همه توان به انواع مختلف سلولهای جنینی تبدیل میشوند که به نوبه خود به سلولهای کاملاً متمایز تبدیل خواهند شد. به عبارت دیگر، در حالی که یک سلول تخمک بارور شده (زیگوت) همچنان تقسیم میشود، سلولهای دختر حاصل به انواع مختلف سلول در ارگانیسم از جمله سلولهای عصبی، سلولهای بافت عضلانی، اپیتلیوم، اندوتلیوم رگهای خونی و سایر بافتها تغییر مییابند، فعال کردن برخی از ژنها در حالی که بیان دیگر ژنها را مهار میکند.

تفاوت ژنوتیپ و فنوتیپ چیست؟
فنوتیپ اصطلاحی است که در ژنتیک برای اشاره به تمام صفات قابل مشاهده در موجودات در نتیجه تعامل ژنوتیپ با محیط مورد استفاده قرار میگیرد. اصطلاح فنو در کلمه فنوتیپ، به مشاهده اشاره دارد و بنابراین فنوتیپ برای نشان دادن مشخصات قابل مشاهده در ارگانیسمها مانند قد و رنگ آنها استفاده میشود.
فنوتیپ یک ارگانیسم، مورفولوژی، شکل و ساختار فیزیکی ارگانیسم، رشد، رفتار، ویژگیهای بیولوژیکی و فیزیولوژیکی و حتی محصولات ارگانیسم را پوشش میدهد. بنابراین، از فنوتیپ برای تشخیص تفاوت توالی DNA بین افراد برای تفاوت در صفاتی مانند قد استفاده میشود.
فنوتیپ موجود زنده به دو عامل وابسته است:
- بیان ژنوم یا ژنوتیپ
- تعامل ژنوم با عوامل محیطی
هر دو عامل ممکن است برای ایجاد فنوتیپ موجود زنده عمل کنند. تنوع در فنوتیپ حتی در یک فرد به دلیل تغییرات محیطی، فیزیولوژیکی و ریختشناسی مرتبط با سن مشاهده میشود. تنوع در فنوتیپ اساس انتخاب طبیعی را در مواردی ایجاد می کند که محیط از بقای افراد متناسبتر نسبت به دیگران برخوردار باشد. این پدیده در مورد دوقلوها به وضوح دیده میشود که با ژنوتیپ یکسان فنوتیپهای مختلفی را بیان کنند.
بنابراین، بدون تنوع فنوتیپ، تکامل با انتخاب طبیعی امکانپذیر نبود. مفهوم تنوع در فنوتیپ ممکن است در زیر ترکیب ژنتیکی فرد عمل کند مانند جهشهای خاموش که توالی اسیدهای آمینه را تغییر نمیدهند اما فراوانی جفت بازهای گوانین - سیتوزین را دستخوش تغییرات میکنند که باعث افزایش پایداری حرارتی DNA میشود و به ارگانیسم امکان میدهد در محیطهای با درجه حرارت بالا زندگی کند. نمونههایی از فنوتیپها که در ارگانیسمهای مختلف دیده میشوند شامل گروه خونی، رنگ چشم، بافت مو و بیماریهای ژنتیکی در انسان هستند.
ژنوتیپ اصطلاحی است که در ژنتیک به کار میرود و به معنای محتوای ژنوم است. اصطلاح ژنوتیپ همچنین به دو آلل منتقل شده برای یک ژن خاص گفته میشود. ژنوتیپ را با حروف الفبا مانند Bb نشان میدهند که B مخفف آلل غالب و b مخفف آلل مغلوب هستند. خصوصیات فیزیکی یک فرد یعنی فنوتیپ، نتیجه بیان این ژنها است. با این حال، ژنوتیپ تنها عامل تفاوت در فنوتیپ نیست و فنوتیپ تحت تأثیر عوامل دیگری مانند اپی ژنتیک ارثی و محیطی نیز هست.
ژنوتیپ تحت تأثیر عوامل مختلفی مانند انواع جهش قرار میگیرد که فراوانی جفت بازها یا توالی نوکلئوتیدها را در DNA تغییر میدهند. با این حال، ژنهایی که به دلیل جهش در ژنوم سلولهای سوماتیک و نه سلولهای جنسی ایجاد شده باشند، به عنوان ژنوتیپ فرد در نظر گرفته نمیشوند چون از طریق گامت به ارث نمیرسند. بیان ژنوتیپ به ترکیب آن بستگی دارد. در حضور یک آلل غالب، قطعاً فرزندان بدون در نظر گرفتن آلل دیگر، صفات مربوط به آلل غالب را به ارث میبرند.
ژنوتیپ به جز جهشهای وراثتی کاملاً به توالی ژن بستگی دارد. بنابراین ژنوتیپ در طول زندگی یک فرد ثابت میماند مگر اینکه تحت تأثیر جهشها باشد. تغییرات فنوتیپی هیچ تغییری در ژنوتیپ فرد ایجاد نمیکنند زیرا ژنوتیپ تحت تأثیر فنوتیپ نیست. ژنوتیپ برخلاف فنوتیپ، از بیرون قابل مشاهده نیست. روند تعیین ژنوتیپ یک فرد ژنوتایپ نامیده میشود که برای اهداف مختلف مانند PCR، تعیین توالی DNA و چند شکلی طول قطعه محدود (RFLP) استفاده میشود.
نمونههایی از الگوی وراثت ژنهای مختلف در حیوانات شامل TT به عنوان آلل هموزایگوت برای قد، Tt برای آلل هتروزایگوت برای قد و BB برای آلل هموزایگوت برای رنگ چشم هستند. در گذشته مقاله «فنوتیپ چیست؟ — به زبان ساده» با اشاره به برخی آزمایشات مندلی به تعریف ساده و کاملی از فنوتیپ پرداخته است که برای درک بهتر این مفهوم و مطالعه پست ذکر شده میتوانید + اینجا کلیک کنید.

تکنیک های مطالعه اپی ژنتیک
در تحقیقات اپی ژنتیک برای درک بیشتر پدیدههای اپی ژنتیکی از طیف گستردهای از تکنیکهای مولکولی استفاده میشود:
- رسوب کروماتین (همراه با انواع مختلف آن Chip-on-chip و ChIP-Seq)
- تکنیک نشانهگذاری فلورسنت
- آنزیمهای محدود کننده حساس به متیلاسیون
- شناسایی DNA آدنین متیل ترانسفراز (DamID)
- تعیین توالی بیسولفیت
علاوه بر این، استفاده از روشهای بیوانفورماتیکی در محاسبات اپی ژنتیکی نقش مهمی دارند.
اپی ژنتیک مولکولی
تغییرات اپی ژنتیکی فعالسازی ژنهای خاصی را تغییر میدهند بدون اینکه توالی کد ژنتیکی DNA را دچار هرگونه تغییر ساختاری کنند. ریزساختار DNA یا پروتئینهای مربوط به کروماتین ممکن است اصلاح شده، باعث فعال شدن یا خاموش شدن آن شود. این مکانیسم سلولهای تمایز یافته موجود در ارگانیسم چند سلولی را قادر میسازد تا فقط ژنهای لازم برای فعالیت خود را بیان کنند. تغییرات اپی ژنتیکی هنگام تقسیم سلولها حفظ میشود. بیشتر تغییرات اپی ژنتیکی فقط در طول زندگی یک موجود زنده خاص رخ میدهند.
با این حال، این تغییرات اپی ژنتیکی میتوانند از طریق فرآیندی به نام وراثت اپی ژنتیک تراریخته به فرزندان ارگانیسم منتقل شود. علاوه بر این، اگر غیر فعال شدن ژن در اسپرم یا سلول تخمک منجر به لقاح شود، این اصلاح اپی ژنتیکی نیز ممکن است به نسل بعدی منتقل شوند. فرآیندهای خاص اپی ژنتیکی شامل پاراموتاسیون، نشانهگذاری، نقشپذیری ژنی، خاموش شدن ژن، غیرفعالسازی کروموزوم X، اثر موقعیت، برنامهریزی مجدد متیلاسیون DNA، ترانسفورماتور، اثرات سلول مادری، پیشرفت سرطان، بسیاری از اثرات تراتوژنها، تنظیم تغییرات هیستون و هتروکروماتین را شامل میشوند.

آسیب DNA
آسیب DNA میتواند باعث تغییرات اپی ژنتیکی شود. این آسیبها در DNA بسیار رایج هستند و به طور متوسط حدود ۶۰ هزار بار در روز در هر سلول از بدن انسان اتفاق میافتند. این آسیبها تا حد زیادی توسط سیستم ترمیم برطرف میشوند اما در محل ترمیم DNA، تغییرات اپی ژنتیکی میتوانند پایدار باشند. به طور خاص، شکستگی دو رشتهای در DNA می تواند خاموشی ژن اپی ژنتیکی برنامهریزی نشده را هم با متیلاسیون DNA و هم با انواع تغییرات هیستونی آغاز کند.
علاوه بر این، آنزیم Parp1 (پلی ADP - ریبوز پلیمراز) و محصول پلی (ADP) - Ribose (PAR) آن در محلهای آسیب DNA، به عنوان بخشی از فرآیند ترمیم تجمع مییابند. این تجمع به نوبه خود، جذب و فعالسازی پروتئین بازسازی کروماتین ALC1 را هدایت میکند که میتواند باعث بازسازی نوکلئوزوم شود.
مشخص شده است که بازسازی نوکلئوزوم از طریق فرآیندهای اپی ژنتیکی باعث خاموشی ژن ترمیم کننده DNA میشود. مواد شیمیایی آسیبرسان به DNA، مانند بنزن، هیدروکینون، استایرن، تتراکلریدکربن و تری کلرواتیلن، از طریق فعالسازی مسیرهای استرس اکسیداتیو باعث هیپومتیلاسیون قابل توجه DNA میشوند. برخی از ترکیبات غذایی سطح آنزیمهای ترمیمکننده DNA مانند MGMT و MLH1 و p53 را افزایش میدهند.
سایر اجزای غذایی مانند ایزوفلاون سویا میتوانند آسیب DNA را کاهش دهند. در یک مطالعه، نشانگرهای استرس اکسیداتیو مانند نوکلئوتیدهای اصلاح شده که میتوانند از آسیب DNA حاصل شوند با یک رژیم غذایی 3 هفتهای همراه با سویا کاهش یافتند. کاهش آسیب اکسیداتیو DNA نیز 2 ساعت پس از مصرف عصاره زغال اخته غنی از آنتوسیانین مشاهده شد.
تغییرات کووالانسی کروماتین چه هستند؟
تغییرات کووالانسی DNA (مانند متیلاسیون سیتوزین و هیدروکسی متیلاسیون) یا تغییرات هیستونی (به عنوان مثال استیلاسیون لیزین، متیلاسیون لیزین و آرژنین، فسفوریلاسیون سرین و ترئونین و افزایش لیزین و سوموئیلاسیون) در بسیاری از انواع وراثت اپی ژنتیکی نقش اصلی را دارند. بنابراین گاهی از کلمه اپی ژنتیک به عنوان مترادف این فرایندها استفاده میشود. بازسازی کروماتین همیشه به ارث نمی رسد و همه وراثت اپی ژنتیک شامل بازسازی کروماتین نیست.
از آنجا که فنوتیپ سلول یا فرد تحت تأثیر رونویسی متفاوت از ژنها قرار دارد، حالات رونویسی وراثتی میتواند اثرات اپی ژنتیکی ایجاد کند. چندین لایه تنظیم بیان ژن وجود دارند و یکی از راههای تنظیم بیان ژن، بازسازی کروماتین است. کروماتین به مجموعه DNA و پروتئینهای هیستونی گفته میشود. اگر نحوه قرارگیری DNA در اطراف هیستونها تغییر کند، بیان ژن نیز میتواند دستخوش تغییر شود. بازسازی کروماتین از طریق دو مکانیزم اصلی انجام میگیرد:
- اصلاح اسیدهای آمینه هیستونی پس از ترجمه
پروتئینهای هیستونی از زنجیرههای طولانی اسیدهای آمینه ساخته شدهاند. اگر اسیدهای آمینه موجود در زنجیره تغییر کنند، ممکن است شکل هیستون دچار تغییر شود. DNA طی همانندسازی کاملاً ذوب نشده است، بنابراین احتمال دارد که هیستونهای تغییر یافته شده به هر نسخه جدید از DNA منتقل شوند. این هیستونها ممکن است به عنوان الگوها عمل کرده و هیستونهای جدید را شکل دهند و پس از تقسیم سلول، نسخه متفاوتی طی رونویسیهای جدید تولید شود. - افزودن گروههای متیل به DNA، بیشتر در جایگاه CpG، برای تبدیل سیتوزین به 5-متیل سیتوزین
5-متیل سیتوزین بسیار شبیه سیتوزین معمولی عمل میکند و با یک گوانین در DNA دو رشتهای جفت میشود. اما وقتی سیتوزینهای متیله شده در سایتهای CpG در مناطق پروموتر و تقویتکننده ژنها وجود داشته باشد، ژنها اغلب سرکوب میشوند. وقتی سیتوزینهای متیله شده در جایگاههای CpG وجود داشته باشد (به استثنای جایگاه شروع رونویسی) بیان ژن اغلب افزایش مییابد.
رونویسی ژن معمولاً به فاکتور رونویسی بستگی دارد که به یک توالی تشخیص (10 پایه یا کمتر) در ناحیه پروموتر آن ژن متصل میشود. وقتی توالی شناسایی دارای سیتوزین متیله شده باشد، حدود 22٪ از عوامل رونویسی از اتصال جلوگیری میکنند. علاوه بر این، سیتوزینهای متیله شده در یک منطقه پروموتر میتواند پروتئینهای حوزه اتصال متیل-CpG (MBD) را جذب کنند. تمام MBDها با مجتمعهای بازسازی نوکلئوزوم و دیاستیلاز هیستون تعامل دارند که منجر به خاموش شدن ژن میشود. علاوه بر این، اصلاح کووالانسی دیگری که شامل سیتوزین متیله شده است، متیلاسیون آن توسط آنزیمهای TET است. صدها مورد مشابه، به عنوان مثال در هنگام یادگیری و ایجاد حافظه در نورون رخ میدهند.
مکانیسمهای وراثت تغییرات هیستونی به خوبی شناخته نشده است. با این حال، اطلاعات زیادی در مورد مکانیسم وراثت متیلاسیون DNA در طول تقسیم و تمایز سلول وجود دارد. وراثتپذیری متیلاسیون، به آنزیمهای خاصی (مانند DNMT1) وابسته است که میل بیشتری به 5 - متیل سیتوزین نسبت به سیتوزین دارند. اگر این آنزیم به بخشی از DNA همیمتیله برسد (جایی که 5 - متیل سیتوزین فقط در یکی از دو رشته DNA است)، آنزیم نیمه دیگر را متیله میکند.
اگرچه تغییرات هیستون در کل توالی ژنوم رخ میدهد، انتهای آمینی هیستونها (به نام دمهای هیستونی) دچار طیف وسیعی از تغییرات شامل استیلاسیون، متیلاسیون، یوبیکوئیتینه شدن، فسفوریلاسیون، سوموئیلاسیون، ریبوسیلاسیون و سیترولیناسیون میشوند. به عنوان مثال، استیلاسیون لیزینهای K14 و K9 در دم هیستون H3 توسط آنزیمهای استیل ترانسفراز (HATs) به طور کلی به درستی رونویسی مربوط میشود.
قبلا در مورد تنظیم بیان ژن مطلب مفصلی در مجله فرادرس تحت عنوان تنظیم بیان ژن — به زبان ساده منتشر شده است که برای درک بهتر مفاهیم اپی ژنتیک، مطالعه آن را توصیه میکنیم. برای مشاهده پست مربوطه + اینجا کلیک کنید.

متیلاسیون DNA چیست؟
«متیلاسیون» (Metilation) به طور مکرر در توالی DNA اتفاق میافتد و به سرکوب بیان ژن و تحرک عناصر قابل انتقال کمک می کند. از آنجا که 5-متیل سیتوزین می تواند به طور خود به خود از بین برود (جایگزین نیتروژن توسط اکسیژن) به تیمیدین، جایگاههای CpG اغلب جهش یافته و نادر میشوند، به جز در جزایر CpG که غیر متیل شده باقی میمانند.
بنابراین تغییرات اپی ژنتیکی از این نوع، امکان افزایش فرکانسهای جهش ژنتیکی دائمی را دارند. الگوهای متیلاسیون DNA در پاسخ به عوامل محیطی، با یک کنش متقابل پیچیده، با حداقل سه نوع DNA متیل ترانسفراز مستقل یعنی DNMT1 ،DNMT3A و DNMT3B ایجاد و اصلاح میشود. طی تحقیقات مشاهده شده است که از دست دادن هریک از این سه آنزیم اثر کشنده در موش دارد.
DNMT1 فراوانترین متیلترانسفراز در سلولهای سوماتیک است، در کانونهای همانندسازی قرار می گیرد برای DNA همیمتیله 10 تا 40 برابر اولویت دارد و با آنتیژن هستهای سلول تکثیرکننده (PCNA) تعامل دارد. با اصلاح ترجیحی DNA همیمتیله، DNMT1 الگوهای متیلاسیون را به یک رشته تازه سنتز شده پس از تکثیر DNA منتقل میکند و بنابراین اغلب به عنوان متیل ترانسفراز نگهدارنده شناخته میشود.
DNMT1 برای رشد مناسب جنین، ایمپرینتینگ و غیرفعالسازی کروموزوم X ضروری است. برای تأکید بر تفاوت این مکانیزم وراثتی مولکولی از مکانیسم متعارف جفتسازی واتسون - کریک برای انتقال اطلاعات ژنتیکی، اصطلاح الگوی اپی ژنتیک مطرح شد. علاوه بر نگهداری و انتقال حالتهای DNA متیله، همین اصل میتواند در حفظ و انتقال تغییرات هیستون و حتی حالتهای وراثتی سیتوپلاسمی (ساختاری) کار کند.
هیستونهای H3 و H4 را میتوان از طریق متیلاسیون با استفاده از هیستون لیزین متیلاز (KDM) نیز دستکاری کرد. این آنزیم اخیراً شناسایی شده است و یک جایگاه فعال کاتالیزوری به نام دامنه Jumonji یا JmjC دارد. زمانی که JmjC از چندین فاکتور برای هیدروکسیله گروه متیل استفاده میکند و از بین میرود. JmjC قادر به متیلاسیون لایههای مونو، دی و تری متیله است.
نواحی کروموزومی میتوانند حالتهای جایگزین پایدار و وراثتی و در نتیجه بیان ژن قابل دوام بدون تغییر در توالی DNA اتخاذ کنند. کنترل اپی ژنتیک اغلب با تغییرات کووالانسی جایگزین هیستونها در ارتباط است. پایداری و وراثت مناطق بزرگتر کروموزومی در مواردی که نوکلئوزومهای اصلاح شده آنزیمهایی را استخراج میکنند که به طور مشابه نوکلئوزومهای مجاور را اصلاح کنند، بازخورد مثبتی دارند. تنظیم رونویسی مبتنی بر کروماتین میتواند با تأثیر RNAهای کوچک ایجاد شود و RNAهای کوچک تداخلی میتوانند بیان ژن رونویسی را از طریق مدولاسیون اپی ژنتیکی پروموترهای هدفمند تعدیل کنند.
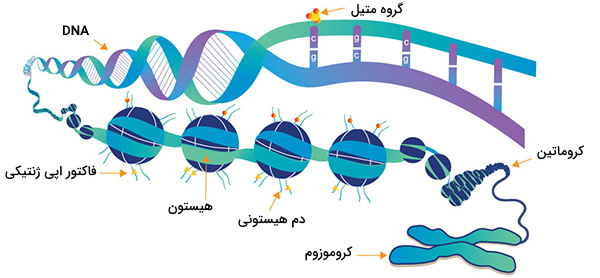
رونویسی RNA
گاهی اوقات یک ژن پس از روشن شدن، محصولی را رونویسی (مستقیم یا غیرمستقیم) و فعالیت آن ژن را حفظ میکند. به عنوان مثال، Hnf4 و MyoD به ترتیب رونویسی بسیاری از ژنهای خاص کبدی و عضلانی از جمله خودشان را از طریق فعالیت فاکتور رونویسی پروتئینهای رمزگذار، تقویت میکنند. سیگنالینگ RNA شامل استخدام افتراقی سلسله مراتب مجتمعهای اصلاحکننده کروماتین عمومی و متیل ترانسفرازهای DNA به نواحی خاص توسط RNAها در طول تمایز و توسعه است. تغییرات اپی ژنتیکی دیگر با تولید اشکال مختلف اتصال RNA یا با تشکیل RNA دو رشتهای (RNAi) ایجاد میشود.
فرزندان حاصل از سلولی که ژن در آن روشن شده است، این فعالیت را به ارث میبرند حتی اگر محرک اصلی فعالسازی ژن، دیگر وجود نداشته باشد. این ژن ها اغلب با انتقال سیگنال روشن یا خاموش میشوند، اگرچه در بعضی از سیستمها که اتصالات سینسیتیا یا اتصالات سلولی شکافدار مهم هستند، RNA ممکن است با انتشار مستقیم به سلولها یا هستههای دیگر گسترش یابد. طی تخمکگذاری یا از طریق سلولهای پشتیبان، مقدار زیادی RNA و پروتئین از مادر به این تخم كمک میكند و در نتیجه باعث تولید فنوتیپهای مادری میشود.
مقدار کمتری از RNA اسپرم از پدر به تخم منتقل میشود اما اخیراً شواهد نشان میدهند این اطلاعات اپی ژنتیکی میتوانند منجر به تغییرات قابل مشاهده در چندین نسل از فرزندان شوند.
میکرو RNA
MicroRNAها (miRNA) از جمله RNAهای غیر کد کننده هستند و طول آنها از 17 تا 25 نوکلئوتید است. miRNAها عملکردهای بیولوژیک متنوعی را در گیاه و حیوانات تنظیم میکنند. در سال 2013، حدود 2000 miRNA در انسان کشف شد. هر miRNA بیان شده در یک سلول ممکن است حدود 100 تا 200 RNA پیامرسان (mRNA) را هدف قرار داده و تنظیم کند. بیشتر تنظیمات سلولی بر روی mRNA با از بین رفتن mRNA هدف اتفاق میافتد، در حالی که بخشی از تنظیمات در سطح ترجمه بر روی پروتئین انجام میشوند.
به نظر میرسد که حدود 60 درصد از ژنهای کدکننده پروتئین انسانی، توسط miRNA تنظیم میشوند. بسیاری از miRNAها از نظر اپی ژنتیکی تنظیم میشوند. حدود 50 درصد از ژنهای miRNA با جزایر CpG در ارتباط هستند که ممکن است توسط متیلاسیون اپی ژنتیک سرکوب شوند. رونویسی از جزایر CpG متیله به شدت و به طور موروثی سرکوب میشوند. سایر miRNAها از طریق اپی ژنتیک، تغییرات هیستون یا متیلاسیون DNA تنظیم خواهند شد.
mRNA
در سال 2011 نشان داده شد که متیلاسیون mRNA نقش مهمی در هومئوستاز انرژی در انسان دارد و ژن FTO مرتبط با چاقی قادر به دمتیله کردن N6 - متیل آدنوزین در RNA است.
sRNA
sRNAها قطعات کوچک (50 تا 250 نوکلئوتیدی) بسیار ساختاریافته RNA هستند که در باکتری یافت میشوند. آنها بیان ژن از جمله ژنهای حدت در عوامل بیماریزا را کنترل میکنند و اهداف جدید در مبارزه با باکتریهای مقاوم به دارو هستند. sRNAها در بسیاری از فرآیندهای بیولوژیکی نقش مهمی دارند و به اهداف mRNA و پروتئینی در پروکاریوتها متصل میشوند.
تجزیه و تحلیلهای فیلوژنتیک به عنوان مثال از طریق فعل و انفعالات هدف sRNA – mRNA یا خواص اتصال به پروتئین، برای ایجاد پایگاههای اطلاعاتی جامع استفاده میشوند. همچنین نقشههای ژنی sRNA بر اساس اهداف آنها در ژنومهای میکروبی ساخته شدهاند.
وراثت ساختارها
وراثت ساختاری مژکها در ارگانیسمهایی مانند مانند Tetrahymena و Paramecium، سلولهای یکسان ژنتیکی تفاوت ارثی در الگوهای ردیفهای مژگانی سطح سلول آنها نشان میدهد. الگوهای تغییر یافته میتوانند به سلولهای دختر منتقل شوند. ساختارهای موجود به عنوان الگوهایی برای ساختارهای جدید عمل میکنند. مکانیسمهای چنین ارثی مشخص نیست اما دلایلی وجود دارد مبنی بر اینکه موجودات چند سلولی از ساختارهای سلولی موجود برای جمعآوری ساختارهای جدید نیز استفاده میکنند.
نقش پذیری ژنی چیست؟
«نقشپذیری ژنی» (Genomic Imprinting) یکی از اثرات اپی ژنتیکی است. این پدیده به تأثیرپذیری آللها از یکدیگر اشاره دارد. در فرزندان هتروزایگوس، فنوتیپ بستگی به این دارد که فرزند آللها را از کدام والد دریافت کرده باشد و بر این اساس فنوتیپ مربوط به ژنوتیپ Aa و aA یکسان نیست در حالیکه فرزندان هموزایگوس aa و AA فنوتیپ یکسانی دارند بنابراین وراثت در اینگونه ژنها از قوانین مندل پیروی نمیکند. تغییر تراکم ژنوم به دلیل تغییرات هیستونی، متیلاسیون DNA و تداخل RNA از جمله دلایل مؤثر بر پدیده نقشپذیری ژنی هستند.
پریون ها
«پریونها» (Prions) اشکال عفونی پروتئین هستند. پروتئینها به گونهای سازمان یافتهاند که بتوانند عملکرد خاص سلولی را انجام دهند اما پریونها، قادر به ایجاد حالت ساختاری عفونی هستند. اگرچه پریون غالباً در بیماریهای عفونی مشاهده میشود، با این وجود قادرند با تغییر ساختار پروتئینهای دیگر آنها را به فرم عفونی خود تبدیل کنند. بر این اساس میتوان آنها را عوامل اپی ژنتیکی محسوب کرد که که قادر به ایجاد تغییر فنوتیپی بدون تغییر ژنوم هستند. بعضی از افراد پریون قارچی را عامل اپی ژنتیکی میدانند زیرا فنوتیپ عفونی ناشی از پریون میتواند بدون اصلاح ژنوم به ارث برسد.
موقعیت نوکلئوزوم
ژنوم یوکاریوتی نوکلئوزومهای بیشماری دارد. موقعیت نوکلئوزوم تصادفی نیست و دسترسی DNA به پروتئینهای تنظیم کننده را تعیین میکند. نوکلئوزومها در بافتهای مختلف ویژگیهای موقعیتیابی متفاوتی هستند که این تفاوتها چگونگی بیان ژن و تمایز سلولی را مشخص میکنند. حداقل برخی از نوکلئوزومها در سلولهای اسپرم حفظ خواهند شد (جایی که اکثر هیستونها با پروتامین جایگزین نمیشوند) بنابراین موقعیت نوکلئوزومی تا حدی وراثتی است. مطالعات ارتباط بین موقعیت نوکلئوزوم و سایر عوامل اپی ژنتیکی مانند متیلاسیون DNA و هیدروکسی متیلاسیون را کشف کردهاند.
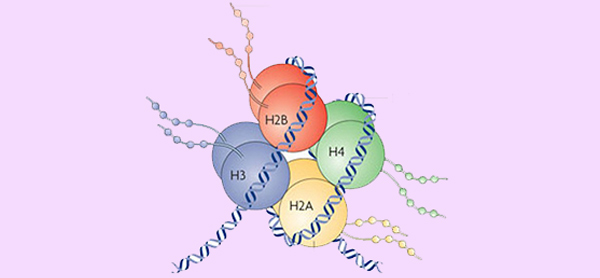
ساختار ژنومی
پیکربندی سه بعدی ژنوم (ژنوم سه بعدی) برای تنظیم عملکرد ژنومی و فرآیندهای هستهای مانند تکثیر DNA، رونویسی و ترمیم آسیب DNA، پیچیده، پویا و حیاتی است.
پدیده پرایمینگ
آغازگر اپی ژنتیک یا پرایمینگ (Epigenetic Priming) یا آغازگر ژن، تغییر در اپیژنوم سلول است که موجب تبدیل نواحی خاص کروماتین از حالت بسته به حالت باز میشود و معمولاً در نتیجه یک محرک یا مسیر بیولوژیکی خارجی، به فاکتورهای رونویسی یا سایر مکانیسمهای اصلاح امکان دسترسی به DNA را میدهد.
عملکرد آغازگر اپی ژنتیک برای یک منطقه خاص از DNA حکم میکند که چگونه سایر مکانیسمهای تنظیم ژن قادر خواهند بود در مراحل بعدی زندگی سلول بر روی DNA عمل کنند. آغازگر اپی ژنتیک به طور عمده در علوم اعصاب و تحقیقات سرطان مورد بررسی قرار گرفته زیرا مشخص شده است که به ترتیب نقش مهمی در تشکیل حافظه در سلولهای عصبی و فعالسازی ژن مهارکننده تومور در درمان سرطان دارد.
دوقلوها
مقایسه مستقیم دوقلوهای همسان یک مدل بهینه برای بازجویی از اپی ژنتیک محیط است. در مورد انسان با مواجهه محیطی متفاوت، دوقلوهای تک تخمکی (همسان) از نظر اپی ژنتیکی در طول سالهای اولیه غیر قابل تشخیص بودند، در حالی که دوقلوهای مسن تفاوتهای چشمگیری در محتوای کلی و توزیع ژنومی DNA - ۵ متیل سیتوزین و استیلاسیون هیستون داشتند. دو جفت دوقلویی که کمتر از عمر خود را با هم گذراندهاند و یا اختلاف بیشتری در تاریخ پزشکی خود داشتند، کسانی بودند که بیشترین اختلاف را در سطح 5-متیل سیتوزین DNA و استیلاسیون هیستونهای H3 و H4 داشتند.
دوقلوهای دو تخمکی و تک تخمکی شواهدی از تأثیر اپی ژنتیکی در انسان را نشان میدهد. اختلاف توالی DNA که در یک مطالعه مبتنی بر یکپارچه فراوان خواهد بود، با تجزیه و تحلیل تداخل نمیکند. اختلافات زیست محیطی می تواند اثرات اپی ژنتیکی طولانی مدت ایجاد کند و انواع مختلف دوقلوی تک سلولی رشدی ممکن است از نظر حساسیت متفاوت باشد تا از نظر اپی ژنتیک ناسازگار باشند.
در یک مطالعه که بر تفاوت اپی ژنتیکی بین دوقلوهای تکسلولی متمرکز شده تا تغییرات جهانی و موضعی را در متیلاسیون DNA و اصلاحات هیستون در یک نمونه 40 جفت دوقلوی تکسلولی مقایسه کند. فقط جفتهای دوقلوی سالم در طیف وسیعی از سنین ۳ تا ۷۴ ساله مورد مطالعه قرار گرفتند. یکی از نتیجهگیریهای عمده در این مطالعه این است که یک تجمع وابسته به سن از اختلاف اپی ژنتیکی بین دو خواهر و برادر جفت دوقلو وجود دارد. این انباشت وجود رانش اپی ژنتیک را نشان میدهد.
رانش اپی ژنتیکی اصطلاحی است که به تغییرات اپی ژنتیکی داده میشود زیرا با افزایش سن عملکرد مستقیمی دارند. در حالی که سن یک عامل خطر شناخته شده برای بسیاری از بیماری ها است ، مشخص شده است که متیلاسیون مربوط به سن به طور متفاوت در مکانهای خاص در طول ژنوم رخ می دهد. با گذشت زمان، این میتواند منجر به تفاوتهای قابل اندازهگیری بین سن بیولوژیکی و زمانی شود. مشخص شده است که تغییرات اپی ژنتیکی انعکاسی از سبک زندگی است و ممکن است به عنوان نشانگرهای زیستی عملکردی بیماری قبل از رسیدن به آستانه بالینی عمل کند.
یک مطالعه جدیدتر که در آن 114 دوقلوی تک تخمکی و 80 دوقلوی دو تخمکی برای وضعیت متیلاسیون DNA حدود 6000 منطقه ژنومی منحصر به فرد مورد بررسی قرار گرفت، نتیجه گرفت که شباهت اپی ژنتیکی در زمان تقسیم بلاستوسیست نیز میتواند به شباهتهای فنوتیپی در دوقلوهای مونوزایگوت کمک کند. این مفهوم را پشتیبانی میکند که محیط کوچک در مراحل اولیه رشد جنینی میتواند برای ایجاد اثرات اپی ژنتیکی بسیار مهم باشد.
بیماری ژنتیکی مادرزادی به خوبی درک شده است و به روشنی میدانیم که اپی ژنتیک میتواند به عنوان مثال در سندرم آنجلمن و سندرم پرادر-ویلی نقش داشته باشد. این بیماریهای ژنتیکی که به دلیل حذف ژن یا غیرفعال شدن ژنها ایجاد میشوند اما به طور غیر معمولی شایع هستند زیرا افراد در اصل به دلیل نقشپذیری ژنومی، همزیگوت هستند و بنابراین یک ناک اوت ژن برای ایجاد بیماری کافی است که در بیشتر موارد نیاز به حذف هر دو نسخه وجود دارد.
ارتباط اپی ژنتیک و سلامت چیست؟
اپی ژنتیک کاربردهای پزشکی بالقوه متنوعی از جمله مکانیسمهای پیری، رشد انسانی و ریشههای سرطان، بیماریهای قلبی، بیماریهای روحی و همچنین چندین بیماری دیگر را دارد. در نهایت اپی ژنتیک ممکن است نقش بیشتری نسبت به ژنتیک در بیماری داشته باشد.
اثر دارو بر اپی ژنتیک
نمونه هایی از داروها که بیان ژن را از وقایع اپی ژنتیکی تغییر میدهند شامل استفاده از آنتیبیوتیکهای بتا لاکتام، میتواند فعالیت گیرندههای گلوتامات و عملکرد سیکلوسپورین را بر روی چندین فاکتور رونویسی تغییر دهد. علاوه بر این، ممکن است لیتیوم بر اتوفاژی پروتئینهای نابجا تأثیر بگذارد. استفاده زیاد از مخدرها نیز میتواند بیان ژنهای مرتبط با فنوتیپهای اعتیاد را افزایش دهد.
سرطان
اپی ژنتیک سرطان انواع مختلفی از مکانیسمهای اپی ژنتیکی میتوانند در انواع مختلف سرطان دستخوش تغییر شوند. تغییرات اپی ژنتیکی ژنهای ترمیمکننده DNA یا ژنهای کنترل چرخه سلولی در سرطانهای پراکنده (در دودمان غیر زایا) بسیار مکرر است، به طور قابل توجهی شیوع بیشتری نسبت به جهشهای در دودمان زایا (خانوادگی) در این سرطانهای پراکنده دارد. تغییرات اپی ژنتیکی در تبدیل سلول به سرطان مهم هستند و دستکاری آنها نویدبخش پیشگیری، تشخیص و درمان سرطان است. چندین دارو که دارای اثر اپی ژنتیکی هستند در بسیاری از این بیماریها استفاده میشود.
ترمیم زخم دیابتی
اصلاحات اپی ژنتیکی بینشی در درک پاتوفیزیولوژی شرایط مختلف بیماری ایجاد کرده است. اگرچه آنها به شدت با سرطان در ارتباط هستند اما نقش آنها در سایر شرایط پاتولوژیک از اهمیت یکسانی برخوردار است. به نظر میرسد که محیط هایپرگلیسمیک میتواند چنین تغییراتی را در سطح ژنومی ایجاد کند که ماکروفاژها به سمت حالت پیش التهابی سوق پیدا میکنند و ممکن است در نمایش هرگونه تغییر فنوتیپی نسبت به نوع پیشدرمانی موفق نباشند.
این پدیده تغییر قطب ماکروفاژ بیشتر با همه عوارض دیابتی در یک مجموعه بالینی همراه است. از سال 2018، چندین گزارش ارتباط انواع مختلف اپی ژنتیک را با توجه به عوارض دیابتی نشان میدهند. با پیشرفت ابزارهای پزشکی، تشخیص این نشانگرهای زیستی به عنوان ابزارهای پیش آگهی و تشخیصی در بیماران میتوانند به عنوان رویکردهای جایگزین استفاده شوند. استفاده از تغییرات اپی ژنتیک به عنوان اهداف درمانی، ارزیابی گسترده بالینی و همچنین بالینی قبل از استفاده را تضمین میکند.
افسردگی ارثی
وراثت اپی ژنتیکی فنوتیپهای مربوط به افسردگی نیز در یک مطالعه بالینی گزارش شده است. وراثت صفات ناشی از استرس پدری در طول نسل شامل سیگنالهای کوچک غیر رمزگذار RNA است که از طریق دودمان زایای والدین منتقل میشوند.
استرس در اوایل زندگی
در سال 2003، کاسپی و همکارانش نشان دادند که در بیش از هزار نفر که چندین بار از دوره پیش دبستانی تا بزرگسالی ارزیابی شدهاند، افرادی که حامل یک یا دو نسخه از آلل کوتاه پلیمورفیسم پروموتر ناقل سروتونین هستند، نرخ بالاتری در افسردگی بزرگسالی و خودکشی را نشان دادهاند.
تغذیه والدین، استرس در دوران بارداری و قرار گرفتن در معرض مواد شیمیایی مختل کننده غدد درونریز، سن مادر و پدر و جنسیت فرزندان، میتوانند بر جایگزینی دودمان زایا در فرزندان و میزان پایداری وراثت در نسل بعد اثر بگذارند. با این حال، اینکه تا چه حد میتوان اثرات اپی ژنتیکی را به نسلهای بعد منتقل کرد، خصوصاً در انسان هنوز مشخص نیست.
اعتیاد و وراثت
اعتیاد نوعی اختلال در سیستم پاداش مغز است که از طریق مکانیسمهای رونویسی و نورواپی ژنتیک بوجود می آید و با گذشت زمان از مقادیر زیاد مزمن قرار گرفتن در معرض محرک اعتیاد آور (به عنوان مثال، مورفین، کوکائین، رابطه جنسی و قمار) ایجاد میشود. شواهد قوی در حمایت از تداوم اثرات اپی ژنتیک طی چندین نسل، هنوز در انسان ثابت نشده است. به عنوان مثال، اثر اپی ژنتیکی قرار گرفتن در معرض سیگار کشیدن قبل از تولد که در دو نسل بعد که در معرض آن قرار نگرفتهاند، مشاهده میشود.







سلام خانم بصیری واقعاااااااا دمتون گرم که مطالب پیچیده ژنتیک رو به زبان ساده نوشتین خیلی بهدردم خورد ممنونم ازتون