آمین ها در شیمی – به زبان ساده
آمین ها مشتقاتی از آمونیاک هستند که یک یا چند هیدروژن آنها با یک گروه آلکیل یا آریل جایگزین شدهاند. به عبارت دیگر در یک آمین، اتم هیدروژنِ آمونیاک با یک یا چند گروه هیدروکربنی جایگزین شده است. گروههای آمینی که به یک آروماتیک متصل باشند موسوم به آمینهای آروماتیکی هستند. از پیشوند «آمینو» یا پسوند آمین برای نامگذاری این ترکیبات بهره میگیرند. ترکیبات آلی که دارای چندین گروه آمین باشند را با نامهای دیآمین، تریآمین، تتراآمین و ... میشناسند.

انواع مختلف آمین
آمینها بسته به اینکه چه تعداد اتم هیدروژن با گروههای هیدروکربنی جایگزین شده باشد، در دستهبندیهای مختلفی قرار میگیرند.
آمین نوع اول
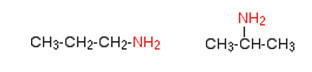
در «آمین نوع اول» (Primary Amine)، تنها یک هیدروژن در مولکول آمونیاک، جایگزین شده است. در نتیجه فرمول آمین نوع اول به صورت خواهد بود که در آن ، یک گروه آلکیل را نشان میدهد. نمونهای از آمینها را در تصویر زیر مشاهده میکنید:

نامگذاری آمینها قدری پیچیده است چراکه روشهای متفاوتی برای آن وجود دارد، به طور مثال، سادهترین آمین با فرمول نامهای متفاوتی از قبیل متیل آمین، متان آمین و آمینو متان دارد. معمولترین نامی که برای ترکیب بالا ذکر میشود، متیل آمین است. برای اینکه شماره گروه متصل به زنجیر کربنی را پیدا کنیم بهتر است به هنگام نامگذاری از عبارت آمینو استفاده کنیم. در تصویر زیر، مولکول های ۱-آمینو پروپان و ۲ـآمینو پروپان را مشاهده میکنید.
آمین نوع دوم
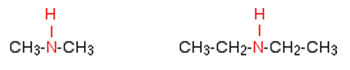
در «آمین نوع دوم» (Secondary Amine)، دو اتم هیدروژن در آمونیاک با گروههای هیدروکربنی جایگزین شدهاند. از جمله آمینهای معروف نوع دوم میتوان دیمتیل آمین و دیاتیل را نام برد.
آمین نوع سوم
در «آمین نوع سوم» (Tertiary Amine)، تمامی هیدروژنهای متصل به نیتروژن با گروههای هیدروکربنی جایگزین شدهاند. از نمونههای این آمین میتوان به تریمتیل آمین اشاره کرد که بویی همچون بوی ماهی دارد.
آمینهای حلقوی
آمینهای حلقوی از نوع آمینهای نوع دوم یا سوم هستند. نمونههایی از آمینهای حلقوی موسوم به «آزیریدین» (Aziridine) و «پیپریدین» (Piperidine) در تصویر زیر آورده شدهاند:
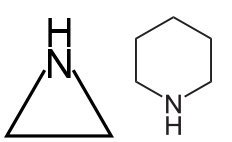
لازم به ذکر است که میتوان چهار گروه متصل به نیتروژن را هم مشاهده کرد. این مواد در دستهبندی آمینها قرار نمیگیرند و موسوم به «کاتیون آمونیوم نوع چهارم» (Quaternary Ammonium Cations) هستند.
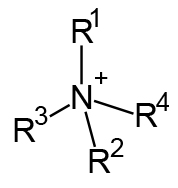
خواص فیزیکی آمینها
پیوندهای هیدروژنی به طور قابل توجهی بر خواص آمینهای نوع اول و دوم تاثیرگذار است. به طور مثال، متیلآمین و اتیلآمین در شرایط استاندارد به شکل گاز وجود دارند اما متانول و اتانول در این شرایط مایع هستند. در نتیجه، نقطه جوش آمینها از فسفینهای متناظر با خود بیشتر و از الکلها کمتر است. آمینها بویی شبیه به آمونیاک و آمینهای مایع بویی همانند بوی ماهی دارند. اتم نیتروژن دارای یک جفتالکترون ناپیوندی است که میتواند با پیوند و یون آمونیوم به شکل تشکیل دهد.
آمینها همچنین در آب حلالپذیراند. این انحلالپذیری با افزایش تعداد اتم کربن کاهش پیدا میکند چراکه خاصیت آبگریزی آن با افزایش تعداد اتم کربن افزایش مییابد. آمینهایی که به یک زنجیر آلکیلی متصل و موسوم به آمینهای آلیفاتیکی هستند، در حلالهای آلیِ قطبی حل میشوند. در آمینهای آروماتیک، جفتالکترونهای ناپیوندی به حلقه بنزنی داده میشوند و قابلیت آنها برای شرکت در پیوندهای هیدروژنی کاهش مییابد. در نتیجه این امر، حلالپذیری آن در آب کاهش پیدا میکند و نقطه جوش بالایی نیز دارند.
خواص اسیدی و بازی آمینها
آمینهایی که به شکل و هستند مولکولهایی «کایرال» (Chiral) هستند که میتوانند شرایط وارونگی را نیز تجربه کنند. آمینها خاصیتی بازی دارند و این خاصیت با گروههایی که جایگزین هیدروژن میشوند متناسب هستند به طوریکه گروههای آلکیلی موجب تقویت خاصیت بازی و گروههای آریل، سبب تضعیف این خاصیت میشوند.
علاوه بر این، اثر گروههایی آلکیلی، افزایش انرژی جفتالکترون ناپیوندی و به تبع آن افزایش خاصیت بازی را به همراه دارد. در نتیجه، انتظار میرود که خاصیت بازی یک آمین با افزایش تعداد گروههای آلکیلی افزایش پیدا کند. در مقابل، همانطور که در بالا اشاره شد، حلقههای آروماتیک، جفتالکترونهای ناپیوندی را از نیتروژن به سمت حلقه بنزنی انتقال میدهند که موجب کاهش خاصیت بازی خواهد بود. به طور کلی، آمینها در مقایسه با هیدروکسید فلزات قلیایی، بازهای ضعیفتری هستند.

سنتز آمینها
آمینها با روشهای متعددی اعم از «آلکیلدار کردن» (Alkyaltion) و فرآیندهای کاهشی تولید میشوند.
آلکیلدار کردن
بسیاری از آمینها با روش صنعتی آلکیلدار کردن (آلکیلاسیون) الکلها به تولید میرسند:
بر خلاف واکنش آمینها با آلکیل هالیدها، روش صنعتی بالا خطرات زیستمحیطی ندارد چراکه فرآورده جانبی این واکنش آب است. واکنش آمین و آمونیاک با آلکیل هالیدها به منظور سنتز در آزمایشگاه بکار میرود:
این نوع از واکنشها که برای آلکیل یدیدها و برمیدها مناسب هستند، به دلیل کنترل دشوار درجه آلکیلدار شدن، کمتر بکار گرفته میشوند.
واکنشهای کاهشی
در حضور کاتالیزور نیکل، نیتریلها طی فرآیند هیدروژناسیون به آمین کاهش پیدا میکنند. این نوع از واکنشها به نوع اسیدی یا بازی بودن شرایط، حساس هستند. به طور معمول از «لیتیوم آلومینیوم هیدرید» برای کاهش نیتریلها در مقیاس آزمایشگاهی استفاده میشود.
به طور مشابه میتوان با استفاده از ، آمیدها را به آمین کاهش داد. بسیاری از آمینها توسط «آمیناسیون کاهشی» (Reductive Amination) آلدهیدها و کتونها به تولید میرسند. لازم به ذکر است که آنیلین با فرمول و همینطور مشتقات آن توسط کاهش «نیتروآروماتیکها» (Nitroaromatics) تولید میشوند. در صنعت از هیدروژن به عنوان کاهنده قوی استفاده میشود اما برای این دسته از واکنشها در آزمایشگاه از قلع و آهن استفاده میکنند.

واکنشها
در ادامه به توضیح واکنشهایی که آمینها در آن شرکت میکنند خواهیم پرداخت:
آلکیلدار کردن، آسیلاسیون و سولفوندار کردن
جدای خاصیت بازی، علت اصلی واکنشپذیری آمینها، هستهدوست بودن آنها است. بیشتر آمینهای نوع اول، لیگاندهای خوبی برای یونهای فلزی و تشکیل کمپلکسهای کوئوردینانسی هستند. همانطور که گفته شد، آمینها توسط آلکیلهالیدها در واکنشهای آلکیلدارشدن شرکت میکنند. اسید کلرید و اسیدانیدریدها در واکنشی با نام «شاتن-بومان» (Schotten–Baumann Reaction) با آمینهای نوع اول و دوم واکنش میدهند:
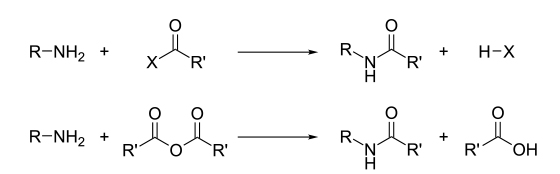
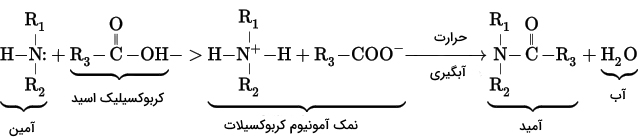
از آنجایی که آمینها خاصیتی بازی دارند، اسیدها را در واکنشهای خنثیسازی دخیل میکنند و آنها را به نمکهای آمونیوم متناظرشان تبدیل میکنند. نمکهایی که از کربوکسیلیک اسید و آمین نوع اول و دوم بدست میآیند، با استفاده از حرارت دادن و آبگیری، به آمید متناظر با خود تبدیل میشوند:
دیآزو شدن
آمینها در واکنش با نیترو اسید، «نمکهای دیآزونیوم» (Diazonium Salt) تولید میکنند، این نمکها اهمیت کمی دارند چراکه بسیار ناپایداراند. مهمترین آنها، مشتقات آمینهای آروماتیک همچون آنیلین هستند. در رابطه زیر، حرف بیانگر یک آریل یا نفتیل است:
آنیلینها و «نفتیلآمینها» (Naphthylamines) نمکهای دیآزونیوم پایدارتری تولید میکنند. این نمکها در واکنشهای جانشینی (تبادلی) متنوعی شرکت میکنند که شامل جایگزینی گروه نیتروژن با آنیونها هستند. به طور مثال، «مس (I) سیانید» (Cuprous Cyanide) طی واکنش زیر موجب تولید نیتریل میشود:
تبدیل شدن به ایمین
تشکیل ایمین واکنش حائز اهمیتی است. آمینهای نوع اول با کتونها و آلدهیدها برای تشکیل ایمین وارد واکنش میشوند:
کاهش این ایمینها موجب تولید آمینهای نوع دوم خواهد بود:
به طور مشابه، آمینهای نوع دوم با کتونها و آلدهیدها وارد واکنش میشوند و «انامین» (Enamin) تولید میکنند:
فعالیت بیولوژیکی آمین
آمینها حضوری پر رنگ در بیولوژی دارند. شکسته شدن آمینو اسیدها موجب آزادسازی آمین میشود. نمونهای از آن را میتوان در فرآیند فاسد شدن ماهی مشاهده کرد که بوی متساعد از آن، بوی تریمتیلآمین است. بسیاری از پیامرسانهای عصبی همچون آدرنالین، نوراپینفرین، دوپامین، سروتونین و هیستامین، همگی آمین هستند. گروههای آمینی «پروتوندهی شده» (Protonated) که به صورت نمایش داده میشوند، از مهمترین بخشهای با بار مثبت در پروتئینها هستند. پلیمر یونی DNA به طور معمول با پروتئینهای آمینه تشکیل پیوند میدهد.
کاربردهای آمینها
از آمینها در رنگها، داروها و فرآوری گاز استفاده میشود که در ادامه به آنها خواهیم پرداخت:
رنگ
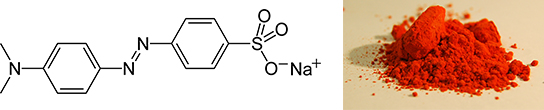
آمینهای آروماتیک نوع اول جهت تولید «رنگهای آزو» (Azo Dyes) بکار گرفته میشوند. این مواد با نیترو اسید واکنش و نمکهای دیآزونیوم را تشکیل میدهند. این نمکها در نهایت در واکنشهای جفتشدن شرکت میکنند و «ترکیبات آزو» (Azo Compounds) را بوجود میآورند. از آنجایی که ترکیبات آزو رنگی هستند، به طور گسترده در صنایع رنگرزی مورد استفاده قرار میگیرند. برخی از این ترکیبات عبارتند از:
- متیل اورانژ
- رنگ قهوهای 138
- «سانست یلو اف سی اف» (Sunset yellow FCF)
- «پونسو» (Ponceau)
داروها
بسیاری از داروها به منظور مداخله در عملکرد پیامرسانهای عصبی یا تقلید از آنها طراحی میشوند که برخی از آنها در زیر آورده شدهاند:
- کلرفنامین، نوعی آنتی هیستامین است که در صورت بروز اختلالات آلرژیک ناشی از سرماخوردگی، تب، حساسیت پوستی و نیش حشرات تجویز میشود.
- افدرین و «فنیل افرین» (Phenylephrine) به عنوان ضد احتقان بکار میروند.
- برخی از مسکنها همچون مورفین و کدئین از جمله آمینهای نوع سوم هستند.

فرآوری گاز
از مواد زیر به طور صنعتی برای حذف دیاکسید کربن و «سولفید هیدروژن» از گاز طبیعی استفاده میکنند:
- اتانولآمین MEA
- دیگلایگولآمین (DGA)
- دیاتانول آمین (DEA)
- دیایزوپروپانول آمین (DIPA)
- متیل دیاتانول آمین (MDEA)
اگر این مطلب برای شما مفید بوده است، آموزشهای زیر نیز به شما پیشنهاد میشوند:
- مجموعه آموزشهای دروس شیمی
- مجموعه آموزشهای مهندسی شیمی
- آموزش شیمی آلی ۱
- اصل لوشاتلیه — به زبان ساده
- آلومینیوم و فرآیند هال — از صفر تا صد
^^












