پیوند شیمیایی – به زبان ساده
پیوندهای شیمیایی، اتمها را بهصورت موقت یا دائم کنار یکدیگر نگه میدارد. شناخته شدهترین نوع این پیوندها، کووالانسی، یونی و هیدروژنی هستند که در این مطلب هرکدام از آنها را معرفی میکنیم.


مقدمه
اجزاء زنده در طبیعت از اتمها تشکیل شدهاند. در حقیقت این نحوه قرارگیری اتمها کنار یکدیگر است که منجر به ایجاد ساختارهای متفاوت میشود. اتمهای تشکیل دهنده یک مولکول به نحوی شناور هستند که میتوانند با اتمهای مولکولهای اطراف ارتباط داشته باشند. این ارتباط به نوع پیوندهای بین اتمهای یک مولکول وابسته است. به راستی چرا پیوندهای شیمیایی وجود دارند؟ پیوندهای مختلف در یک اتم دارای انرژیهای متفاوتی هستند. از طرفی اتمهای یک ماده همواره تلاش میکنند تا به کمترین سطح انرژی خود برسند. از این رو اتمها در یک واکنش شیمیایی با گرفتن یا از دست دادن الکترون، سطح انرژیشان تغییر کرده و پیوندهای جدیدی را ایجاد میکنند.
لازم به ذکر است «فایل PDF پیوندهای شیمیایی» (تقلبنامه پیوندهای شیمیایی) را نیز میتوانید به طور جداگانه دانلود و مطالعه کنید. این تقلبنامه شامل تعریف انواع پیوندهای شیمیایی همچون پیوندهای یونی و کووالانسی است. همچنین، نیروهای بین مولکولی و پیوندهای هیدروژنی و فلزی نیز به طور کامل مورد بررسی قرار گرفتهاند.
یون و پیوند یونی
برخی از اتمها با گرفتن یا از دست دادن یک الکترونِ کامل، پایدارتر میشوند. زمانی که الکترونهای یک اتم تغییر کنند، اتمها تبدیل به بارهایی الکتریکی یا «یون» (Ion) خواهند شد. اتمها از لایههایی تشکیل شدهاند که در هر کدام از آنها تعدادی الکترون قرار گرفته است. در شکل زیر شماتیک اتم کربن و الکترونهای مربوط به آن نشان داده شده است.

تشکیل یون
یونها در حالت کلی به دو دسته تقسیمبندی میشوند. «کاتیونها» (Cations)، یونهایی هستند که با از دست دادن الکترون، دارای باری مثبت میشوند. برای نمونه اتم سدیم (Na) را فرض کنید که با از دست دادن الکترون تبدیل به +Na میشود. از طرفی برخی از اتمها با گرفتن الکترون، منفی شده که به آنها آنیون میگویند. برای نمونه اتم کلر (Cl) با گرفتن یک الکترون منفی شده و تبدیل به -Cl میشود. توجه داشته باشید که جهت نامگذاری آنیونها از پسوند -اید استفاده میشود.
مثلا به -Cl کلرید گفته میشود. در هنگام تشکیل پیوندی یونی یکی از اتمها، الکترون از دست داده و دیگری الکترون دریافت میکند. به این فرآیند انتقال الکترون گفته میشود. انتقال الکترون میان اتمهای کلر و سدیم که منجر به تولید سدیم-کلرید (نمک) میشود، از یکی نمونههای معروف انتقال الکترون است. اتم سدیم (Na) تنها یک الکترون در لایهی بیرونیش دارد. از این رو بهجای گرفتن چندین الکترون، از دست دادن یک الکترون برای این اتم مناسبتر است. بنابراین نهایتا اتم Na یک الکترون از دست داده و تبدیل به +Na مثبت میشود.
اتم کلر (Cl) در لایه آخر خود ۷ الکترون دارد. بنابراین برای این اتم راحتتر است که به جای از دست دادن این الکترونها، یک الکترون دریافت کرده و پایدار شود. از این رو اتم کلر با گرفتن یک الکترون، پایدار شده و به کلرید (-Cl) تبدیل میشود. در شکل زیر فرآیند انتقال الکترون بین اتمهای سدیم و کلر نشان داده شده است.
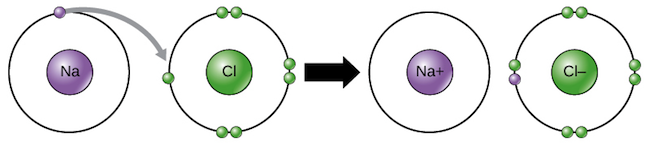
ایجاد پیوند یونی
به پیوند ایجاد شده بینهای یونهای با بار مخالف، پیوند یونی (Ionic bond) گفته میشود. برای نمونه پیوندی یونی میان یونهای +Na و -Cl ایجاد شده که منجر به تولید نمک (NaCl) میشود. همچون نمک، اکثر پیوندهای یونی بین اتمها، در سهبعد و بهصورت کریستال نظم مییابند. در شکل زیر حالت کریستالی نمک نشان داده شده است.

یونهای مورد مطالعه در فیزیولوژی، تحت عنوان «الکترولیت» (Electrolyte) شناخته میشوند. معروفترین الکترولیتها، سدیم، پتاسیم و کلسیم هستند.
پیوند کووالانسی
یکی از راههای پایدارتر شدن اتمها به اشتراک گذاشتن الکترونها -به جای از دست دادن یا گرفتن یک الکترون کامل- است. در حالتی که دو اتم الکترونی را به اشتراک میگذارند، میان آنها پیوندی کووالانسی ایجاد میشود. در مولکولهای تشکیل دهنده موجودات زنده، پیوندهای کووالانسی به نسبت یونی معمولتر هستند. در حقیقت بخش قابل توجهی از بدن ما توسط پیوند کووالانسی ایجاد شده است!
ساختار اصلی ترکیبات آلیِ کربندار، DNA و پروتئینها نیز با استفاده از پیوندهای کووالانسی ایجاد شده است. همچنین بسیاری از ترکیبات غیرآلی همچون H2O ،CO2 و O2 با استفاده از پیوند کووالانسی ایجاد شدهاند. یک پیوند کووالانسی میتواند در نتیجه به اشتراکگذاری دو یا سه جفت الکترون باشد. از این رو پیوند کووالانسی میتواند دوگانه یا سهگانه نیز باشد. هرچه الکترونهای به اشتراک گذاشته شده بیشتر باشد، پیوند ایجاد شده نیز قویتر خواهد بود.
جهت توضیح پیوند کووالانسی، مولکول آب را در نظر بگیرید. یک مولکول آب (H2O)، از دو اتم هیدروژن و یک اکسیژن تشکیل شده است. هرکدام از اتمهای هیدروژن یک الکترون را با تک اتمِ اکسیژن به اشتراک میگذارند. همچنین اتم اکسیژن از یکی از الکترونهایش جهت اشتراکگذاری استفاده میکند. در شکل زیر مفهوم اشتراکگذاری الکترون در مولکول آب نشان داده شده است.
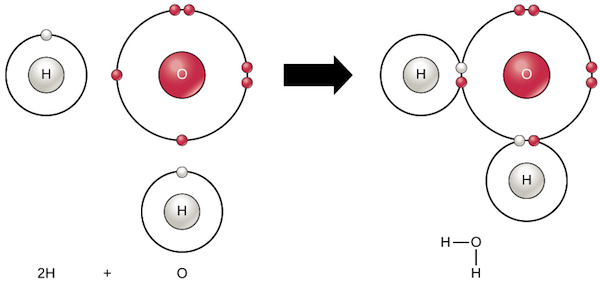
توجه داشته باشید که الکترون به اشتراک گذاشته شده در بخشی از زمان در لایه آخر اتم هیدروژن و در بخشی دیگر در لایه آخر اتم اکسیژن قرار میگیرد.
پیوند قطبی کووالانسی
پیوند کووالانسی به دو دستهی اصلی قطبی و غیرقطبی تقسیمبندی میشود. در پیوند قطبی، الکترونها از نظر زمانی بهطور مساوی بین اتمها به اشتراک گذاشته نمیشوند. در حقیقت الکترونهای به اشتراک گذاشته شده، بازه زمانی بیشتری را در یک اتم و بازهی کمتری را در اتم دیگر میگذرانند. با توجه به این عدم تقارن، در این مولکولها بار جزئی مثبت (δ+) را به یک اتم و جزئی منفی (δ-) را به اتم دیگر اختصاص میدهیم.
در یک مولکول آب، پیوند بین اکسیژن و هرکدام از دو اتم هیدروژن، بهصورت قطبی است. با توجه به الکترونگاتیو بودن اکسیژن (تمایل بیشتر به جذب الکترون)، این اتم، الکترونهای مشترک را به نسبت اتم هیدروژن بیشتر به سمت خود جذب میکند. از این رو در مولکول آب، اکسیژن، بار جزئی منفی و هیدروژن بار جزئی مثبت را دارد. در شکل زیر بارهای جزئی هرکدام از اتمها نشان داده شدهاند.
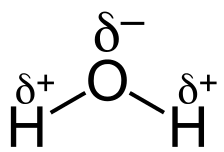
در حالت کلی میزان الکترونگاتیو بودن اتمهای یک مولکول، تعیین کننده قطبی یا غیرقطبی بودن پیوند است.
پیوند غیرقطبی کووالانسی
پیوند غیر قطبی میان اتمهای یکسان یا اتمهایی تشکیل میشود که تمایلشان در جذب الکترون -که همان مفهوم الکترونگاتیوی است- یکسان باشد. برای نمونه مولکول O2 از دو اتم مشابه تشکیل شده؛ بنابراین زمان بهاشتراکگذاری الکترون بین دو اتم یکسان بوده و پیوند کوولانسی ایجاد شده نیز غیرقطبی است. شکل زیر وضعیت دو اتم اکسیژن را قبل و بعد از ایجاد پیوند نشان میدهد.

نمونهای دیگر از پیوند غیرقطبی، پیوند میان اتم کربن و هیدروژن در مولکول CH4 (متان) است. اتم کربن در لایه آخر خود دارای ۴ الکترون است؛ در نتیجه این اتم به چهار الکترون دیگر نیاز دارد تا به حالتی پایدار برسد؛ از این رو ۴ الکترون را با چهار اتم هیدروژن به اشتراک میگذارد. از طرفی اندازه الکترونگاتیوی اتمهای هیدروژن و کربن به هم نزدیک است؛ در نتیجه چهار پیوند ایجاد شده غیرقطبی است. در شکل زیر پیوند کووالانسی قطبی و غیرقطبی در مولکولهای H2O و CH4 نشان داده شده.

پیوندهای هیدروژنی و نیروی پراکندگی لاندن
نیروی ناشی از پیوندهای یونی و کووالانسی، نیروهایی قوی محسوب میشوند. این در حالی است که پیوندهایی نیز وجود دارند که به نسبت ضعیفتر هستند. دو نمونهی شناختهشده از پیوندهای ضعیف که عمدتا در بیولوژی مشاهده میشوند، پیوند «هیدروژنی» (Hydrogen bond) و «نیروی پراکندگی لاندن» (London dispersion force) هستند.
بدون وجود این دو نیرو، زندگی به شکلی که ما امروزه میشناسیم، وجود نخواهد داشت! این نیروها بخش اعظمی از خواص مولکولهای آب، DNA و پروتئینها را تشکیل میدهند. همانطور که میدانید موارد ذکر شده بخش اصلی تشکیل دهنده سلولهای موجودات زنده محسوب میشوند.
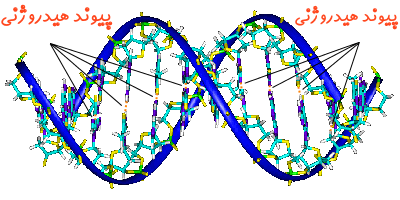
پیوند هیدروژنی
در اکثر پیوندهای کووالانسی قطبی که در آن هیدروژن حضور دارد، معمولا الکترون مشترک به سمت اتم دیگر کشیده شده و اتم هیدروژن دارای بار جزئی مثبت میشود. در این حالت اگر اتمی با بار منفی در نزدیکی هیدروژن قرار گیرد، پیوندی هیدروژنی میان اتمِ با بار جزئیِ منفی و اتم هیدروژن ایجاد خواهد شد. پیوند هیدروژنی در طبیعت بسیار معمول است؛ برای نمونه، آب تعداد زیادی از این پیوندها را ایجاد میکند. شکل زیر پیوند هیدروژنی ایجاد شده در مولکول آب را نشان میدهد.

نیروی پراکندگی لاندن
همانند پیوندهای هیدروژنی، نیروهای پراکندگی لاندن نیز پیوندهایی ضعیف میان مولکولها هستند. برخلاف پیوند هیدروژنی، این نیرو میتواند بین انواع اتمها یا مولکولهای مختلف ایجاد شود. این نیرو در نتیجه توزیع نامتقارنِ لحظهای الکترونها در دو اتم است.
اما نیروی پراکندگی لاندن چگونه ایجاد میشود؟ از آنجایی که الکترونها با سرعت ثابت در حال حرکت هستند، زمانیکه تودهای از الکترونها در یک جهت در حال حرکت باشند، بار جزئی منفی در یک سمت و بار جزئی مثبت در سمت دیگر مولکول ایجاد میشود. این مولکول میتواند توزیع مولکول دیگری را برهم زده و بار جزئی مثبت و منفی نیز در آن ایجاد کند. نهایتا پیوندی ضعیف و موقتی میان دو مولکول ایجاد شده که همان نیروی پراکندگی لاندن است. شکل زیر پیوند لاندن ایجاد شده در نتیجه بار نامتقارن لحظهای را نشان میدهد.
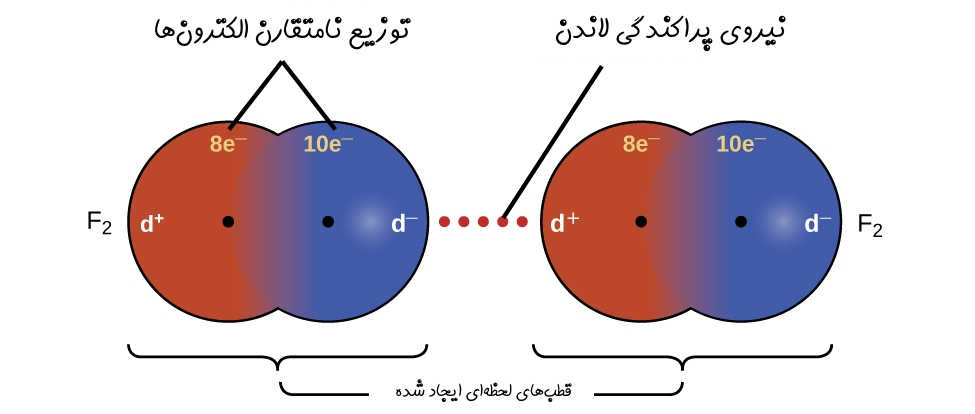
هر دو پیوند لاندن و هیدروژنی، «پیوند واندروالسی» (Van der Waals) محسوب میشوند. پیوندهای واندروالس، در حقیقت نیروهایی بین مولکولی هستند؛ از این رو پیوندهای کووالانسی و یونی از نوع واندروالس محسوب نمیشوند. توجه داشته باشید که در برخی از متون علمی از نیروی لاندن تحت عنوان پیوند واندروالس یاد شده است.
در صورت علاقهمندی به مباحث مرتبط در زمینه فیزیک و شیمی، آموزشهای زیر نیز به شما پیشنهاد میشوند:













ممنون اما چند سوال:
1.بار جزیی مثبت یا منفی در تضاد با اصل کوانتیده بودن بار الکتریکی نیست؟
2.مگر ذرات همنام همدیگر را دفع نمیکنند،پس چگونه در پیوند لاندن زمانی که توده الکترون ها در یک جهت در حال حرکت هستند در سمتی از اتم بار جزیی مثبت پدید میاید؟مگر نباید الکترون ها همدیگر را دفع کنند تا در فضای اتم پخش شوند و به اصطلاح چگالی بار یکسانی داشته باشیم؟
3.لطفا درمورد پیوند هیدروژنی بیشتر توضیح دهید.چگونه هیدروژنی که با اشتراکِ الکترونِ اکسیژن،لایه آخرش پر شده با اکسیژن دیگر پیوند برقرار می کند؟
با سلام؛
اصل کوانتیده بودن بار میگوید بار الکتریکی تنها به مضرب صحیحی از بار الکترون (e) وجود دارد. یعنی شما یا یک الکترون دارید یا ندارید، چیزی بین آنها نیست. اما بار جزئی (Partial Charge) یک مفهوم کوانتومی–شیمیایی است و ربطی به تقسیم واقعی بار الکترون ندارد. در یک پیوند کووالانسی، چگالی الکترونی به طور نامتقارن بین اتمها توزیع میشود.
نیروی لاندن یا برهمکنشهای واندروالسی ناشی از دوقطبی آنی بر پایه این است که در یک لحظه کوتاه، الکترونها به طور تصادفی بیشتر به یک سمت ابر الکترونی کشیده میشوند. این نامتقارنی آنی باعث میشود یک سمت اتم اندکی «منفی» و سمت دیگر اندکی «مثبت» شود (دوقطبی لحظهای). این دوقطبی لحظهای، در اتم مجاور هم دوقطبی القا میکند و باعث جذب ضعیف میشود. درست است که الکترونها همدیگر را دفع میکنند، ولی آنها مثل دانههای شن یکنواخت پخش نمیشوند.
پیوند هیدروژنی در واقع ترکیبی از نیروی الکتروستاتیک و همپوشانی کوانتومی ضعیف اوربیتالها است. در مولکولی مثل آب، اکسیژن الکترونگاتیوتر است و بیشتر چگالی پیوند O–H را به سمت خود میکشد. این باعث میشود که هیدروژن بهطور جزئی مثبت شود. حالا این هیدروژنِ مثبت میتواند با جفت الکترون ناپیوندی یک اکسیژن دیگر (روی مولکول مجاور) جذب الکترواستاتیکی پیدا کند.
با تشکر از همراهی شما با مجله فرادرس
خوب بود
آفرین بر شما
عالي
مطالب جمع بندي شده و كامل و مفيد و مختصر خيلي خفن بود دمتون گرم حال كرديم
خدا قوت . خیلیییی عالیییی بود
عالی عالی دست گل شما درد نکنه
واقعا خوب بود. خیلی راحت فهمیدم.
مقالات دیگه انقدر تخصصی توضیح داده بودن که از خوندنش سردرد گرفتم.
حرف نداشت ، قشنگ فهمیدم ،دمت گرم
عالی بود واقعا دستتون درد نکنه
عالللللییی